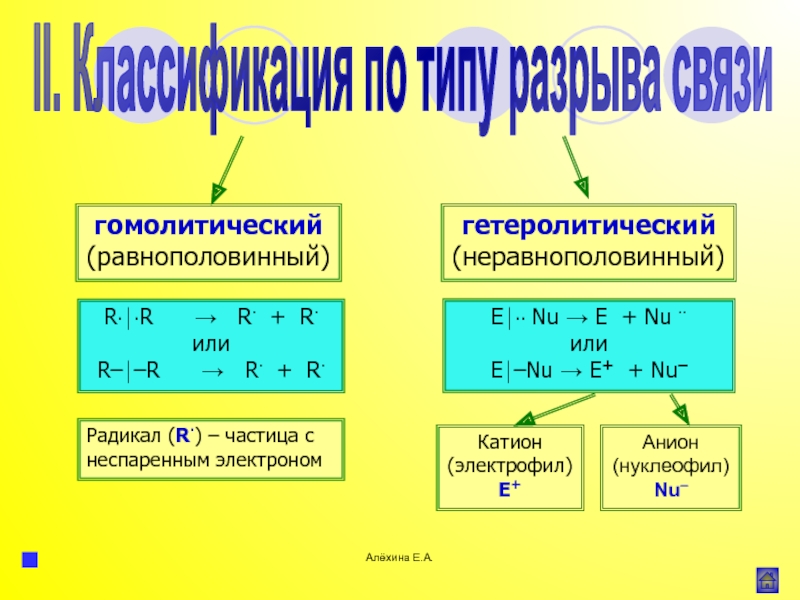
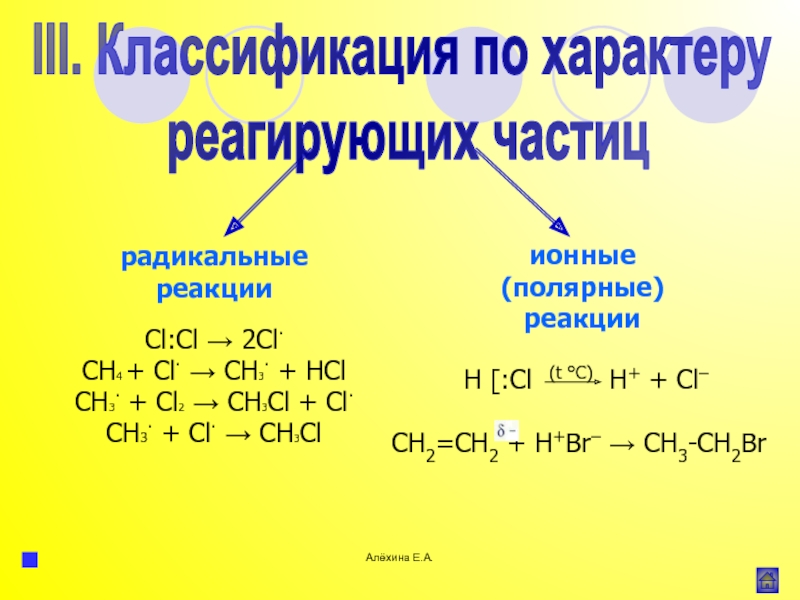
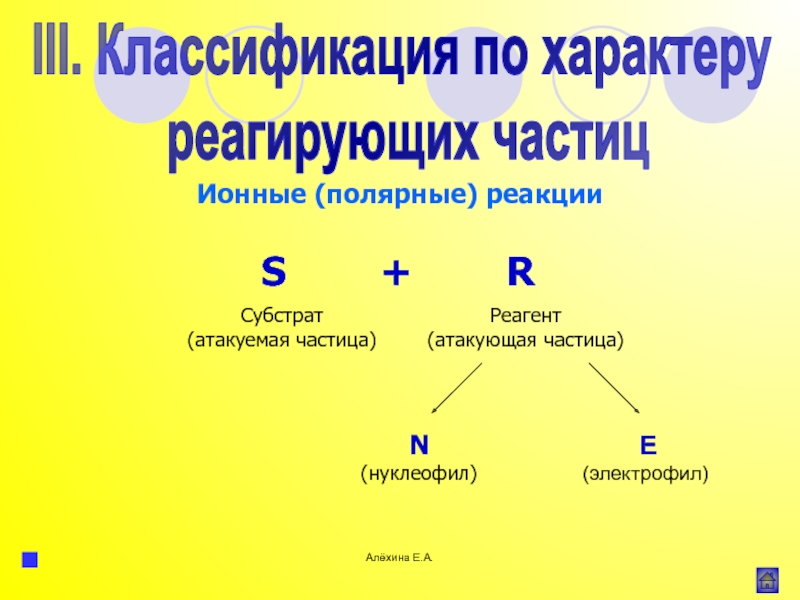
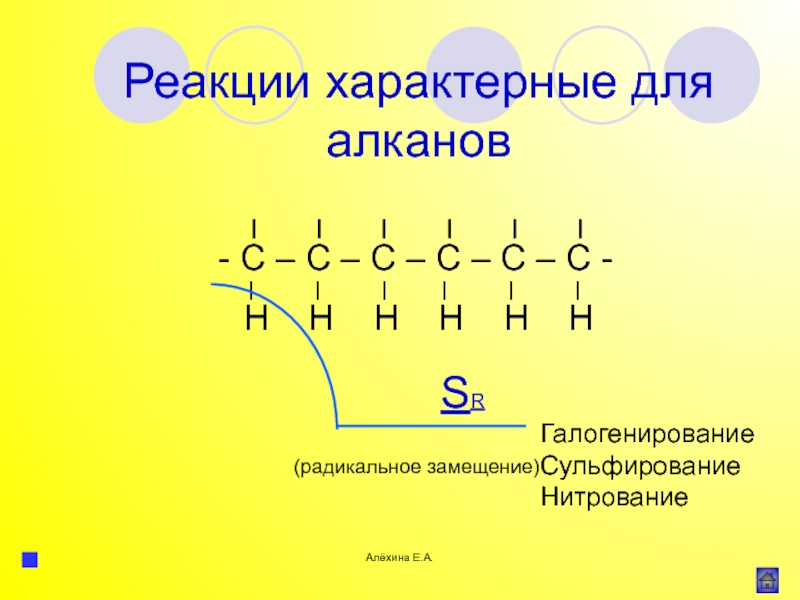
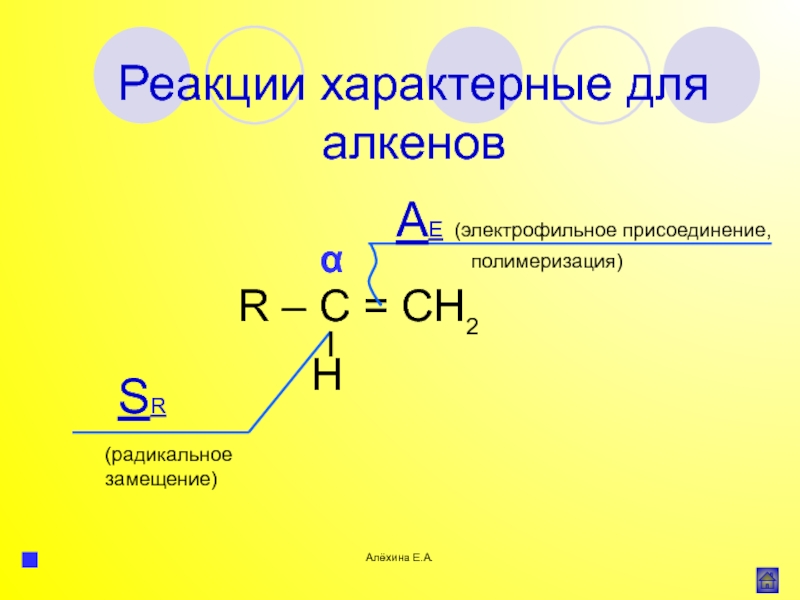
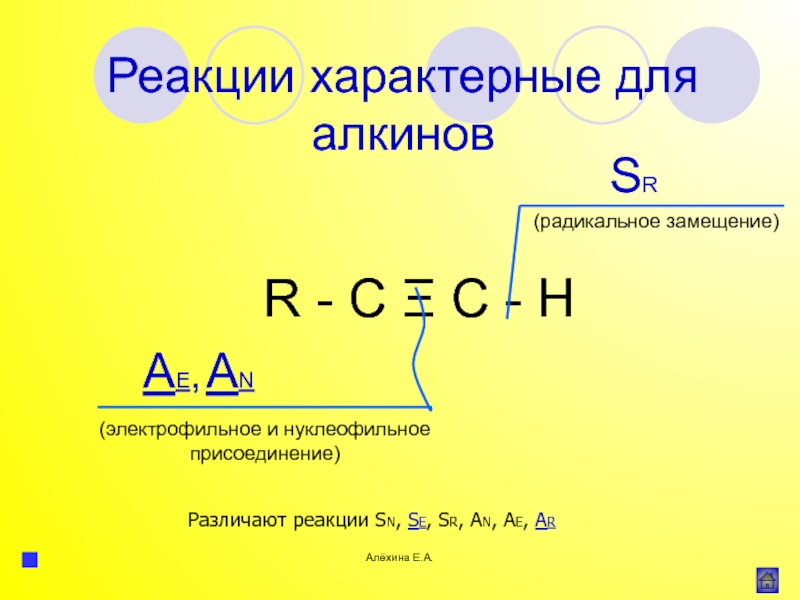
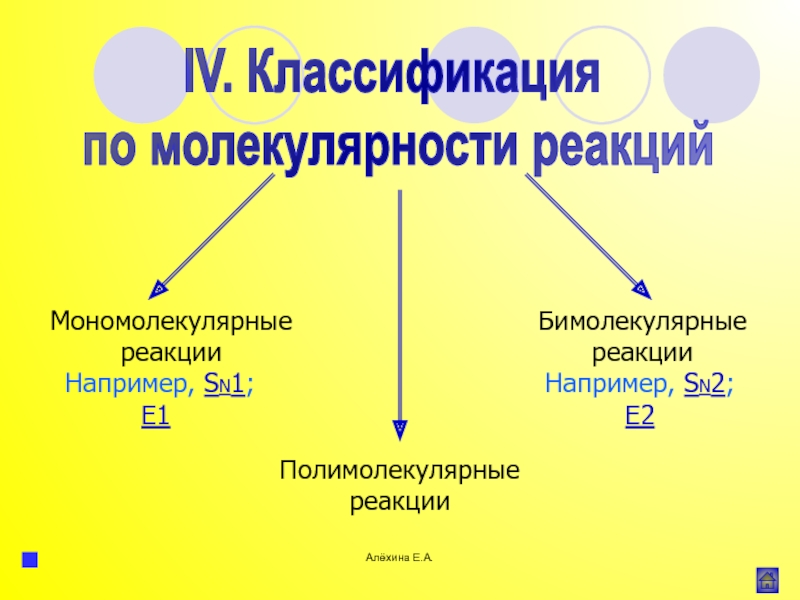
атома элемента или группы атомов.
СН3 – СН2 – СН2 –
ClЗнак эффекта определяется зарядом, приобретаемым заместителем после смещения электронной плотности
Например:
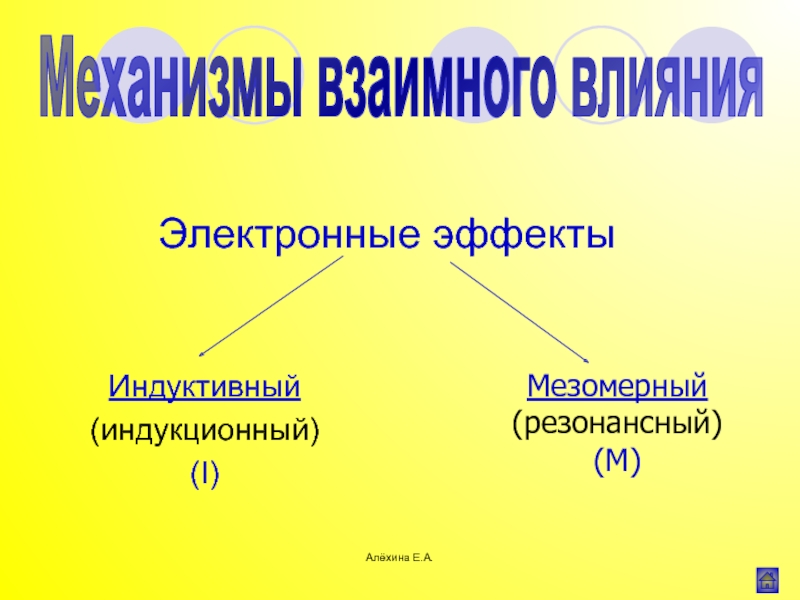
– I
В цепи индуктивный эффект затухает
Индуктивный эффект (I)










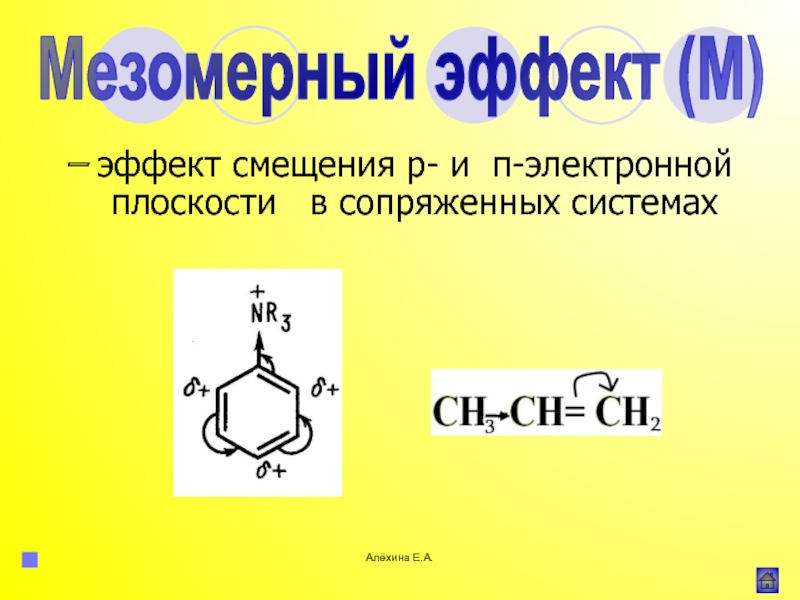






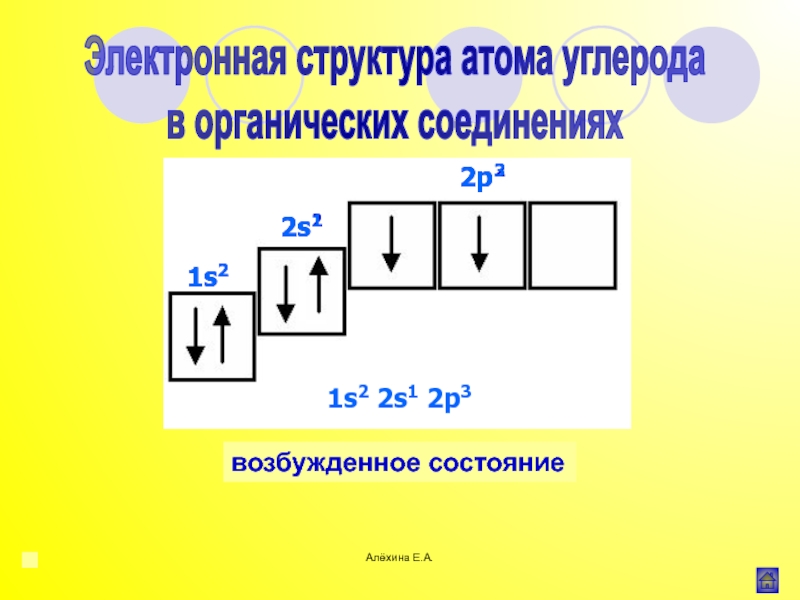




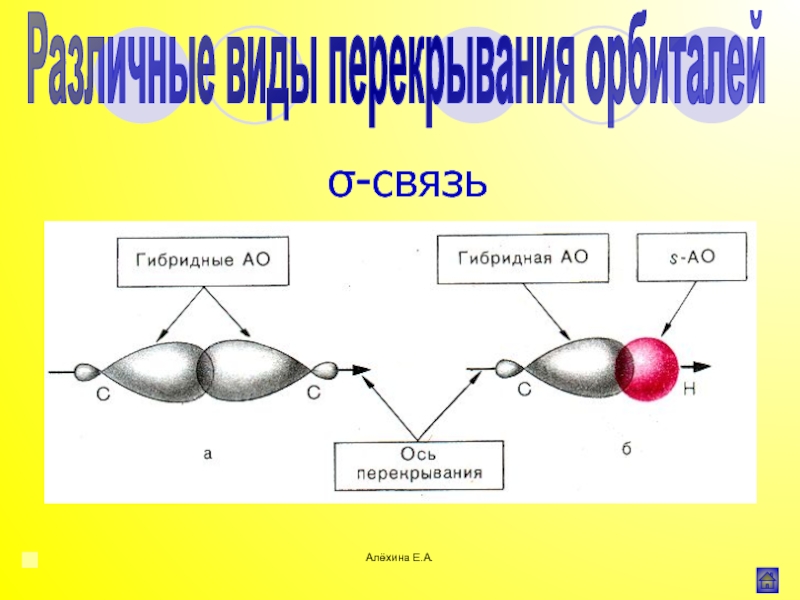

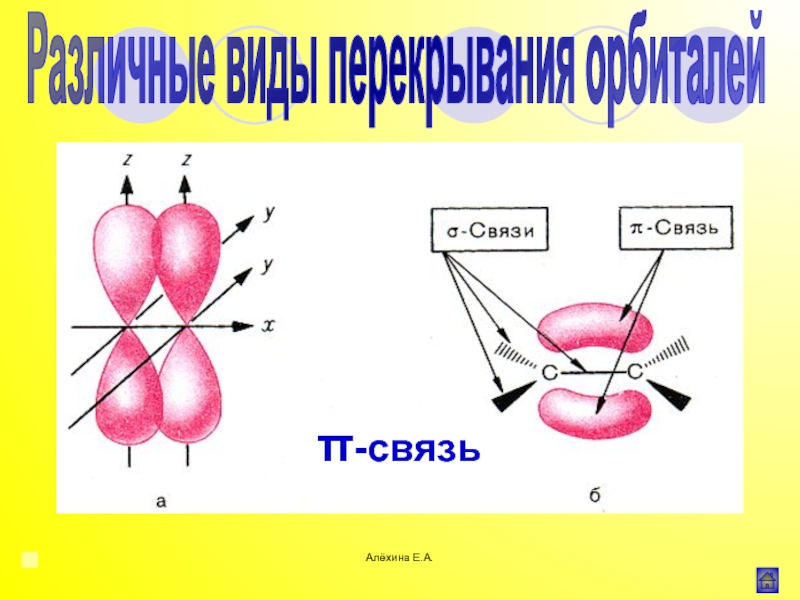
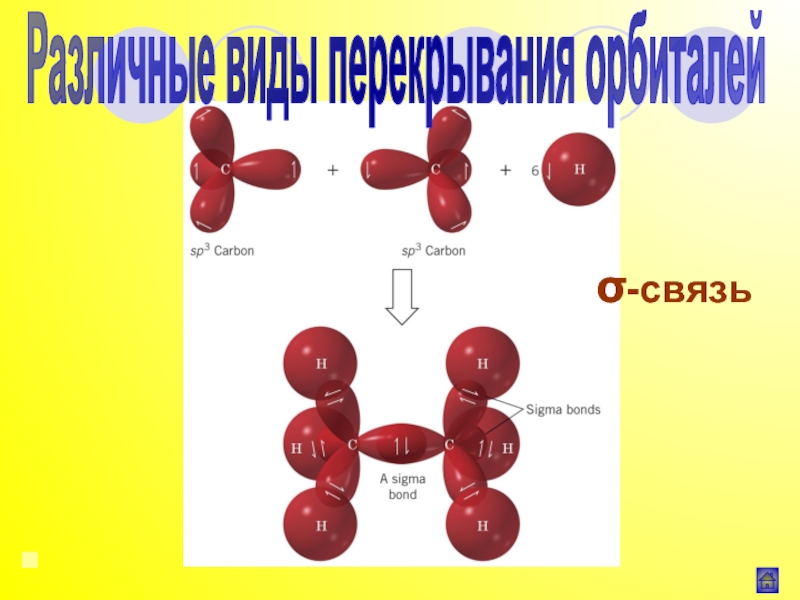
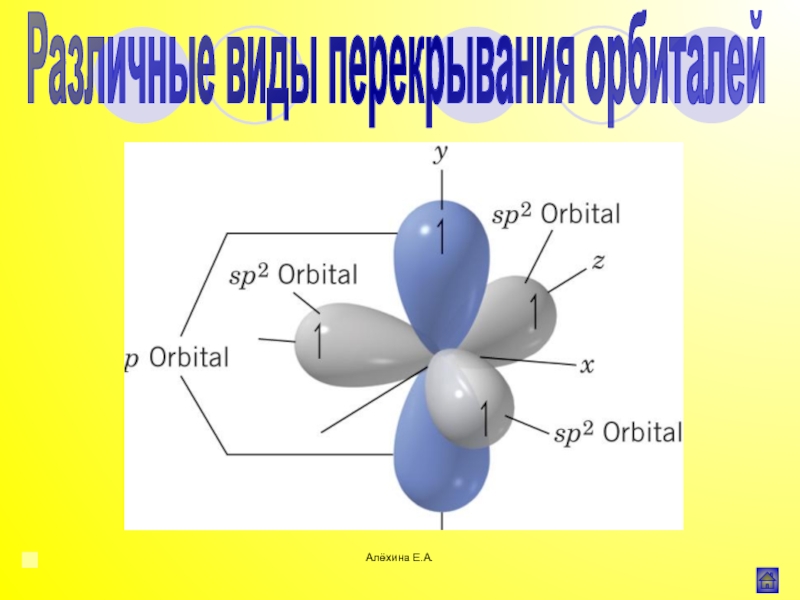
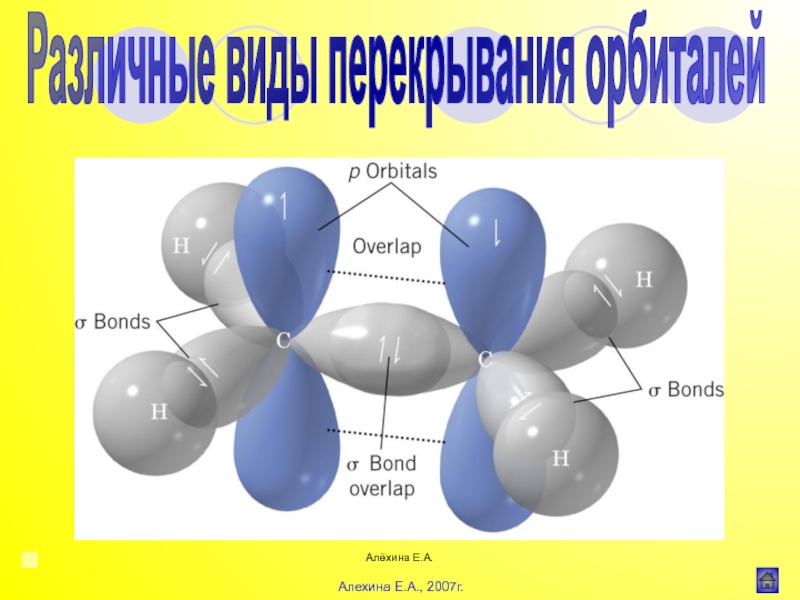
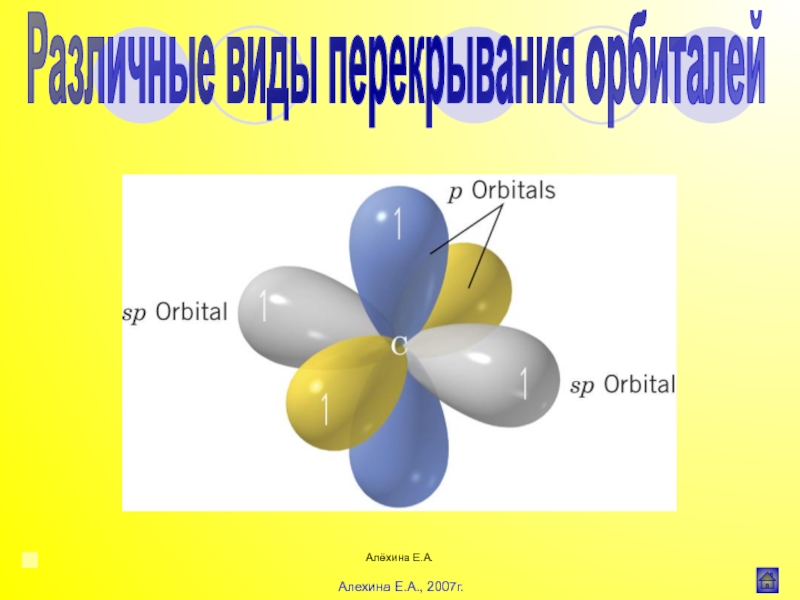
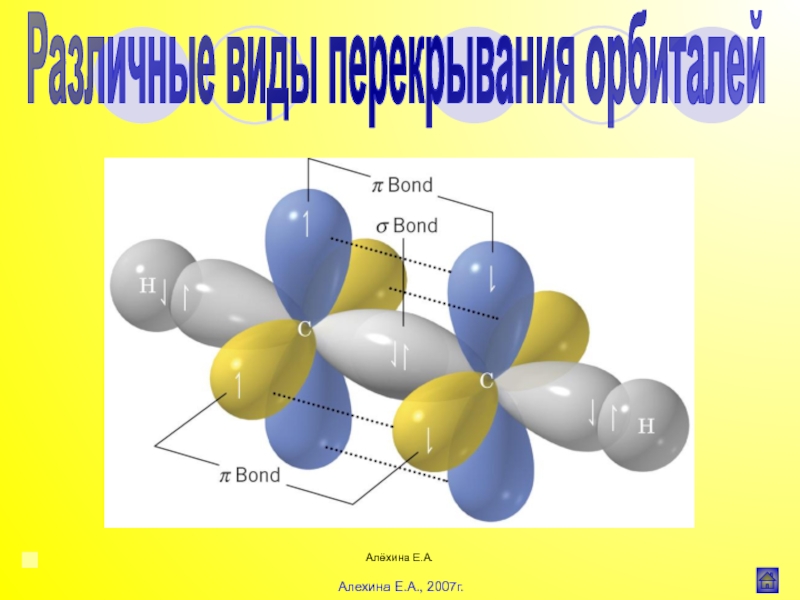
![Алёхина Е.А.
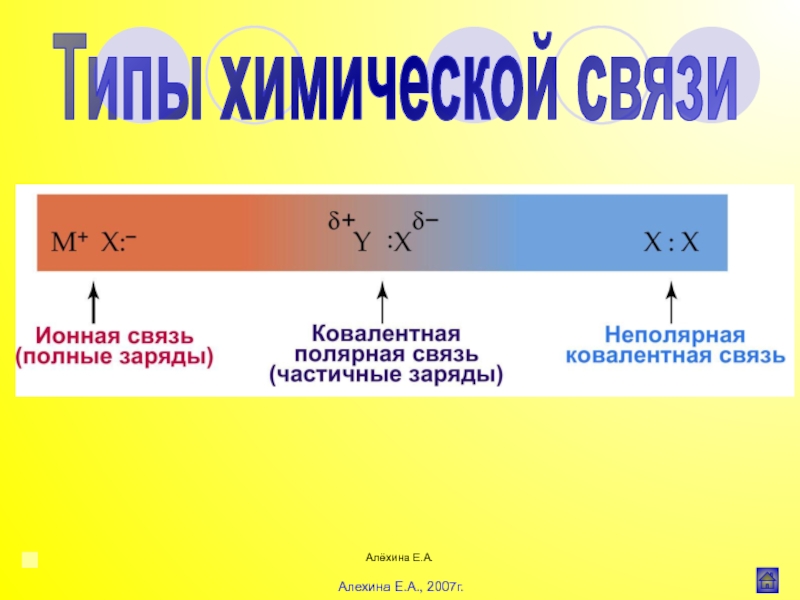
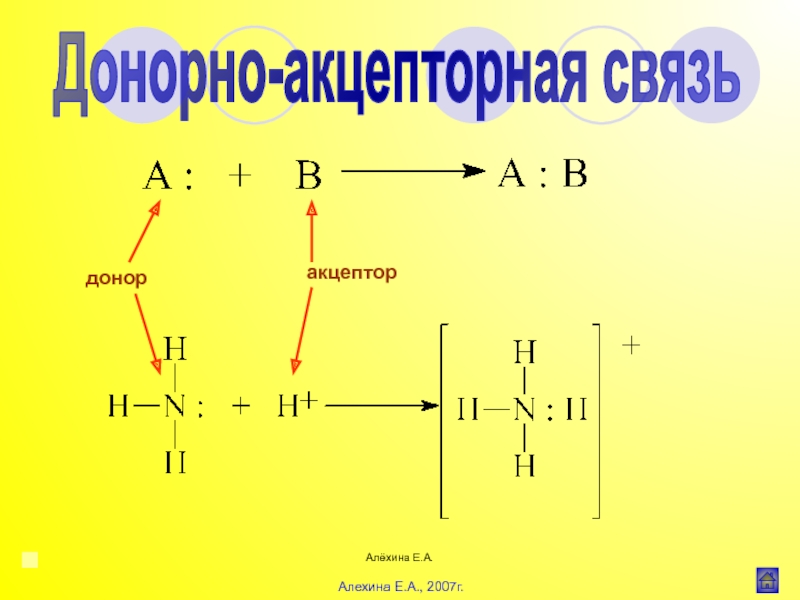
Введение в органическую химию Алёхина Е.А.Ионная (гетерополярная) связьСН3СООNa Ковалентная (гомеополярная) связьСН3-СН3, Cl-ClДонорноакцепторная (координационная) связь :NH3 Алёхина Е.А.Ионная (гетерополярная) связьСН3СООNa Ковалентная (гомеополярная) связьСН3-СН3, Cl-ClДонорноакцепторная (координационная) связь :NH3 + Н+ 3HN:+Н [NH4]+](/img/thumbs/38b21bf9198b206066fcdb900a31f1c6-800x.jpg)



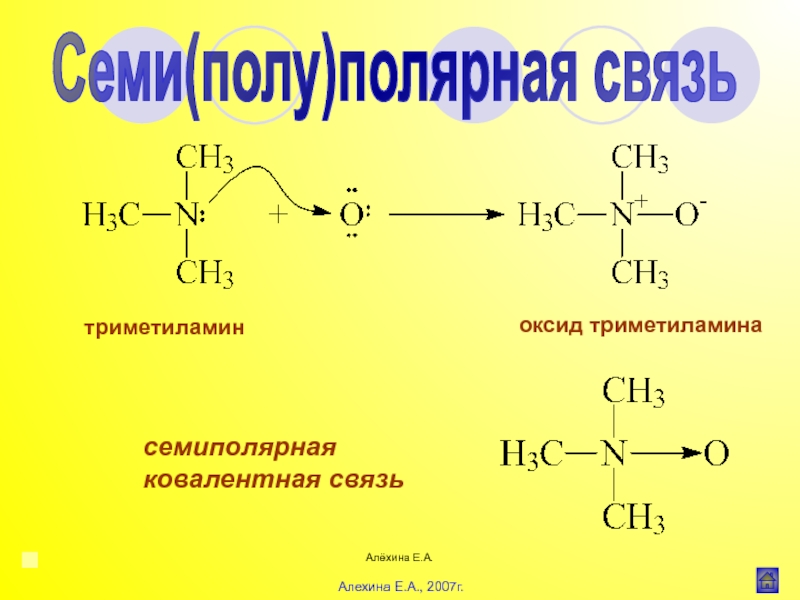

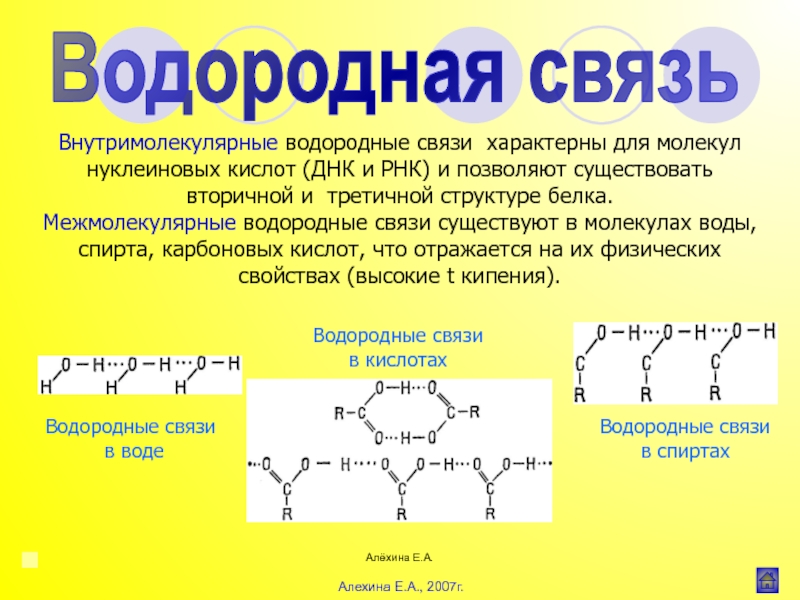

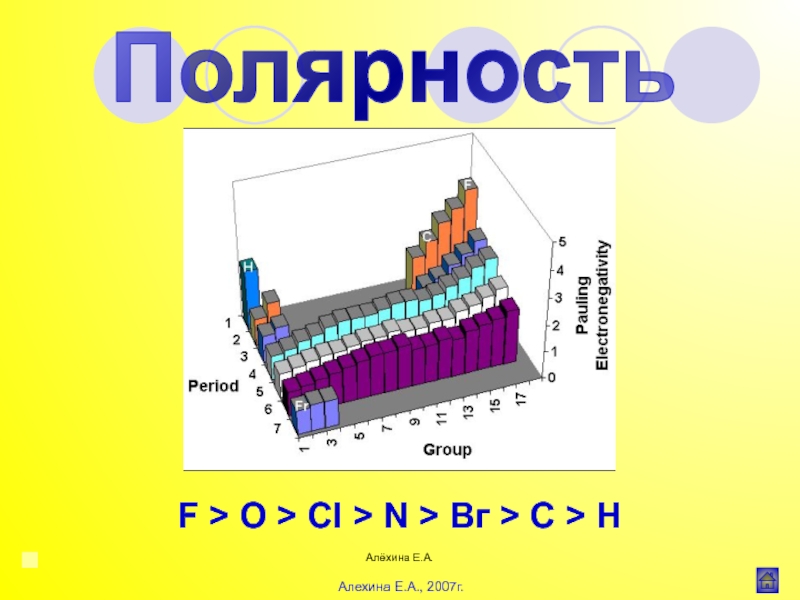


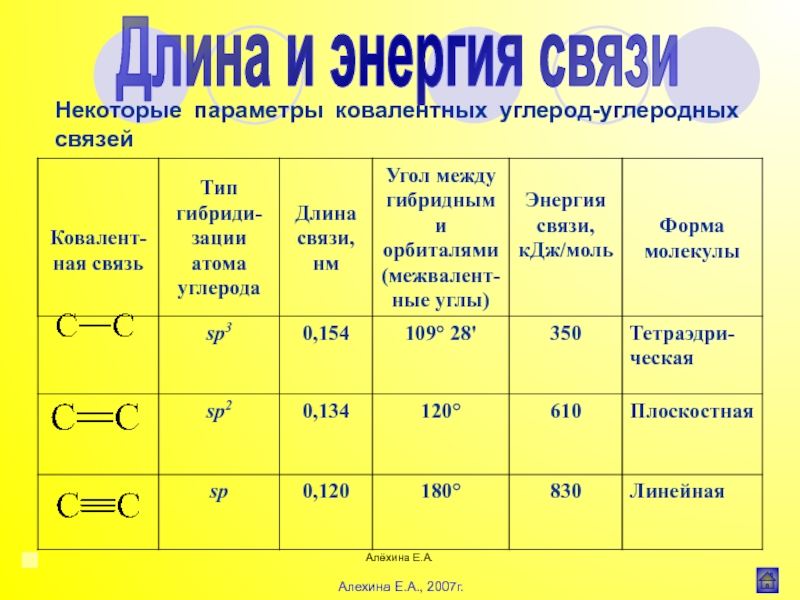




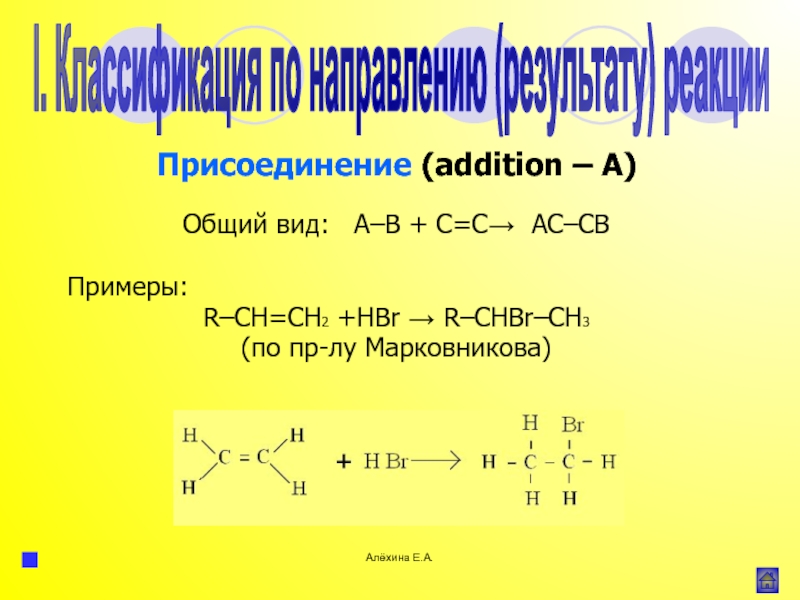



![Алёхина Е.А.
Введение в органическую химию Алёхина Е.А. Перегруппировка (изомеризация)А–В–С А–С–ВCH3–CH2–CCH (изомеризация) CH3–CС–СH3НCCH + Н2О (Hg2+) Алёхина Е.А. Перегруппировка (изомеризация)А–В–С А–С–ВCH3–CH2–CCH (изомеризация) CH3–CС–СH3НCCH + Н2О (Hg2+) [CH2=CH–OH] СH3–CH=OПримеры:Общий вид:I.](/img/thumbs/dcbb888154f966ddeadb95fc63bc7cea-800x.jpg)