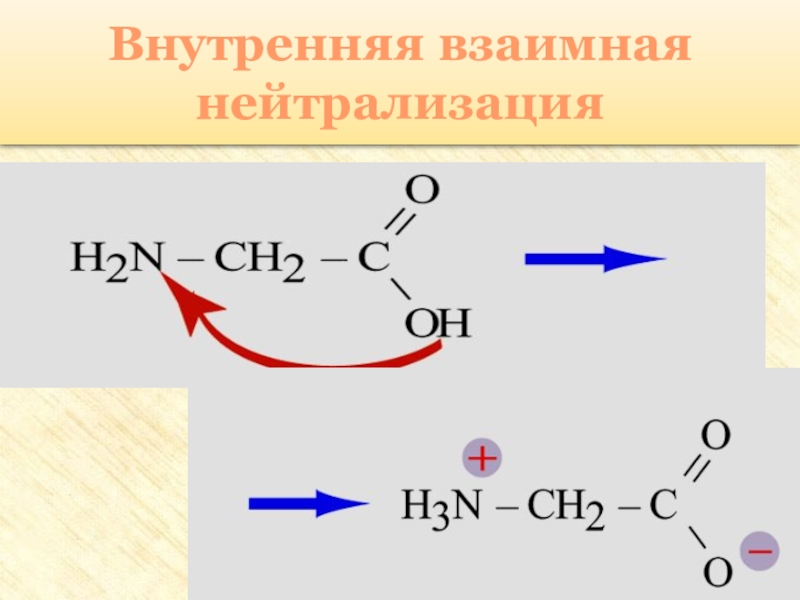
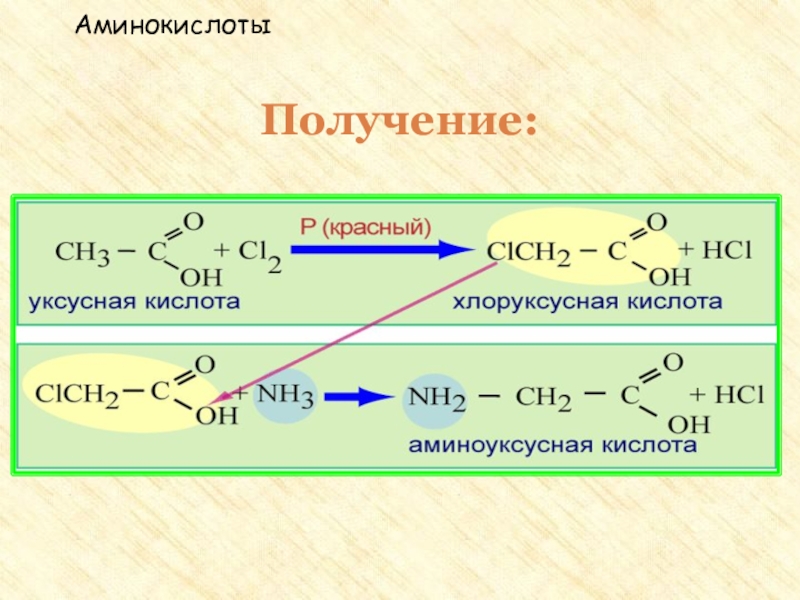
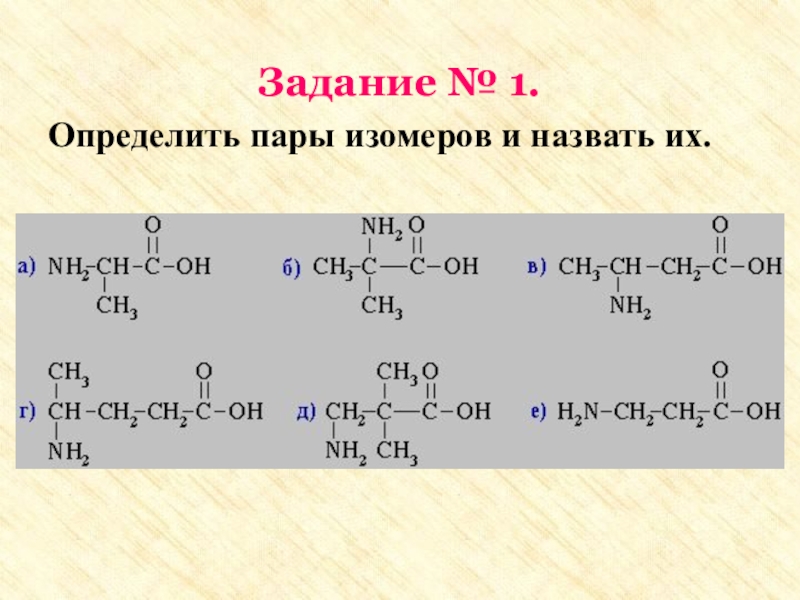
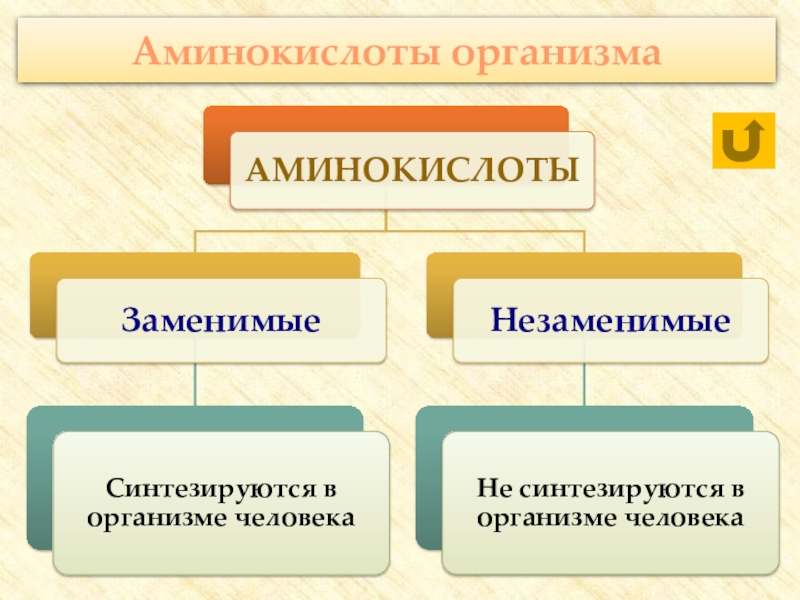
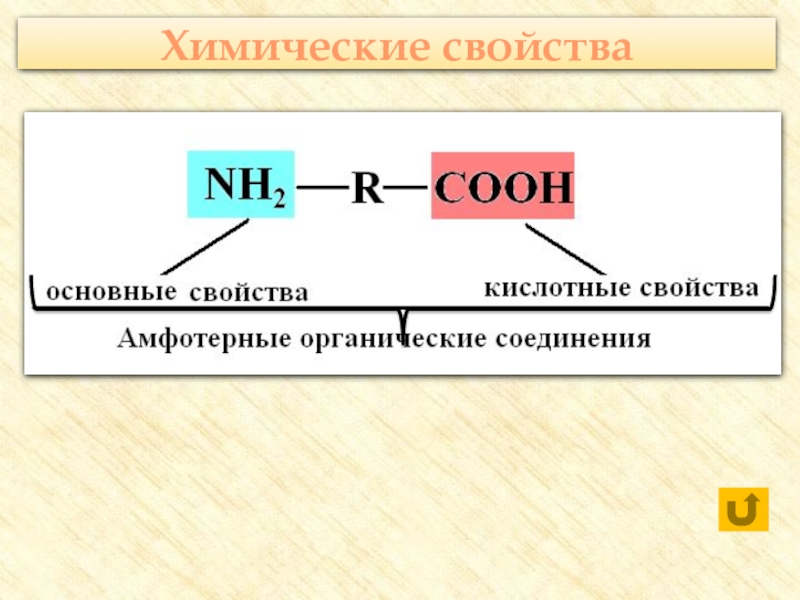
группы: аминогруппу – NH2 и карбоксильную группу – COOH, связанные
с углеводородным радикаломАминокислоты – производные кислот, которые можно рассматривать как продукты замещения одного или более атомов водорода в их радикалах на одну или более аминогрупп















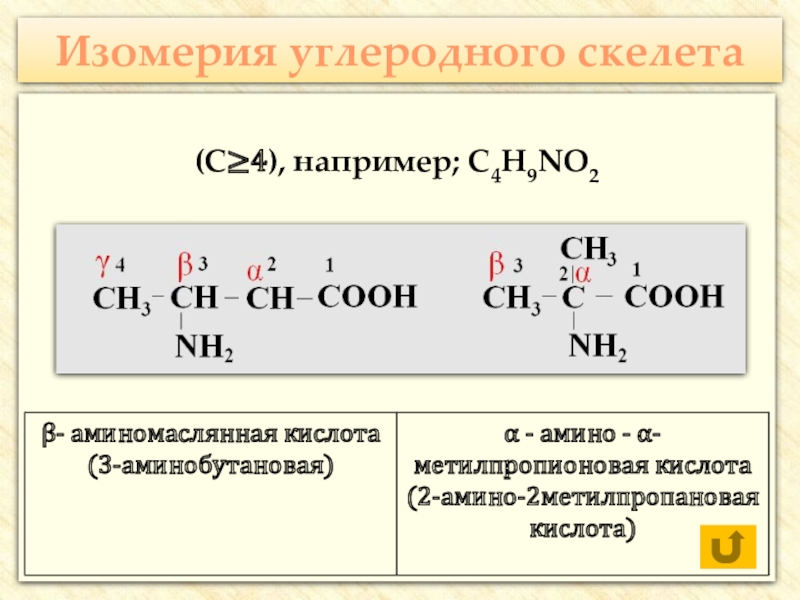


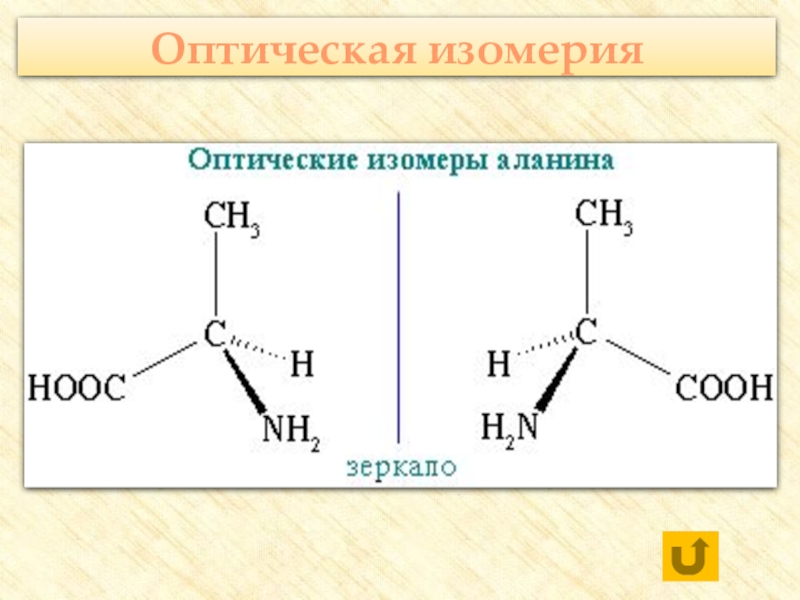
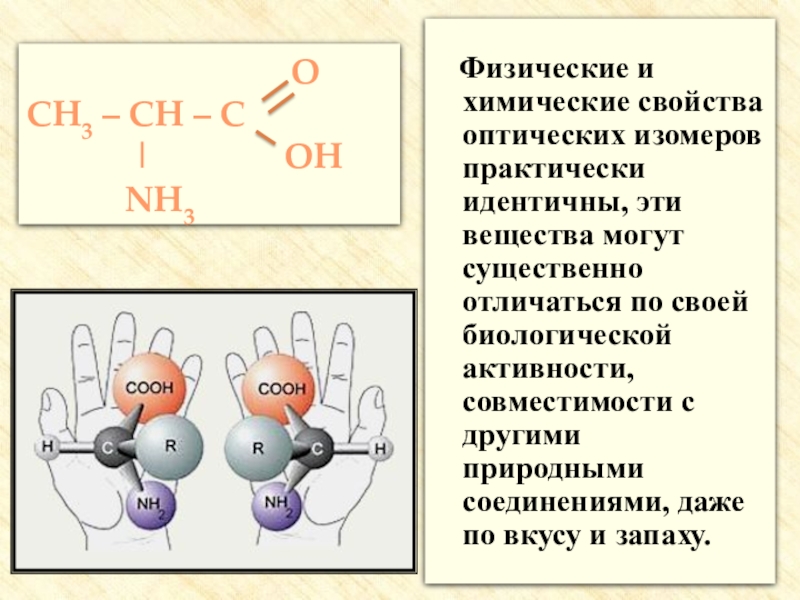


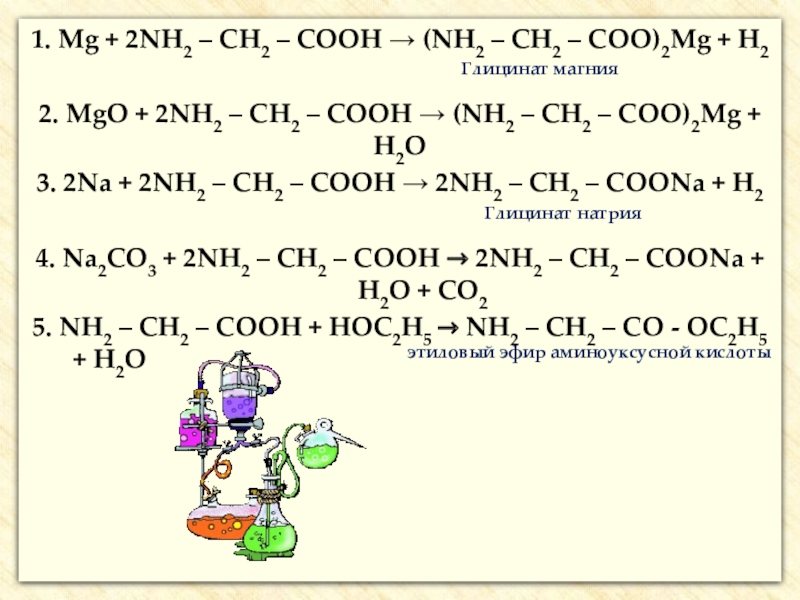
![Аминокислоты Реакции с участием аминогруппыВзаимодействуют с кислотами:H2N–CH2–COOH + HCl → [H3N+–CH2–COOH] Cl- Реакции с участием аминогруппыВзаимодействуют с кислотами:H2N–CH2–COOH + HCl → [H3N+–CH2–COOH] Cl-](/img/thumbs/205b1a79f6cec2c9b989ccdb84058e01-800x.jpg)