Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ароматические углеводороды
Содержание
- 1. Ароматические углеводороды
- 2. Майкл Фарадей (1791–1867)Английский физик и химик, член
- 3. Фридрих Август Кекуле 1829 - 1896Немецкий химик-органик.
- 4. Ароматические углеводороды (Арены)Ароматические углеводороды (арены) – это
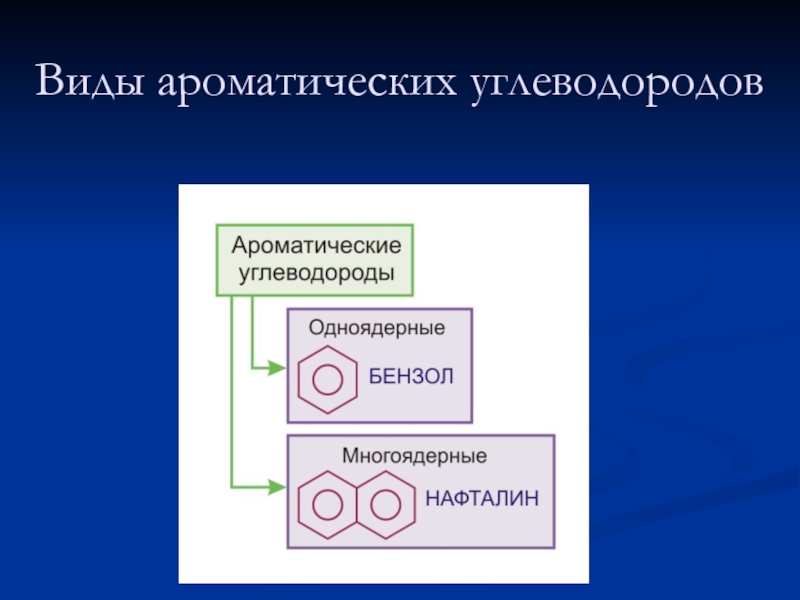
- 5. Виды ароматических углеводородов
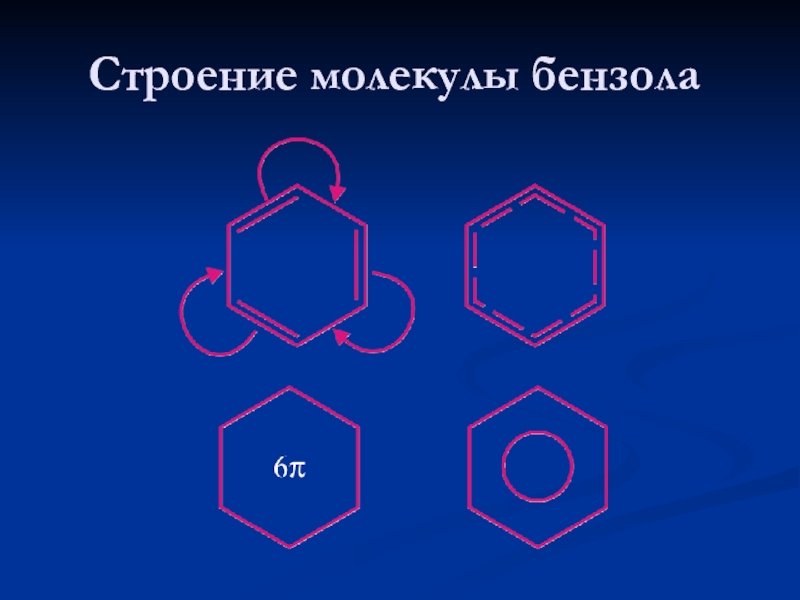
- 6. Строение молекулы бензола
- 7. Модель молекулы бензола
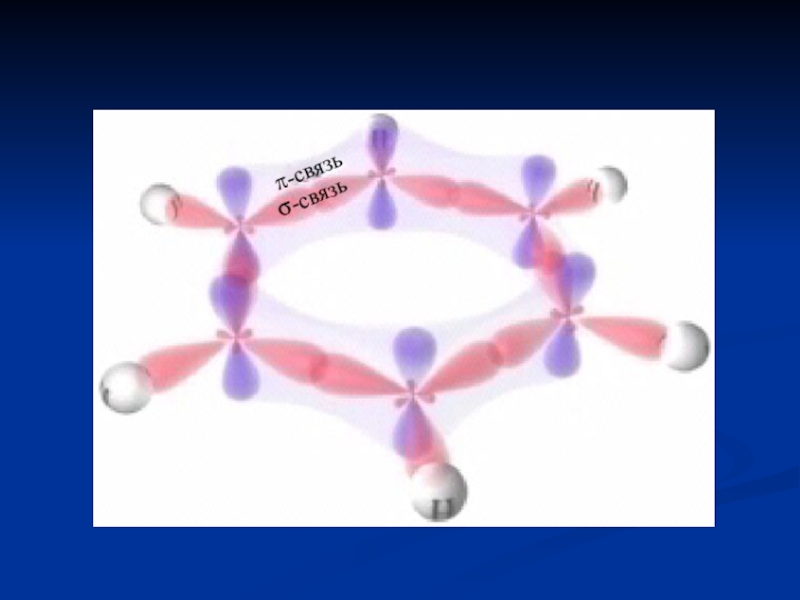
- 8. Образование σ-связей в молекуле бензола
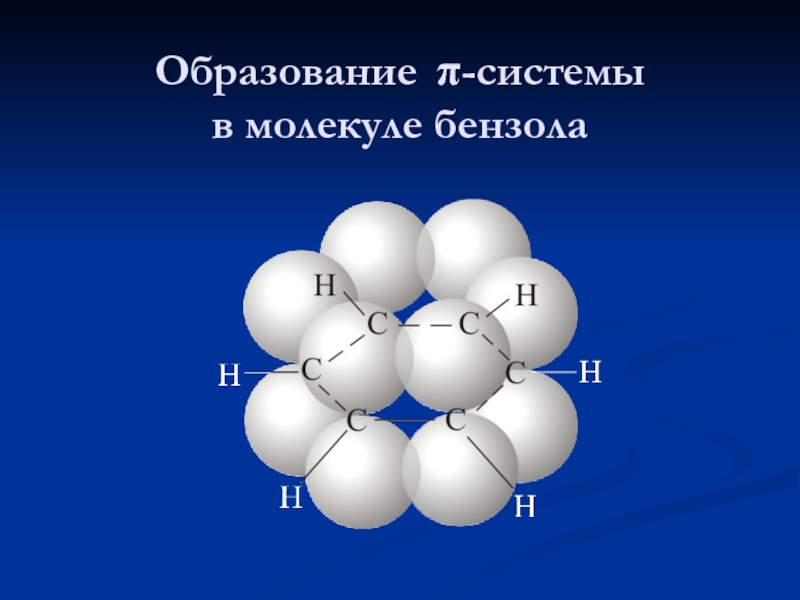
- 9. Образование π-системы в молекуле бензола
- 10. Слайд 10
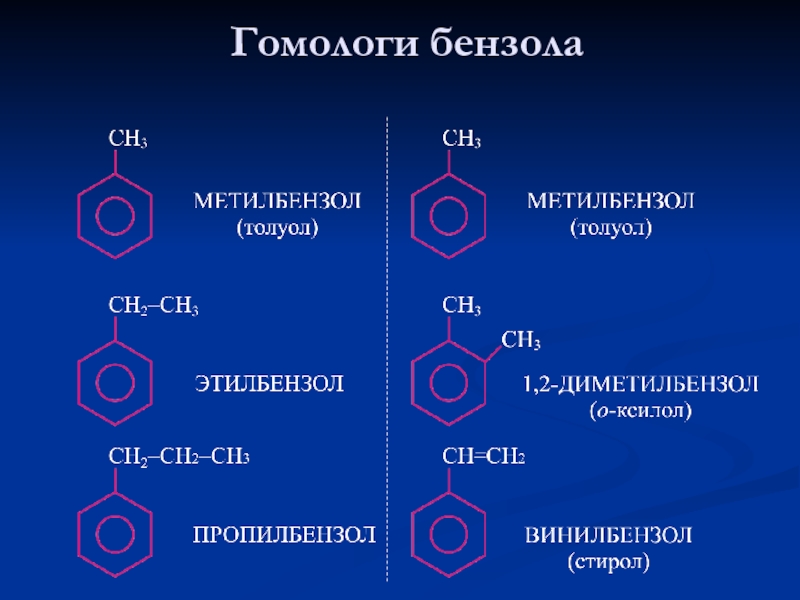
- 11. Гомологи бензола
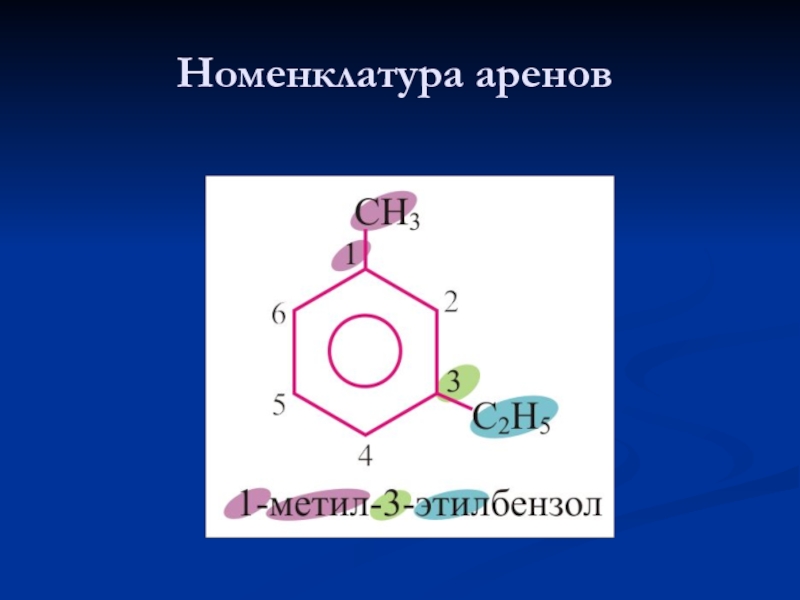
- 12. Номенклатура аренов
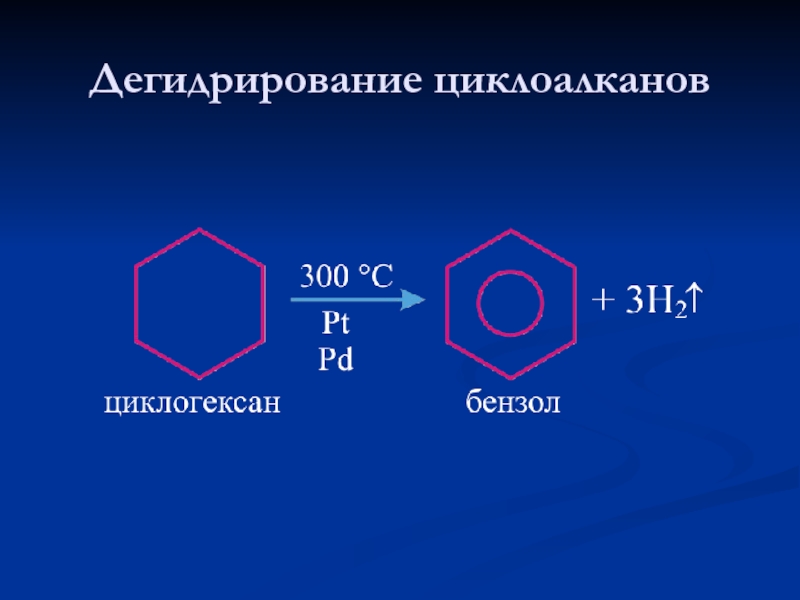
- 13. Дегидрирование циклоалканов
- 14. Дегидрирование циклоалканов
- 15. Циклоароматизация алканов
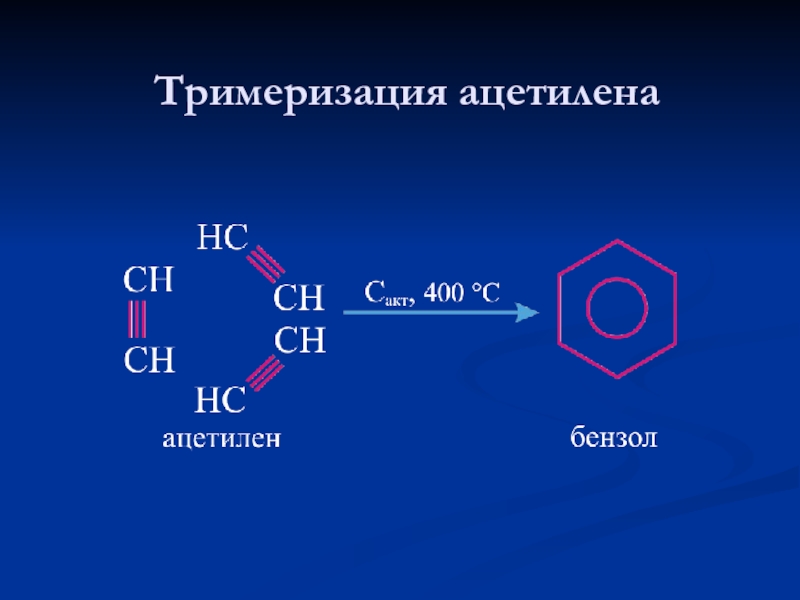
- 16. Тримеризация ацетилена
- 17. Физические свойства аренов В обычных условиях низшие
- 18. Слайд 18
- 19. Химические свойства аренов
- 20. Общая характеристика реакционной способности аренов
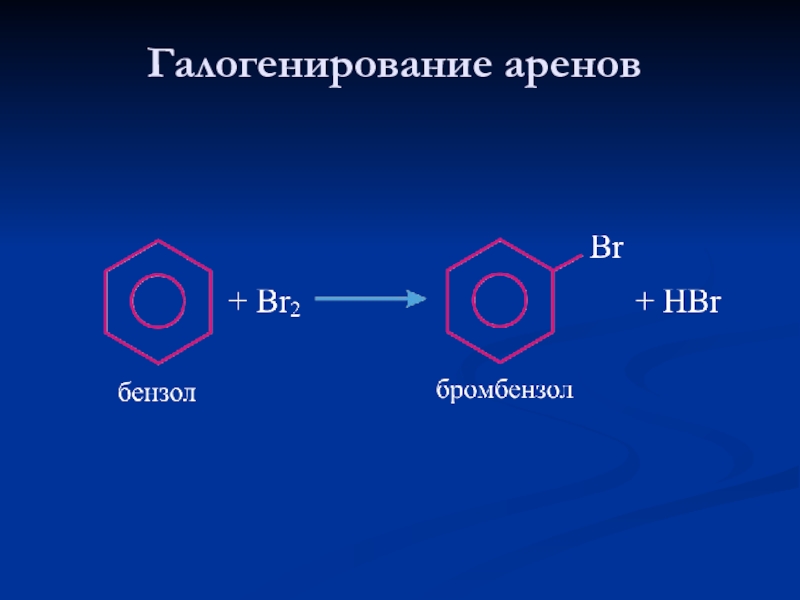
- 21. Галогенирование аренов
- 22. Нитрование бензола
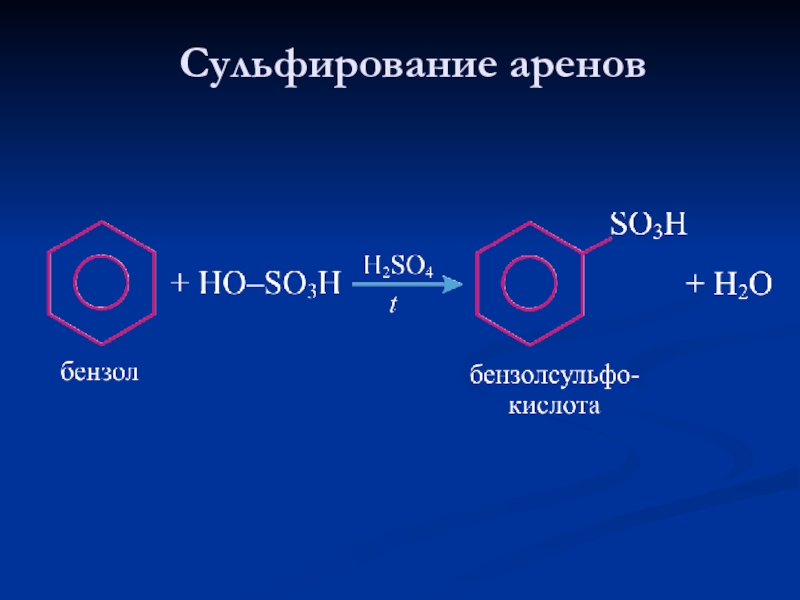
- 23. Сульфирование аренов
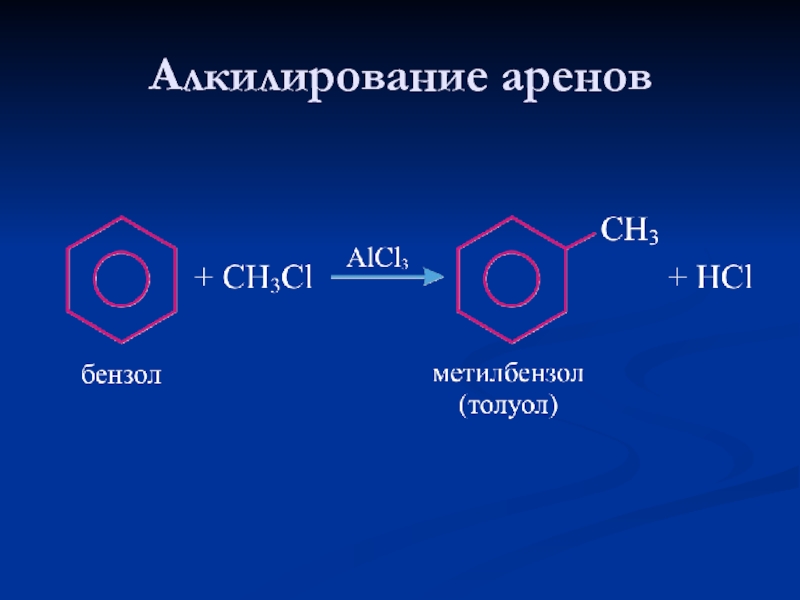
- 24. Алкилирование аренов
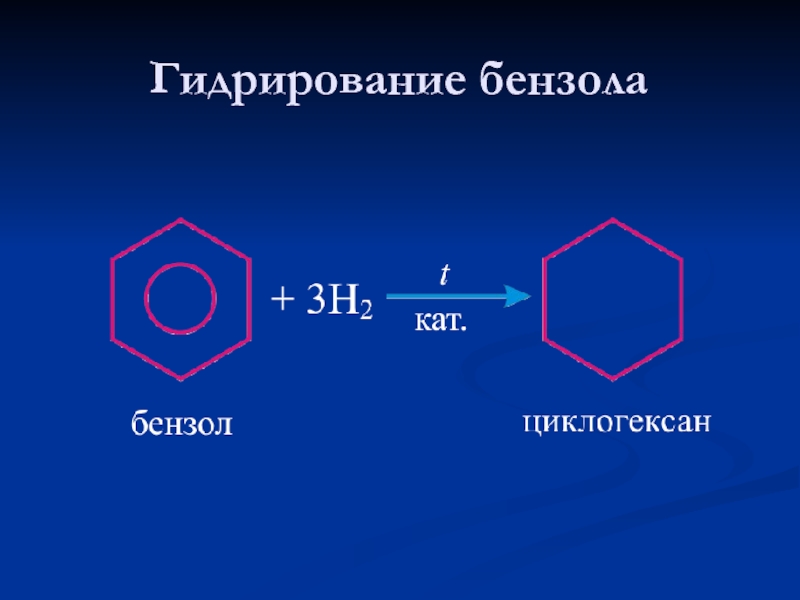
- 25. Гидрирование бензола
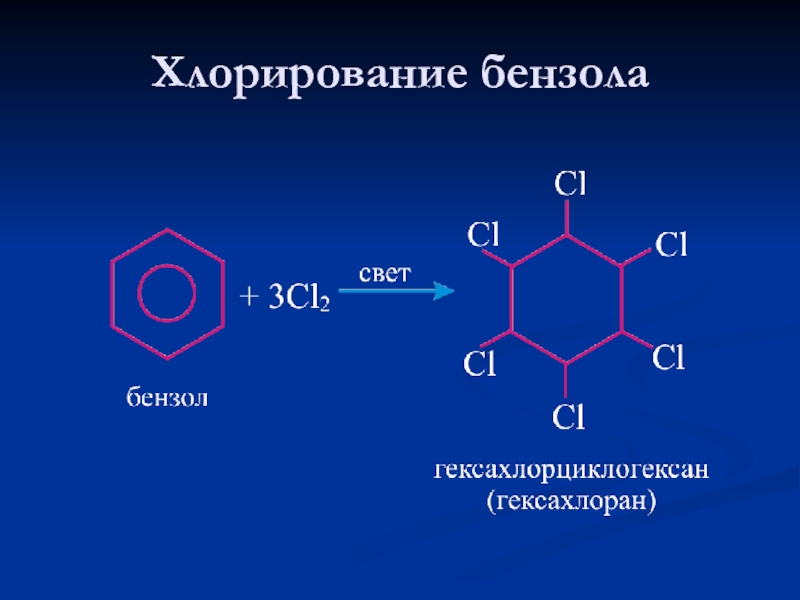
- 26. Хлорирование бензола
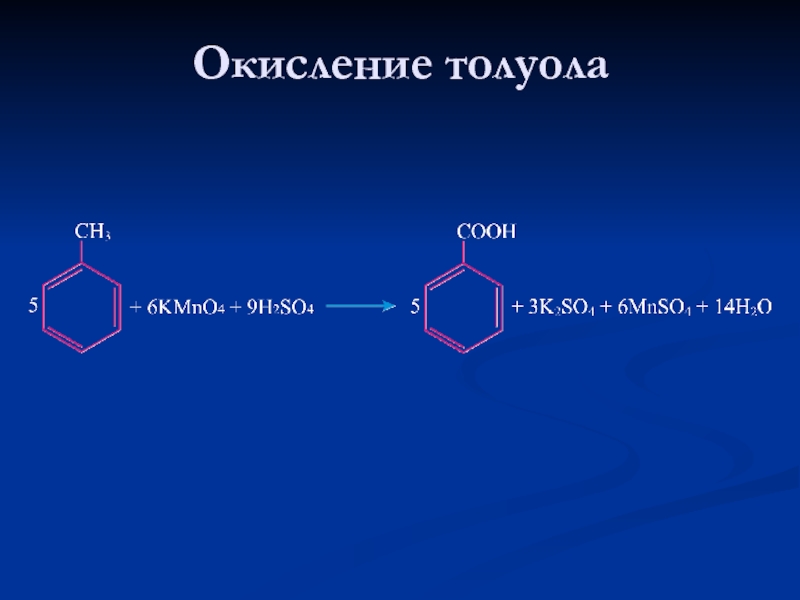
- 27. Окисление толуола
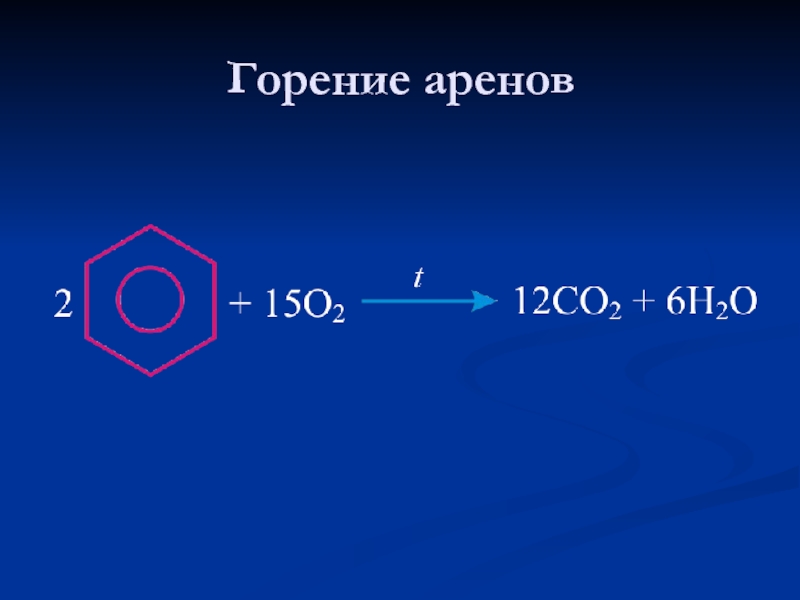
- 28. Горение аренов
- 29. ЗаданиеВыполнить задания из задачника И. Г. Хомченко:Стр. 138 упр.21.4Стр. 139 упр.21.8Стр. 140.упр.21.15
- 30. Домашнее задание§7, повторить §§ 3-6, упр.8 стр.42, стр. 55 упр. 4
- 31. Скачать презентанцию
Майкл Фарадей (1791–1867)Английский физик и химик, член Лондонского королевского общества. Один из основателей количественной электрохимии. В 1823 г. впервые получил жидкие хлор, сероводород, оксид углерода(IV), аммиак, оксид азота(IV). В 1825 г.
Слайды и текст этой презентации
Слайд 2Майкл Фарадей
(1791–1867)
Английский физик и химик, член Лондонского королевского общества. Один
Слайд 3Фридрих Август Кекуле
1829 - 1896
Немецкий химик-органик. Предложил структурную формулу молекулы
бензола. С целью проверки гипотезы о равноценности всех шести атомов
водорода в молекуле бензола получил его галоген-, нитро-, амино-, и карбоксипроизводные. Открыл перегруппировку диазоамино- в азоаминобензол, синтезировал трифенилметан и антрахинон.Слайд 4Ароматические углеводороды (Арены)
Ароматические углеводороды (арены) – это углеводороды с общей
формулой СnH2n-6 , в молекулах которых имеется хотя бы одно
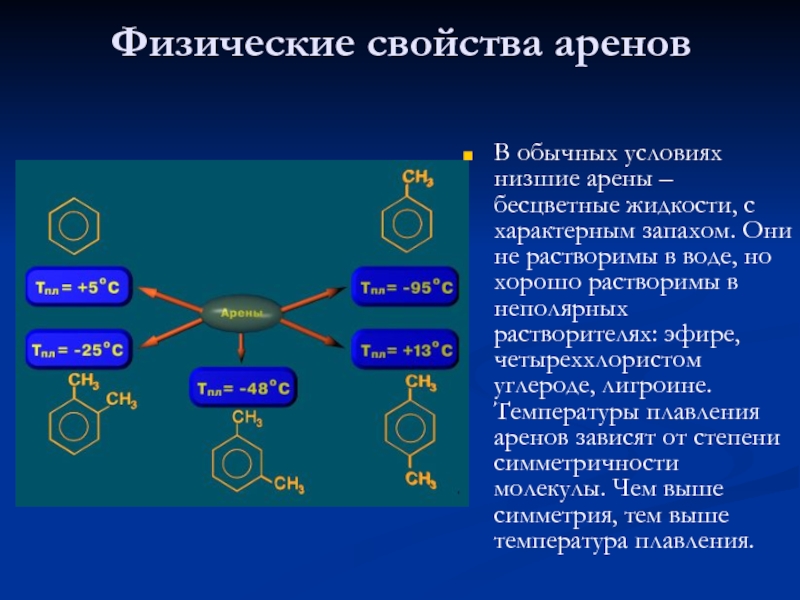
бензольное кольцо.Слайд 17Физические свойства аренов
В обычных условиях низшие арены – бесцветные жидкости,
с характерным запахом. Они не растворимы в воде, но хорошо
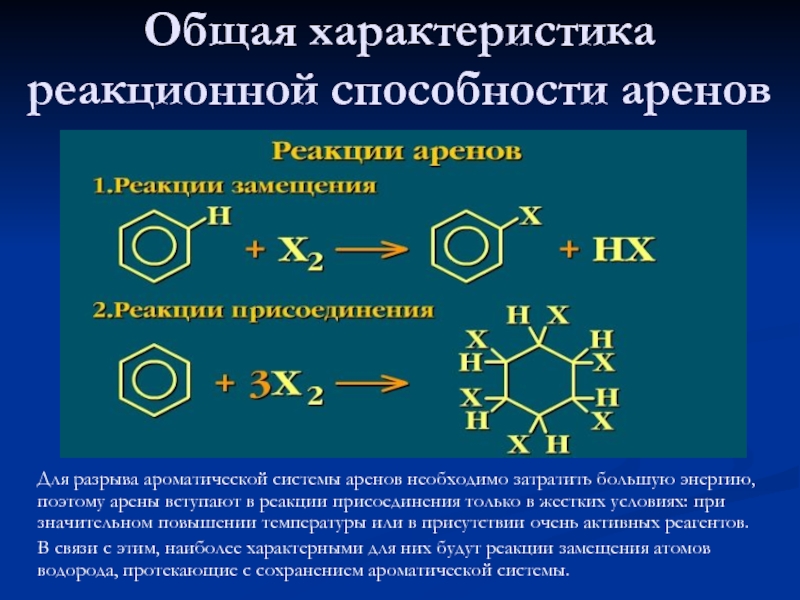
растворимы в неполярных растворителях: эфире, четыреххлористом углероде, лигроине. Температуры плавления аренов зависят от степени симметричности молекулы. Чем выше симметрия, тем выше температура плавления.Слайд 20Общая характеристика реакционной способности аренов
Для разрыва ароматической
системы аренов необходимо затратить большую энергию, поэтому арены вступают в
реакции присоединения только в жестких условиях: при значительном повышении температуры или в присутствии очень активных реагентов.В связи с этим, наиболее характерными для них будут реакции замещения атомов водорода, протекающие с сохранением ароматической системы.