Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
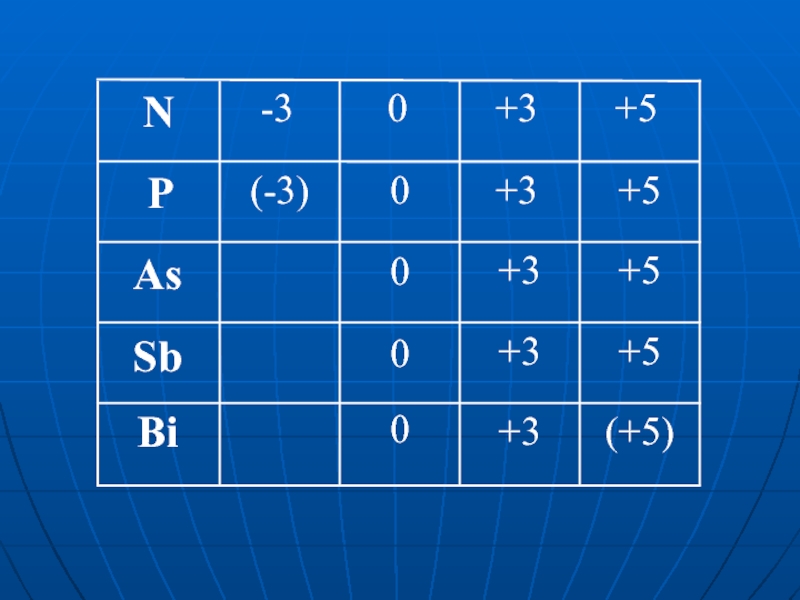
As Sb Bi
Содержание
- 1. As Sb Bi
- 2. N P
- 3. Слайд 3
- 4. P + HNO3 → H3PO4 +
- 5. NH3 PH3
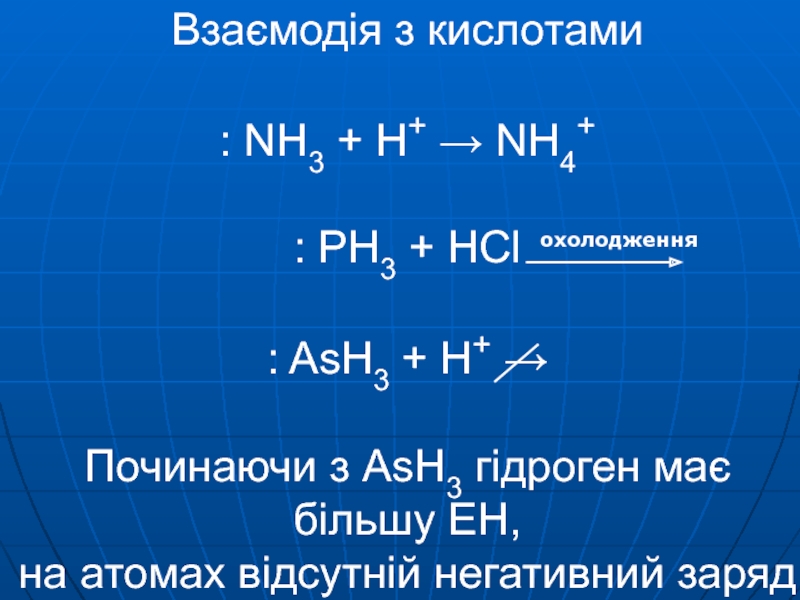
- 6. Взаємодія з кислотами : NH3 +
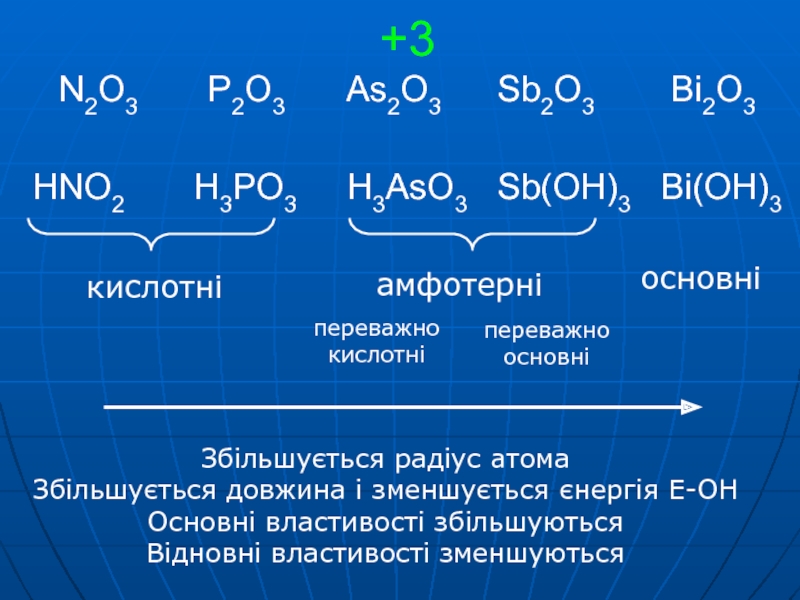
- 7. +3 N2O3 P2O3
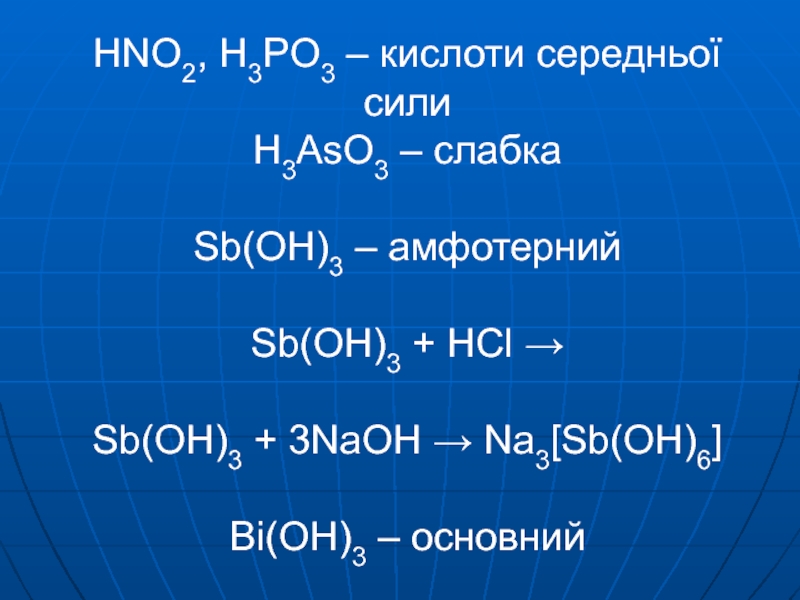
- 8. HNO2, H3PO3 – кислоти середньої сили H3AsO3
- 9. NCl3 PCl3 AsCl3 SbCl3 BiCl3галогеноангідридинітрид хлорусільсіль
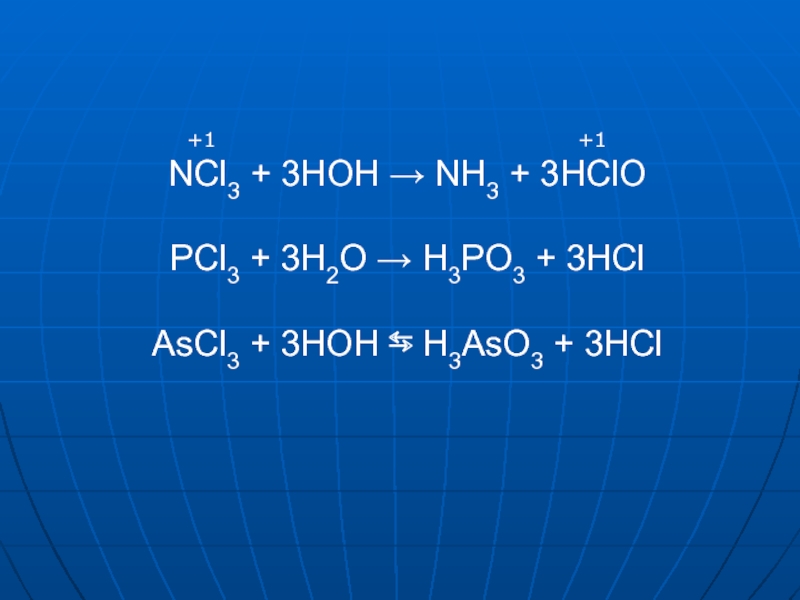
- 10. NCl3 + 3HOH → NH3 + 3HClO
- 11. SbCl3 + HOH ⇆ SbOHCl2 + HCl
- 12. +5 N2O5
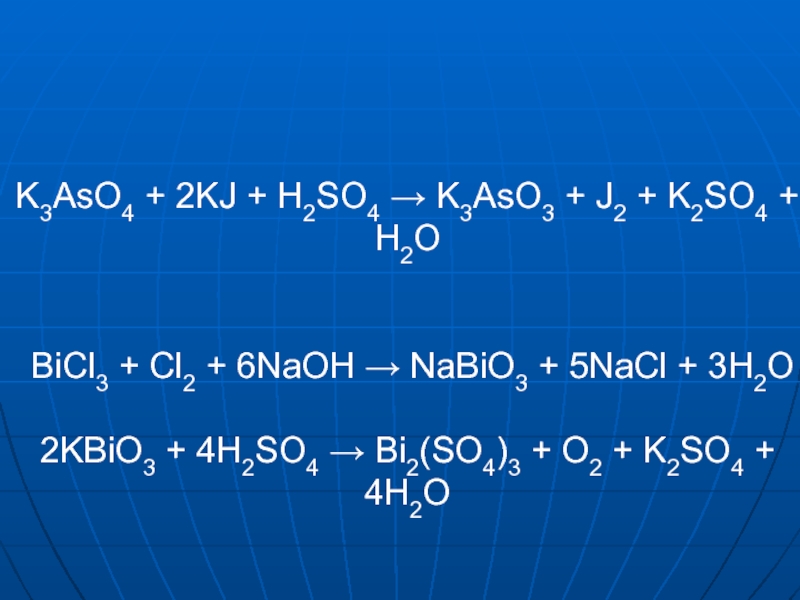
- 13. K3AsO4 + 2KJ + H2SO4
- 14. Скачать презентанцию
Слайды и текст этой презентации
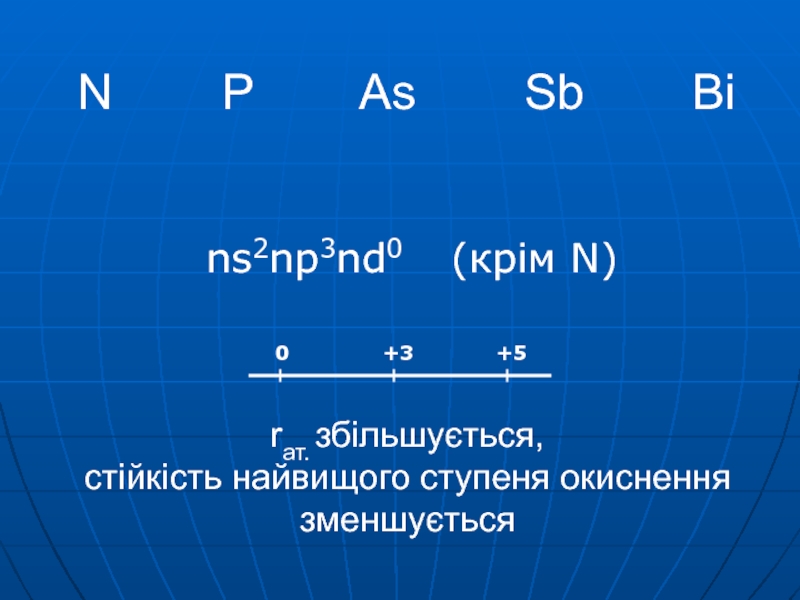
Слайд 2N P As
Sb Bi rат. збільшується, стійкість найвищого
ступеня окиснення зменшуєтьсяns2np3nd0 (крім N)
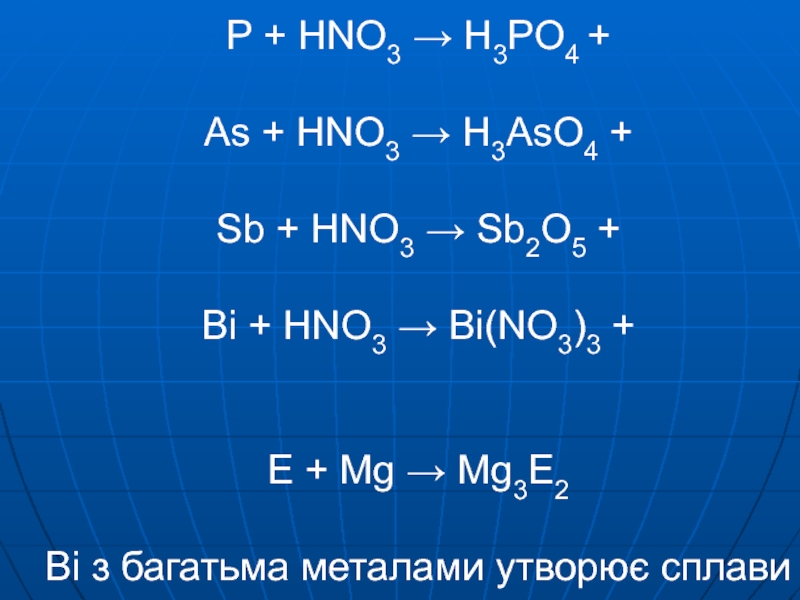
Слайд 4P + HNO3 → H3PO4 + As + HNO3 → H3AsO4
+ Sb + HNO3 → Sb2O5 + Bi + HNO3
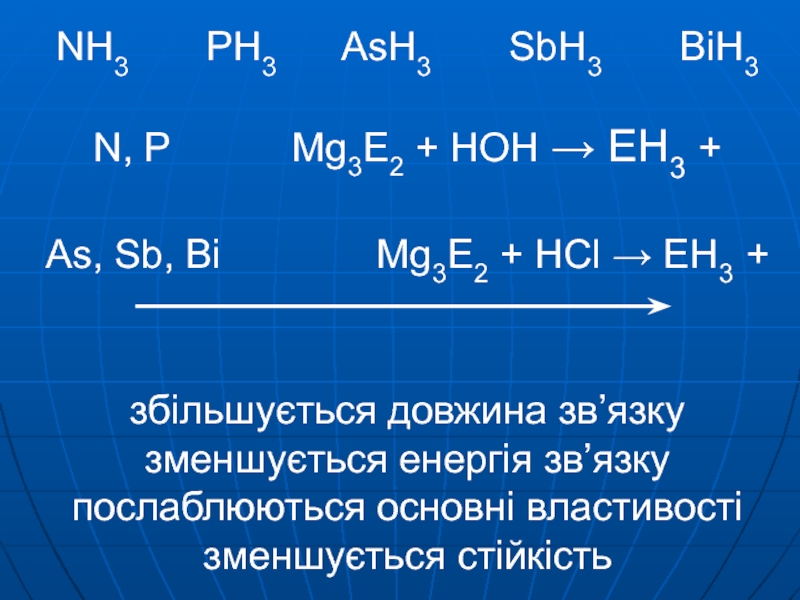
→ Bi(NO3)3 + E + Mg → Mg3E2 Bi з багатьма металами утворює сплавиСлайд 5NH3 PH3 AsH3
SbH3 BiH3 N, P
Mg3E2 + HOH → EH3 + As, Sb, Bi Mg3E2 + HCl → EH3 + збільшується довжина зв’язку зменшується енергія зв’язку послаблюються основні властивості зменшується стійкістьСлайд 6Взаємодія з кислотами : NH3 + H+ → NH4+ : PH3 +
HCl : AsH3 + H+ → Починаючи з AsH3 гідроген має
більшу ЕН, на атомах відсутній негативний зарядСлайд 7+3 N2O3 P2O3 As2O3
Sb2O3 Bi2O3 HNO2
H3PO3 H3AsO3 Sb(OH)3 Bi(OH)3Збільшується радіус атома
Збільшується довжина і зменшується єнергія E-OH
Основні властивості збільшуються
Відновні властивості зменшуються
Слайд 8HNO2, H3PO3 – кислоти середньої сили H3AsO3 – слабка Sb(OH)3 –
амфотерний Sb(OH)3 + HCl → Sb(OH)3 + 3NaOH → Na3[Sb(OH)6] Bi(OH)3
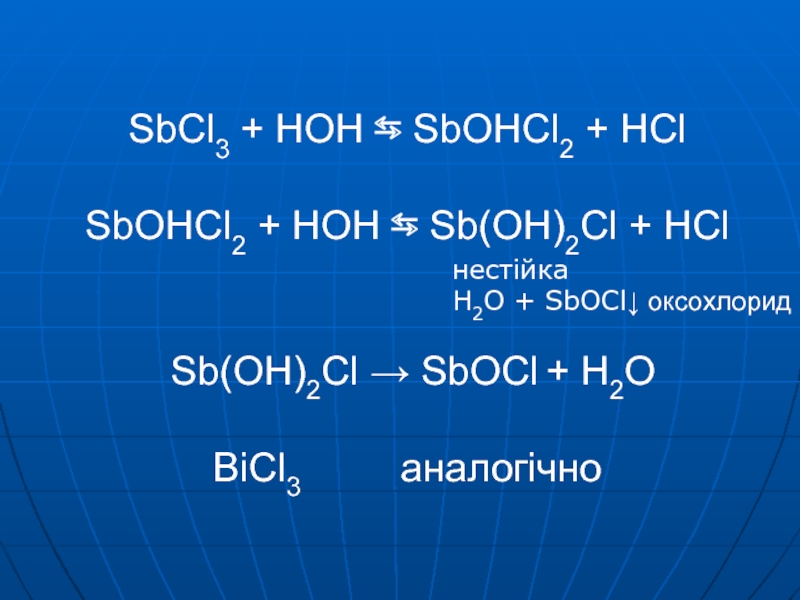
– основнийСлайд 11SbCl3 + HOH ⇆ SbOHCl2 + HCl SbOHCl2 + HOH ⇆
Sb(OH)2Cl + HCl Sb(OH)2Cl → SbOCl + H2O BiCl3
аналогічнонестійка
H2O + SbOCl↓ оксохлорид
Слайд 12+5 N2O5 P2O5
As2O5 Sb2O5
(Bi2O5)Зменшення кислотних властивостей
Збільшення окисних властивостей
sp3
sp3
sp3
sp3d2