Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ациклические углеводороды
Содержание
- 1. Ациклические углеводороды
- 2. Вопросы:Предельные углеводороды: строение, свойства, применение.2. Алкены: строение, свойства, применение.3. Алкины: строение, свойства, применение.
- 3. Алканы (парафины) - это углеводороды, в которых
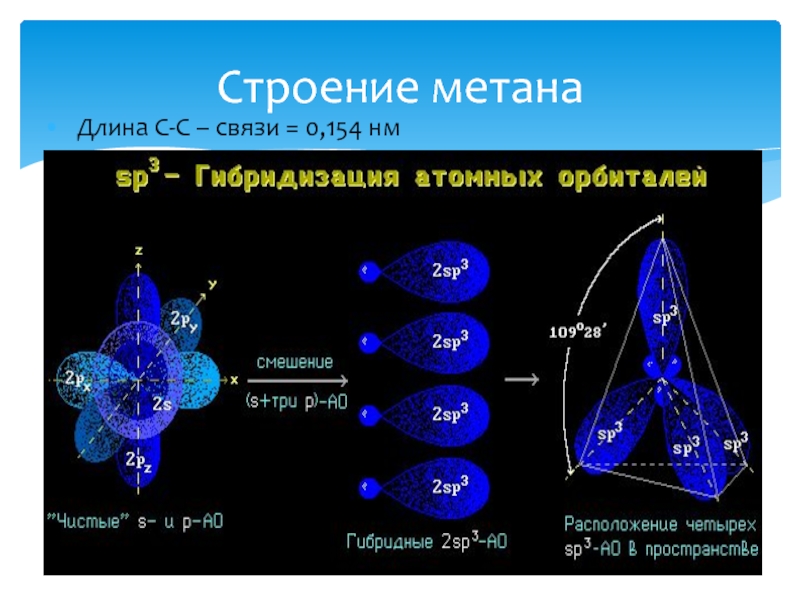
- 4. Строение метана Длина С-С – связи = 0,154 нм
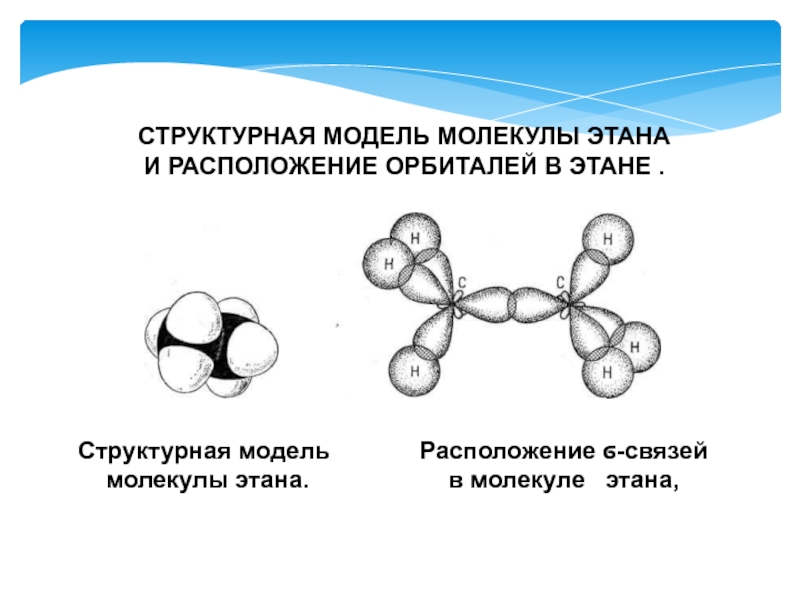
- 5. Расположение ϭ-связейв молекуле этана,СТРУКТУРНАЯ МОДЕЛЬ МОЛЕКУЛЫ
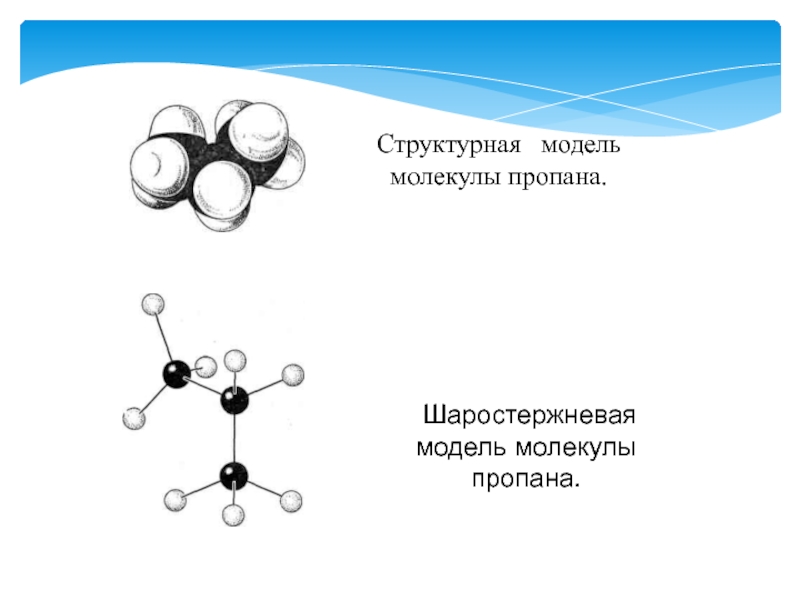
- 6. Слайд 6
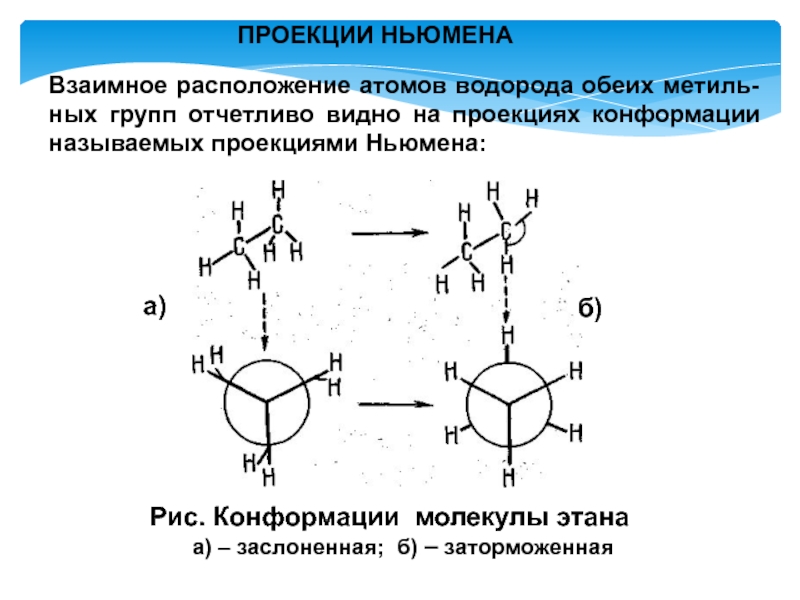
- 7. Для молекулы этана возможны две крайние конформации.
- 8. Рис. Конформации молекулы этанаа) – заслоненная; б)
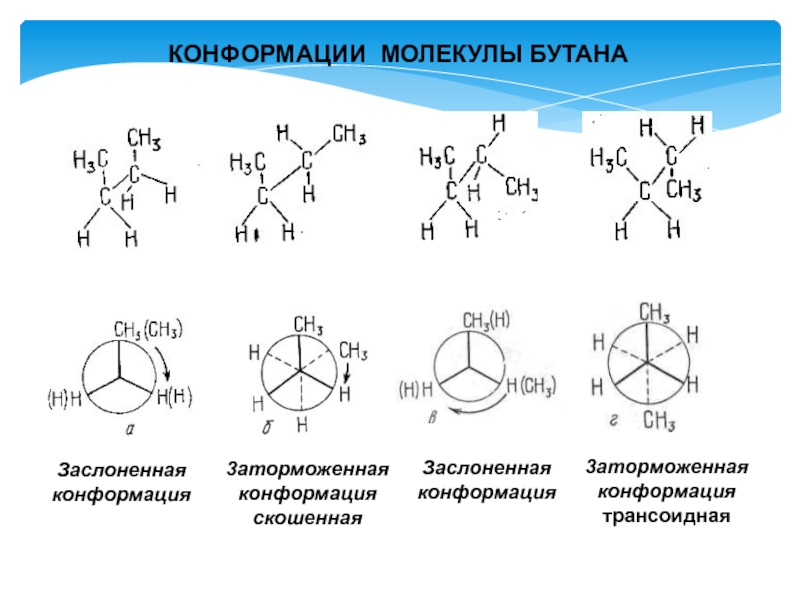
- 9. 3аторможеннаяконформацияскошенная Заслоненнаяконформация Заслоненнаяконформация 3аторможеннаяконформациятрансоидная КОНФОРМАЦИИ МОЛЕКУЛЫ БУТАНА
- 10. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВФизические свойства предельных углеводородов,
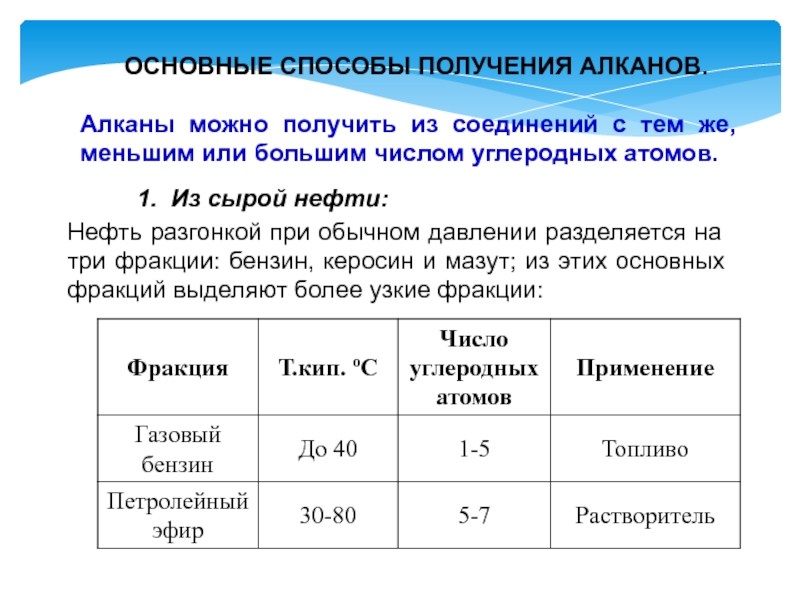
- 11. ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ. Алканы можно
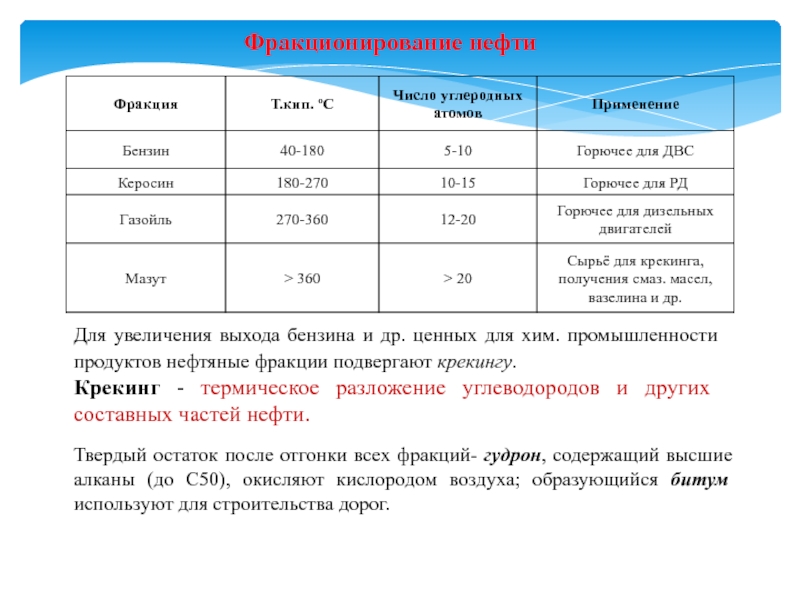
- 12. Фракционирование нефтиДля увеличения выхода бензина и др.
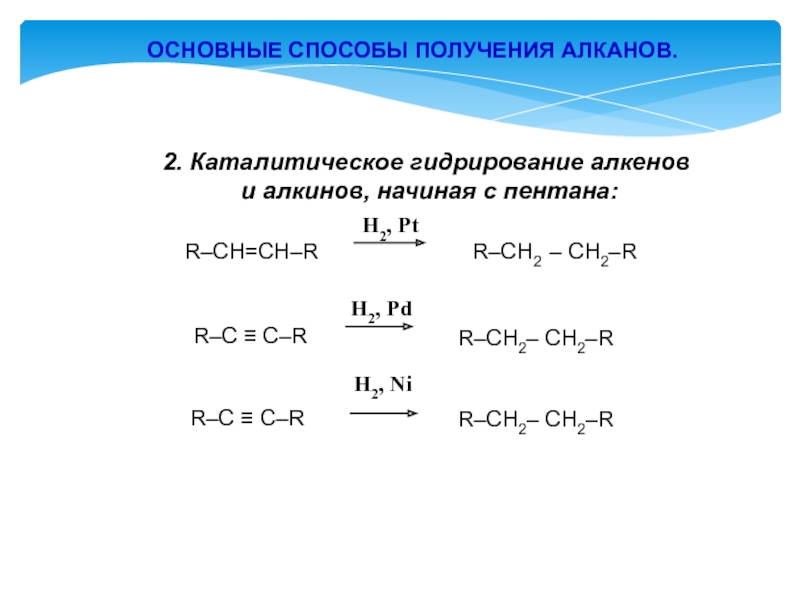
- 13. ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ. 2. Каталитическое гидрирование
- 14. ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ.3. Восстановление галогенопроизводных
- 15. 4. Реакция Вюрца: ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ.2C2H5I
- 16. Синтез Фишера-ТропшаnCO + (2n+1)H2→CnH2n+2 + H2OПроцесс Фишера
- 17. Химические свойстваРеакции радикального замещения а)галогенирование.В первую очередь
- 18. б) Сульфохлорирование (реакция Рида):При облучении УФ-светом алканы
- 19. Реакции окисленияа) ГорениеСnН2n+2 +(1,5n+0,5)O2 → nCO2+ (n+1)H
- 20. Термические превращенияДля метана:CH4 → С + 2H2 —
- 21. Реакция разложения При повышении
- 22. Получение синтез-газа. а) Взаимодействие СH4 с
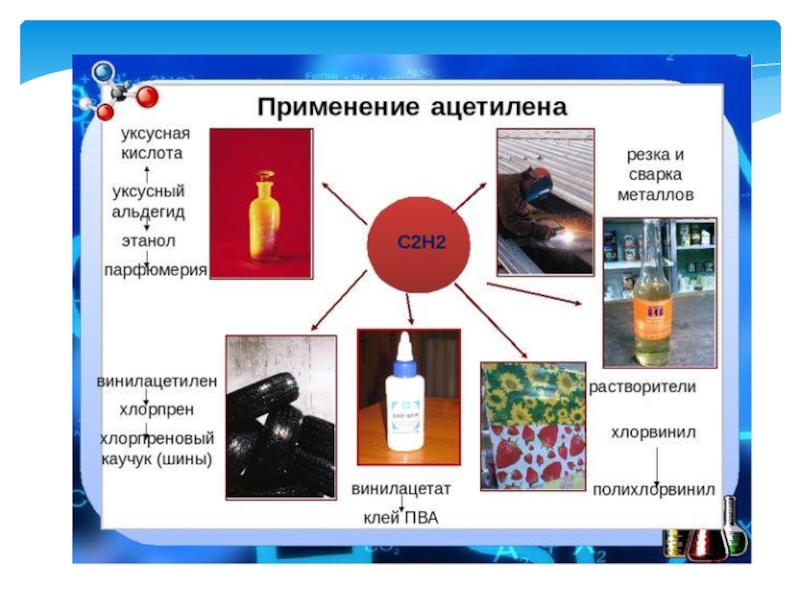
- 23. ПрименениеПолучение ацетиленаГорючее для дизельных и турбореактивных двигателейПолучение растворителейВ металлургииА также сырьё для синтезов спиртов, альдегидов, кислот.
- 24. Применение алканов1-3 – производство сажи(1 – картрижи;2
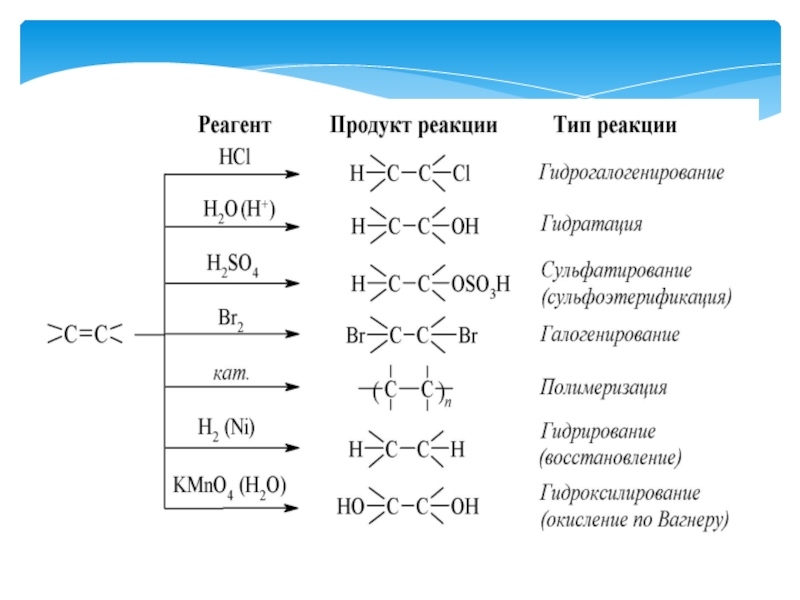
- 25. Алкены – углеводороды, содержащие в молекуле одну
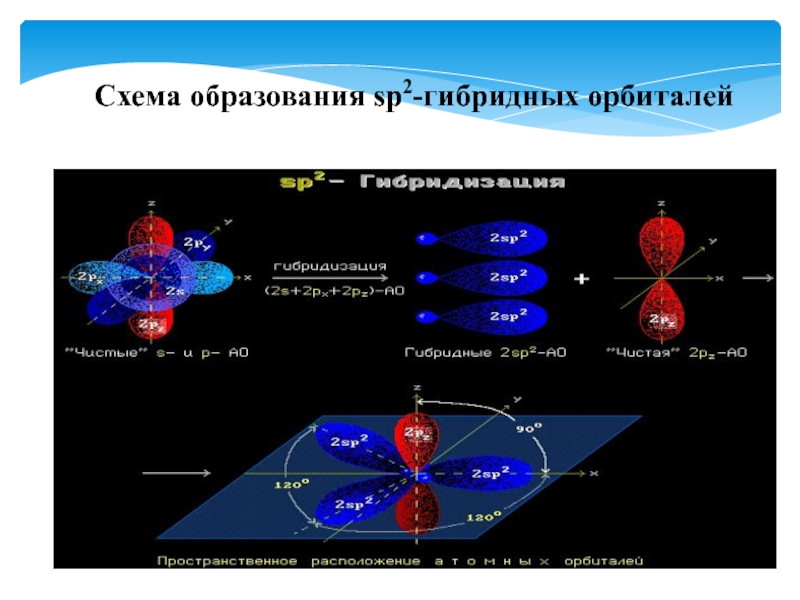
- 26. Схема образования sp2-гибридных орбиталей
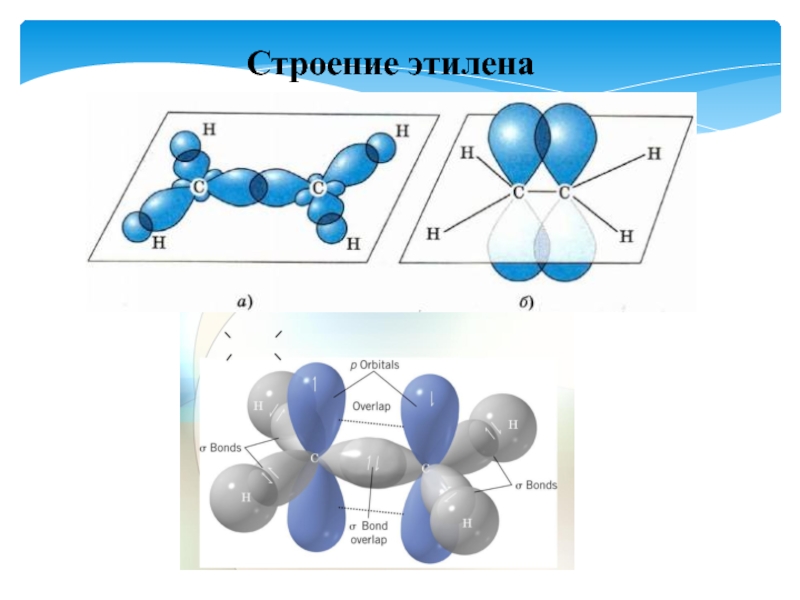
- 27. Строение этилена
- 28. Слайд 28
- 29. Слайд 29
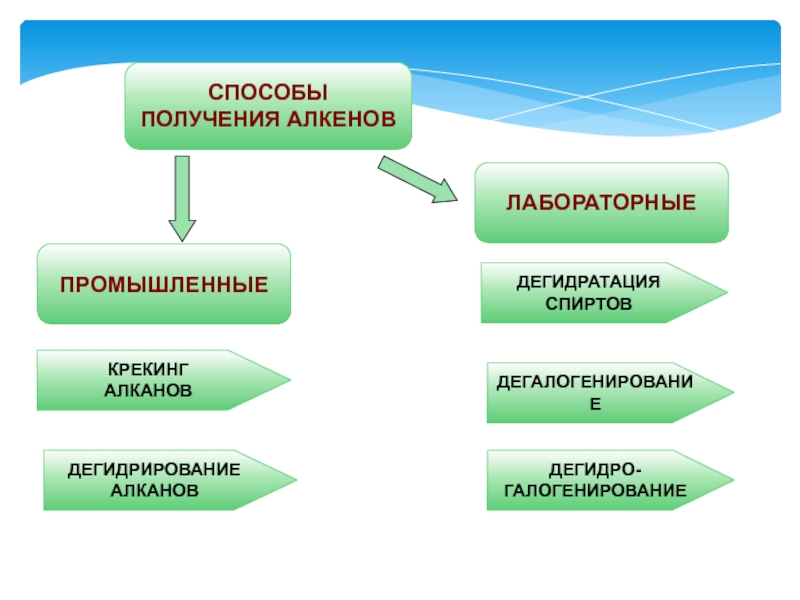
- 30. ПРОМЫШЛЕННЫЕСПОСОБЫПОЛУЧЕНИЯ АЛКЕНОВЛАБОРАТОРНЫЕКРЕКИНГ АЛКАНОВДЕГИДРИРОВАНИЕАЛКАНОВДЕГИДРАТАЦИЯСПИРТОВДЕГАЛОГЕНИРОВАНИЕДЕГИДРО-ГАЛОГЕНИРОВАНИЕ
- 31. Слайд 31
- 32. Слайд 32
- 33. Применение этилена
- 34. Слайд 34
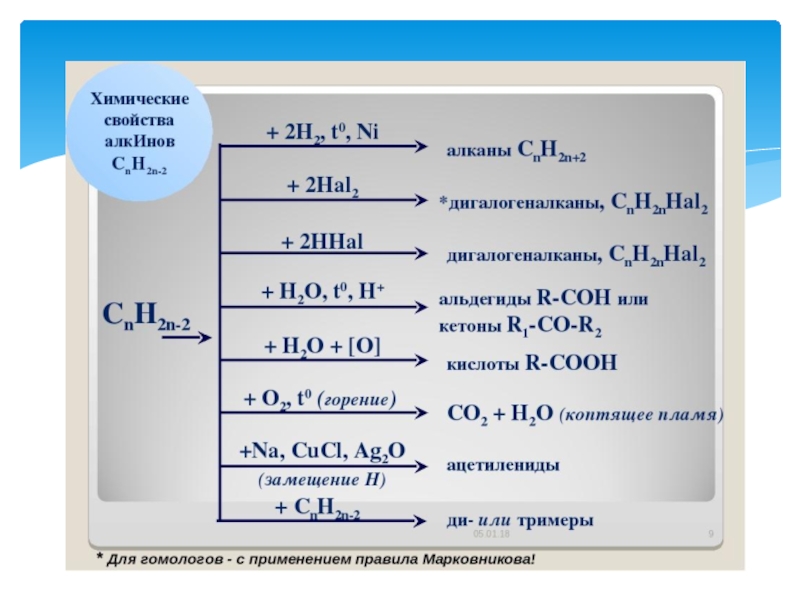
- 35. АЛКИНЫАлки́ны (ацетиленовые углеводороды) — углеводороды, содержащие тройную
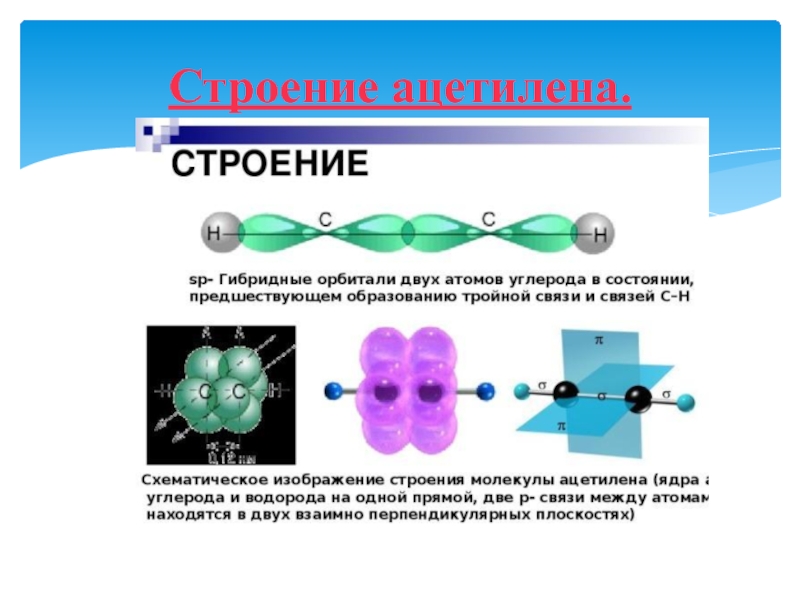
- 36. Строение ацетилена.
- 37. Изомерия алкинов. Изомерия положения тройной связи
- 38. Получение.1) В промышленноси ацетилен получают высокотемпературным пиролизом метана.
- 39. Физические свойства.При обычных условиях алкиныС2Н2-С4Н6 – газы,
- 40. Слайд 40
- 41. Слайд 41
- 42. Слайд 42
- 43. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Вопросы:
Предельные углеводороды: строение, свойства, применение.
2. Алкены: строение, свойства, применение.
3. Алкины:
строение, свойства, применение.
Слайд 3Алканы (парафины) - это углеводороды, в которых атомы углерода соединены
друг с другом простыми (одинарными) связями, а остальные свободные их
валентности насыщены атомами водорода.В обычных условиях алканы мало реакционноспособны, откуда возникло их название "парафины" – от лат. parrum affinis – малоактивный. Члены гомологического ряда предельных углеводородов отвечают общей формуле
CnH2n+2.
Слайд 5Расположение ϭ-связей
в молекуле этана,
СТРУКТУРНАЯ МОДЕЛЬ МОЛЕКУЛЫ ЭТАНА И РАСПОЛОЖЕНИЕ
ОРБИТАЛЕЙ В ЭТАНЕ .
Структурная модель
молекулы этана.
Слайд 7Для молекулы этана возможны две крайние конформации. В одной из
них атомы водорода метильных групп расположены один над другим, в
другой они находятся в просветах.КОНФОРМАЦИИ
Различные геометрические формы молекул, переходящие друг в друга путем вращения вокруг простых связей, называют конформациями или поворотными изомерами (конформерами)
Слайд 8Рис. Конформации молекулы этана
а) – заслоненная; б) – заторможенная
Взаимное расположение
атомов водорода обеих метиль-ных групп отчетливо видно на проекциях конформации
называемых проекциями Ньюмена:ПРОЕКЦИИ НЬЮМЕНА
а)
б)
Слайд 93аторможенная
конформация
скошенная
Заслоненная
конформация
Заслоненная
конформация
3аторможенная
конформация
трансоидная
КОНФОРМАЦИИ МОЛЕКУЛЫ БУТАНА
Слайд 10 ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Физические свойства предельных углеводородов, как и других
органических соединений, определяются их составом и строением. В гомологическом ряду
углеводородов с нормальной цепью четыре первых гомолога при обычной температуре — газы, далее следуют жидкости и, начиная с C16H34, — твердые вещества (табл.).1 При температуре кипения. 2 В жидком состоянии, под давлением.
Слайд 11 ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ.
Алканы можно получить из соединений
с тем же, меньшим или большим числом углеродных атомов.
Нефть разгонкой
при обычном давлении разделяется на три фракции: бензин, керосин и мазут; из этих основных фракций выделяют более узкие фракции: 1. Из сырой нефти:
Слайд 12Фракционирование нефти
Для увеличения выхода бензина и др. ценных для хим.
промышленности продуктов нефтяные фракции подвергают крекингу.
Крекинг - термическое разложение
углеводородов и других составных частей нефти. Твердый остаток после отгонки всех фракций- гудрон, содержащий высшие алканы (до С50), окисляют кислородом воздуха; образующийся битум используют для строительства дорог.
Слайд 13ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ.
2. Каталитическое гидрирование алкенов
и алкинов,
начиная с пентана:
R–CH=CH–R
R–CH2 – CH2–R H2, Pt
R–CH2– CH2–R
R–C ≡ С–R
H2, Pd
R–C ≡ С–R
R–CH2– CH2–R
H2, Ni
Слайд 14 ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ.
3. Восстановление галогенопроизводных R-X
а) R-X
R-H + HX
H2/Pt
б) R-X
R-H + HX
Na,
C2H5OHв) R- I + HI*
R-H + I2
* Иодистый водород восстанавливает и кислородные соединения (кислоты, спирты, эфиры и др.).
Слайд 154. Реакция Вюрца:
ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ.
2C2H5I + 2Na
С2Н5– С2Н5 + 2NaI
возможный механизм:
R–СН2 + R–СН–Сl
R–СН2–СН2–R + СlR–CH2–Cl + 2Na [R—CН2] Na + NaCl
-
-
··
··
+
··
-
Вместо натрия в этой реакции могут быть использованы и другие металлы, например литий, магний, цинк.
Слайд 16Синтез Фишера-Тропша
nCO + (2n+1)H2→CnH2n+2 + H2O
Процесс Фишера — Тропша —
это химическая реакция, происходящая в присутствии катализатора, в которой монооксид
углерода (CO) и водород H2 преобразуются в различные жидкие углеводороды. Обычно используются катализаторы, содержащие железо и кобальт. Принципиальное значение этого процесса — это производство синтетических углеводородов для использования в качестве синтетического смазочного масла или синтетического топлива.синтетическое смазочное масло
Слайд 17Химические свойства
Реакции радикального замещения
а)галогенирование.
В первую очередь галогенируется наименее гидрированый
атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в
последнюю очередь). Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:CH4 + Cl2→ CH 3Cl + HCl (хлорметан)
CH 3Cl + Cl2 → CH 2Cl2 + HCl (дихлорметан)
CH 2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
.
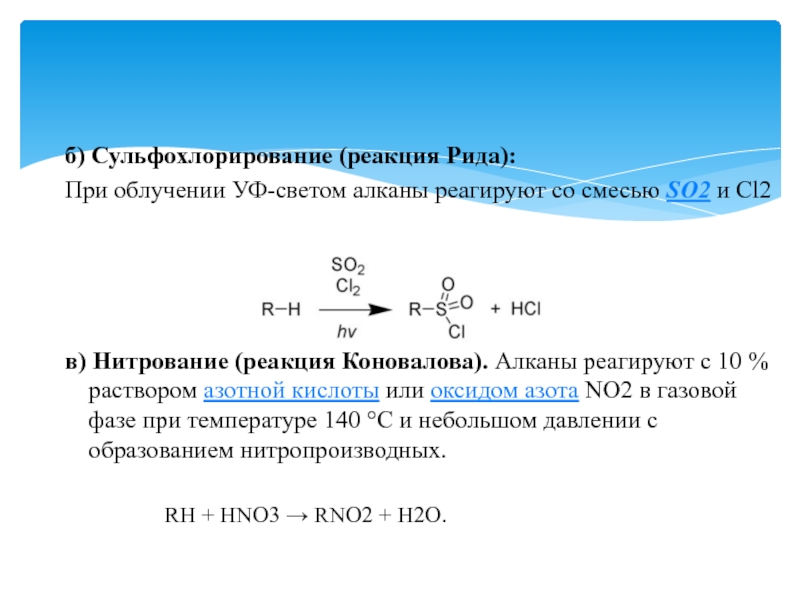
Слайд 18б) Сульфохлорирование (реакция Рида):
При облучении УФ-светом алканы реагируют со смесью
SO2 и Cl2
в) Нитрование (реакция Коновалова). Алканы реагируют с
10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных.RH + HNO3 → RNO2 + H2O.
Слайд 19Реакции окисления
а) Горение
СnН2n+2 +(1,5n+0,5)O2 → nCO2+ (n+1)H 2O
б) Каталитическое
окисление
При мягком окислении СН4 в присутствии катализатора кислородом
при 200 °C могут образоваться:метиловый спирт: 2СН4 + О2 → 2СН 3ОН;
формальдегид: СН4 + О2 → СН 2О + Н 2O;
муравьиная кислота: 2СН4 + 3О2 → 2НСООН + 2Н2O.
Слайд 20Термические превращения
Для метана:
CH4 → С + 2H2 — при 1000 °C.
Частичный крекинг:
2CH4
→ C2H2 + 3H2 — при 1500 °C.
Изомеризация:
Под действием катализатора (например, AlCl3)
происходит изомеризация алкана: например, бутан (C 4H10), взаимодействуя с хлоридом алюминия (AlCl3), превращается из н-бутана в 2-метилпропан.С марганцовокислым калием (KMnO4) и бромной водой (Br2) алканы не взаимодействуют.
Слайд 21Реакция разложения
При повышении температуры до 550-6500
С происходит более глубокое расщепление – пиролиз. В результате образуются
уголь(кокс), простейшие алканы (метан, этан, пропан), углеводороды других классов (этилен С2H4, ацетилен С2H2, и т.д.) и водород H2 . Один из возможных вариантов следующий:С8H18 → 2С + 2СH4+ С2H6 + С2H4 + 2H2
октан кокс метан этан этилен водород
Слайд 22Получение синтез-газа.
а) Взаимодействие СH4 с водой;
СH4 +H2O → СO+3H2
синтез-газ б) взаимодействием СH4 с СО2; СH4 + СО2→ 2СО+2H2 синтез-газ Реакции протекают при 800-9000 С и в присутствии катализатора (Ni, MgO,AI2O3)Слайд 23Применение
Получение ацетилена
Горючее для дизельных и турбореактивных двигателей
Получение растворителей
В металлургии
А также
сырьё для синтезов спиртов, альдегидов, кислот.
Слайд 24Применение алканов
1-3 – производство сажи
(1 – картрижи;
2 – резина;
3 –
типографическая краска)
4-7 – получение
органических веществ
(4 – растворителей;
5 – хладогентов,
используемых
в холодильных установках;
6 – метанол;
7 - ацетилен)
Слайд 25Алкены – углеводороды, содержащие в молекуле одну двойную связь между
атомами углерода, а качественный и количественный состав выражается общей формулой
СnН2n, где n ≥ 2.
Слайд 30ПРОМЫШЛЕННЫЕ
СПОСОБЫ
ПОЛУЧЕНИЯ АЛКЕНОВ
ЛАБОРАТОРНЫЕ
КРЕКИНГ
АЛКАНОВ
ДЕГИДРИРОВАНИЕ
АЛКАНОВ
ДЕГИДРАТАЦИЯ
СПИРТОВ
ДЕГАЛОГЕНИРОВАНИЕ
ДЕГИДРО-
ГАЛОГЕНИРОВАНИЕ
Слайд 35АЛКИНЫ
Алки́ны (ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами
углерода. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.
CnHn-2
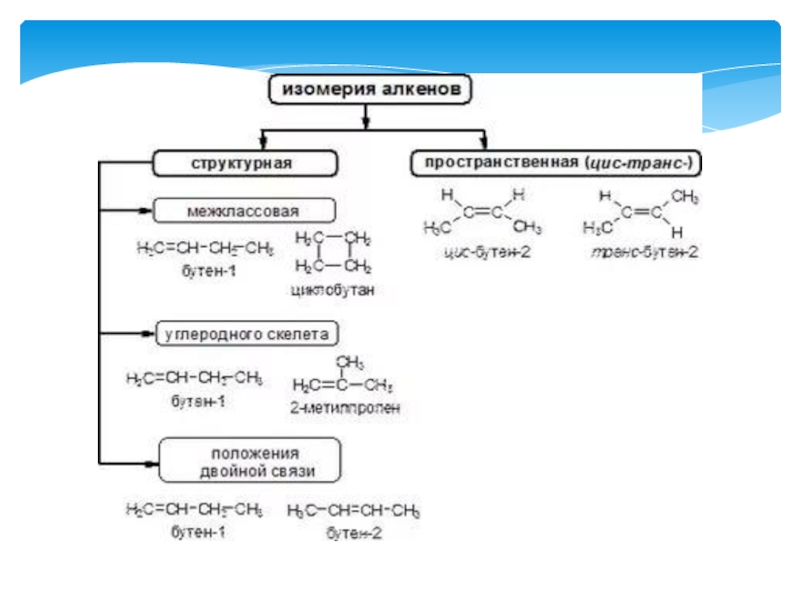
Слайд 37Изомерия алкинов.
Изомерия положения тройной связи (начиная с С4Н6):
Изомерия углеродного скелета ( с С5Н8):
Межклассовая
изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:Слайд 38Получение.
1) В промышленноси ацетилен получают высокотемпературным пиролизом метана.
1500ºС
2CH4 → HC≡CH + 3H2
2) Дегидрирование алканов
CH3 – CH3 (Ni, t)↔ 2H2 + CH CH
3) Ацетилен получают карбидным способом при разложении карбида кальция водой.
CaC2 + 2H2O → Ca(OH)2 + HC≡CH
4) Алкины можно получить дегидрогалогенированием
дигалогенопроизводных парафинов. Атомы
галогена при этом могут быть расположены как у соседних атомов углерода, так и у одного углеродного атома.
Слайд 39Физические свойства.
При обычных условиях алкины
С2Н2-С4Н6 – газы,
С5Н8-С16Н30 – жидкости,
с С17Н32 – твердые вещества.
имеют более высокие температуры кипения,
чем аналоги в алкенах. плохо растворимы в воде, лучше — в органических растворителях.