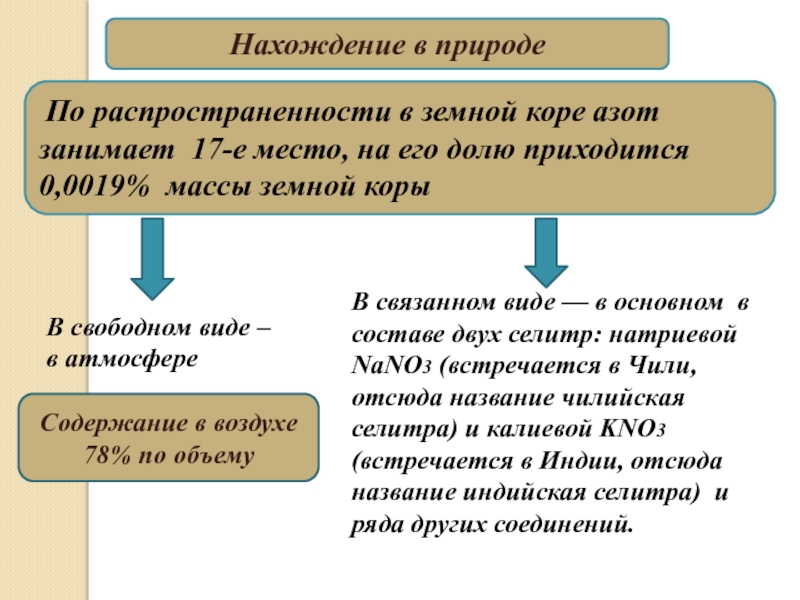
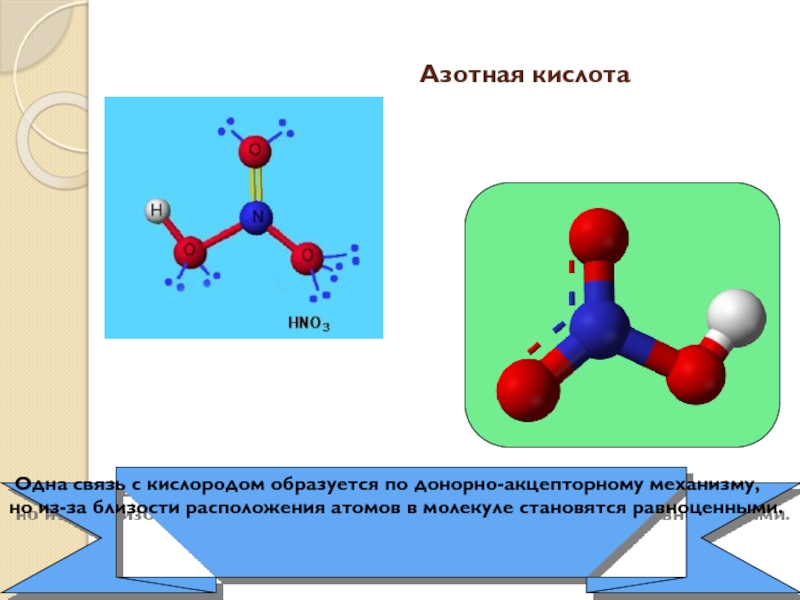
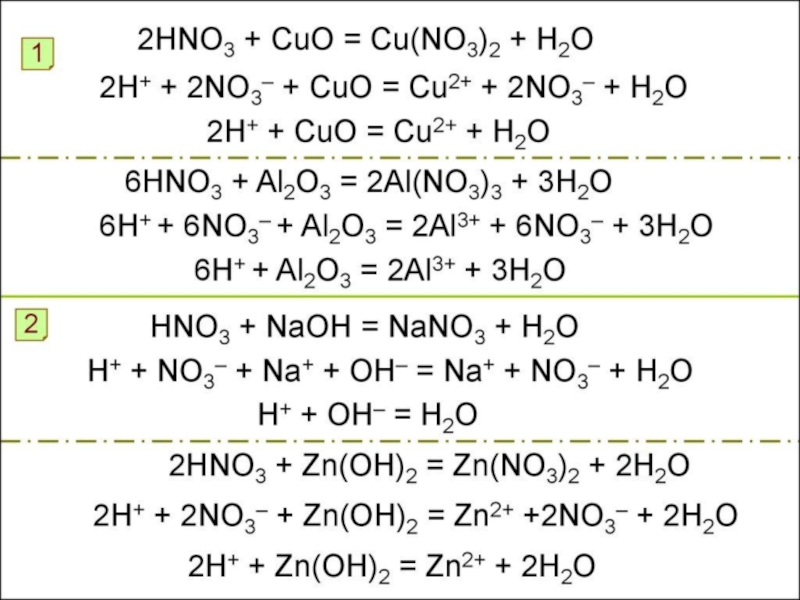
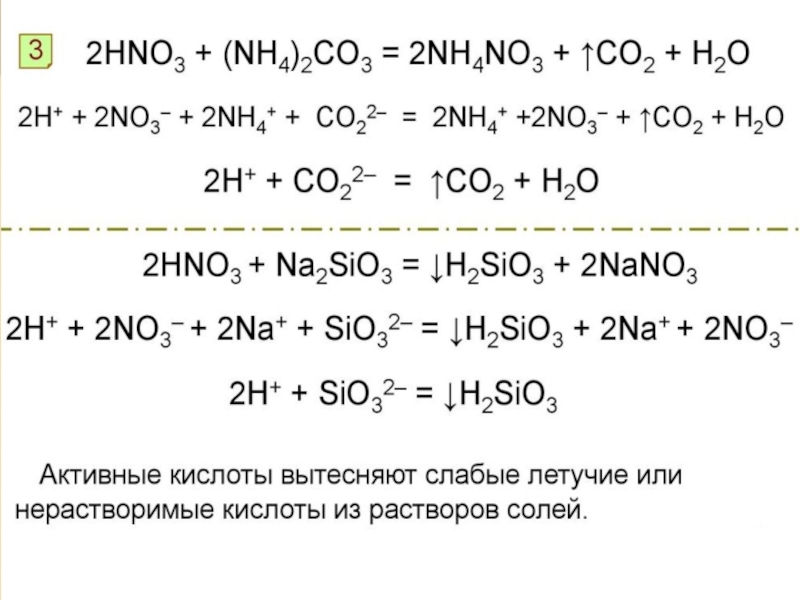
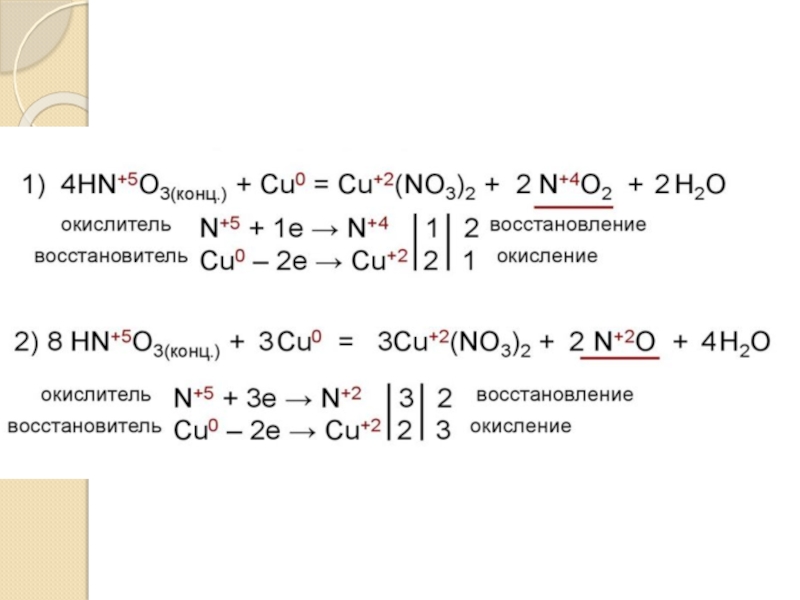
17-е место, на его долю приходится 0,0019% массы земной коры
В
связанном виде — в основном в составе двух селитр: натриевой NaNO3 (встречается в Чили, отсюда название чилийская селитра) и калиевой KNO3 (встречается в Индии, отсюда название индийская селитра) и ряда других соединений. В свободном виде –
в атмосфере
Содержание в воздухе 78% по объему