Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Белки и аминокислоты. Классификация, структура
Содержание
- 1. Белки и аминокислоты. Классификация, структура
- 2. 1. Белки, структура белков, связи.2. Аминокислоты. Классификация
- 3. . 1. Белки, структура белков, связи.Белки называют
- 4. Свойства белков, на которых основана классификация, крайне
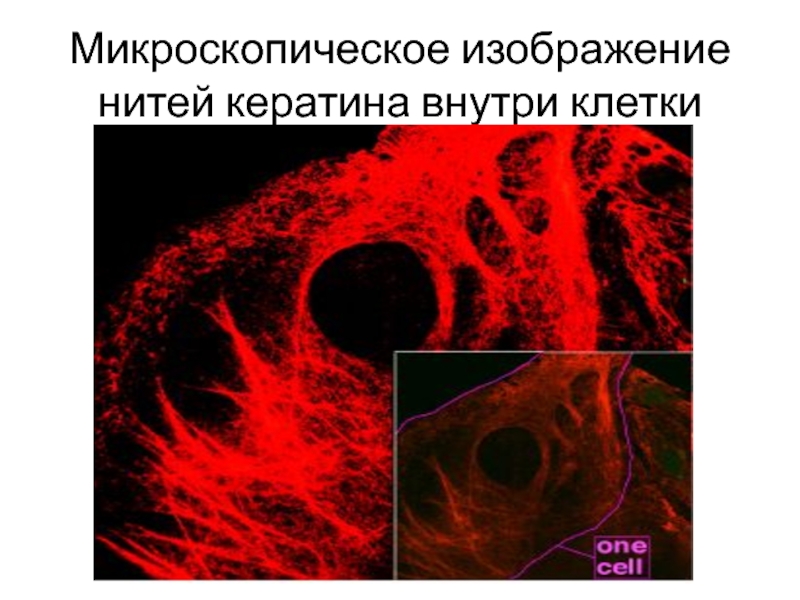
- 5. Микроскопическое изображение нитей кератина внутри клетки
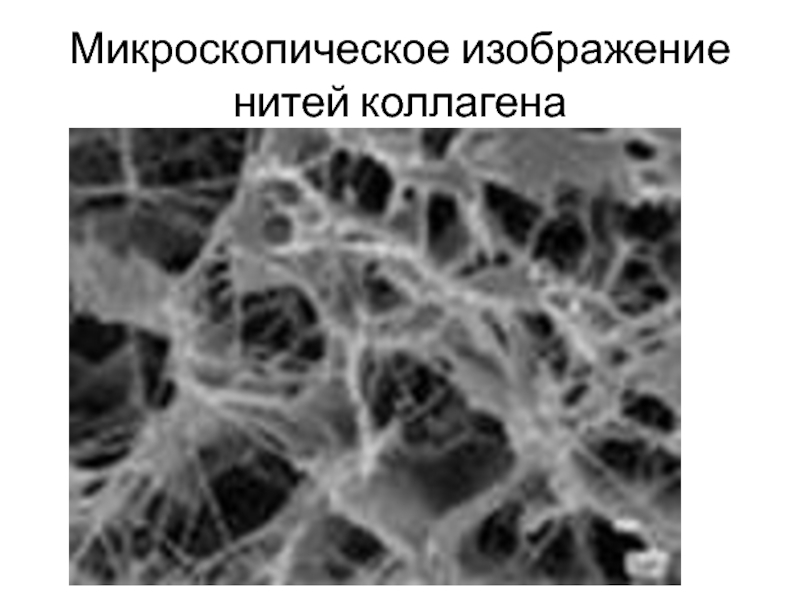
- 6. Микроскопическое изображение нитей коллагена
- 7. Глобулярные белки (яичный альбумин и белки сыворотки)
- 8. Белки острой фазы воспаления
- 9. Имеются сложные белки, в молекулу которых входит
- 10. Полипептидная цепь, построенная из аминокислот, представляет собой
- 11. Молекула белка состоит из нескольких сотен аминокислот,
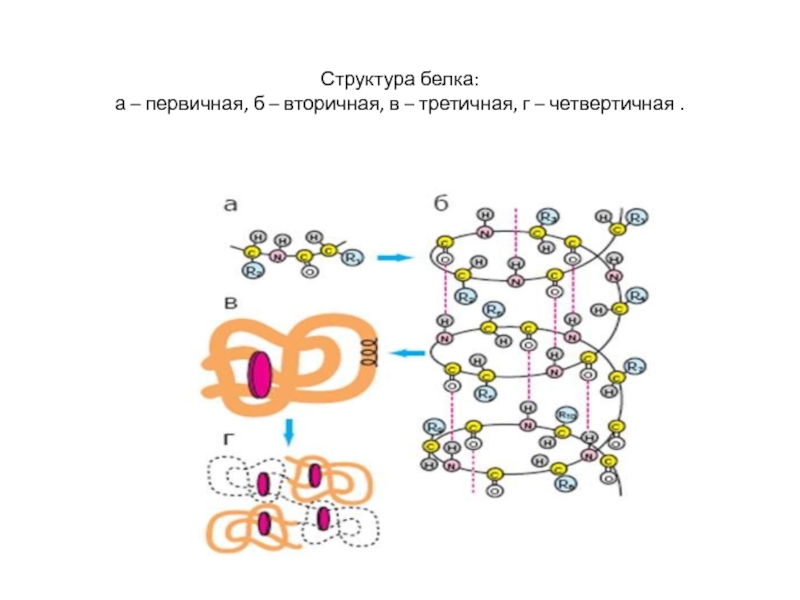
- 12. Структура белка: а – первичная, б – вторичная, в – третичная, г – четвертичная .
- 13. В структуре белков встречаются различные типы связей.
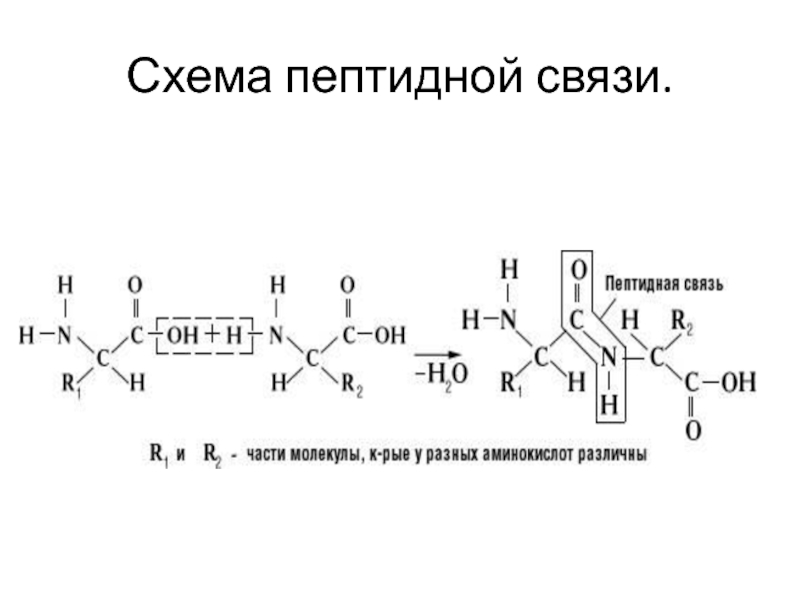
- 14. Схема пептидной связи.
- 15. Аминокислоты. Классификация аминокислот.Аминокислота – производное органической кислоты
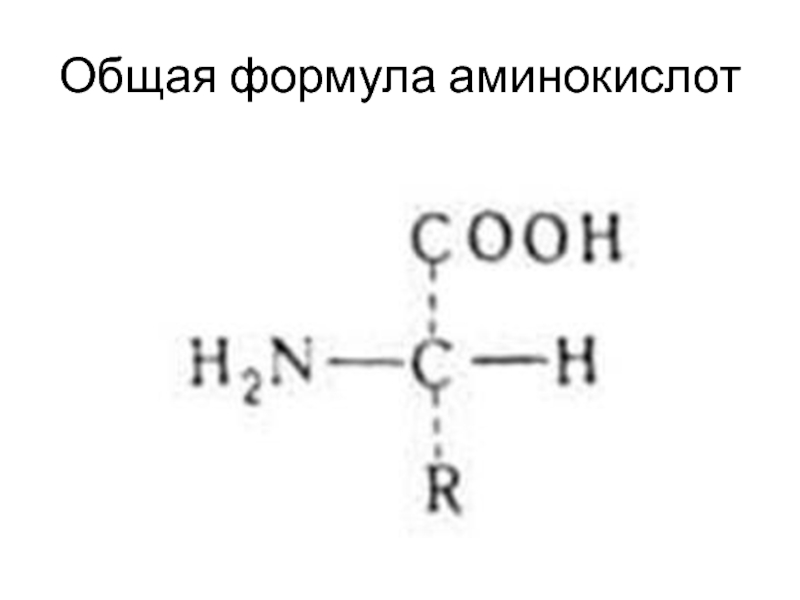
- 16. Общая формула аминокислот
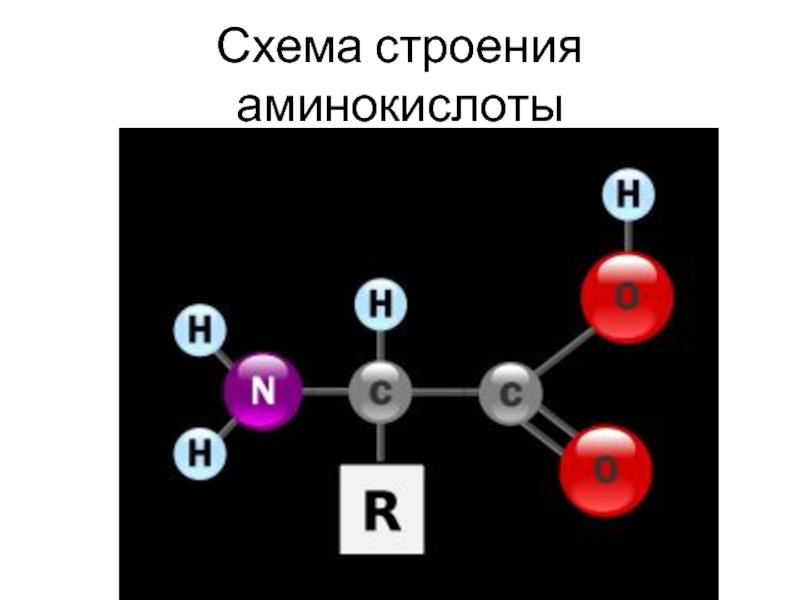
- 17. Схема строения аминокислоты
- 18. Связь –NH–CO– называется пептидной связью. Комбинация из
- 19. Расстояние между двумя пептидными связями равно примерно
- 20. Белки построены из 20 различных а.к.,
- 21. 3. Разделение, выделение и идентификация белков.
- 22. Метод обогащения считают эффективным: если
- 23. Для оценки чистоты белкового препарата используют
- 24. При выделении белка их тканей или клеток
- 25. Для очистки белка часто используют высаливание (добавление
- 26. Для дальнейшей очистки и обогащения белков используют
- 27. Существуют 3 основных способа разделения белков на
- 28. 3. Гель-электрофорез с додецилсульфатом натрия (ДСН). ДСН
- 29. Обычный электрофорез не позволяет разделять одинаково заряженные
- 30. 4. Анализ аминокислотных последовательностей: определение первичной
- 31. Для определения аминокислотной последовательности белок очищают до
- 32. Для количественного определения применяется ионообменная хроматография. При
- 33. Для определения аминокислотного состава молекулу белка расщепляют
- 34. Наибольшей специфичностью обладает трипсин. Примерно через каждые
- 35. С-концевые а.к. остатки идентифицируются по их отщеплению
- 36. N-концевые остатки в пептидах определяют чаще всего
- 37. Оставшийся пептид можно вновь подвергнуть той же
- 38. Скачать презентанцию
1. Белки, структура белков, связи.2. Аминокислоты. Классификация аминокислот.3. Разделение, выделение и идентификация белков.4. Анализ аминокислотных последовательностей: определение первичной структуры.
Слайды и текст этой презентации
Слайд 21. Белки, структура белков, связи.
2. Аминокислоты. Классификация аминокислот.
3. Разделение, выделение
и идентификация белков.
Слайд 3. 1. Белки, структура белков, связи.
Белки называют также протеинами (греч.
«протео» – занимаю 1-е место). Все основные функции организма связаны
со специфическими белками. Они присутствуют в каждой клетке и каждом клеточном органоиде.Слайд 4Свойства белков, на которых основана классификация, крайне разнообразны. Так, склеропротеины
(кератин и коллаген) нерастворимы и обладают фибриллярной структурой.
Слайд 7Глобулярные белки (яичный альбумин и белки сыворотки) растворимы в воде
и солевых растворах и имеют сферическую форму.
Слайд 9Имеются сложные белки, в молекулу которых входит небелковая часть (простетическая
группа). К ним принадлежат нуклеопротеиды, липопротеиды, хромопротеиды (гемоглобин, цитохромы, гемоцианин)
и гликопротеиды.Слайд 10Полипептидная цепь, построенная из аминокислот, представляет собой первичную структуру белковой
молекулы. Это наиболее важная специфическая структура, определяющая вторичную и третичную
структуры. Последовательность расположения аминокислот обуславливает свойства белков.Слайд 11Молекула белка состоит из нескольких сотен аминокислот, поэтому она изогнута
определенным образом и образует вторичную структуру.
В глобулярных белках полипептидные
цепи свернуты определенным образом и образуют компактную, третичную структуру.Слайд 13В структуре белков встречаются различные типы связей.
Первичная структура определяется
ковалентными (химическими) пептидными связями. Вторичная и третичная структуры стабилизируются следующими
видами связей:ионные (электростатические) – между положительными и отрицательными ионами, находящимися на расстоянии 2-3 А,
водородные – (длина связи 2,5-3,2 А) более слабые, чем ионные, образуются между 2-мя сильно отрицательными атомами – C, N, O,
связи, образующиеся за счет вандерваальсовых сил при взаимодействии полярных боковых цепей,
взаимодействие неполярных боковых цепей.
Слайд 15Аминокислоты. Классификация аминокислот.
Аминокислота – производное органической кислоты соединение, в котором
водород в α-положении замещен на аминогруппу. Т.к. в а.к. присутствуют
одновременно кислая и основная группы, они амфотерны.Присутствующие в клетке свободные а.к. образуются в результате расщепления белков или поступают из межклеточной жидкости. Свободные а.к. составляют аминокислотный фонд, из которого клетка черпает строительные блоки для синтеза новых белков.
Слайд 18Связь –NH–CO– называется пептидной связью. Комбинация из двух аминокислот –
дипептид, из 3-х – трипептид. Пептид, состоящий из небольшого числа
аминокислот – олигопептид, из большого – полипептид.Слайд 19Расстояние между двумя пептидными связями равно примерно 3,5 А, а
средний объем аминокислотного остатка равен 3,5х4,6х10 А, или 161 А3.
Следовательно, например, молекула белка с молекулярным весом 30 000, состоящая из 300 аминокислотных остатков, в полностью вытянутом состоянии должна иметь длину 1000 А, ширину 10 А и толщину 4,6 А.Слайд 20 Белки построены из 20 различных а.к., которые можно классифицировать следующим
образом:
Моноаминомонокарбоновые: глицин (гли), аланин (ала), валин(вал), лейцин (лей), изолейцин (илей).
Моноаминодикарбоновые:
глутаминовая кислота (глу), аспарагиновая кислота (асп).Диаминомонокарбоновые: аргинин (арг), лизин (лиз), оксилизин (олиз).
Гидроксилсодержащие: треонин (тре), серин (сер).
Серусодержащие: цистин (цис), метионин (мет).
Ароматические: фенилаланин (фен), тирозин (тир).
Гетероциклические: триптофан (три), пролин (про), оксипролин (опро), гистидин (гис).
Слайд 21
3. Разделение, выделение и идентификация белков.
Большинство методов выделения пригодно в
основном для гидрофильных белков. В качестве растворителей используются ионные и
неионные детергенты, такие как додецилсульфат натрия, холат натрия, соли желчных кислот и др.Процедура очистки белка, как правило, состоит из ряда этапов обогащения.
Слайд 22
Метод обогащения считают эффективным:
если специфическая активность на единицу веса
всего белка увеличивается (например, возрастает каталитическая активность фермента на 1
мг белка в пробе).Общая активность после данного этапа обогащения существенно не уменьшается.
Слайд 23
Для оценки чистоты белкового препарата используют следующие критерии:
кристаллизуемость;
кинетика растворимости;
гомогенность при
ультрацентрифугировании или электрофорезе;
однозначность данных при определении аминокислотной последовательности;
однотипность каталитической активности
(отсутствие побочных активностей);гомогенность при изучении хроматографическими методами (при использовании различных систем растворителей).
Слайд 24При выделении белка их тканей или клеток необходимо разрушить клеточную
структуру, не повредив структуру изучаемого белка. С этой целью используют
следующие методы:1) растирание,
2) фрагментация,
3) воздействие ультразвуком,
4) воздействие химическими и (или) ферментативными агентами.
При выделении белков используют буферы, учитывают температуру и ионную силу, а также время очищения белка.
Слайд 25Для очистки белка часто используют высаливание (добавление соли), оно, как
правило, обратимо. Одним из лучших высаливающих агентов служит (NH4)2SO4, т.к.
соль растворима в больших концентрациях. Из органических растворителей для высаливания используют ацетон, уксусную кислоту, диметилсульфоксид и др.Слайд 26Для дальнейшей очистки и обогащения белков используют различия в следующих
свойствах:
1) в молекулярной массе,
2) в растворимости,
3) в
электрическом заряде,4) в адсорбируемости определенными веществами,
5) в сродстве к другим молекулам.
Слайд 27Существуют 3 основных способа разделения белков на основе их молекулярной
массы:
1. Разделение в поле тяготения (центрифугирование).
2. Метод молекулярного сита. Он
основан на том, что поры в мембране или между частицами проницаемы для молекул только в том случае, если d молекул < d пор.Слайд 283. Гель-электрофорез с додецилсульфатом натрия (ДСН). ДСН гидрофобной частью связывается
с молекулой белка. Молекула ДСН несет отрицательный заряд и, т.о.,
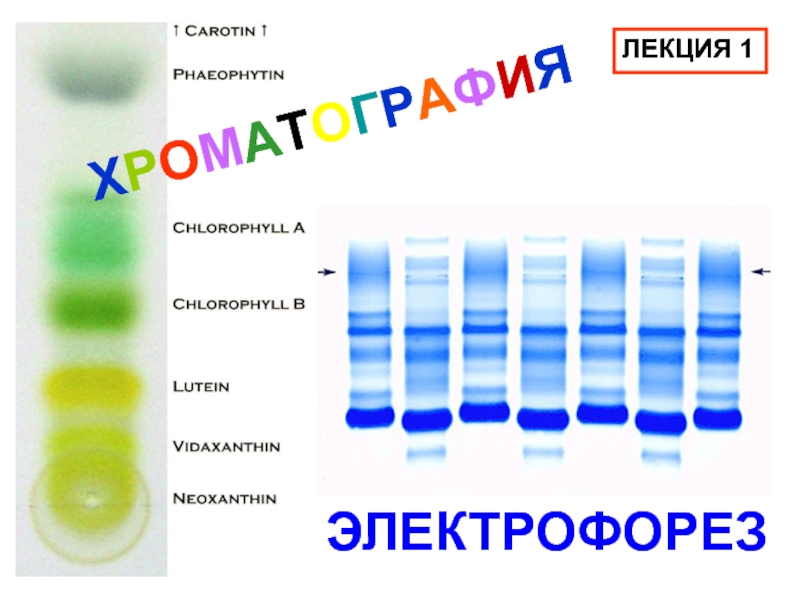
комплекс белок-ДСН становится сильно электроотрицательным. Собственный заряд белка почти не изменяется. Общий заряд комплекса прямо пропорционален величине белковой молекулы. Подвижность в электрическом поле зависит не только от общего заряда молекулы, а в первую очередь от распределения этого заряда.Слайд 29Обычный электрофорез не позволяет разделять одинаково заряженные частицы. При гель-электрофорезе
с ДСН дополнительно используется диффузионный эффект при прохождении через гель.
Небольшие молекулы проходят быстрее, чем крупные. Скорость прохождения пропорциональна их величине.Метод гель-электрофореза относительно прост, он является стандартным методом определения молекулярной массы. Однако в результате получаются лишь относительные величины и необходимо использовать подходящие молекулы в качестве стандарта.