Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
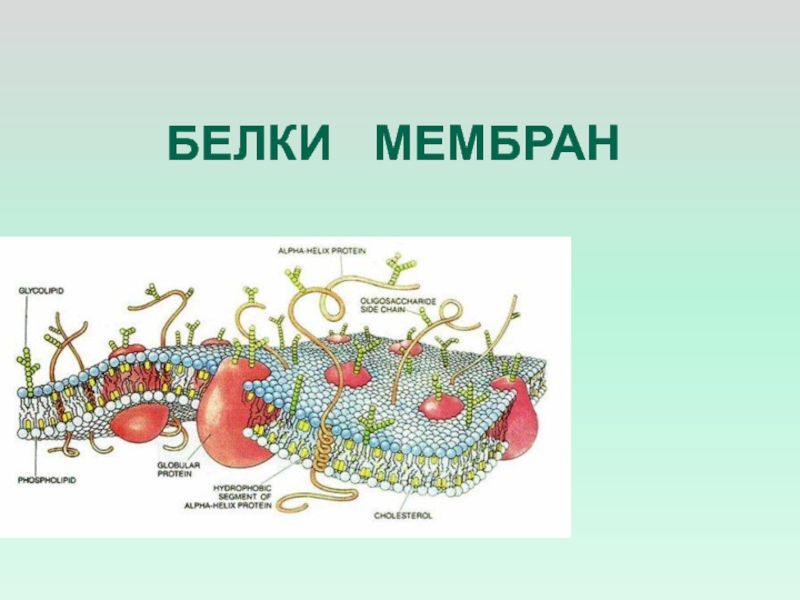
БЕЛКИ МЕМБРАН
Содержание
- 1. БЕЛКИ МЕМБРАН
- 2. 1.СОДЕРЖАНИЕ БЕЛКОВ В МЕМБРАНЕ2. КЛАССИФИКАЦИЯ МЕМБРАННЫХ БЕЛКОВ3.
- 3. СОДЕРЖАНИЕ БЕЛКОВ В МЕМБРАНАХМЕМБРАНЫ СОДЕРЖАТ ОТ 20
- 4. КЛАССИФИКАЦИЯ МЕМБРАННЫХ БЕЛКОВоснована на прочности взаимодействия белка
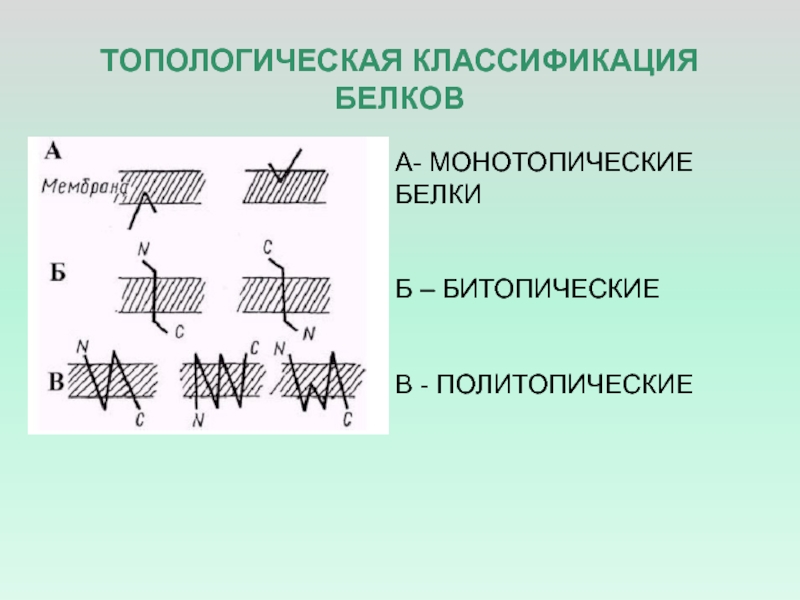
- 5. ТОПОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ БЕЛКОВА- МОНОТОПИЧЕСКИЕ БЕЛКИБ – БИТОПИЧЕСКИЕВ - ПОЛИТОПИЧЕСКИЕ
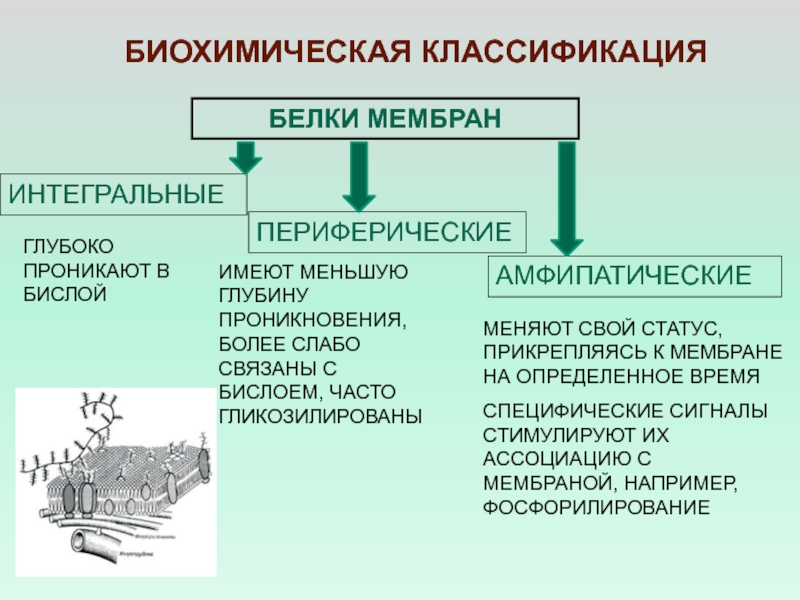
- 6. БЕЛКИ МЕМБРАНИНТЕГРАЛЬНЫЕПЕРИФЕРИЧЕСКИЕБиохимическая классификация МЕНЯЮТ СВОЙ СТАТУС, ПРИКРЕПЛЯЯСЬ
- 7. ДЕЛЕНИЕ БЕЛКОВ НА ИНТЕГРАЛЬНЫЕ И ПЕРИФЕРИЧЕСКИЕ ОПРЕДЕЛЯЕТСЯСТРУКТУРОЙКОЛИЧЕСТВОМ И РАСПОЛОЖЕНИЕ ГИДРОФОБНЫХ ОСТАТКОВ
- 8. МЕМБРАННЫЕ БЕЛКИ СОСТОЯТ ИЗ ДВУХ ЧАСТЕЙ:УЧАСТКИ, БОГАТЫЕ
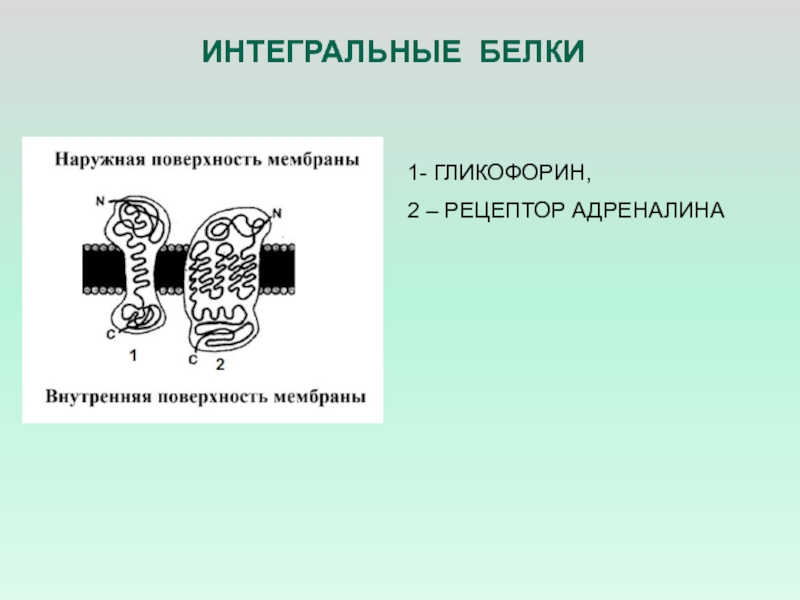
- 9. ИНТЕГРАЛЬНЫЕ БЕЛКИ 1- ГЛИКОФОРИН, 2 – РЕЦЕПТОР АДРЕНАЛИНА
- 10. Связывание интегральных белков с мембраной за счёт единичной трансмембра-нной альфа-спиралимножественных трансмембранных альфа-спиралейбета-складчатой структуры
- 11. ПРИМЕРЫ ИНТЕГРАЛЬНЫХ БЕЛКОВ, СОДЕРЖАЩИХ ОТ 1 ДО 12 ТРАНСМЕМБРАННЫХ ДОМЕНОВС БИСЛОЕМ КОНТАКТИРУЮТ НЕПОЛЯРНЫЕ УЧАСТКИ БЕЛКОВ
- 12. 1. КОЛИЧЕСТВО ГИДРОФИЛЬНЫХ АМИНОКИСЛОТ ПРИМЕРНО ТАКОЕ ЖЕ,
- 13. 2. В СТРУКТУРЕ ИНТЕГРАЛЬНЫХ БЕЛКОВ ЧЕТКО ВЫДЕЛЯЮТСЯ
- 14. амфипатической альфа-спирали, параллельной плоскости мембраны гидрофобной петли
- 15. 5 – БЕЛКИ, СВЯЗАННЫЕ С ИНТЕГРАЛЬНЫМИ БЕЛКАМИ,
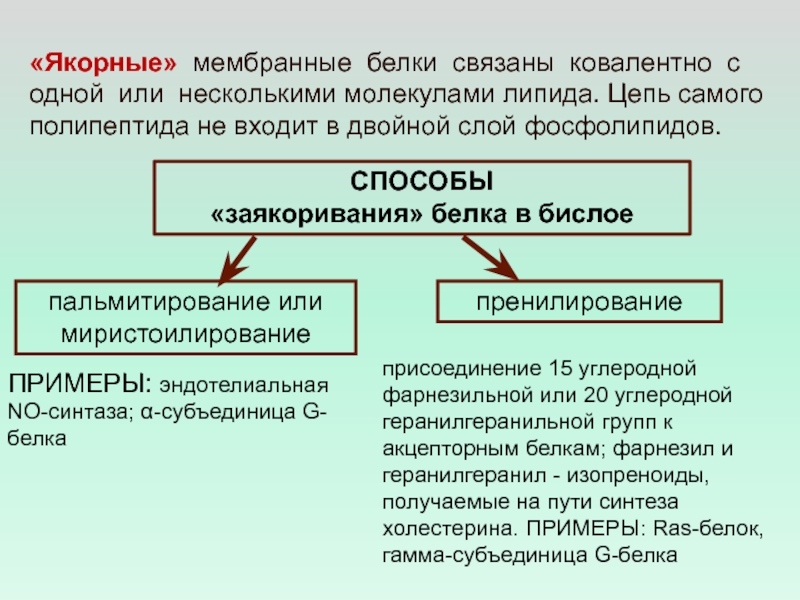
- 16. «Якорные» мембранные белки связаны ковалентно с одной
- 17. Пальмитирование α-субъединицы, пренилирование γ-субъединицы и миристоилирование в
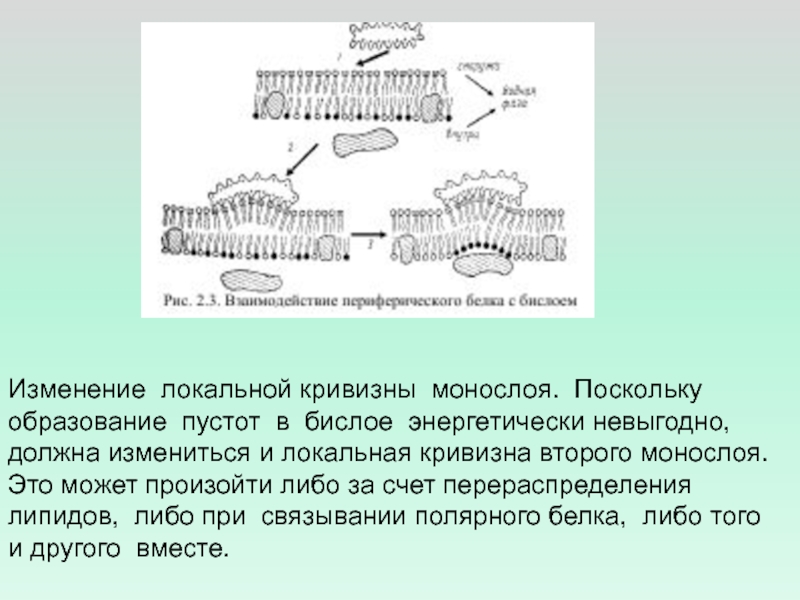
- 18. Изменение локальной кривизны монослоя. Поскольку образование пустот
- 19. СИЛЫ ВЗАИМОДЕЙСТВИЯ БЕЛКОВ С ЛИПИДНЫМ БИСЛОЕМЭЛЕКТРОСТАТИЧЕСКИЕ –
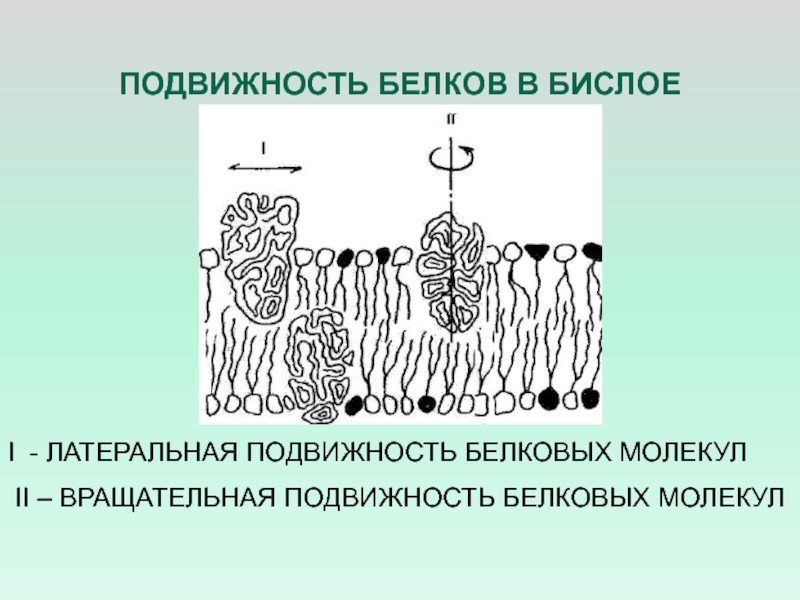
- 20. ПОДВИЖНОСТЬ БЕЛКОВ В БИСЛОЕI - ЛАТЕРАЛЬНАЯ ПОДВИЖНОСТЬ БЕЛКОВЫХ МОЛЕКУЛ II – ВРАЩАТЕЛЬНАЯ ПОДВИЖНОСТЬ БЕЛКОВЫХ МОЛЕКУЛ
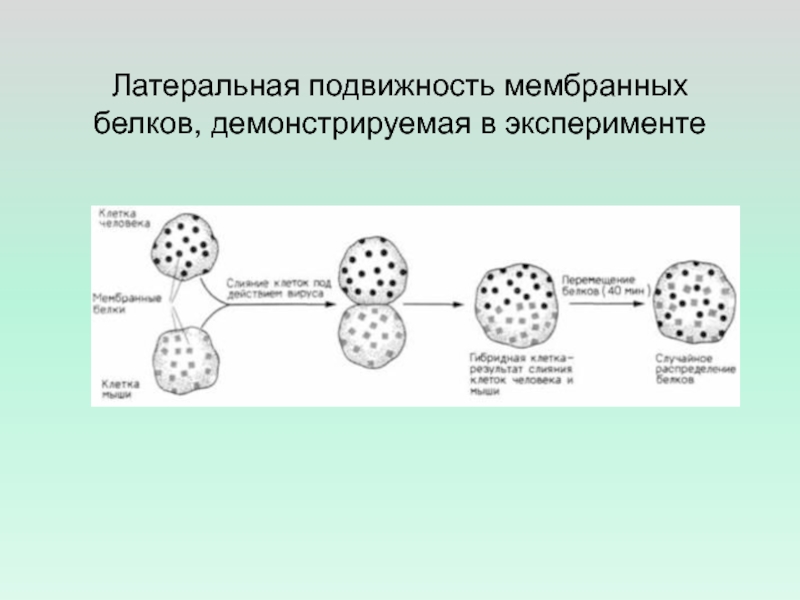
- 21. Латеральная подвижность мембранных белков, демонстрируемая в эксперименте
- 22. ПОДВИЖНОСТЬ БЕЛКОВ В БИСЛОЕ И ИХ ВЛИЯНИЕ
- 23. ЛАТЕРАЛЬНАЯ ДИФФУЗИЯ ИНТЕГРАЛЬНЫХ БЕЛКОВ ОГРАНИЧЕНА ИХ РАЗМЕРАМИ,
- 24. ИНТЕГРАЛЬНЫЕ БЕЛКИ СИЛЬНО ОГРАНИЧИВАЮТ ПОДВИЖНОСТЬ АННУЛЯРНЫХ ЛИПИДОВ.
- 25. Фазовый переход приводит к увеличению подвижности ацильных
- 26. МОДИФИКАЦИЯ БИСЛОЯ БЕЛКАМИВЫДЕЛЯЮТ 4 ОСНОВНЫХ ТИПА БЕЛОК-ЛИПИДНЫХ КОНТАКТОВ
- 27. ЛОКАЛЬНОЕ ВОЗРАСТАНИЕ УПОРЯДОЧЕННОСТИ АННУЛЯРНЫХ ЛИПИДОВПРИМЕРЫ: бактериородопсин
- 28. ЭЛАСТИЧЕСКАЯ ДЕФОРМАЦИЯ ОДНОЙ СТОРОНЫ БИСЛОЯ Такое влияние
- 29. РЕЗКОЕ ИЗМЕНЕНИЕ ГРАДИЕНТА КРИВИЗНЫ И ДЕФОРМАЦИЯ БИСЛОЯВыраженная
- 30. ИЗМЕНЕНИЕ ГЕОМЕТРИИ БИСЛОЯ ВСЛЕДСТВИЕ НЕСОВПАДЕНИЯ ДЛИНЫ ГИДРОФОБНЫХ
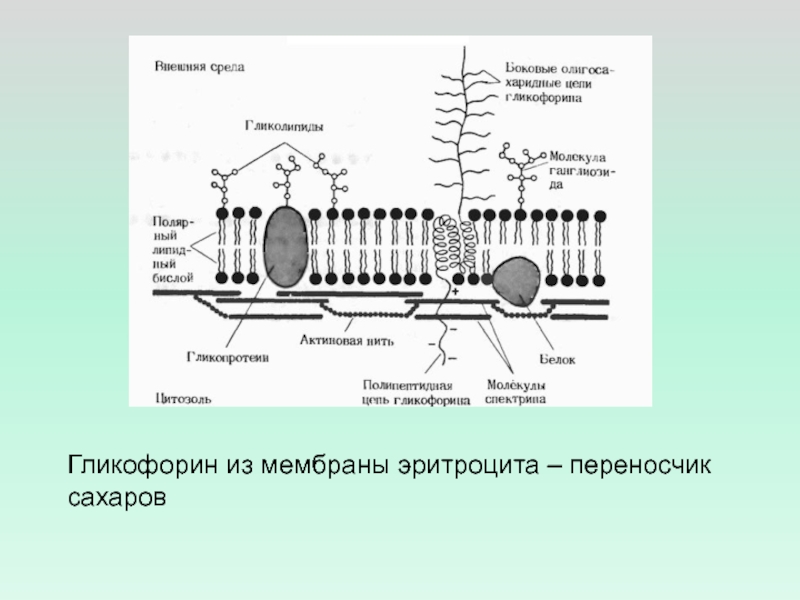
- 31. Гликофорин из мембраны эритроцита – переносчик сахаров
- 32. НЕКОТОРЫЕ ФУНКЦИИ БЕЛКОВ В МЕМБРАНЕ
- 33. Скачать презентанцию
Слайды и текст этой презентации
Слайд 21.СОДЕРЖАНИЕ БЕЛКОВ В МЕМБРАНЕ
2. КЛАССИФИКАЦИЯ МЕМБРАННЫХ БЕЛКОВ
3. ПОДВИЖНОСТЬ БЕЛКОВ В
МЕМБРАНЕ
Слайд 3СОДЕРЖАНИЕ БЕЛКОВ В МЕМБРАНАХ
МЕМБРАНЫ СОДЕРЖАТ ОТ 20 ДО 80% БЕЛКА
ПО ВЕСУ. В РАЗНЫХ МЕМБРАНАХ СОДЕРЖАНИЕ БЕЛКА РАЗЛИЧНО.
В МЕМБРАНАХ МИТОХОНДРИЙ
БЕЛКА ДО 75%В МИЕЛИНОВОЙ ОБОЛОЧКЕ ОКОЛО 25%
Слайд 4КЛАССИФИКАЦИЯ МЕМБРАННЫХ БЕЛКОВ
основана на прочности взаимодействия белка с мембраной
Топологическая классификация
Биохимическая классификация
основана на локализации белка по отношению к липидному
бислоюСлайд 6БЕЛКИ МЕМБРАН
ИНТЕГРАЛЬНЫЕ
ПЕРИФЕРИЧЕСКИЕ
Биохимическая классификация
МЕНЯЮТ СВОЙ СТАТУС, ПРИКРЕПЛЯЯСЬ К МЕМБРАНЕ НА
ОПРЕДЕЛЕННОЕ ВРЕМЯ
СПЕЦИФИЧЕСКИЕ СИГНАЛЫ СТИМУЛИРУЮТ ИХ АССОЦИАЦИЮ С МЕМБРАНОЙ, НАПРИМЕР,
ФОСФОРИЛИРОВАНИЕАМФИПАТИЧЕСКИЕ
ГЛУБОКО ПРОНИКАЮТ В БИСЛОЙ
ИМЕЮТ МЕНЬШУЮ ГЛУБИНУ ПРОНИКНОВЕНИЯ, БОЛЕЕ СЛАБО СВЯЗАНЫ С БИСЛОЕМ, ЧАСТО ГЛИКОЗИЛИРОВАНЫ
Слайд 7ДЕЛЕНИЕ БЕЛКОВ НА ИНТЕГРАЛЬНЫЕ И ПЕРИФЕРИЧЕСКИЕ ОПРЕДЕЛЯЕТСЯ
СТРУКТУРОЙ
КОЛИЧЕСТВОМ И РАСПОЛОЖЕНИЕ ГИДРОФОБНЫХ
ОСТАТКОВ
Слайд 8МЕМБРАННЫЕ БЕЛКИ СОСТОЯТ ИЗ ДВУХ ЧАСТЕЙ:
УЧАСТКИ, БОГАТЫЕ ПОЛЯРНЫМИ АМИНОКИСЛОТНЫМИ ОСТАТКАМИ,
ОБРАЩЕННЫЕ ВО ВНЕКЛЕТОЧНУЮ СРЕДУ ЧАСТО ГЛИКОЗИЛИРОВАНЫ, ЧТО УВЕЛИЧИВАЕТ ИХ РЕЗИСТЕНТНОСТЬ
К ПРОТЕОЛИЗУУЧАСТКИ, ОБОГАЩЕННЫЕ НЕПОЛЯРНЫМИ ОСТАТКАМИ АМИНОКИСЛОТ
Слайд 10Связывание интегральных белков с мембраной за счёт
единичной трансмембра-нной альфа-спирали
множественных
трансмембранных альфа-спиралей
бета-складчатой структуры
Слайд 11ПРИМЕРЫ ИНТЕГРАЛЬНЫХ БЕЛКОВ, СОДЕРЖАЩИХ ОТ 1 ДО 12 ТРАНСМЕМБРАННЫХ ДОМЕНОВ
С
БИСЛОЕМ КОНТАКТИРУЮТ НЕПОЛЯРНЫЕ УЧАСТКИ БЕЛКОВ
Слайд 121. КОЛИЧЕСТВО ГИДРОФИЛЬНЫХ АМИНОКИСЛОТ ПРИМЕРНО ТАКОЕ ЖЕ, КАК И В
ОБЫЧНЫХ ВОДОРАСТВОРИМЫХ БЕЛКАХ, НО В ВОДЕ ОНИ РАСТВОРЯЮТСЯ ОЧЕНЬ ПЛОХО.
ПРИЧИНА:ГИДРОФОБНЫЕ
АМИНОКИСЛОТНЫЕ ОСТАТКИ СКОНЦЕНТРИРОВАНЫ В ГИДРОФОБНЫЕ ДОМЕНЫ, А НЕ РАССЕЯНЫ ВДОЛЬ ПОЛИПЕПТИДНОЙ ЦЕПИ.НЕКОТОРЫЕ БЕЛКИ УВЕЛИЧИВАЮТ ГИДРОФОБНОСТЬ, КОВАЛЕНТНО СОЕДИНЯЯСЬ С ЛИПИДАМИ МЕМБРАН
ОСОБЕННОСТИ ИНТЕГРАЛЬНЫХ БЕЛКОВ
Слайд 132. В СТРУКТУРЕ ИНТЕГРАЛЬНЫХ БЕЛКОВ ЧЕТКО ВЫДЕЛЯЮТСЯ УЧАСТКИ, ОТВЕТСТВЕННЫЕ ЗА
ИХ БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ.
ЭТИ УЧАСТКИ СОСТОЯТ ИЗ ПОЛЯРНЫХ АМИНОКИСЛОТНЫХ ОСТАТКОВ.
ДОМЕНЫ ИЗ
НЕПОЛЯРНЫХ ОСТАТКОВ ОБЕСПЕЧИВАЮТ СТРУКТУРНУЮ УСТОЙЧИВОСТЬ МОЛЕКУЛЫ, ЗАКРЕПЛЯЯ ЕЕ В ЛИПИДНОМ БИСЛОЕСлайд 14амфипатической альфа-спирали, параллельной плоскости мембраны
гидрофобной петли (ЦИТОХРОМ b5)
ковалентно
соединённого жирнокислотного остатка
электростатического взаимодействия (прямого или кальций-опосредованного) (ПРОТЕИНКИНАЗА С).
Связывание
поверхностных белков с мембраной за счёт ПОВЕРХНОСТНЫЕ БЕЛКИ
Слайд 16«Якорные» мембранные белки связаны ковалентно с одной или несколькими молекулами
липида. Цепь самого полипептида не входит в двойной слой фосфолипидов.
способы
«заякоривания» белка в бислое
пренилирование
пальмитирование или миристоилирование
присоединение 15 углеродной фарнезильной или 20 углеродной геранилгеранильной групп к акцепторным белкам; фарнезил и геранилгеранил - изопреноиды, получаемые на пути синтеза холестерина. ПРИМЕРЫ: Ras-белок, гамма-субъединица G-белка
ПРИМЕРЫ: эндотелиальная
NO-синтаза; α-субъединица G-белка
Слайд 17Пальмитирование α-субъединицы, пренилирование γ-субъединицы и миристоилирование в нескольких субъединицах приводят
к тому, что G-белок оказывается «заякорен» на внутренней стороне клеточной
мембраны, что создаёт условия для его взаимодействия с G-белок- связанными рецепторамиСлайд 18Изменение локальной кривизны монослоя. Поскольку образование пустот в бислое энергетически
невыгодно,
должна измениться и локальная кривизна второго монослоя. Это может
произойти либо за счет перераспределения липидов, либо при связывании полярного белка, либо того и другого вместе.Слайд 19СИЛЫ ВЗАИМОДЕЙСТВИЯ БЕЛКОВ С ЛИПИДНЫМ БИСЛОЕМ
ЭЛЕКТРОСТАТИЧЕСКИЕ – НА УРОВНЕ ГОЛОВОК
ЛИПИДОВ
ГИДРОФОБНЫЕ И ДИСПЕРСИОННЫЕ – В ТОЛЩЕ БИСЛОЯ
Слайд 20ПОДВИЖНОСТЬ БЕЛКОВ В БИСЛОЕ
I - ЛАТЕРАЛЬНАЯ ПОДВИЖНОСТЬ БЕЛКОВЫХ МОЛЕКУЛ
II
– ВРАЩАТЕЛЬНАЯ ПОДВИЖНОСТЬ БЕЛКОВЫХ МОЛЕКУЛ
Слайд 22ПОДВИЖНОСТЬ БЕЛКОВ В БИСЛОЕ И ИХ ВЛИЯНИЕ НА ЛИПИДЫ МЕМБРАН
БОЛЕЕ
ПОДВИЖНЫМИ ОКАЗЫВАЮТСЯ ПЕРИФЕРИЧЕСКИЕ БЕЛКИ. ОНИ ОКАЗЫВАЮТ МЕНЬШЕЕ ВОЗДЕЙСТВИЕ НА ЖИРНОКИСЛОТНЫЕ
ЦЕПИ ЛИПИДОВСлайд 23ЛАТЕРАЛЬНАЯ ДИФФУЗИЯ ИНТЕГРАЛЬНЫХ БЕЛКОВ ОГРАНИЧЕНА ИХ РАЗМЕРАМИ, ВЗАИМОДЕЙСТВИЕМ С ДРУГИМИ
БЕЛКАМИ И ЭЛЕМЕНТАМИ ЦИТОСКЕЛЕТА
Времена вращательной релаксации для интегральных белков лежат
в диапазоне от 20 до 500 мксКоэффициент латеральной диффузии (вдоль бислоя) варьирует от 7.10-9 до 10-12см2.с-1.
Слайд 24ИНТЕГРАЛЬНЫЕ БЕЛКИ СИЛЬНО ОГРАНИЧИВАЮТ ПОДВИЖНОСТЬ АННУЛЯРНЫХ ЛИПИДОВ. ПО СВОЕЙ ПОДВИЖНОСТИ
ОНИ ОТЛИЧАЮТСЯ ОТ ОБЩИХ ЛИПИДОВ: АННУЛЯРНЫЕ ЛИПИДЫ ОКАЗЫВАЮТСЯ БОЛЕЕ УПОРЯДОЧЕННЫМИ
Слайд 25Фазовый переход приводит к увеличению подвижности ацильных цепей в бислое,
увеличению угла их наклона и уменьшению плотности упаковки.
Латеральная подвижность
мембранных белков после фазового перехода возрастает, увеличивается вероятность образования их ассоциатовСлайд 28ЭЛАСТИЧЕСКАЯ ДЕФОРМАЦИЯ ОДНОЙ СТОРОНЫ БИСЛОЯ
Такое влияние на физико–химические параметры
характеризуется определенным дальнодействием.
Именно им определяется облегчение взаимодействия мембранных рецепторов
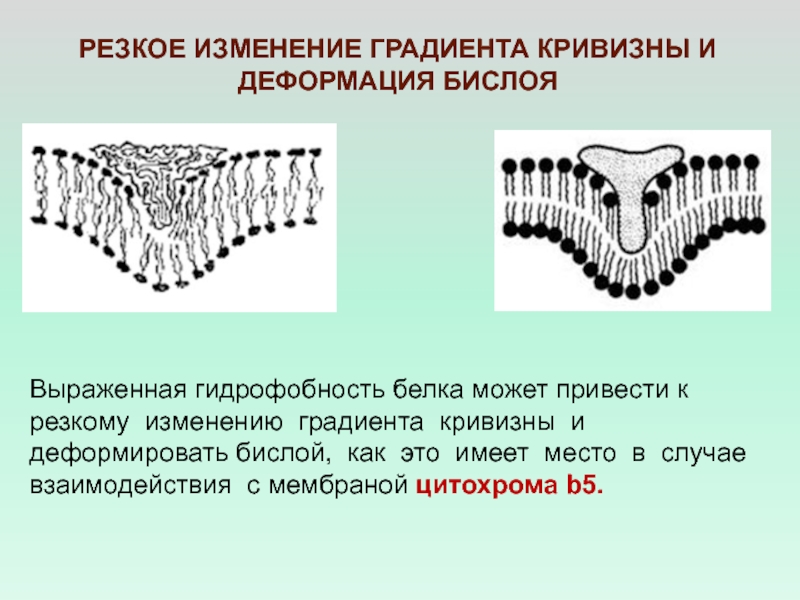
с инсулином Слайд 29РЕЗКОЕ ИЗМЕНЕНИЕ ГРАДИЕНТА КРИВИЗНЫ И ДЕФОРМАЦИЯ БИСЛОЯ
Выраженная гидрофобность белка может
привести к
резкому изменению градиента кривизны и деформировать бислой, как
это имеет место в случае взаимодействия с мембраной цитохрома b5. Слайд 30ИЗМЕНЕНИЕ ГЕОМЕТРИИ БИСЛОЯ ВСЛЕДСТВИЕ НЕСОВПАДЕНИЯ ДЛИНЫ ГИДРОФОБНЫХ УЧАСТКОВ ЛИПИДНЫХ МОЛЕКУЛ
И ВСТРАИВАЕМОГО БЕЛКА
Сочетание гидрофильных и гидрофобных свойств белковой молекулы может
обеспечить не только проникновение белка через бислой, но и существенное давление на него, что приводит к изменению геометрии бислоя – сжиманию одних частей и
уширению других (гликофорин)