Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
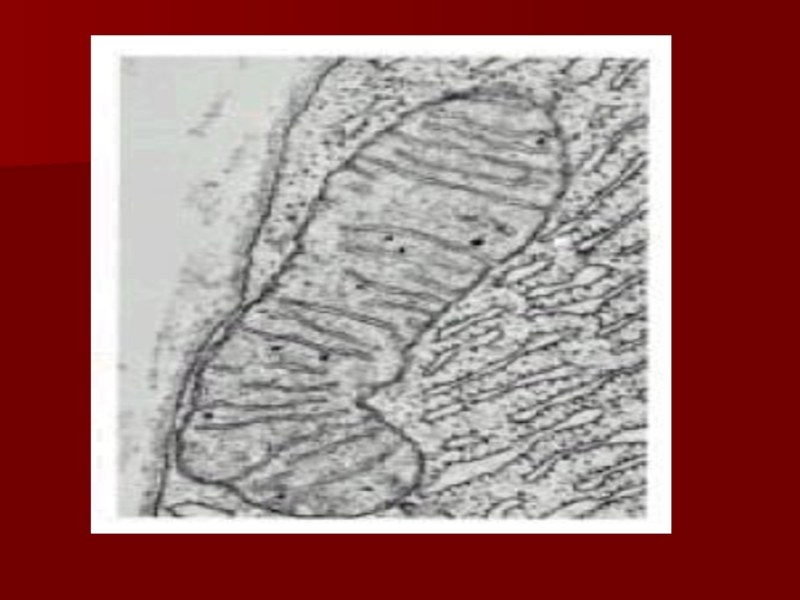
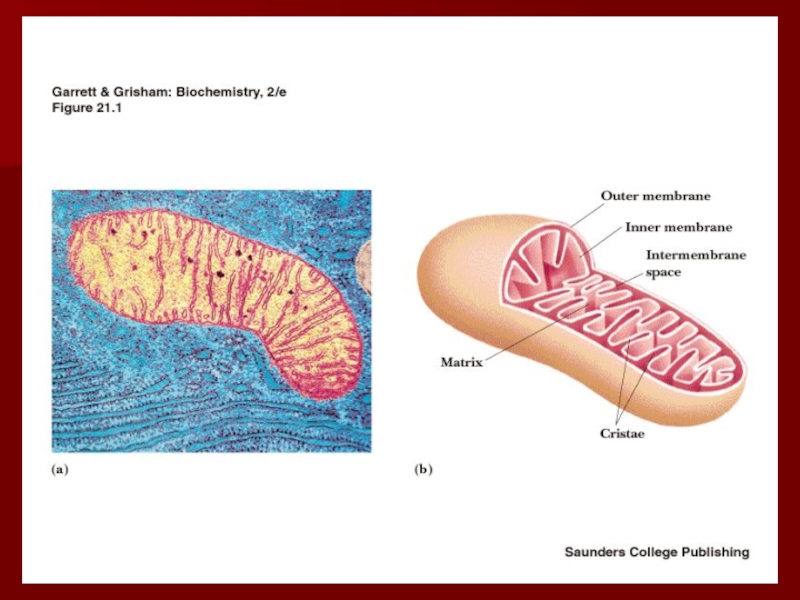
Биоэнергетика
Содержание
- 1. Биоэнергетика
- 2. ПланЦепь переноса электронов и окислительное фосфорилирование;Окислительно-восстановительный потенциал;Переносчики
- 3. Слайд 3
- 4. Цикл превращений АТФАТФ универсальный переносчик энергии для
- 5. Слайд 5
- 6. Роль окислительно-восстановительных процессов в метаболизмеОсновной путь получения
- 7. Коферменты никотиновой кислоты и никотинамидаСуществуют два кофермента
- 8. Слайд 8
- 9. Слайд 9
- 10. Сравнение степеней окисления атомов углерода в биомолекулах
- 11. Окислительно-восстановительные реакции Окислительно-восстановительные реакции включают
- 12. Окислительно-восстановительный потенциал. Стандартный окислительно-восстановительный
- 13. Стандартные условия: - рН 7;температура 250С;концентрация растворенных веществ 1моль;атмосферное давление 1 атм.
- 14. Слайд 14
- 15. Аппарат для измерения стандартного окислительно-восстановительного потенциала
- 16. Слайд 16
- 17. Уравнение расчета энергии переноса 2е от НАДН+
- 18. Уравнение расчета энергии переноса 2е от НАДН+
- 19. Строение дыхательной цепи
- 20. Строение дыхательной цепиЧетыре белковых комплекса расположены во
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Комплекс I НАДН-КоQ редуктазаПереносит электроны от
- 26. Слайд 26
- 27. Рибофлавин (витамин В2)Молекула содержит спирт рибитол
- 28. Флавиновые коферментыФМН и ФАД – одно и
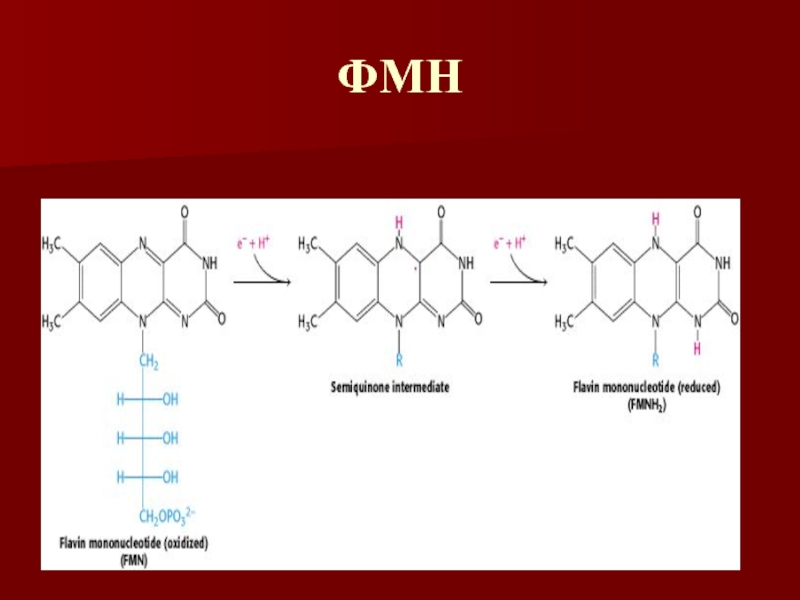
- 29. ФМН
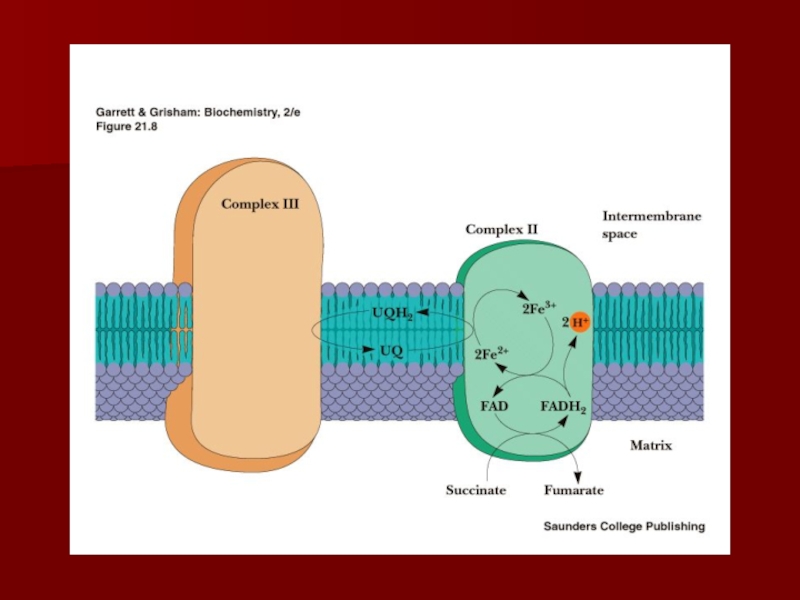
- 30. Комплекс II (сукцинат-кофермент Q редуктаза)сукцинатдегидрогеназа –
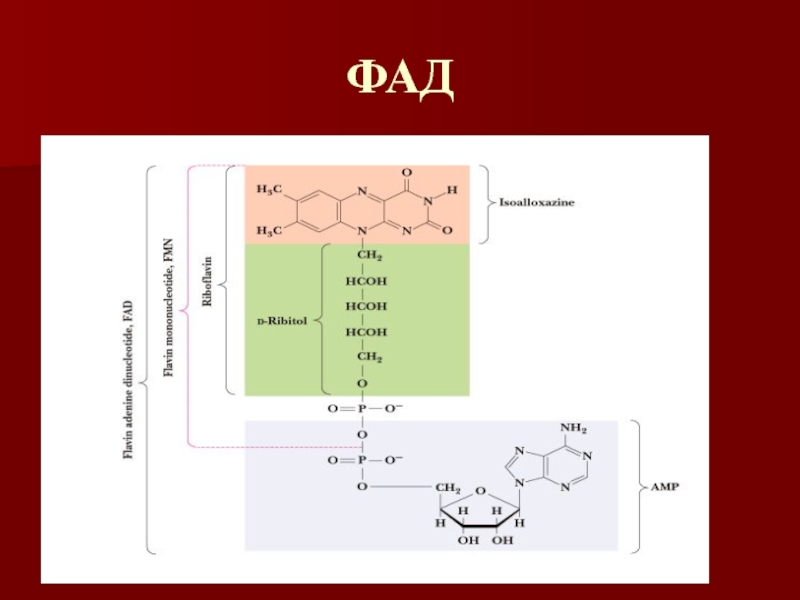
- 31. ФАД
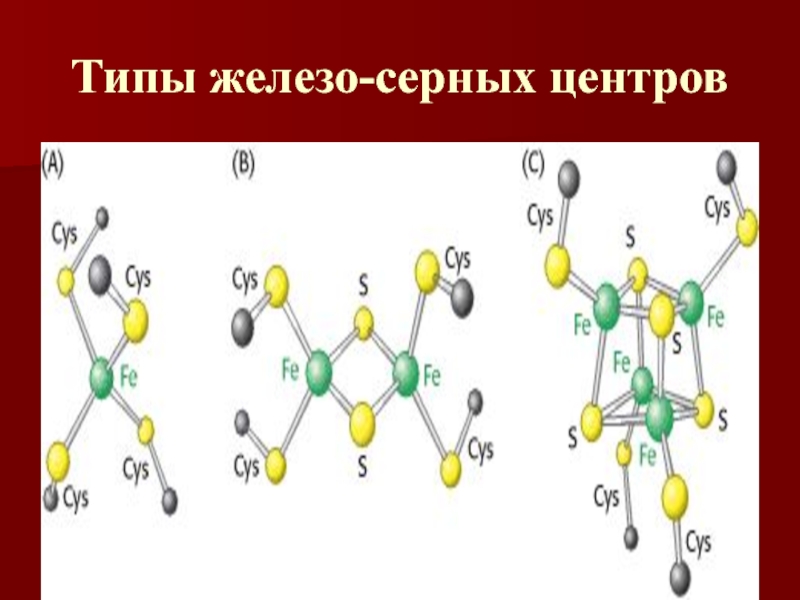
- 32. Типы железо-серных центров
- 33. Слайд 33
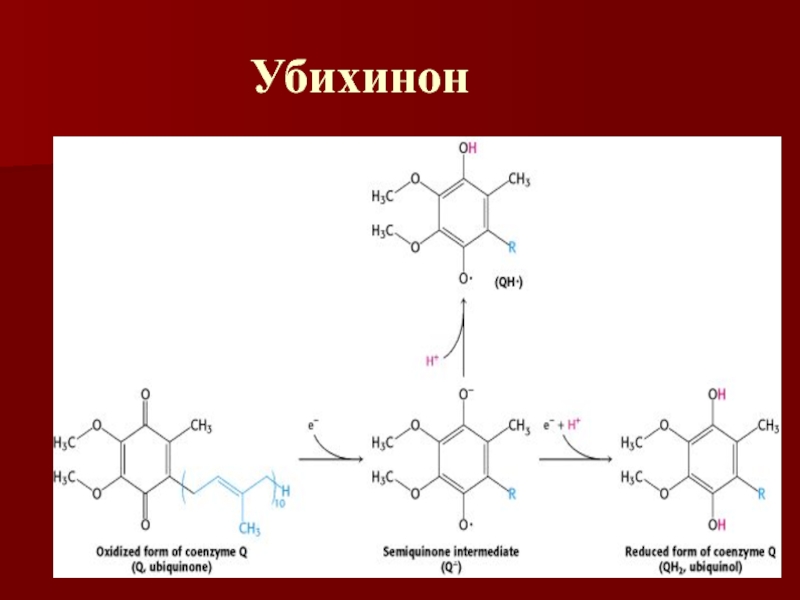
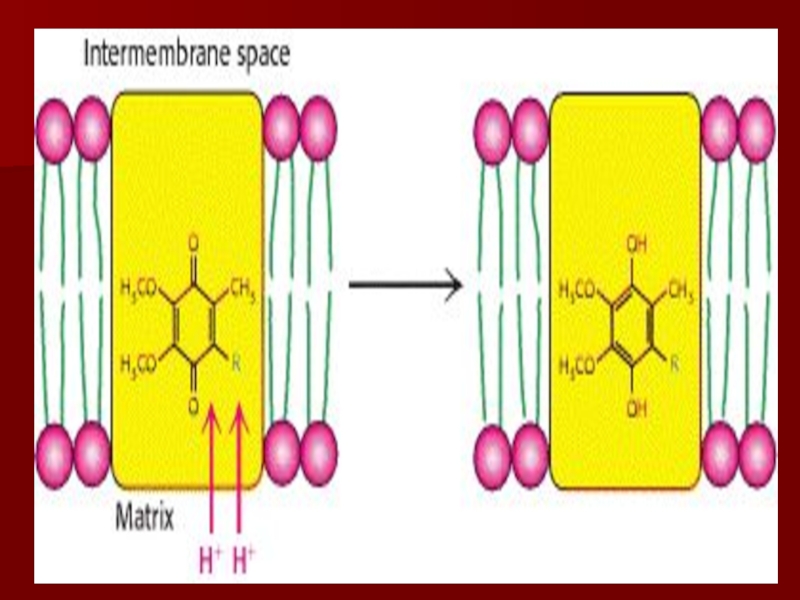
- 34. Убихинон
- 35. Слайд 35
- 36. Комплекс III коэнзим Q-цитохром с редуктазакоэнзим
- 37. Слайд 37
- 38. Слайд 38
- 39. Слайд 39
- 40. Слайд 40
- 41. Комплекс IV цитохром с оксидазаЭлектроны с цитохрома
- 42. Слайд 42
- 43. Слайд 43
- 44. Слайд 44
- 45. Слайд 45
- 46. Слайд 46
- 47. Сопряжение транспорта электронов и окислительного фосфорилированияМного исследователей
- 48. Слайд 48
- 49. Q циклПроисходит передача двух электронов с восстановленной
- 50. Слайд 50
- 51. Слайд 51
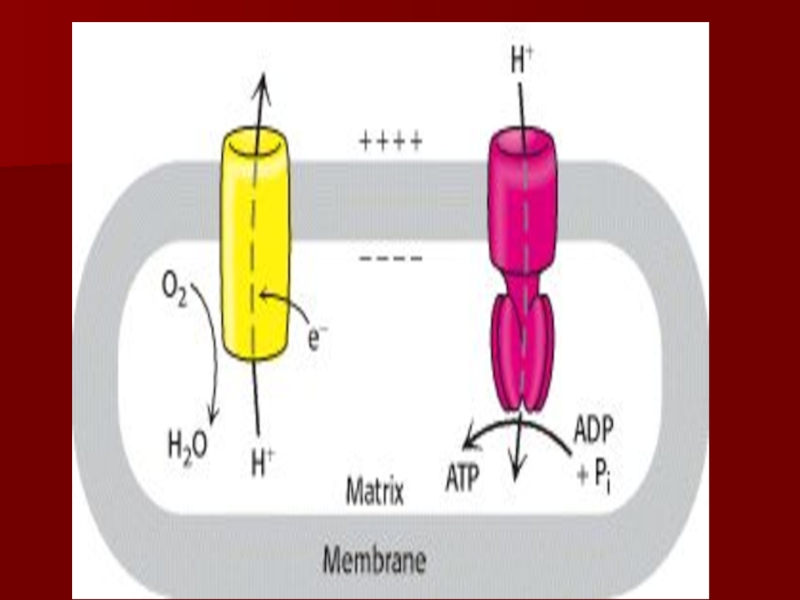
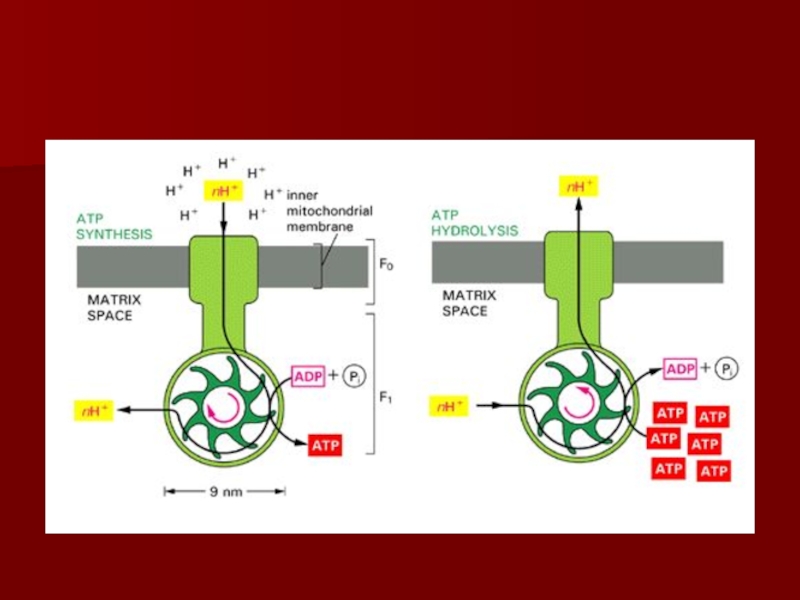
- 52. Гипотеза Митчелла
- 53. Основные положения теории Митчелла.Перенос электронов по дыхательной
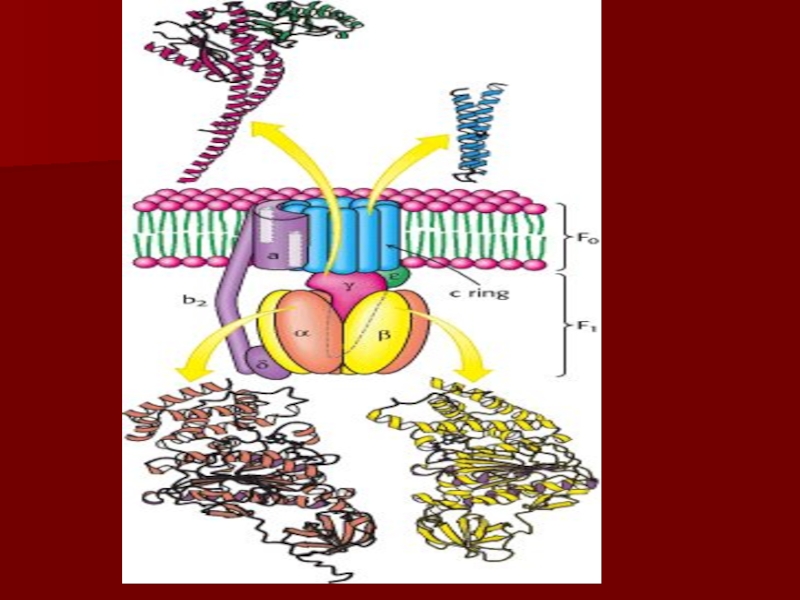
- 54. Протонный градиент и АТФ синтаза
- 55. Слайд 55
- 56. Слайд 56
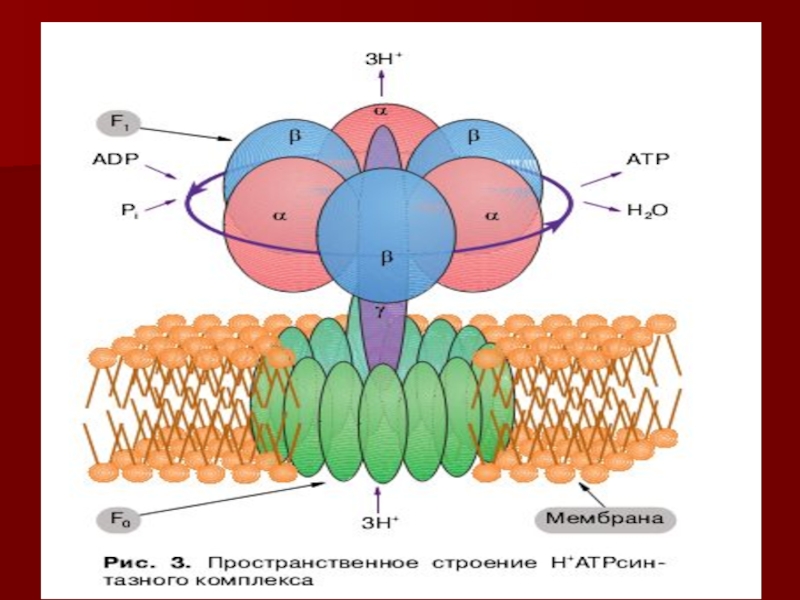
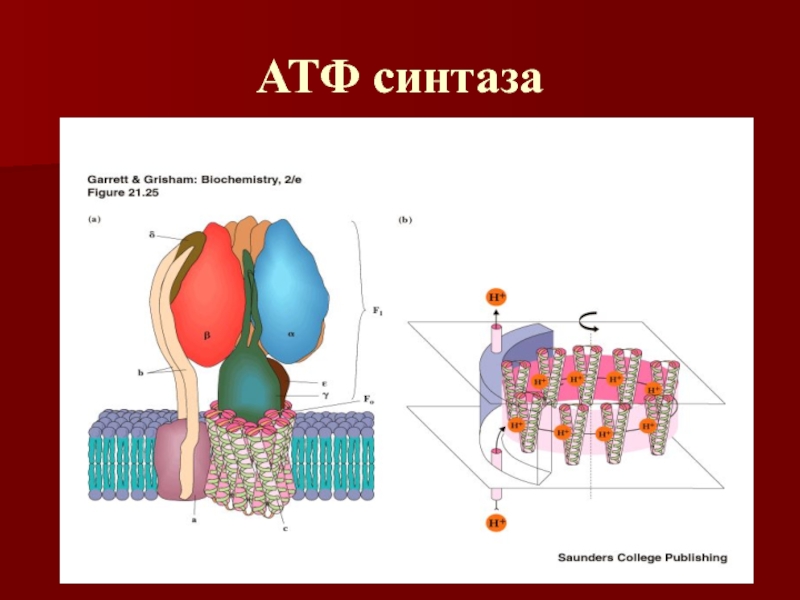
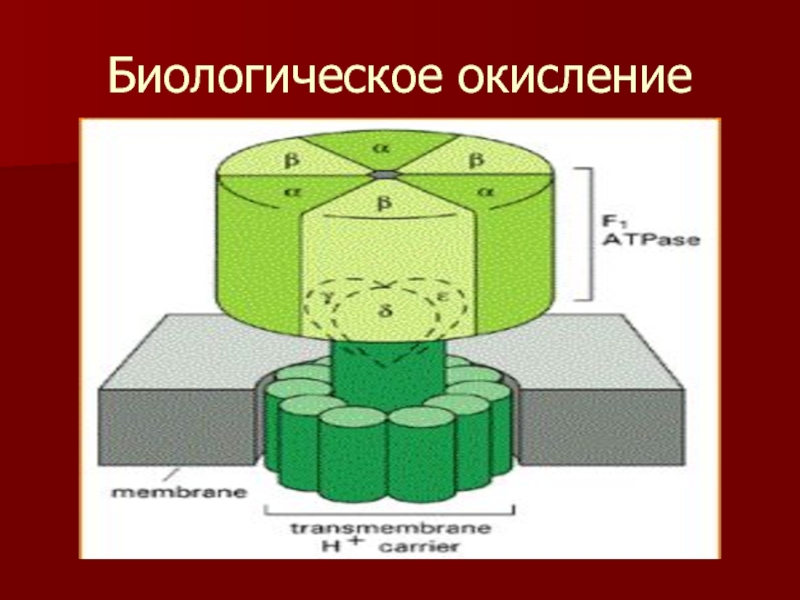
- 57. АТФ синтаза
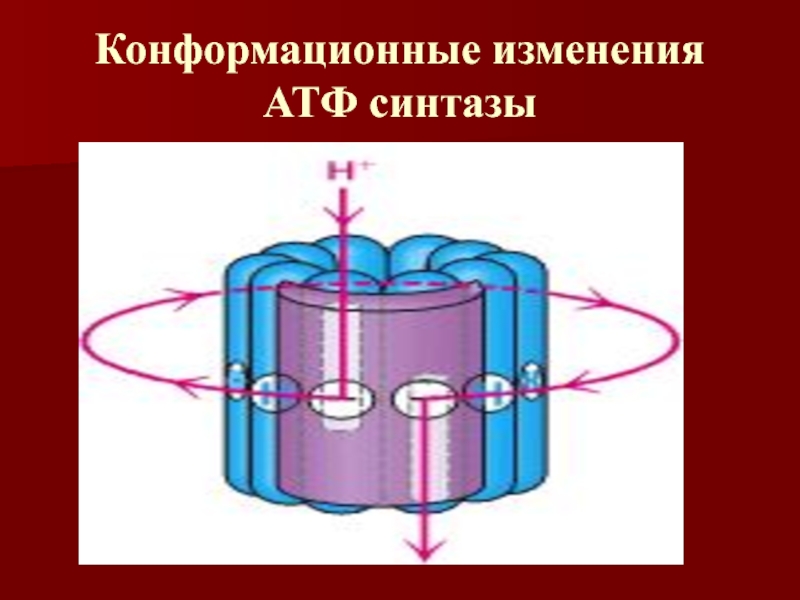
- 58. Конформационные изменения АТФ синтазы
- 59. Слайд 59
- 60. Слайд 60
- 61. РезюмеДыхательная цепь- путь переноса протонов и электронов
- 62. Слайд 62
- 63. Ингибиторы окислительного фосфорилированияРотенон (рыбий яд) ингибирует комплекс
- 64. Слайд 64
- 65. Слайд 65
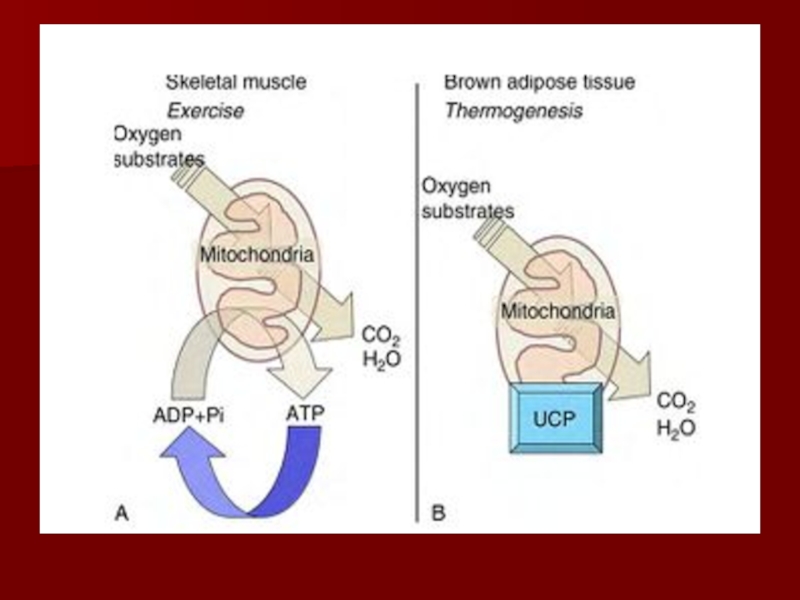
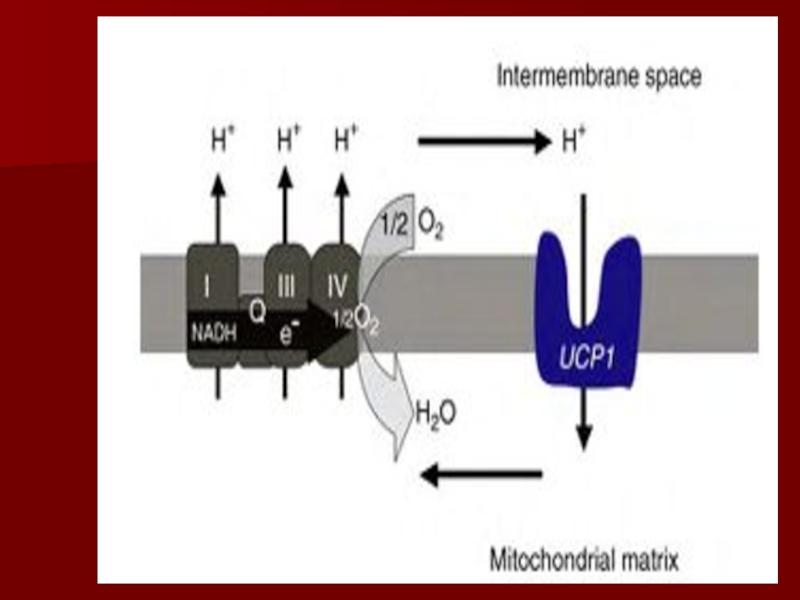
- 66. РазобщителиРазобщение потока электронов и окислительного фосфорилирования происходит
- 67. Слайд 67
- 68. Слайд 68
- 69. Слайд 69
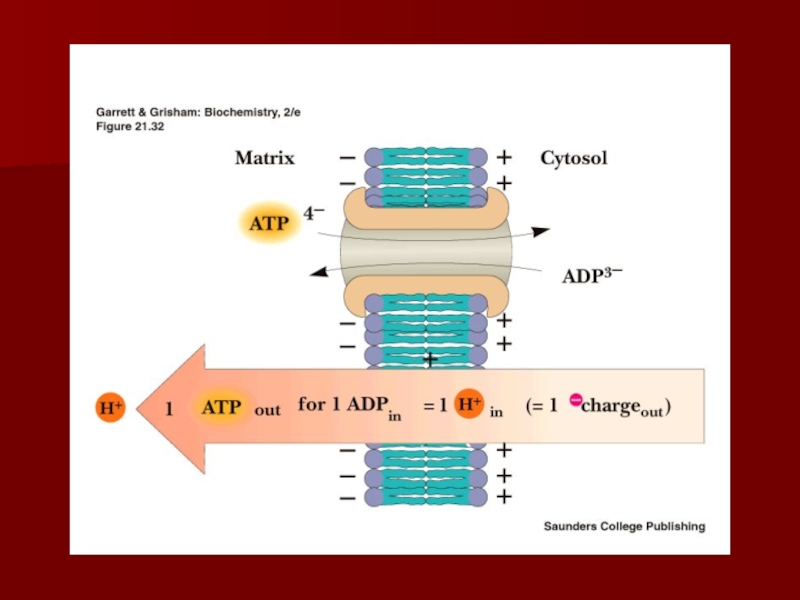
- 70. АТФ-АДФ транслоказаВ большинстве клеток синтез основного количества
- 71. Слайд 71
- 72. Слайд 72
- 73. Коэффициент P/OОзначает сколько молекул АТФ синтезируется при
- 74. Активные формы кислорода. Кислород является потенциально
- 75. Супероксид ионСупероксид ион может образовываться в митохондриях
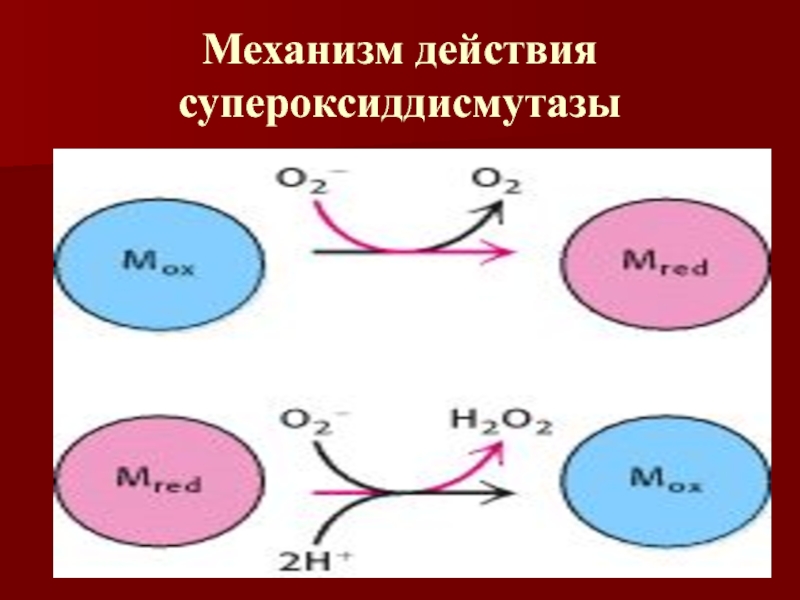
- 76. Механизм действия супероксиддисмутазы
- 77. Пероксид водорода Н2О2 так же токсичен
- 78. Слайд 78
- 79. Биологическое окисление
- 80. Слайд 80
- 81. Слайд 81
- 82. Скачать презентанцию
ПланЦепь переноса электронов и окислительное фосфорилирование;Окислительно-восстановительный потенциал;Переносчики электронов дыхательной цепиСопряжение окисления и фосфорилированияИнгибирование окислительного фосфорилированияРазобщение окислительного фосфорилированияБурая жировая тканьАктивные формы кислорода
Слайды и текст этой презентации
Слайд 2План
Цепь переноса электронов и окислительное фосфорилирование;
Окислительно-восстановительный потенциал;
Переносчики электронов дыхательной цепи
Сопряжение
окисления и фосфорилирования
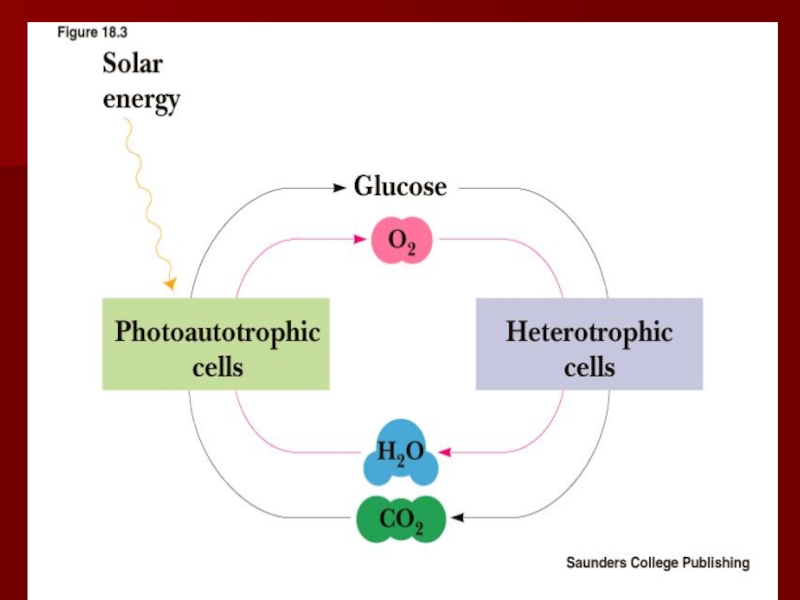
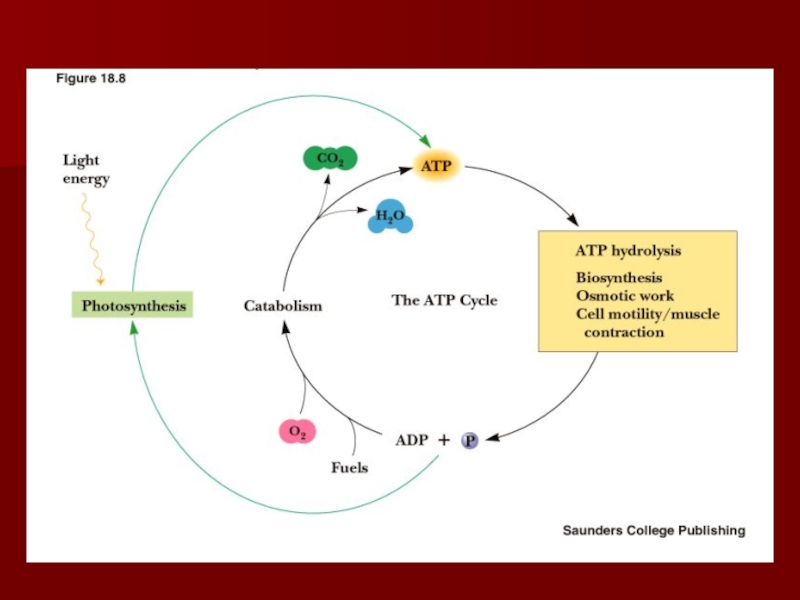
кислородаСлайд 4Цикл превращений АТФ
АТФ универсальный переносчик энергии для клеток;
аутотрофы трансформируют энергию
солнечного света в энергию химических связей органических веществ;
катаболизм органических веществ
в клетках гетеротрофов приводит к освобождению энергии и запасанию её в виде АТФ;АТФ используется клетками для различных процессов, требующих энергии.
Слайд 6Роль окислительно-восстановительных процессов в метаболизме
Основной путь получения энергии гетеротрофами -
окисление органических веществ путем дегидрирования.
НАД+ собирает электроны, освобождающиеся в процессе
катаболизмав реакциях восстановительного синтеза используются НАДФH+H+.
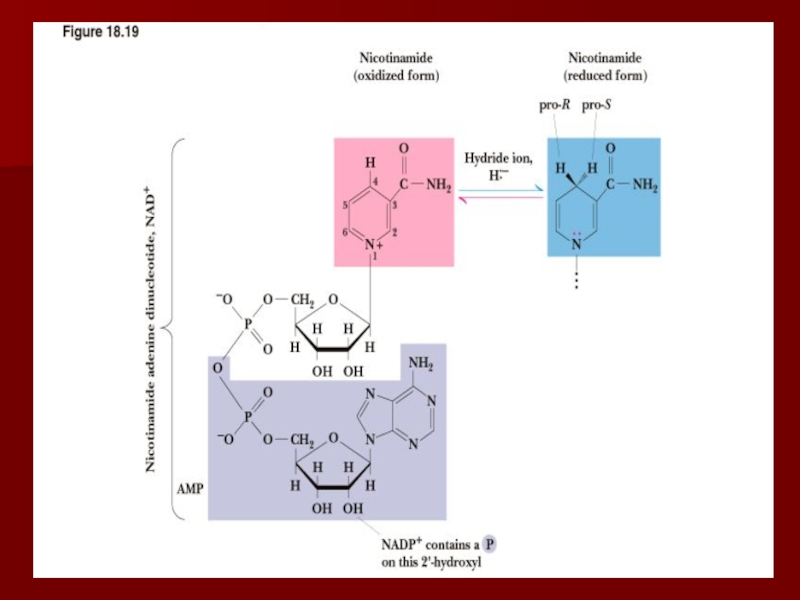
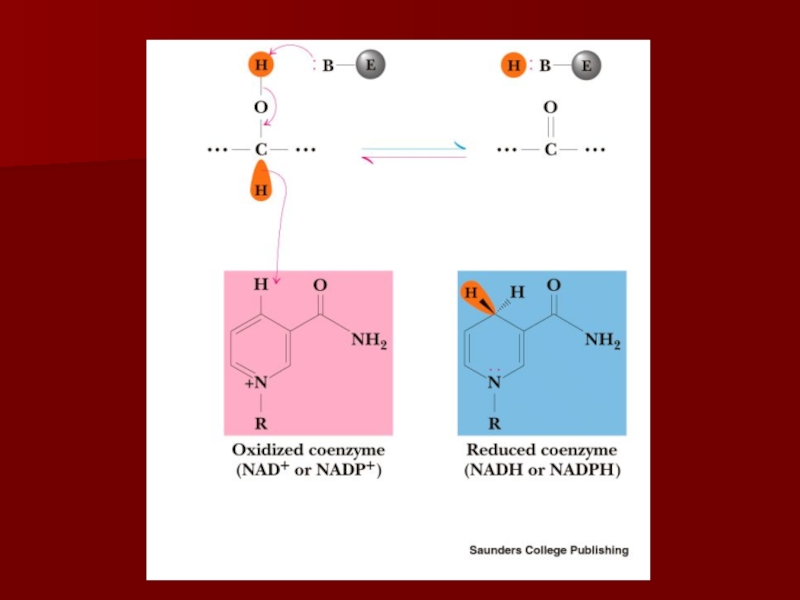
Слайд 7Коферменты никотиновой кислоты и никотинамида
Существуют два кофермента никотиновой кислоты и
никотинамида: НАД+ и НАДФ+;
НАД+ и НАДФ+ - двухэлектронные переносчики;
Они
переносят гидрид ионы к и от субстратов. Слайд 11Окислительно-восстановительные
реакции
Окислительно-восстановительные реакции включают транспорт электронов, каждая из
реакций состоит из двух сопряженных полуреакций: А(окисленный)+В(восстановленный)=В(окисленный)+А(восстановленный)
Окисление – процесс потери
электронов.Восстановление – процесс присоединения электронов.
В уравнении А является акцептором электронов, В – донор электронов.
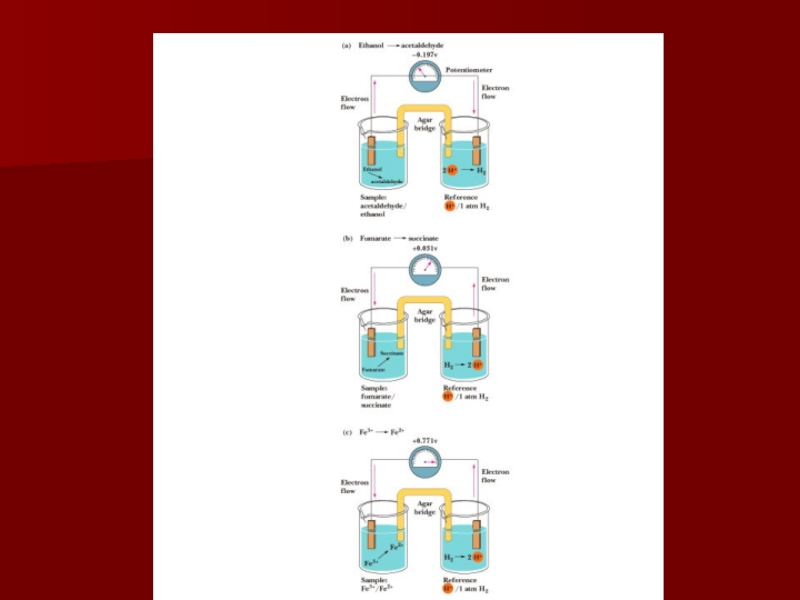
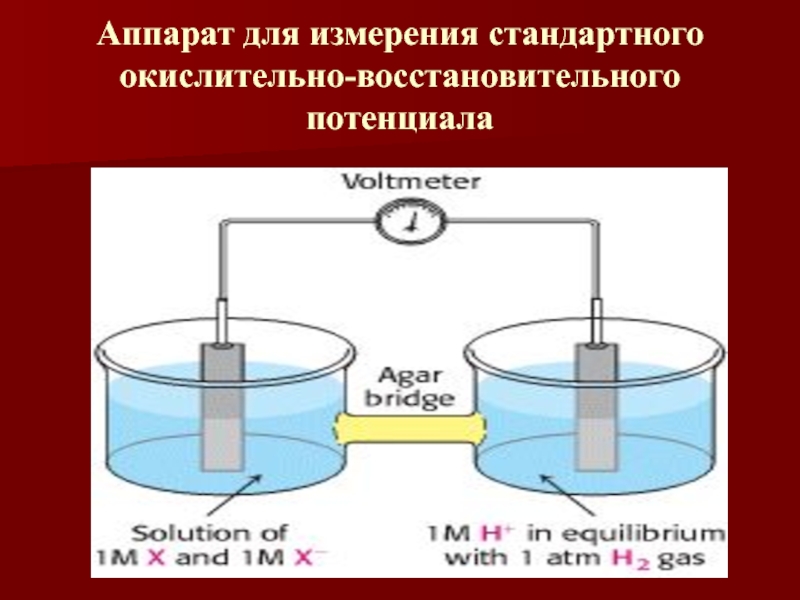
Слайд 12Окислительно-восстановительный
потенциал.
Стандартный окислительно-восстановительный
потенциал (редокс потенциал ) для
полуреакций – электрический потенциал (E0') в вольтах, измеряемый в течение
реакций в стандартных условиях. Для сравнения используется водородный электрод.Слайд 13Стандартные условия:
- рН 7;
температура 250С;
концентрация растворенных веществ 1моль;
атмосферное
давление 1 атм.
Слайд 17Уравнение расчета энергии переноса 2е от НАДН+ Н+ к ½
О2.
Go' = -nF Eo'
где G - стандартная свободная
энергия реакции;n - число электронов;
F - число Фарадея;
E - разность между значениями окислительно-восстановительных потенциалов исходных веществ и продуктов реакции.
Слайд 18Уравнение расчета энергии переноса 2е от НАДН+ Н+ к ½
О2.
E НАДН/ О2 = (О,82-(- О,32) = 1,14.
G = 2*
23,065* 1,14 = 52,6 ккал/моль или 220 кДж/моль.Величина - теоретически достаточна для синтеза 7 АТФ, но синтезируется не более 3- х.
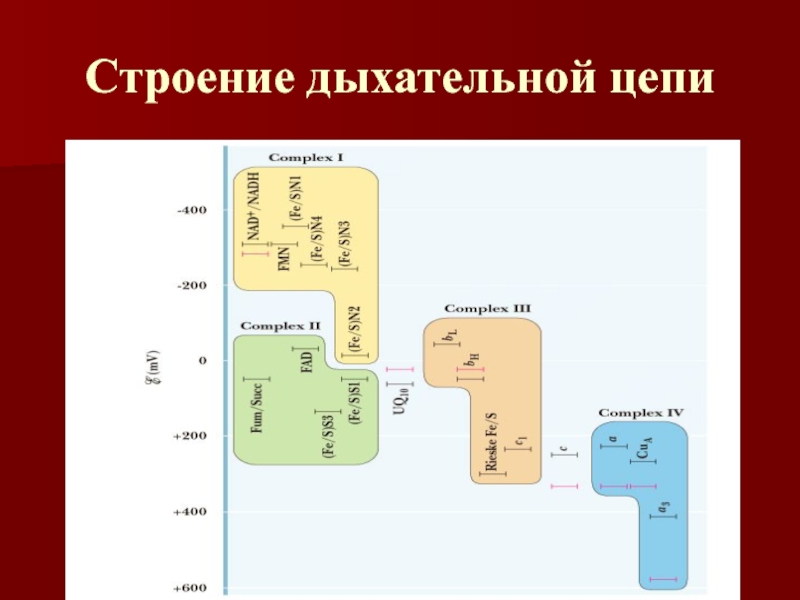
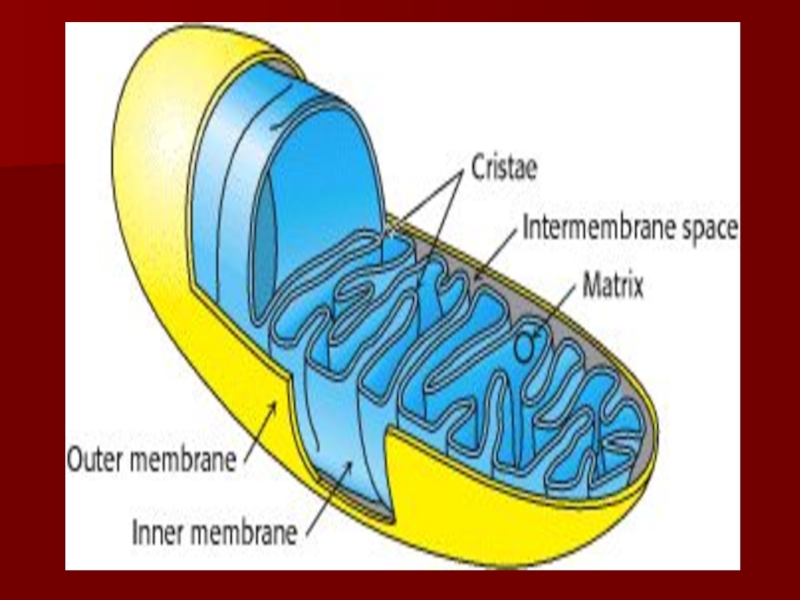
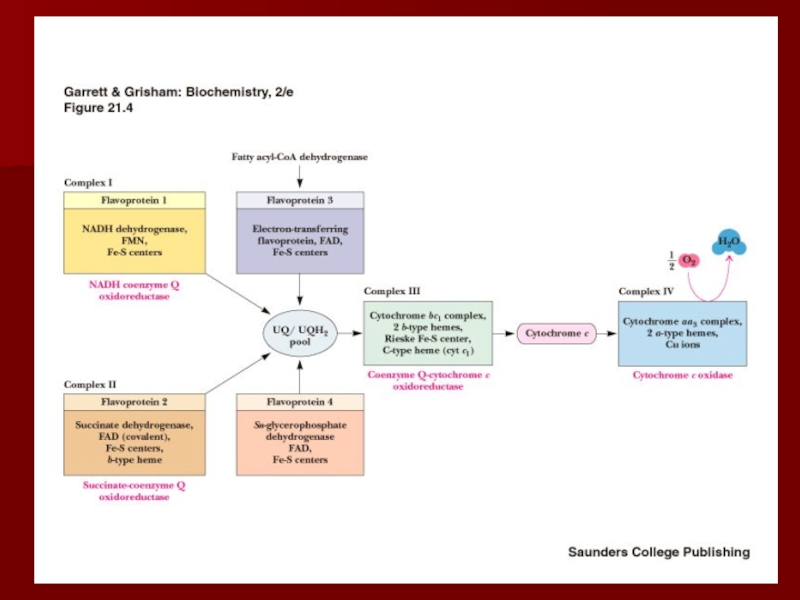
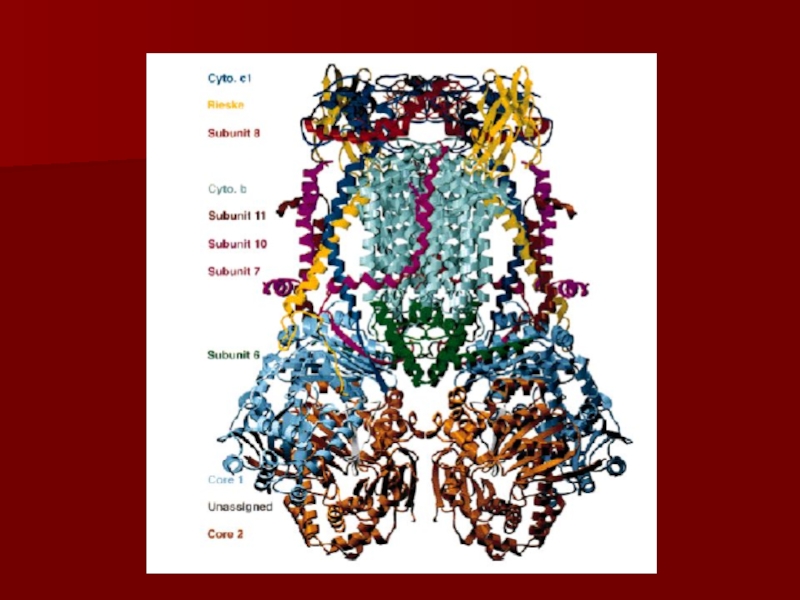
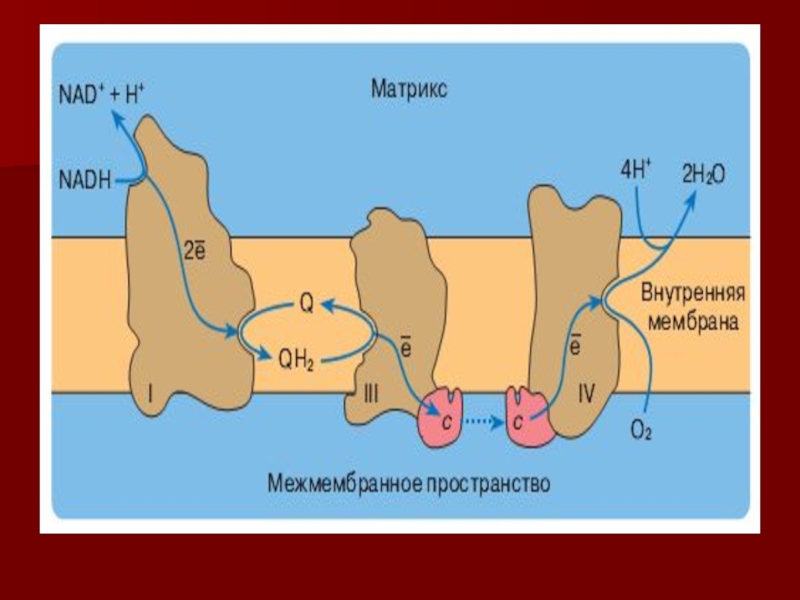
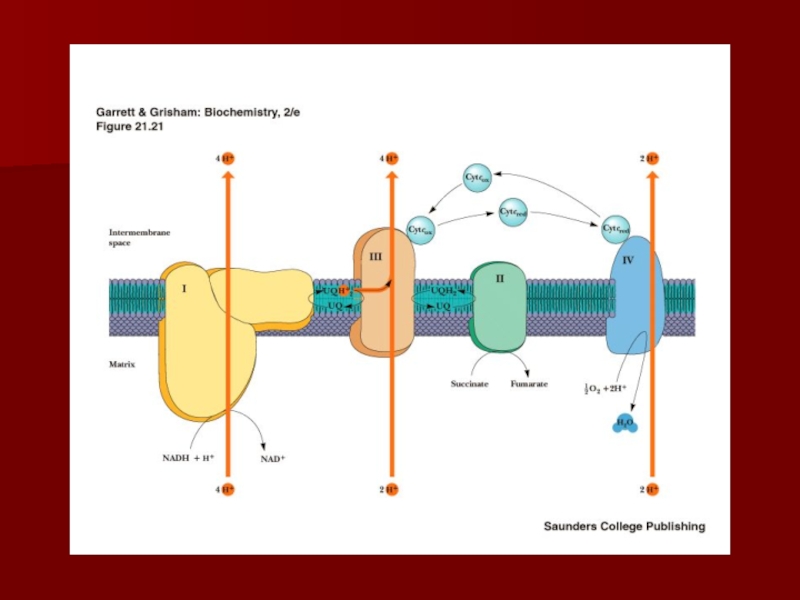
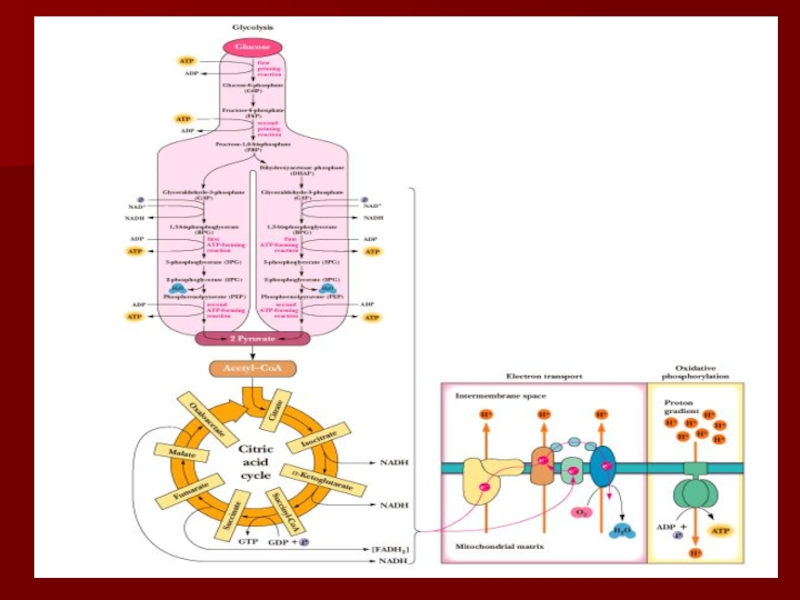
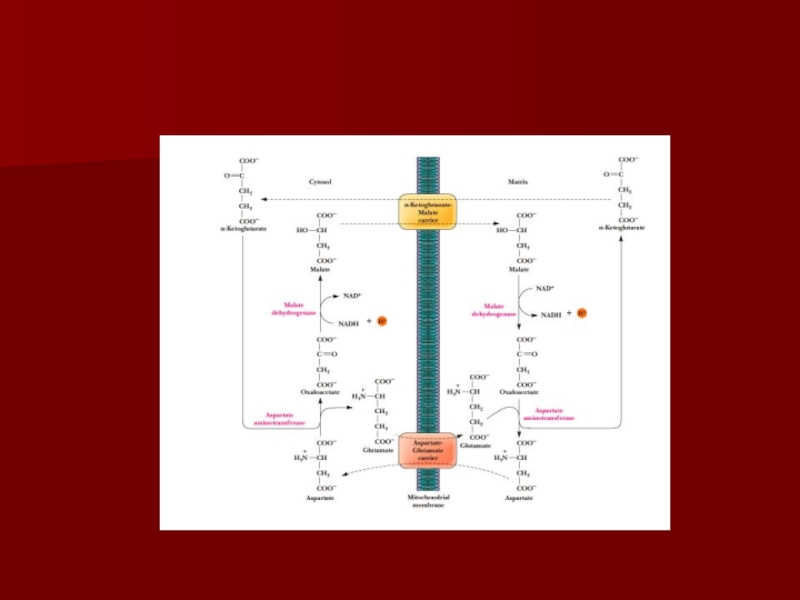
Слайд 20Строение дыхательной цепи
Четыре белковых комплекса расположены во внутренней митохондриальной мембране
Жирорастворимый
кофермент кофермент Q и водорастворимый цитохром c перемещаются между
белковыми комплексамиЭнергия электронов при их движении по дыхательной цепи снижается
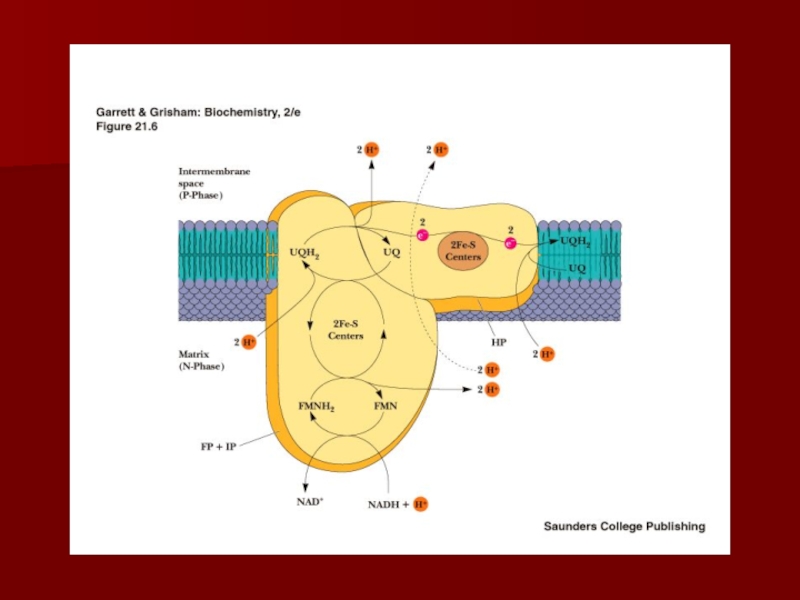
Слайд 25Комплекс I
НАДН-КоQ редуктаза
Переносит электроны от НАДН к коферменту Q
Состоит
из более 30 субъединиц масса- 850 kD
Путь движения электронов
NADH
FMN Fe-S UQ FeS UQ Четыре протона H+ переходят в межмембранное пространство при переносе 2-х электронов
Слайд 27Рибофлавин
(витамин В2)
Молекула содержит спирт рибитол и флавин или изоаллоксазиновое
кольцо
Активные формы витамина – ФМН и ФАД
ФМН и ФАД
не являются настоящими нуклеотидами, однако традиционные названия до сих пор существуютСлайд 28Флавиновые коферменты
ФМН и ФАД – одно и двухэлектронные переносчики
Название флавин
происходит от латинского flavius, что означает желтый
Окисленная форма (хинон)
является желтой, полухинон – голубой, восстановленная форма не окрашена Слайд 30Комплекс II
(сукцинат-кофермент Q редуктаза)
сукцинатдегидрогеназа – фермент цикла Кребса;
сукцинатдегидрогеназа –
ФАД-зависима;
Содержит четыре субъединицы, включая два железосерных центра (Fe-S);
Содержит три
типа Fe-S центров : 4Fe-4S, 3Fe-4S, 2Fe-2S
Передача электронов: сукцинат ФАДН2 2Fe2+ коэнзим QH2
Суммарная реакция:
сукцинат + коэнзим Q фумарат+ коэнзим QH2
Слайд 36 Комплекс III
коэнзим Q-цитохром с редуктаза
коэнзим Q передаёт электроны на
-цитохром с и выкачивает протоны в межмембранное пространство в уникальном
цикле, называемом Q циклом;главным белком этого комплекса является цитохром b с гемами bl и bн;
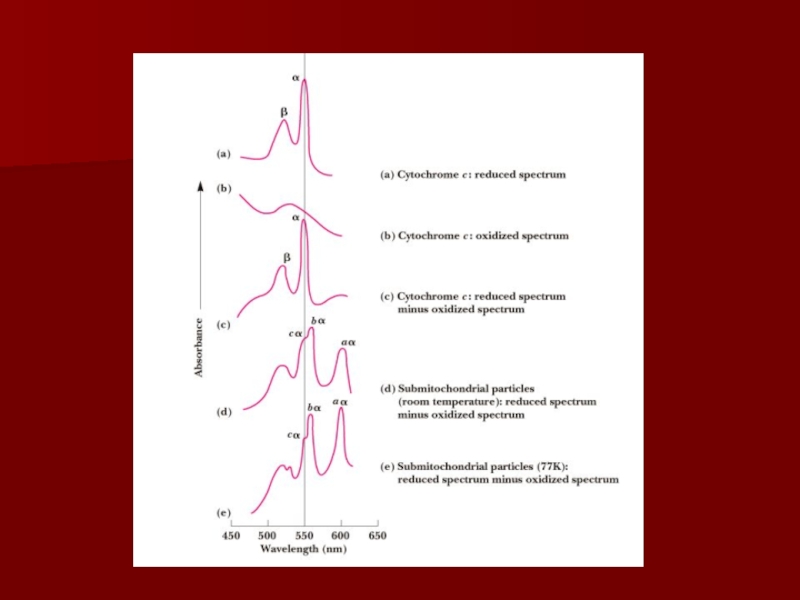
цитохромы, как и железосерные центры являются одноэлектронными переносчиками;
коэнзим Q – жирорастворимый переносчик электронов;
цитохром с – водорастворимый переносчик электронов.
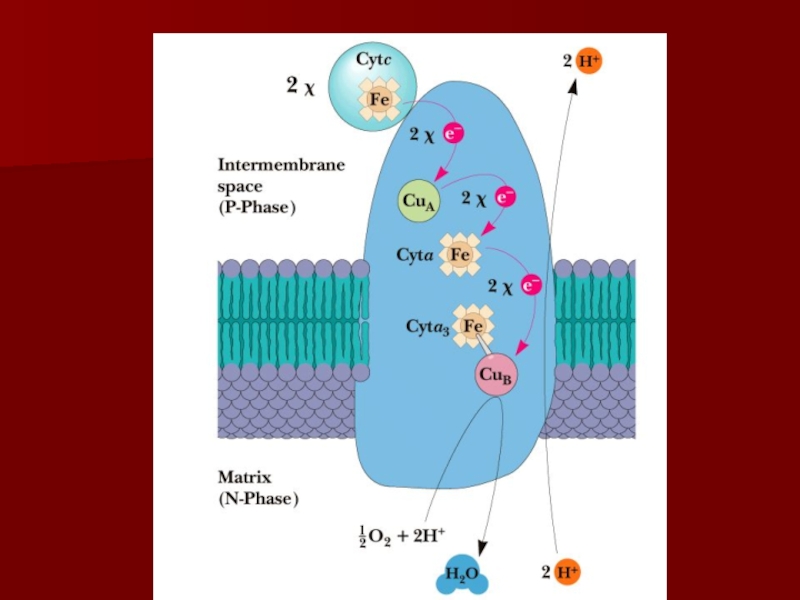
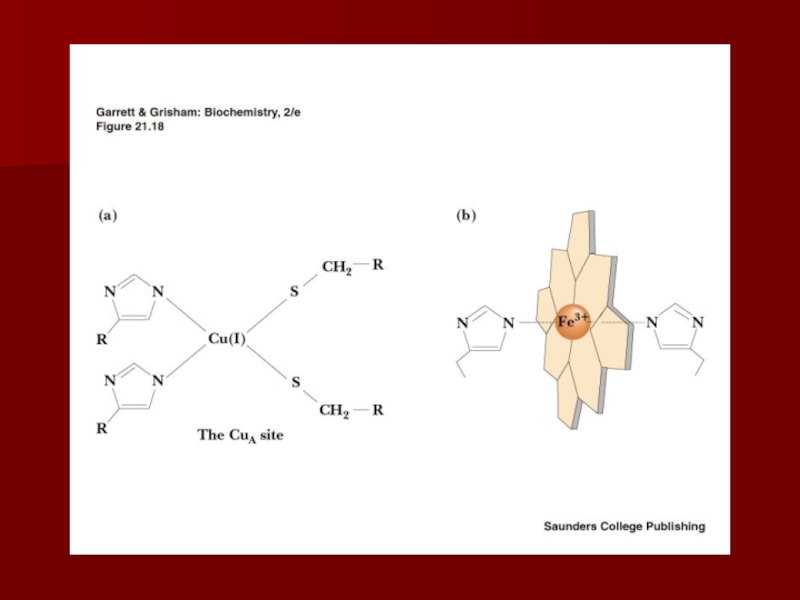
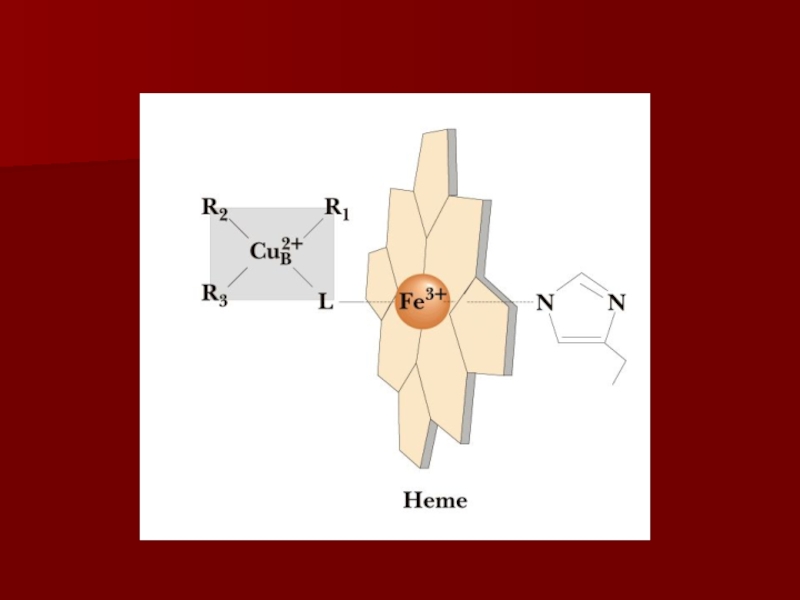
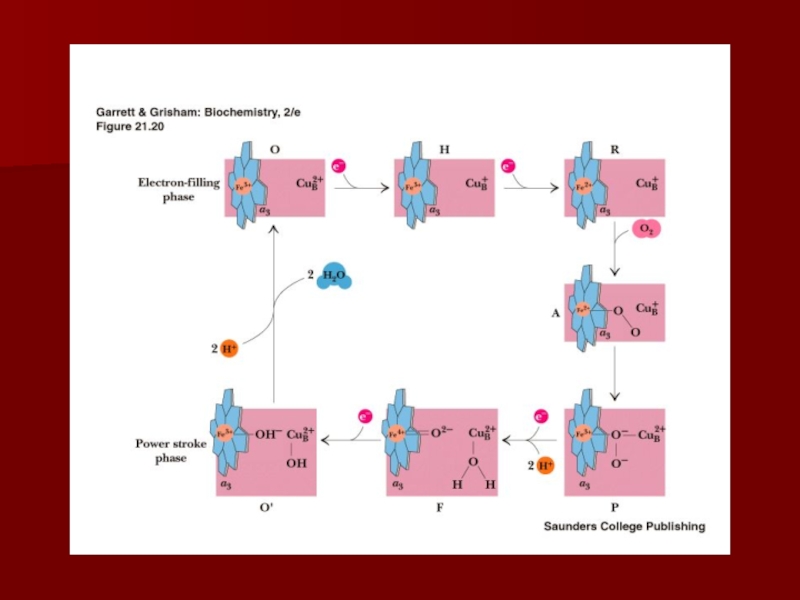
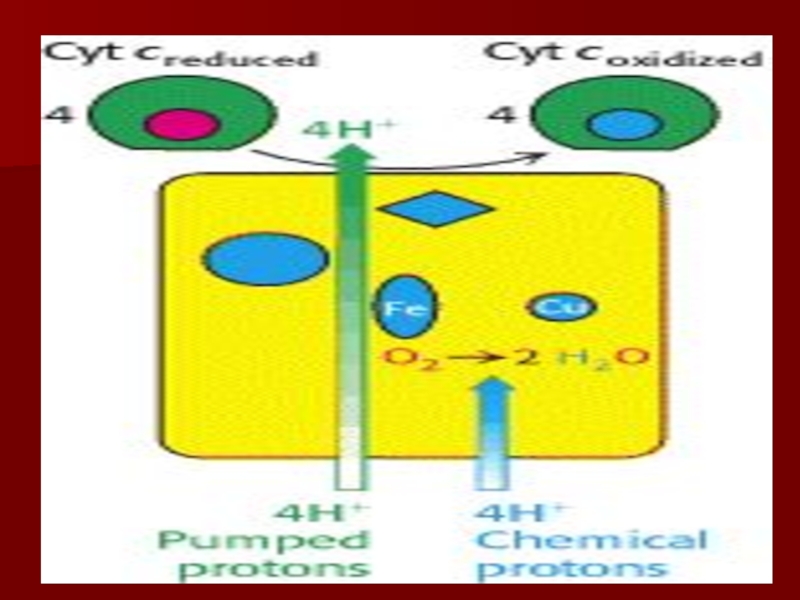
Слайд 41Комплекс IV
цитохром с оксидаза
Электроны с цитохрома с используются для четырехэлектронного
восстановления молекулы кислорода, что приводит к образованию двух молекул воды;
кислород конечный акцептор электронов в дыхательной цепи;
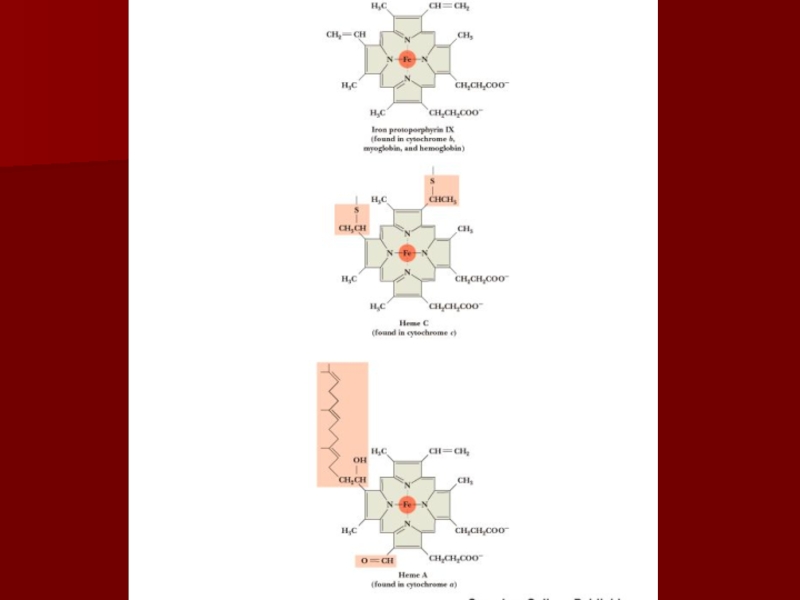
цитохром с оксидаза использует два гема (а и а3) и два иона меди;
структура комплекса до конца не изучена;
комплекс IV также транспортирует протоны водорода.
Слайд 47Сопряжение транспорта электронов и окислительного фосфорилирования
Много исследователей пытались найти «высокоэнергетический
посредник»;
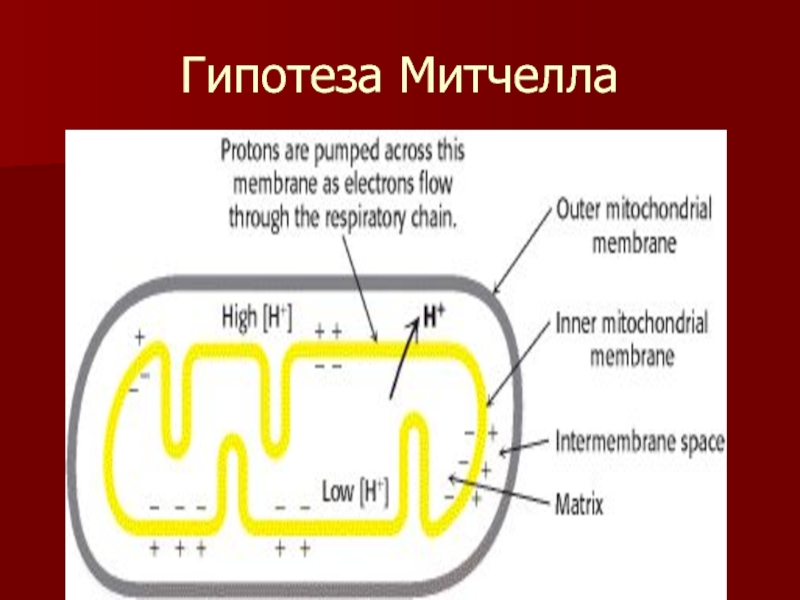
Питер Митчелл предложил необычную идею: протонный градиент через внутреннюю
митохондриальную мембрану может быть использован для синтеза АТФ; Митчелл был осмеян, но хемиоосмотическая гипотеза позволила ему получить Нобелевскую премию.
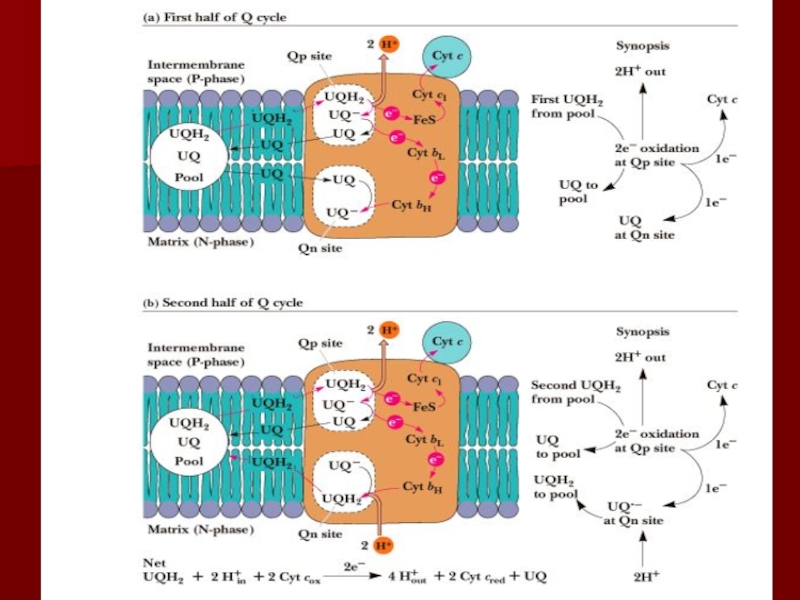
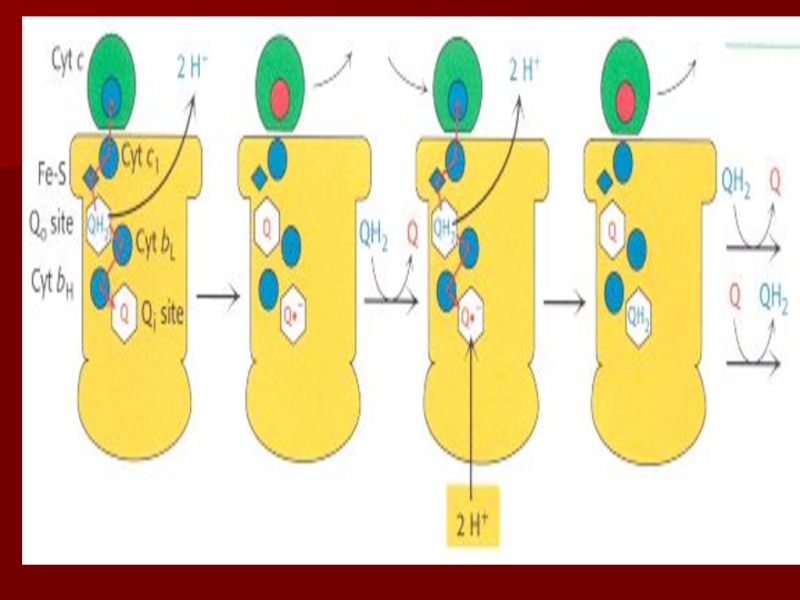
Слайд 49Q цикл
Происходит передача двух электронов с восстановленной формы коэнзима Q:
один на цитохром с, другой на коэнзим Q, образуя полухинон.
Вновь
образованный коэнзим Q диффундирует и замещается новой молекулой QH2 , которая тоже отдает электроны: один на второй цитохром с, второй на полухинон. Транспорт второго электрона сопровождается выкачиванием двух протонов из матрикса.
Слайд 53Основные положения теории Митчелла.
Перенос электронов по дыхательной цепи от НАД.Н+Н+
к кислороду сопровождается выкачиванием протонов из матрикса митохондрий в межмембранное
пространство.Протоны, перенесенные из матрикса в межмембранное пространство, не могут вернуться обратно в матрикс, так как внутренняя мембрана непроницаема для протонов.
Таким образом, создается протонный градиент, при котором концентрация протонов в межмембранном пространстве больше, а рН меньше, чем в матриксе.
Каждый протон несет положительный заряд, и вследствие этого появляется разность потенциалов по обе стороны мембраны: отрицательный заряд на внутренней стороне и положительный на внешней.
В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал Н+– источник энергии для синтеза АТФ.
Слайд 61Резюме
Дыхательная цепь- путь переноса протонов и электронов от органических веществ
на кислород воздуха
Это система переносчиков, структурно закрепленная в мембране
митохондрий и расположенных в соответствии со своими редокс – потенциалами.В процессе переноса электронов по дыхательной цепи создаётся протонный градиент;
Окислительное фосфорилирование: поступление протонов обратно в матрикс приводит к синтезу АТФ
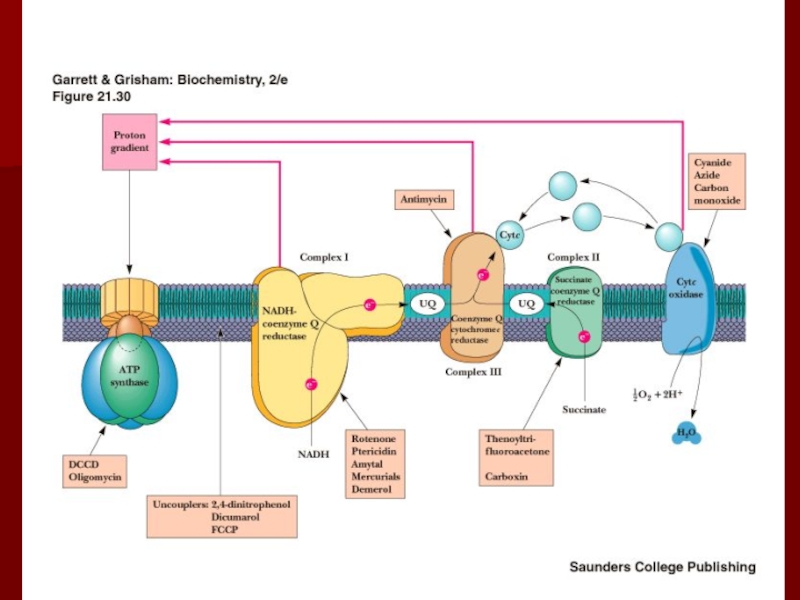
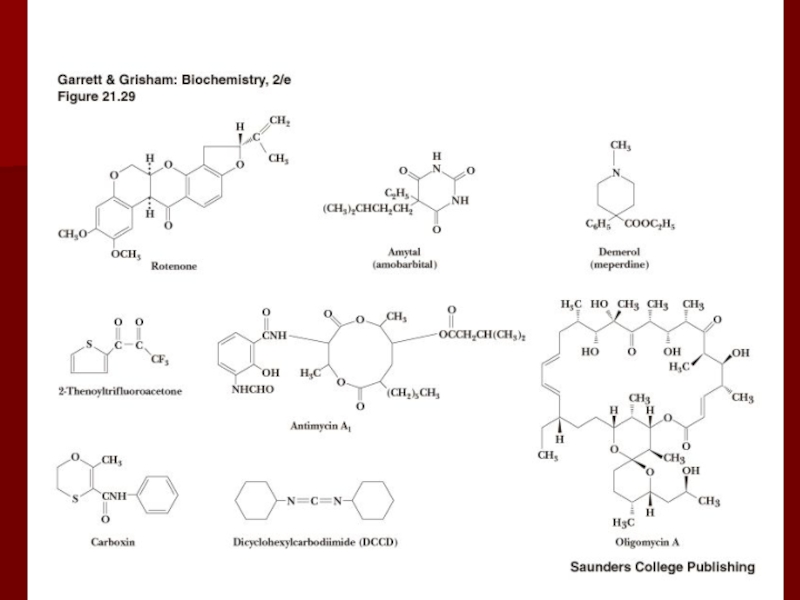
Слайд 63Ингибиторы окислительного фосфорилирования
Ротенон (рыбий яд) ингибирует комплекс I;
Цианиды, азиды
и угарный газ ингибируют комплекс IV, взаимодействуя с ферри формой
цитохрома а3;олигомицин и дициклогексокарбодиимид ингибируют АТФ синтазу.
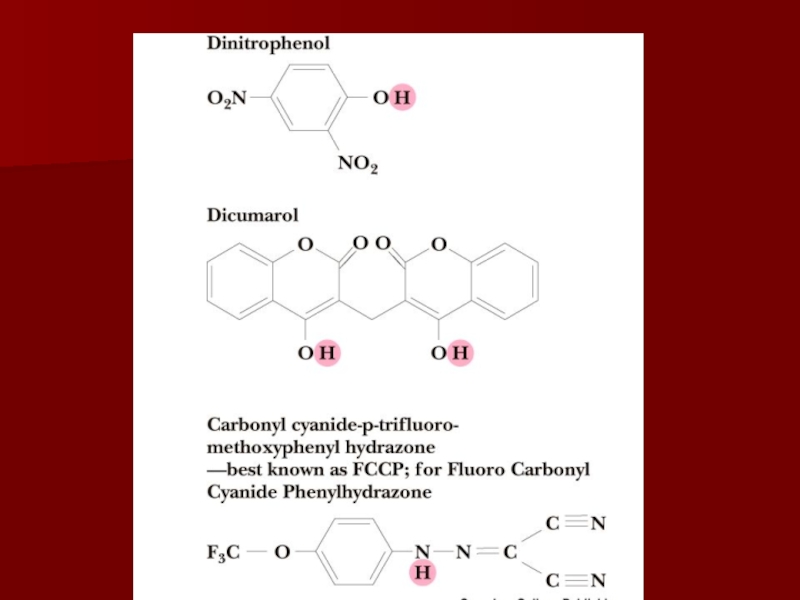
Слайд 66Разобщители
Разобщение потока электронов и окислительного фосфорилирования происходит при нарушении протонного
градиента;
Разобщители являются гидрофобными молекулами, способными диссоциировать;
Они перемещаются через мембрану, переносят
протоны из межмембранного пространства обратно в матрикс, нарушая протонный градиент.Слайд 70АТФ-АДФ транслоказа
В большинстве клеток синтез основного количества АТФ происходит в
митохондриях, а основные потребители АТФ расположены вне её;
В мембране есть
белок АТФ/АДФ-антипортер, осуществляющий перенос этих метаболитов через мембрану;Молекула АДФ поступает в митохондриальный матрикс только при условии выхода молекулы АДФ из матрикса;
Движущая сила такого обмена - мембранный потенциал переноса электронов по ЦПЭ;
На транспорт АТФ и АДФ расходуется около четверти свободной энергиипротонного потенциала.
Слайд 73Коэффициент P/O
Означает сколько молекул АТФ синтезируется при передаче пары электронов
от субстрата на кислород;
Транспорт e- по дыхательной цепи от
НАД+ к кислороду сопровождается синтезом 3 АТФ;Транспорт e- по дыхательной цепи от ФАД к кислороду сопровождается синтезом 2 АТФ.
Слайд 74Активные формы кислорода.
Кислород является потенциально токсическим веществом.Токсичность может
возрастать в результате неполного восстановления молекулы кислорода в супероксидный радикал
(О2-), который высокотоксичен и может повреждать ДНК, белки и липиды мембран. Супероксид ион опосредует процессы старения.Слайд 75Супероксид ион
Супероксид ион может образовываться в митохондриях при реакции кислорода
с восстановленными ФАД или убихиноном.
Детоксикация О2-:
2О2- + 2Н+ Н2О2+О2 Слайд 77Пероксид водорода
Н2О2 так же токсичен и разрушается пероксидазой
в следующей реакции:
2Н2О22Н2О+О2а. Наиболее распространенная пероксидаза - гемсодержащий фермент каталаза.
б. В эритроцитах, глутатион пероксидаза, селенсодержащий фермент, катализирует реакцию, сопутствующую окислению восстановленного глутатиона.
в. Витамин С и витамин Е, также принимают участие в детоксикации супероксидного иона и других потенциально опасных свободных радикалов.