Слайд 1БИОХИМИЯ МЫШЦ
А.И. Артюхина
ВолГМУ
Слайд 2План
Характеристика мышечной ткани. Миоцит. Особенности гладкомышечных клеток
Строение саркомера Саркоплащма.Небелковые азотистые
экстрактивные вещества.
Строение сократительных белков
Строение регуляторных белков
Механизм сокращения и расслабления скелетной
и гладкой мускулатуры. Особенности функционирования миокарда
Особенности энергетического обмена в мышцах
Биохимические показатели в диагностике патологии скелетных мышц
Динамика биохимических процессов в организме человека при мышечной деятельности
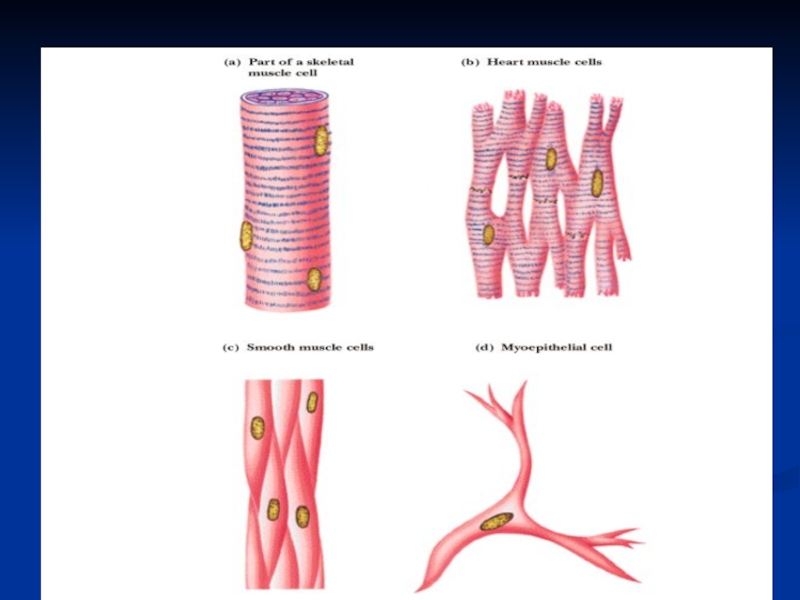
Слайд 5МЫШЕЧНАЯ ТКАНЬ
Мышечная ткань составляет 40-42% от массы тела человека.
Красные скелетные мышцы – аэробы содержат много митохондрий и миоглобина,
сокращаются медленно.
Белые скелетные мышцы – анаэробные, содержат мало митохондрий и миоглобина, сокращаются быстро.
Слайд 6МИОЦИТ
Структурной единицей мышечной ткани является мышечная клетка (миоцит), в которой
различают: ядра, сарколемму (белково-липидный слой);
саркоплазму;
пучки белков миофибрилл;
- опорные белки
стромы (коллаген и эластин).
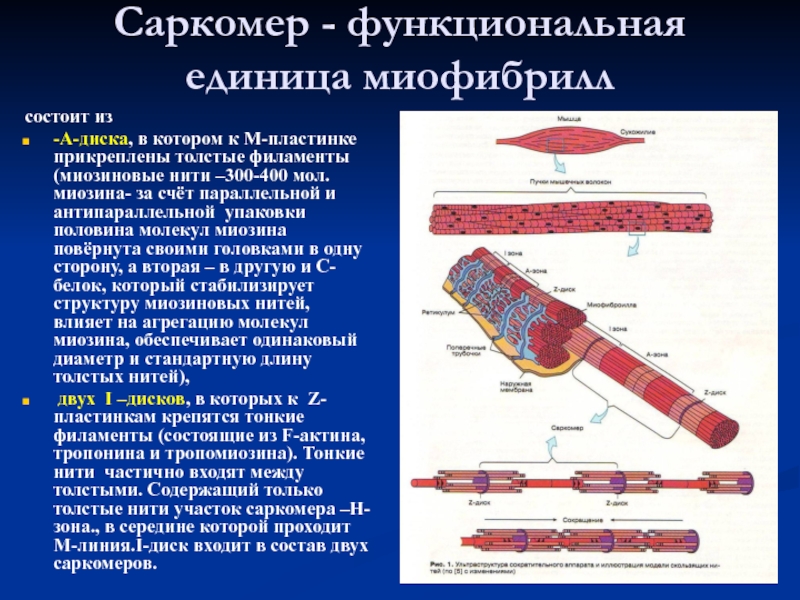
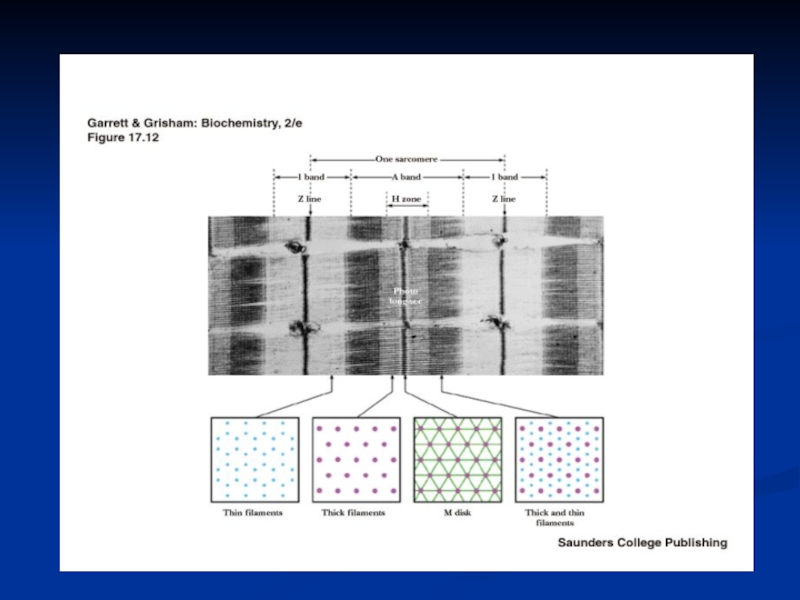
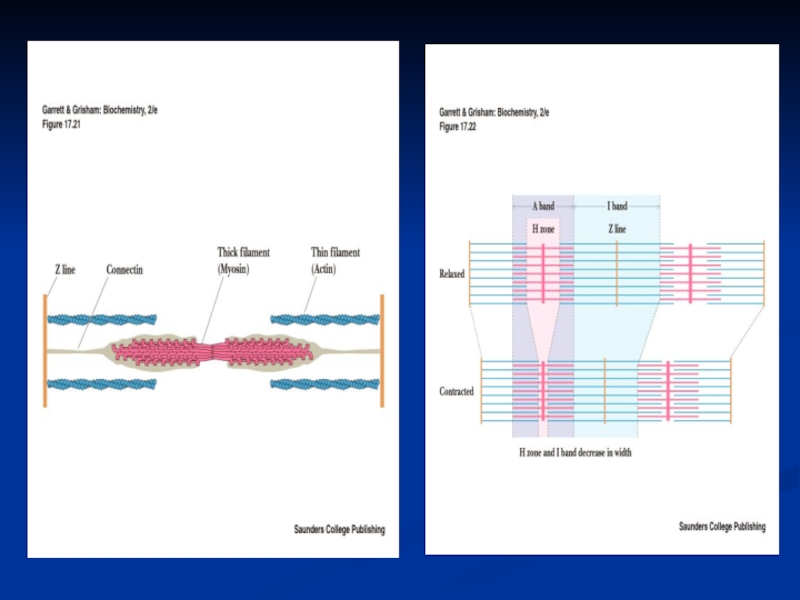
Слайд 8Саркомер - функциональная единица миофибрилл
состоит из
-А-диска, в котором к
М-пластинке прикреплены толстые филаменты (миозиновые нити –300-400 мол. миозина- за
счёт параллельной и антипараллельной упаковки половина молекул миозина повёрнута своими головками в одну сторону, а вторая – в другую и С-белок, который стабилизирует структуру миозиновых нитей, влияет на агрегацию молекул миозина, обеспечивает одинаковый диаметр и стандартную длину толстых нитей),
двух I –дисков, в которых к Z-пластинкам крепятся тонкие филаменты (состоящие из F-актина, тропонина и тропомиозина). Тонкие нити частично входят между толстыми. Содержащий только толстые нити участок саркомера –Н-зона., в середине которой проходит М-линия.I-диск входит в состав двух саркомеров.
Слайд 9Особенности гладкомышечных клеток : отсутствие цистерн, Z-пластинок, прикрепление тонких нитей
непосредственно к цитолемме, (другим концом, как и в саркомерах, они
заходят в промежутки между толстыми нитями).
При сокращении мышц происходит скольжение тонких нитей актина по миозиновым. При их взаимодействии образуются поперечные мостики, тем самым нити перекрываются и саркомер укорачивается на 20-50%.
Во время сокращения мышцы длина толстых и тонких филаментов не меняется, но Н-зона и I-диски укорачиваются.
Слайд 12
БЕЛКИ МИОФИБРИЛЛ
cократительные – актин и миозин (80%);
регуляторные –
тропонин (Тн-С, Тн-Т, Тн-I) и тропомиозин (Тм) (20%).
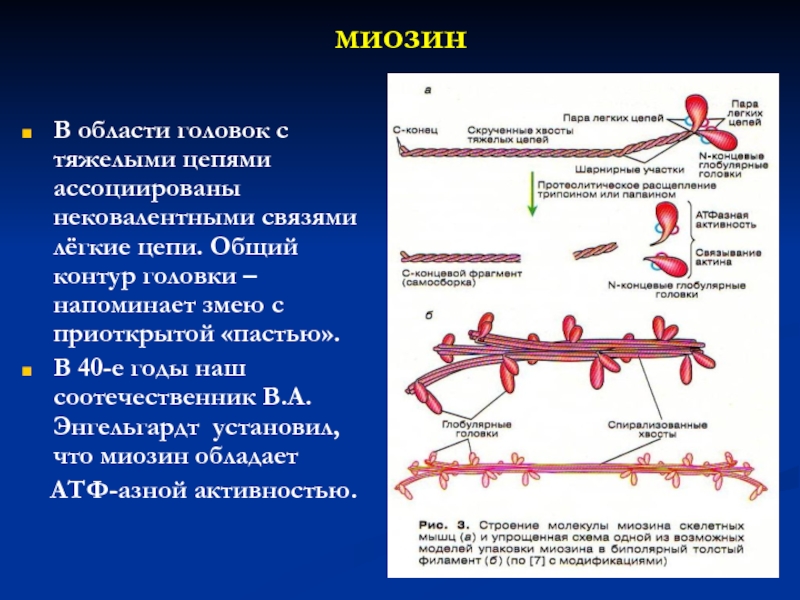
Миозин - асимметрический
гексамер:
2 идентичных тяжелых (М.м. 200 000-250 000) и 4 легких п/п цепей (18 000-28 000).
Спирализованные хвосты тяжелых цепей скручены между собой наподобие каната – высокая жесткость -хвост миозина образует палочкообразные структуры, в некоторых местах – шарнирные участки. Тяжелые цепи заканчиваются грушевидными “головками”. В головке миозина можно выявить 3 основные части:-
N-концевая часть головки миозина формирует АТФ-связывающий центр;
центральная часть головки содержит в своём составе центр связывания актина
С-концевая часть образует как бы каркас всей головки.
Слайд 13миозин
В области головок с тяжелыми цепями ассоциированы нековалентными связями лёгкие
цепи. Общий контур головки –напоминает змею с приоткрытой «пастью».
В
40-е годы наш соотечественник В.А.Энгельгардт установил, что миозин обладает
АТФ-азной активностью.
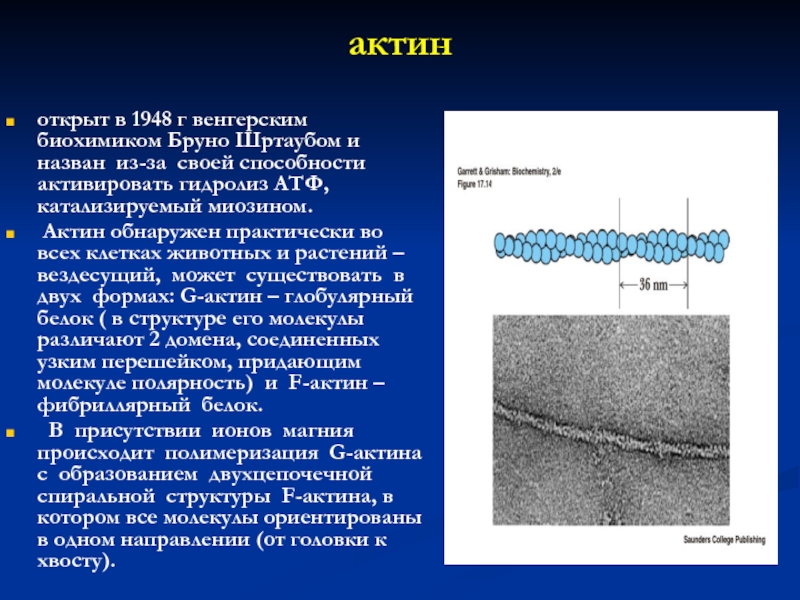
Слайд 14актин
открыт в 1948 г венгерским биохимиком Бруно Шртаубом и назван
из-за своей способности активировать гидролиз АТФ, катализируемый миозином.
Актин обнаружен
практически во всех клетках животных и растений –вездесущий, может существовать в двух формах: G-актин – глобулярный белок ( в структуре его молекулы различают 2 домена, соединенных узким перешейком, придающим молекуле полярность) и F-актин – фибриллярный белок.
В присутствии ионов магния происходит полимеризация G-актина с образованием двухцепочечной спиральной структуры F-актина, в котором все молекулы ориентированы в одном направлении (от головки к хвосту).
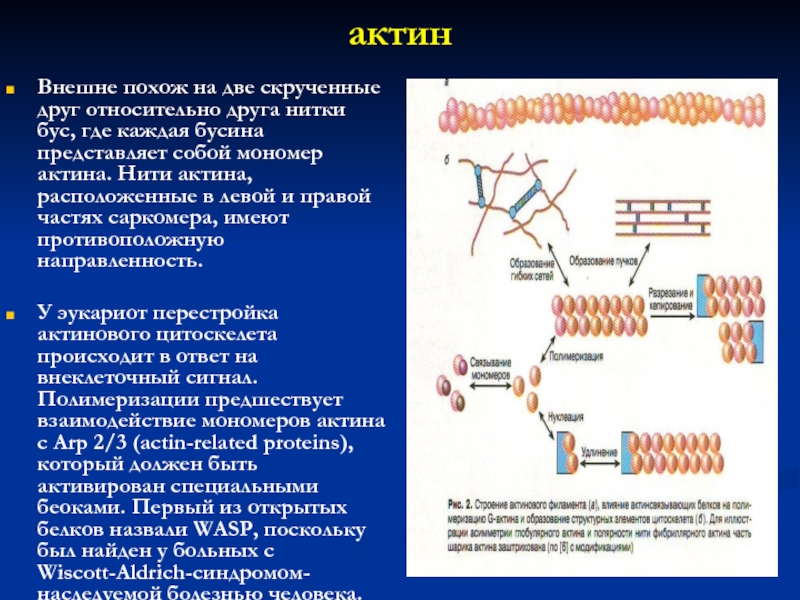
Слайд 15актин
Внешне похож на две скрученные друг относительно друга нитки бус,
где каждая бусина представляет собой мономер актина. Нити актина, расположенные
в левой и правой частях саркомера, имеют противоположную направленность.
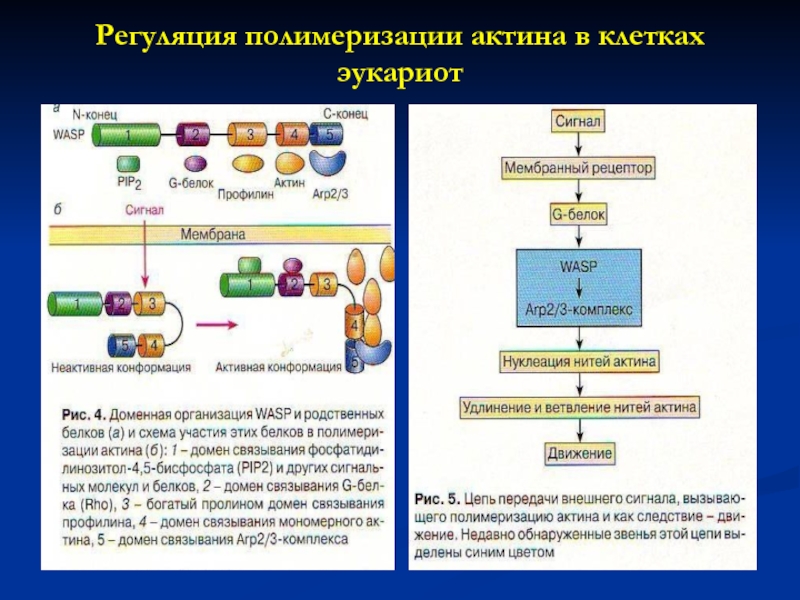
У эукариот перестройка актинового цитоскелета происходит в ответ на внеклеточный сигнал. Полимеризации предшествует взаимодействие мономеров актина с Arp 2/3 (actin-related proteins), который должен быть активирован специальными беоками. Первый из открытых белков назвали WASP, поскольку был найден у больных с Wiscott-Aldrich-синдромом-наследуемой болезнью человека.
Слайд 16Регуляция полимеризации актина в клетках эукариот
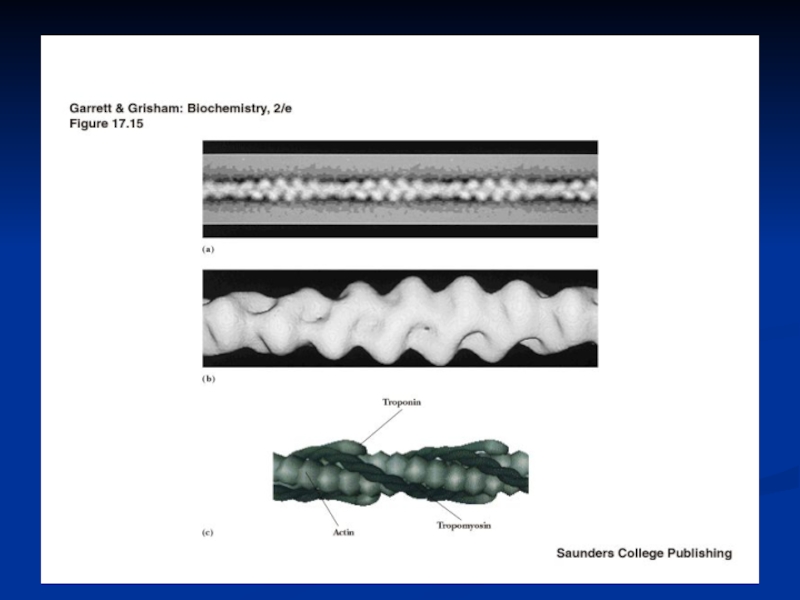
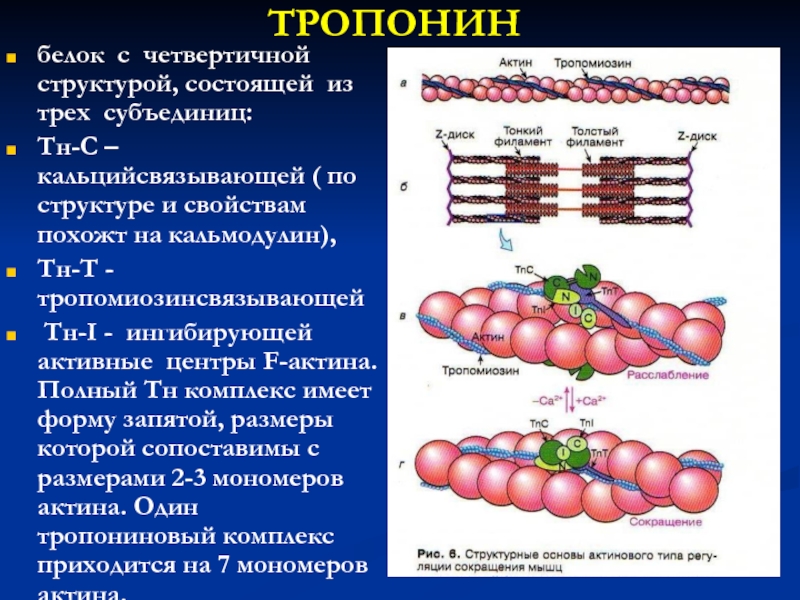
Слайд 18ТРОПОНИН
белок с четвертичной структурой, состоящей из трех субъединиц:
Тн-С –
кальцийсвязывающей ( по структуре и свойствам похожт на кальмодулин),
Тн-Т
- тропомиозинсвязывающей
Тн-I - ингибирующей активные центры F-актина. Полный Тн комплекс имеет форму запятой, размеры которой сопоставимы с размерами 2-3 мономеров актина. Один тропониновый комплекс приходится на 7 мономеров актина.
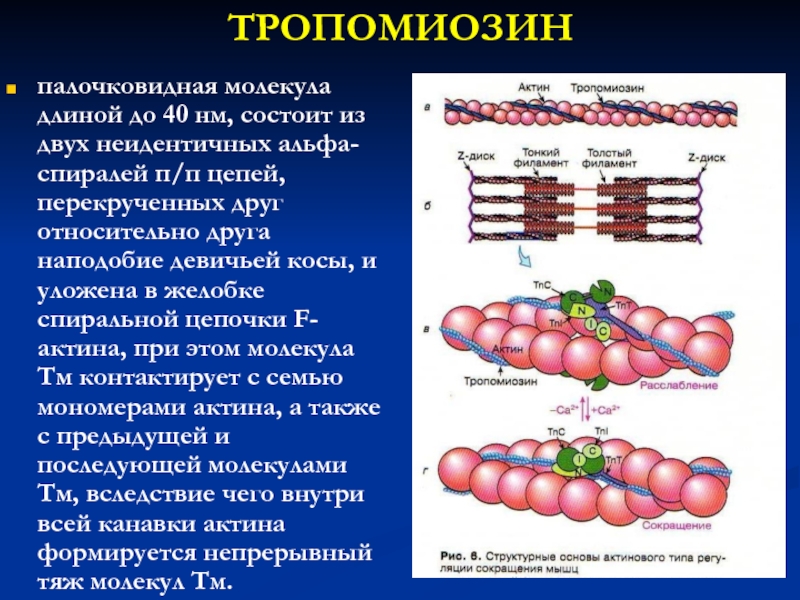
Слайд 19ТРОПОМИОЗИН
палочковидная молекула длиной до 40 нм, состоит из двух неидентичных
альфа-спиралей п/п цепей, перекрученных друг относительно друга наподобие девичьей косы,
и уложена в желобке спиральной цепочки F-актина, при этом молекула Тм контактирует с семью мономерами актина, а также с предыдущей и последующей молекулами Тм, вследствие чего внутри всей канавки актина формируется непрерывный тяж молекул Тм.
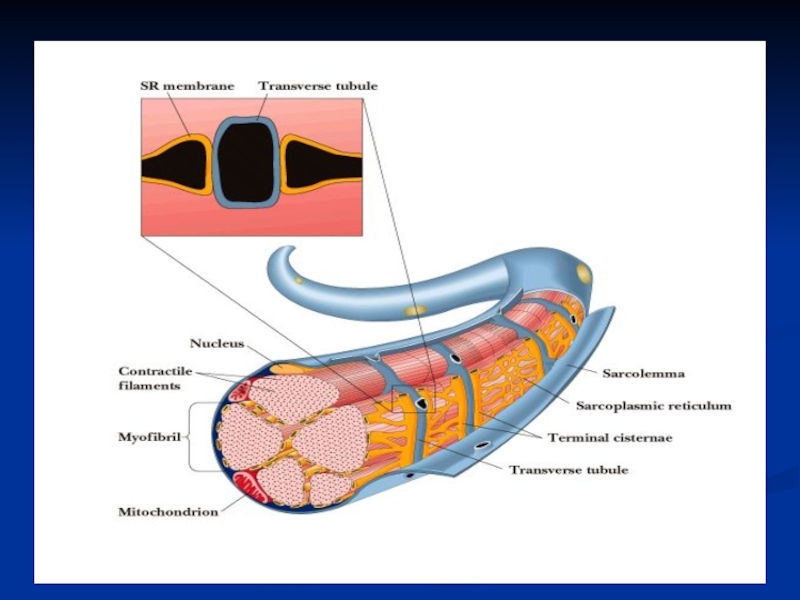
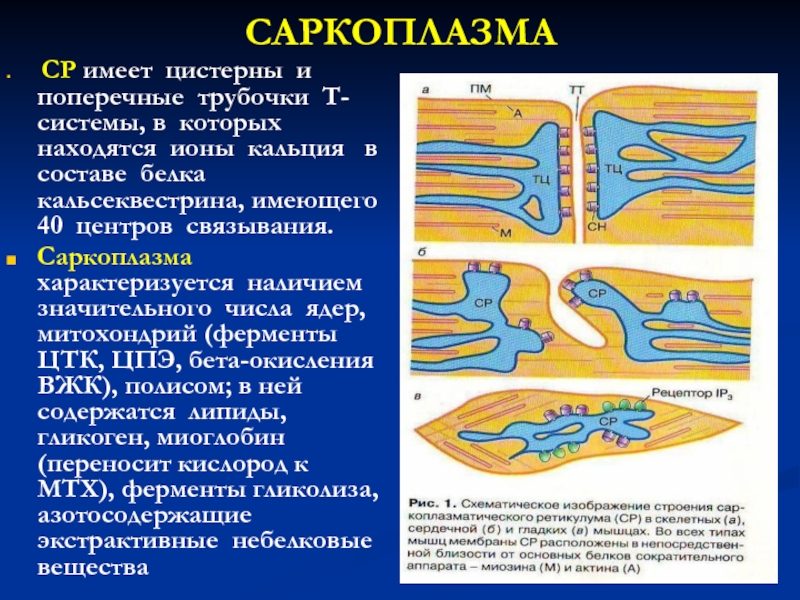
Слайд 20САРКОПЛАЗМА
CР имеет цистерны и поперечные трубочки Т-системы, в которых
находятся ионы кальция в составе белка кальсеквестрина, имеющего 40
центров связывания.
Саркоплазма характеризуется наличием значительного числа ядер, митохондрий (ферменты ЦТК, ЦПЭ, бета-окисления ВЖК), полисом; в ней содержатся липиды, гликоген, миоглобин (переносит кислород к МТХ), ферменты гликолиза, азотосодержащие экстрактивные небелковые вещества
Слайд 21Небелковые азотистые экстрактивные вещества
Адениловые нуклеотиды (АТФ, АДФ, АМФ),
Креатин, креатинин,
креатинфосфат (КФ)
Дипептиды: карнозин (бета-аланингистидин) и его N-метилпроизводное –анзерин
обеспечивают увеличение амплитуды мышечного сокращения
Слайд 22Механизм сокращения поперечнополосатой мышечной ткани
1. Разряд мотонейрона. До сокращения
мышцы концентрация ионов кальция в саркоплазме составляет 10-8 –10-7 моль/л.
2. Высвобождение нейромедиатора : из нервных окончаний ацетилхолин
3.Связывание АХ : связывается с холинорецепторами = никотинрецепторами (одновременно являются Nа-каналами, которые открываются) в цитоплазму ток ионов Nа (по градиенту концентрации и градиенту заряда) потенциал ПМ от -80 мВ до +40 мВ =деполяризация мембраны : а)-активация потенциалзависимых Nа-каналов----потенциал действия по трубочкам Т-системы ---мышечное сокращение; б) активация потенциалчувствительных К-каналов (ионы К+ наружу) и потенциал покоя восстанавливается.
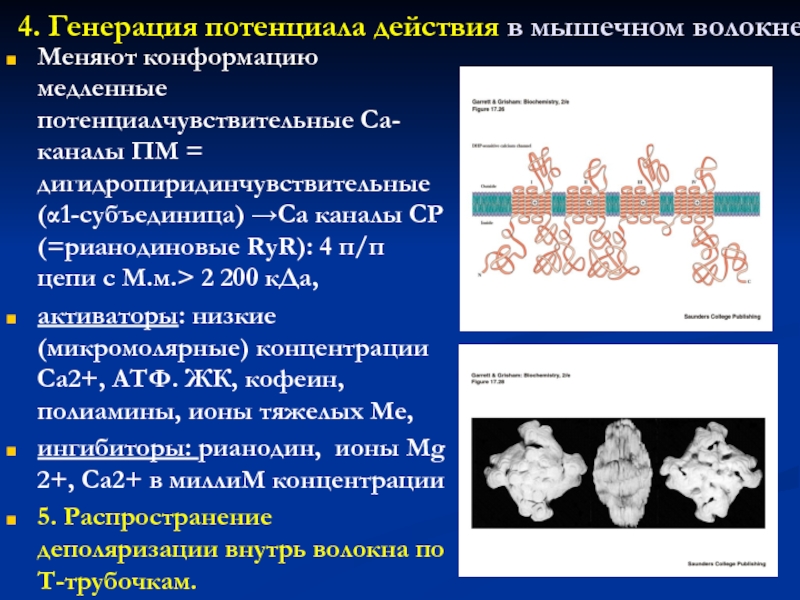
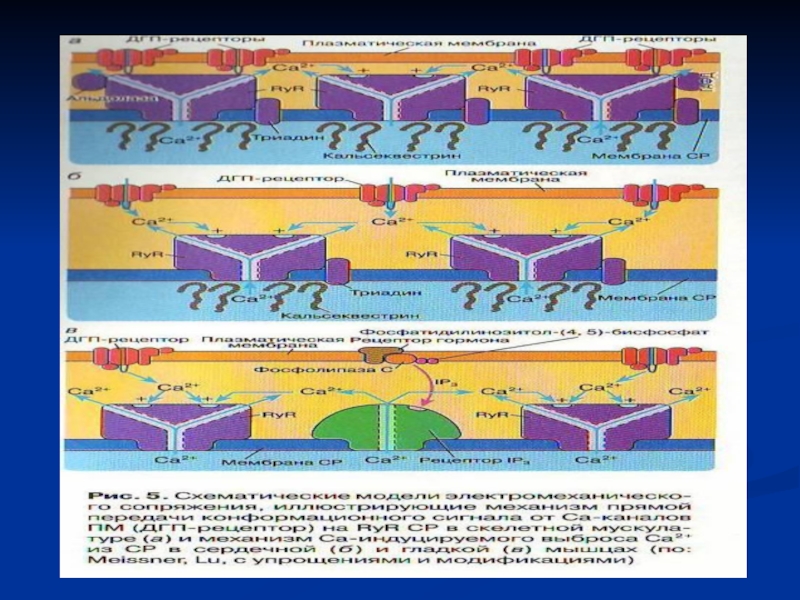
Слайд 234. Генерация потенциала действия в мышечном волокне
Меняют конформацию медленные потенциалчувствительные
Са-каналы ПМ = дигидропиридинчувствительные (1-субъединица) Са каналы СР (=рианодиновые RyR):
4 п/п цепи с М.м. 2 200 кДа,
активаторы: низкие (микромолярные) концентрации Са2+, АТФ. ЖК, кофеин, полиамины, ионы тяжелых Ме,
ингибиторы: рианодин, ионы Mg 2+, Са2+ в миллиМ концентрации
5. Распространение деполяризации внутрь волокна по Т-трубочкам.
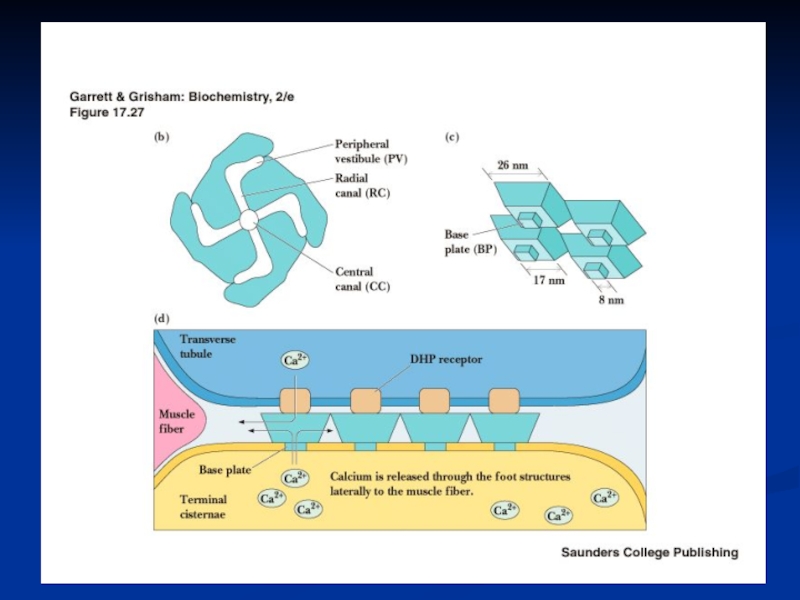
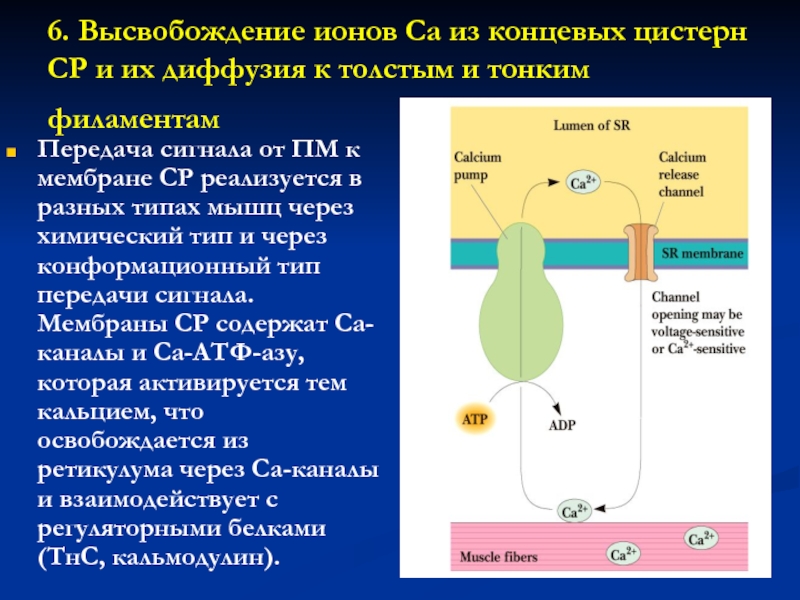
Слайд 266. Высвобождение ионов Са из концевых цистерн СР и их
диффузия к толстым и тонким филаментам
Передача сигнала от ПМ
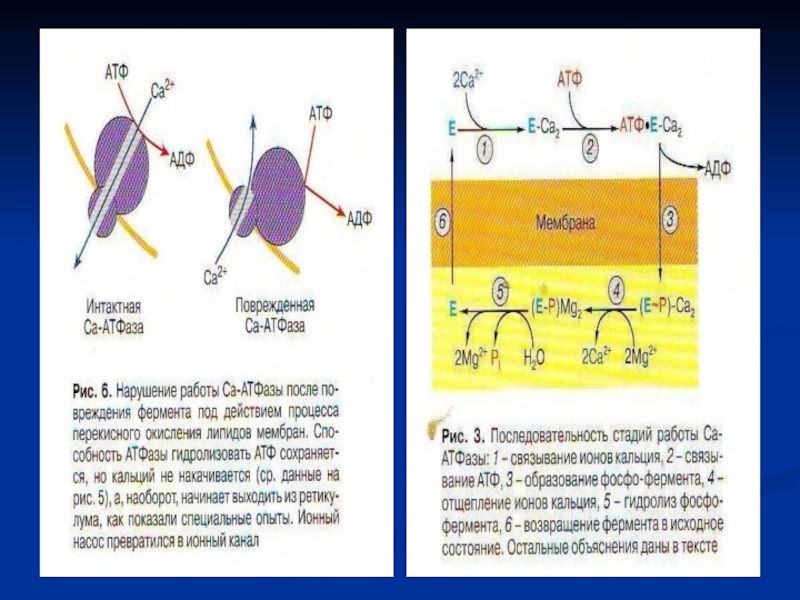
к мембране СР реализуется в разных типах мышц через химический тип и через конформационный тип передачи сигнала. Мембраны СР содержат Са-каналы и Са-АТФ-азу, которая активируется тем кальцием, что освобождается из ретикулума через Са-каналы и взаимодействует с регуляторными белками (ТнС, кальмодулин).
Слайд 28 7. Связывание Са с ТнС, открывающее миозин-связывающие участки актина
Концентрация Са+2 10-6 - 10-5 моль/л необходима и достаточна
для образования I комплекса ТнС- Са+2.
Связывание Са+2 изменяет пространственную структуру тропонина и комплекс реагирует с ТнI и ТнТ влияя на их взаимодействие с Тм,
образуя II комплекс ТнС- 4Са+2- Тм
При изменении конформации Тн открываются активные центры F-актина, который взаимодействует с «головками» миозина, образует актомиозин, обладающий АТФ-азной активностью.
Слайд 298. Образование поперечных связей между актином и миозином
и скольжение тонких
филаментов относительно толстых, сопровождающееся укорочением волокна
Актомиозин, гидролизуя АТФ, высвобождает энергию
для мышечного сокращения, что обеспечивает продвижение актина по миозину. Каждая из головок генерирует маленькое тянущее усилие (несколько пиконьютонов) -усилия суммируются – мышца может развивать достаточно большие напряжения.
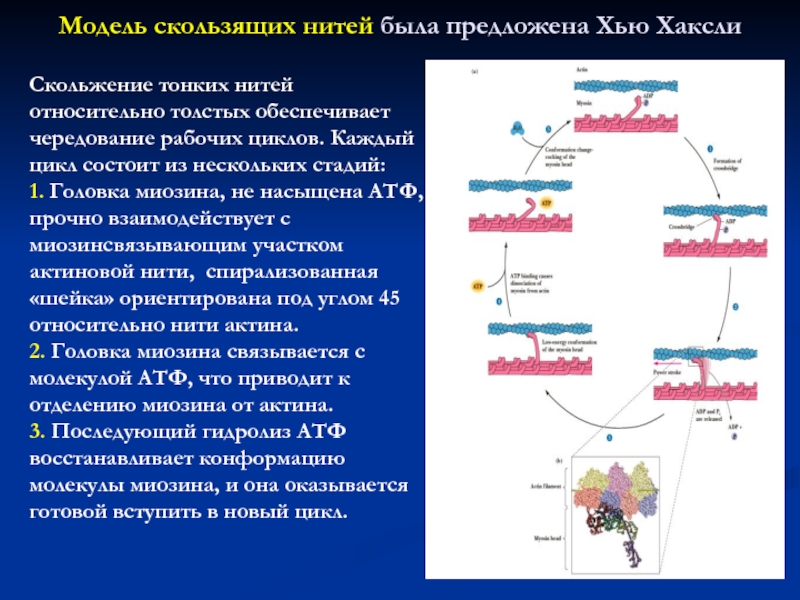
Слайд 30Скольжение тонких нитей относительно толстых обеспечивает чередование рабочих циклов. Каждый
цикл состоит из нескольких стадий:
1. Головка миозина, не насыщена АТФ,
прочно взаимодействует с миозинсвязывающим участком актиновой нити, спирализованная «шейка» ориентирована под углом 45 относительно нити актина.
2. Головка миозина связывается с молекулой АТФ, что приводит к отделению миозина от актина.
3. Последующий гидролиз АТФ восстанавливает конформацию молекулы миозина, и она оказывается готовой вступить в новый цикл.
Модель скользящих нитей была предложена Хью Хаксли
Слайд 31
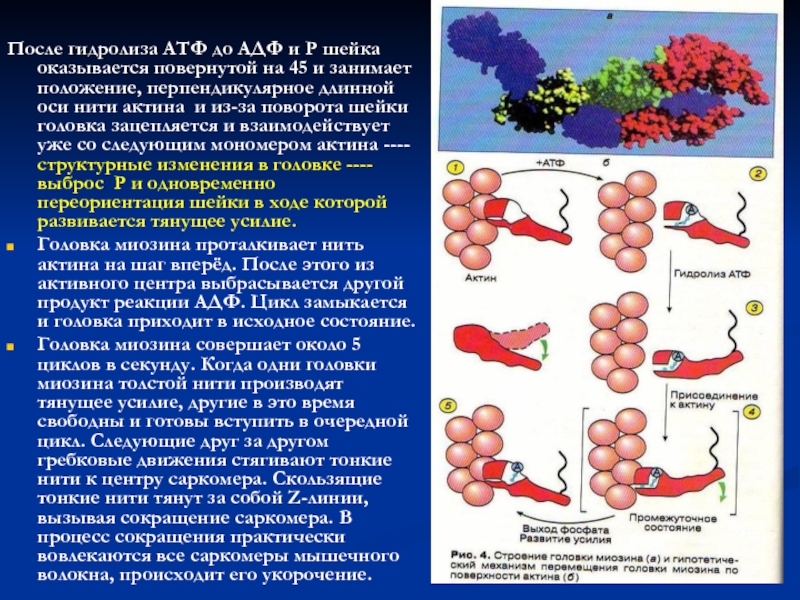
После гидролиза АТФ до АДФ и Р шейка оказывается
повернутой на 45 и занимает положение, перпендикулярное длинной оси нити
актина и из-за поворота шейки головка зацепляется и взаимодействует уже со следующим мономером актина ----структурные изменения в головке ----выброс Р и одновременно переориентация шейки в ходе которой развивается тянущее усилие.
Головка миозина проталкивает нить актина на шаг вперёд. После этого из активного центра выбрасывается другой продукт реакции АДФ. Цикл замыкается и головка приходит в исходное состояние.
Головка миозина совершает около 5 циклов в секунду. Когда одни головки миозина толстой нити производят тянущее усилие, другие в это время свободны и готовы вступить в очередной цикл. Следующие друг за другом гребковые движения стягивают тонкие нити к центру саркомера. Скользящие тонкие нити тянут за собой Z-линии, вызывая сокращение саркомера. В процесс сокращения практически вовлекаются все саркомеры мышечного волокна, происходит его укорочение.
Слайд 32Расслабление
Для процесса расслабления требуется энергия в виде АТФ, Mg+2-Ca+2 -
АТФ-аза,
находящаяся в мембране СР, активируясь под действием карнозина и анзерина,
используя энергию АТФ, начинают перекачивать ионы кальция из саркоплазмы в полость цистерн.
Вследствие этого:
содержание Са+2 в саркоплазме падает ниже 10-7 моль/л ;
что ведёт к распаду комплексов I, II;
комплекс ТнС-4Са+2 утрачивает свой Са+2;
тропонинI, реагируя с тропомиозином, подавляет дальнейшее взаимодействие миозиновой головки с F-актином;
блокировка активных центров F-актина приводит к распаду актомиозина.
Мышца расслабляется и её длина достигает исходной.
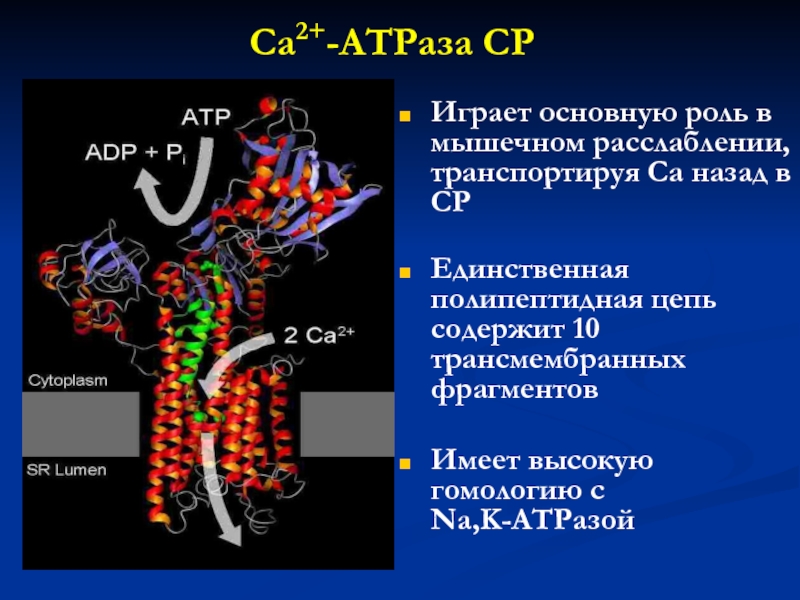
Слайд 33Ca2+-ATPaза СР
Играет основную роль в мышечном расслаблении, транспортируя Ca назад
в СР
Единственная полипептидная цепь содержит 10 трансмембранных фрагментов
Имеет высокую гомологию
с Na,K-ATPaзой
Слайд 35Механизм сокращения
МИОКАРДА:
основным источником ионов Са+2 для возбуждения служит внеклеточная жидкость
( кальций индуцированный выброс Са+2).
Если Са+2 во
внеклеточной жидкости отсутствует, сокращения сердечной мышцы прекращаются в течение 1 минуты; скелетная мышца в таких условиях может сокращаться часами.
Деполяризация ПМ кардиомиоцитов → активация потенциалчувствительных Са-каналов ПМ→ из внеклеточной среды в цитозоль небольшое количество Са+2 → активация Са-каналов СР → освобождение основного количества Са+2 для мышечного сокращения.
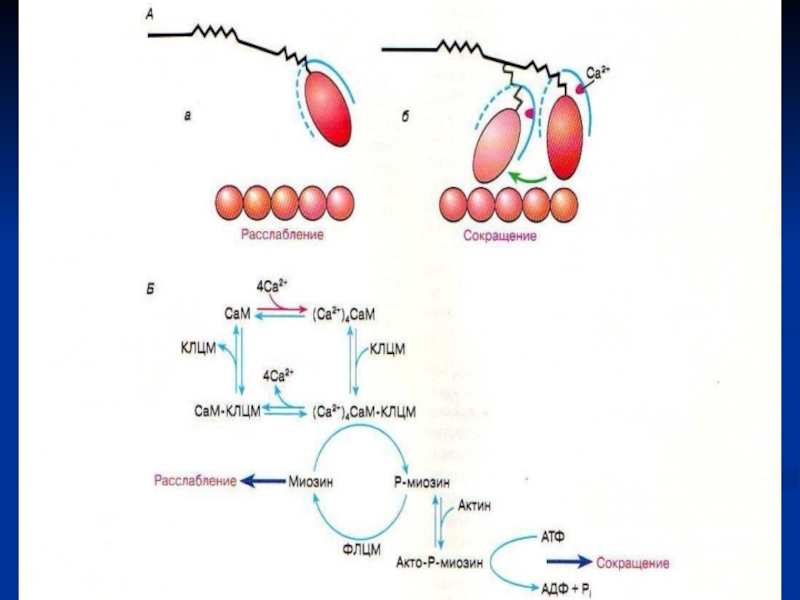
гладких мышц: регулируется Са+2 опосредованно. Одна из лёгких цепей (р) миозина ингибирует связывание головки миозина с F-актином.
Ионы кальция соединяются с белком кальмодулином, вызывая в нем конформационные изменения, в результате которых комплекс Са+2 -кальмодулин присоединяется к неактивной киназе лёгких цепей миозина и активирует её. Киназа ЛЦМ в присутствии АТФ фосфорилирует р-лёгкую цепь и снимает ингибирование, вызывая таким образом сокращение.
Слайд 37
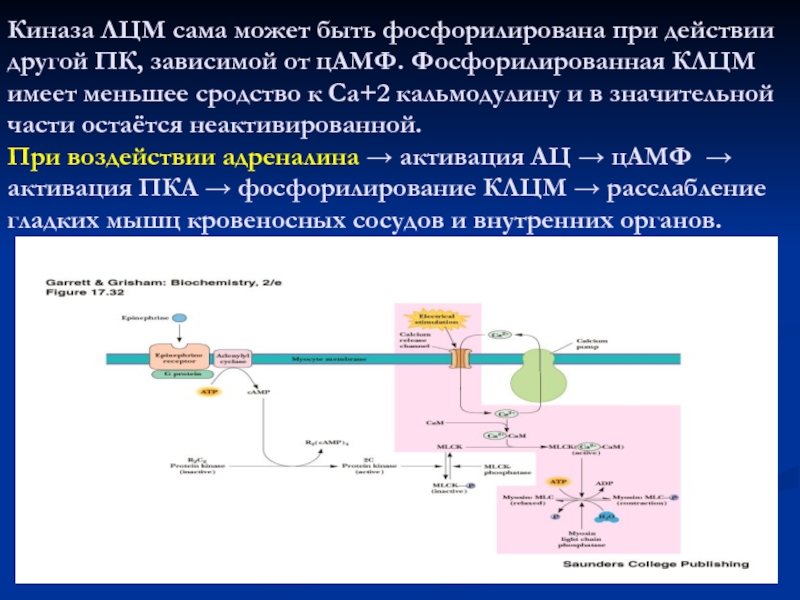
Киназа ЛЦМ сама может быть фосфорилирована при действии другой ПК,
зависимой от цАМФ. Фосфорилированная КЛЦМ имеет меньшее сродство к Са+2
кальмодулину и в значительной части остаётся неактивированной.
При воздействии адреналина активация АЦ цАМФ активация ПКА фосфорилирование КЛЦМ расслабление гладких мышц кровеносных сосудов и внутренних органов.
Слайд 38Расслабление гладких мышц
происходит когда :
1) содержание ионов Са+2 в
саркоплазме падает ниже 10-7;
2) Са+2 отсоединяется от кальмодулина, который отделяется
от киназы р- лёгкой цепи миозина, вызывая её инактивацию;
3) нового фосорилирования р-лёгкой цепи не происходит;
4) дефосфорилированная р-лёгкая цепь миозина ингибирует связывание миозиновых головок с F-актином и подавляет активность АТФ-азы;
5) миозиновые головки в присутствии АТФ отделяются от F-актина.
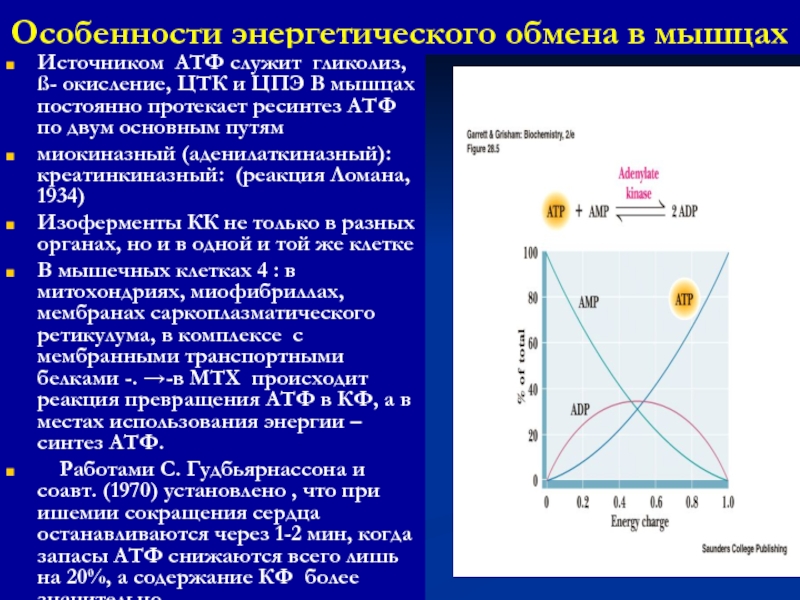
Слайд 39Особенности энергетического обмена в мышцах
Источником АТФ служит гликолиз, ß-
окисление, ЦТК и ЦПЭ В мышцах постоянно протекает ресинтез АТФ
по двум основным путям
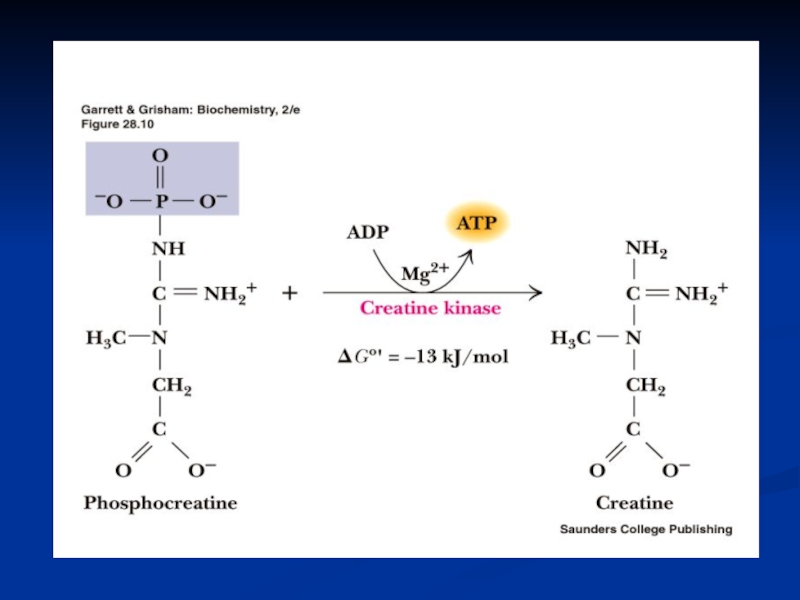
миокиназный (аденилаткиназный): креатинкиназный: (реакция Ломана, 1934)
Изоферменты КК не только в разных органах, но и в одной и той же клетке
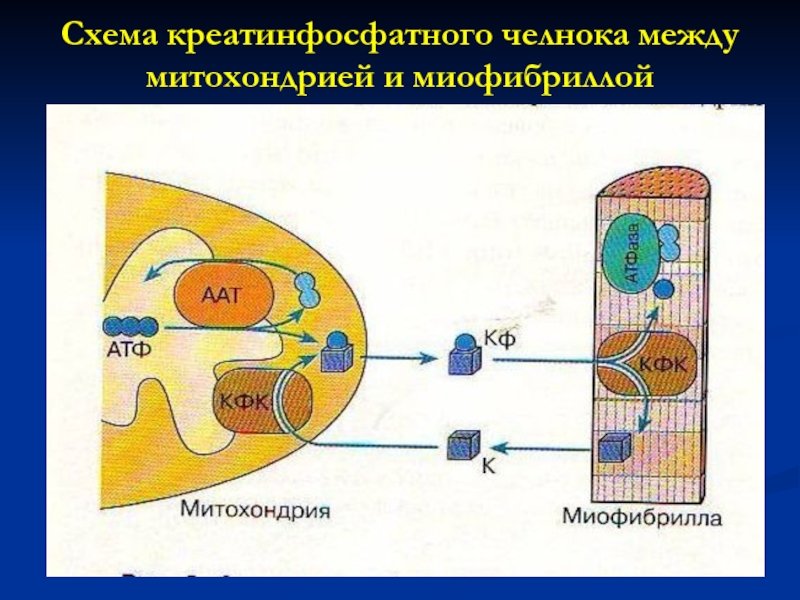
В мышечных клетках 4 : в митохондриях, миофибриллах, мембранах саркоплазматического ретикулума, в комплексе с мембранными транспортными белками -. -в МТХ происходит реакция превращения АТФ в КФ, а в местах использования энергии – синтез АТФ.
Работами С. Гудбьярнассона и соавт. (1970) установлено , что при ишемии сокращения сердца останавливаются через 1-2 мин, когда запасы АТФ снижаются всего лишь на 20%, а содержание КФ более значительно.
Слайд 41 СИНТЕЗ КРЕАТИНА: в почках, метилирование в
печени, транспорт в мышцы и клетки мозга
Неферментативно
КФ креатинин, выводится с мочой
Слайд 42Схема креатинфосфатного челнока между митохондрией и миофибриллой
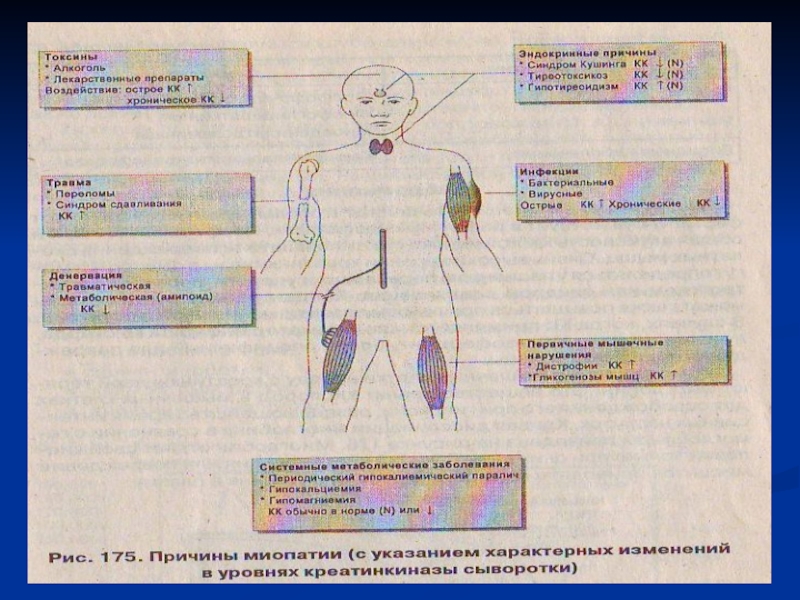
Слайд 43Биохимические показатели в диагностике патологии скелетных мышц
Моча взрослого здорового человека не содержит креатина и выделение его
с мочой (креатинурия) свидетельствует о патологии поперечно-полосатых мышц: миастении, мышечной дистрофии. Количество же креатинина в моче при этих заболеваниях уменьшается. В крови при заболеваниях скелетных мышц резко увеличивается активность ферментов ККз и ЛДГ5.
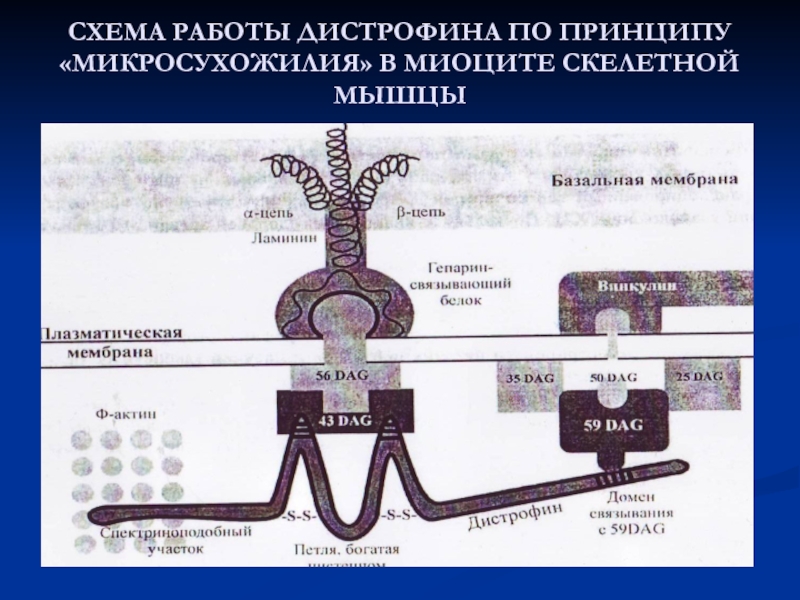
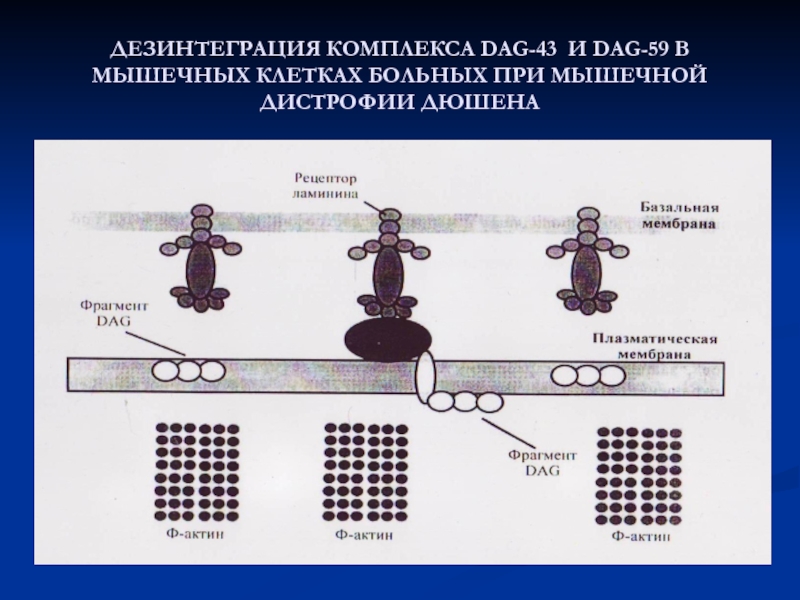
Актиновые и миозиновые филаменты в каждой миофибрилле должны располагаться строго на оптимальном расстоянии друг от друга. Один из белков, регулирующий этот процесс -дистрофин - крупный стержневидный полипетид (М.м.> 400 000) связывает белки мышечной мембраны с актиновыми филаментами в миофибрилле.
МЫШЕЧНАЯ ДИСТРОФИЯ ДЮШЕНА Дефект гена ( сцеплен с Х-хромосомой): потеря координации во время мышечного сокращения, КК выходит из мышц, а туда поступает Са, альбумин –– у мальчиков 1: 3000 – такие дети часто не доживают до совершеннолетия.
Слайд 44СХЕМА РАБОТЫ ДИСТРОФИНА ПО ПРИНЦИПУ «МИКРОСУХОЖИЛИЯ» В МИОЦИТЕ СКЕЛЕТНОЙ МЫШЦЫ
Слайд 45ДЕЗИНТЕГРАЦИЯ КОМПЛЕКСА DAG-43 И DAG-59 В МЫШЕЧНЫХ КЛЕТКАХ БОЛЬНЫХ ПРИ
МЫШЕЧНОЙ ДИСТРОФИИ ДЮШЕНА
Слайд 46МИАСТЕНИЯ ГРЕВИС- аутоиммунное
заболевание вызванное образованием антител к ацетилхолиновым рецепторам и последующим блокированием связывания АХ с рецептором, что предотвращает деполяризацию.
Проявления: огромная мышечная слабость, невозможность поднять руки, правильно держать голову, а также поднять надолго веки.
Лечение антихолинэстеразными препаратами.
Это стимулирует выход АХ и позволяет ему соединиться с незаблокированными рецепторами.
Слайд 48Динамика биохимических процессов в организме человека при мышечной деятельности
Увеличение
доставки кислорода к работающим мышцам;
Мобилизация энергетических ресурсов при мышечной работе
а) Запасы КФ, используемые в первые сек быстро снижаются б) Углеводные запасы -гликоген мышц, гликоген печени в) ЖК и кетоновые тела
( когда понижен уровень глюкозы, лактата)
г) Глюконеогенез (при длительной работе)
В зависимости от количества мышц, участвующих в работе выделяют: 1) локальную – не менее ¼ всех мышц –(спуск курка, переставление шахматных фигур) -изменения в работающей мышце, но в организме в целом биохимические сдвиги невелики- больше доля анаэробных реакций в её обеспечении;
2) региональную (элементы гимнастических упражнений, удар по мячу стоя) – большие биохимические сдвиги, чем локальная;
в) глобальную - в энергетическом обеспечении больше доля аэробных реакций ресинтеза АТФ.
Слайд 49Режим мышечной деятельности
а) статический (изометрический ) приводит к пережиманию капилляров
---велика доля участия анаэробных реакций – для отдыха нужна динамическая
работа (штангисту- походить);
б) динамический ( изотонический) – прерывисто сокращающиеся мышцы действуют как «насос», проталкивающий кровь через капилляры.
Зависимость биохимических процессов от мощности выполняемой мышечной работы и её продолжительности: чем выше мощность, а следовательно, больше скорость расщепления АТФ, тем меньше возможность удовлетворить энергетический запрос за счёт дыхатеьных процессов и тем в большей мере выражены процессы анаэробного ресинтеза АТФ.
Слайд 50Энергетическое обеспечение
в зоне:
–максимальной мощности: за счёт АТФ, КФ, частично
за счёт гликолиза;
субмаксимальной мощности в основном за счёт анаэробного
гликолиза;
большой мощности -аэробные источники энергии при достаточно высоком уровне развития гликолиза;
умеренной мощности максимально аэробное производство энергии.