Слайд 2Редактирование генома – это внесение направленных изменений в геном непосредственно
в живой клетке.
Такой биоинженерный подход значительно более удобен, чем традиционная
генная инженерия, которая подразумевает манипуляции с ДНК in vitro. В пробирке оно, конечно, легче, но ведь эту ДНК потом надо из пробирки взять и каким-то образом засунуть в живой организм, а это не всегда получается.
Сегодня технологии редактирования геномов еще довольно дороги и недостаточно эффективны, а самое главное – слишком часто приводят к редактированию геномов не там, где надо (так называемый эффект off-target). Однако доведение этих технологий до ума – это вопрос только времени, сегодня в этом уже никто не сомневается.
Сейчас все думают, что редактирование генома тождественно равно CRISPR/Cas9, но это далеко не так.
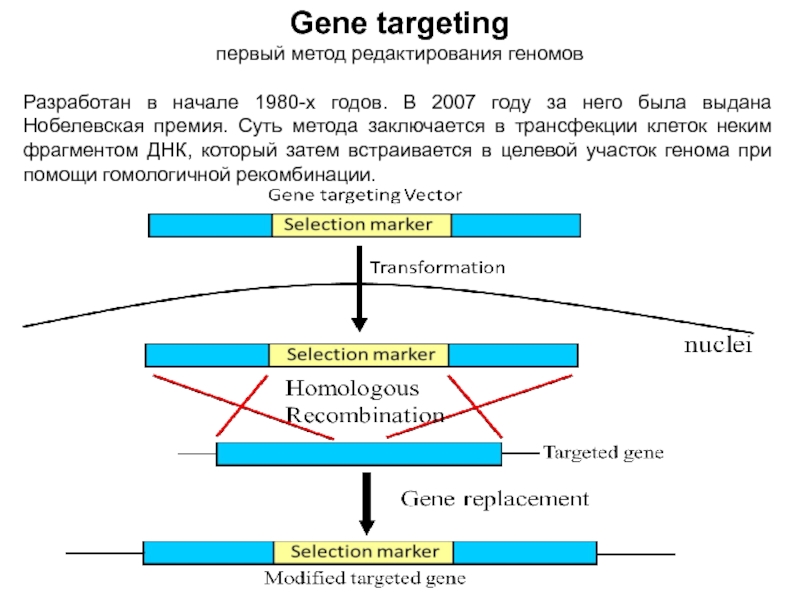
Слайд 3Gene targeting
первый метод редактирования геномов
Разработан в начале 1980-х годов. В
2007 году за него была выдана Нобелевская премия. Суть метода
заключается в трансфекции клеток неким фрагментом ДНК, который затем встраивается в целевой участок генома при помощи гомологичной рекомбинации.
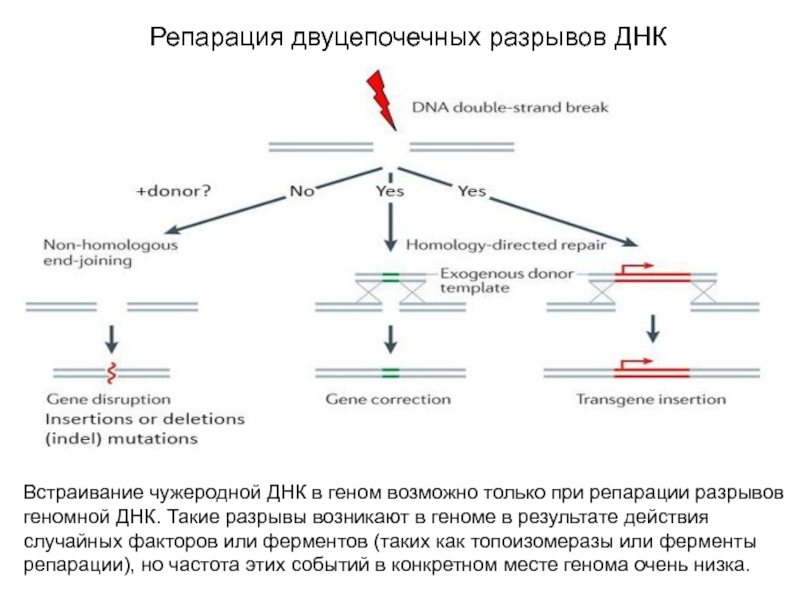
Слайд 4Репарация двуцепочечных разрывов ДНК
Встраивание чужеродной ДНК в геном возможно только
при репарации разрывов геномной ДНК. Такие разрывы возникают в геноме
в результате действия случайных факторов или ферментов (таких как топоизомеразы или ферменты репарации), но частота этих событий в конкретном месте генома очень низка.
Слайд 5Gene targeting
Как и любой пионерский метод, он поначалу был не
очень удачен.
Две его основные проблемы:
Очень высокая частота событий неспецифического встраивания
в геном (эффекта off-target, как сейчас говорят) за счет прохождения негомологичной рекомбинации.
Низкая эффективность процесса гомологичной рекомбинации у высших эукариот (от 10-7 до 10-6).
В целом, обе проблемы были преодолены.
Слайд 6Gene targeting
Дрожжи – организм, которому плевать на проблемы жалких высших
эукариот!
Эффективность гомологичной рекомбинации у дрожжей на два порядка выше
За счет
этого и эффект off-target проявляется слабее
Дрожжевая генетика – самая сильная генетика на свете!
Работая на дрожжах, вы с изумительной легкостью можете:
Удалить ген из генома (первая полная делеционная библиотека – дрожжевая),
Вносить в целевые гены любые нужные вам изменения,
Скрестить два гаплоидных штамма дрожжей, у каждого из которых делетирован какой-либо ген, и получить двойного делетанта,
Вы даже можете организовать гомологичную рекомбинацию в митохондриях и получать мутации в митохондриальной ДНК,
И многое, многое другое!
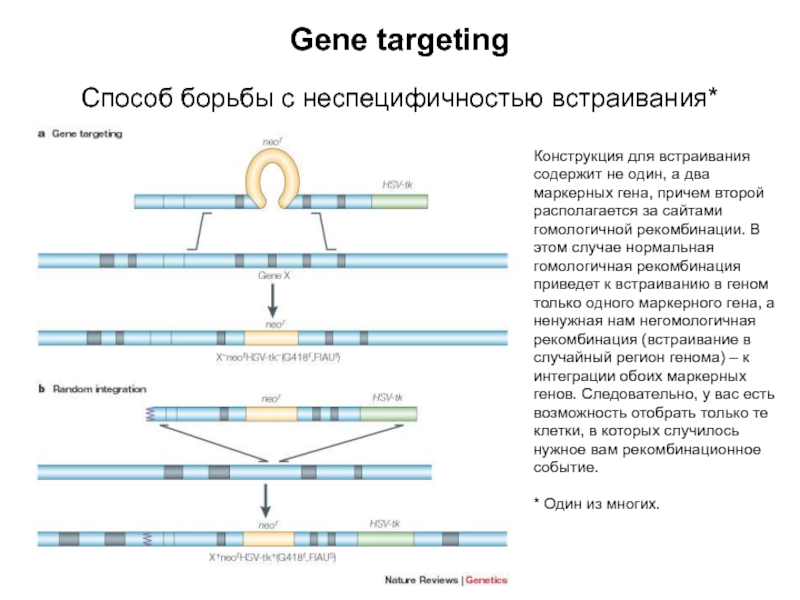
Слайд 7Gene targeting
Способ борьбы с неспецифичностью встраивания*
Конструкция для встраивания содержит не
один, а два маркерных гена, причем второй располагается за сайтами
гомологичной рекомбинации. В этом случае нормальная гомологичная рекомбинация приведет к встраиванию в геном только одного маркерного гена, а ненужная нам негомологичная рекомбинация (встраивание в случайный регион генома) – к интеграции обоих маркерных генов. Следовательно, у вас есть возможность отобрать только те клетки, в которых случилось нужное вам рекомбинационное событие.
* Один из многих.
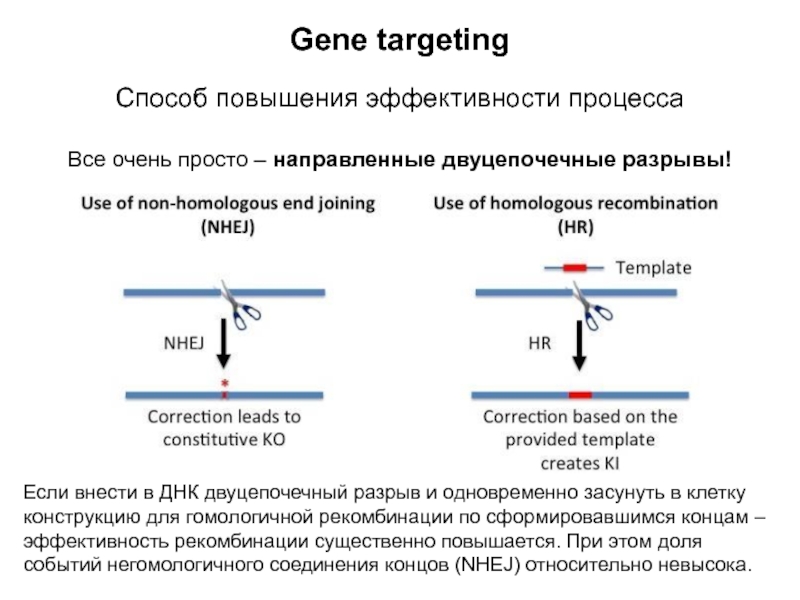
Слайд 8Gene targeting
Способ повышения эффективности процесса
Все очень просто – направленные двуцепочечные
разрывы!
Если внести в ДНК двуцепочечный разрыв и одновременно засунуть в
клетку конструкцию для гомологичной рекомбинации по сформировавшимся концам – эффективность рекомбинации существенно повышается. При этом доля событий негомологичного соединения концов (NHEJ) относительно невысока.
Слайд 9Это всё просто великолепно, но есть одна проблема:
Как внести двуцепочечный
разрыв ровно в то место генома, куда вам надо?
С попыток
ответа на этот вопрос началась современная геномная инженерия.
Первое, что для этого придумали – мегануклеазы.
Мегануклеазы – природные ферменты, найденные у некоторых прокариот и водорослей. Высокоэффективно и высокоспецифично расщепляют строго определённые последовательности ДНК. Распознают участок ДНК длинной от 12 до 40 п.н., что делает их наиболее специфичными из всех встречающихся в природе эндонуклеаз рестрикции.
Сильные стороны: очень высокая эффективность и специфичность (в геноме не так много одинаковых последовательностей длиной по 40 нуклеотидов).
Слабая сторона: плохо поддаются инженерии (очень трудно сделать искусственную мегануклеазу для распознавания какого-то другого сайта). Поэтому их применение в редактировании геномов сильно ограничено.
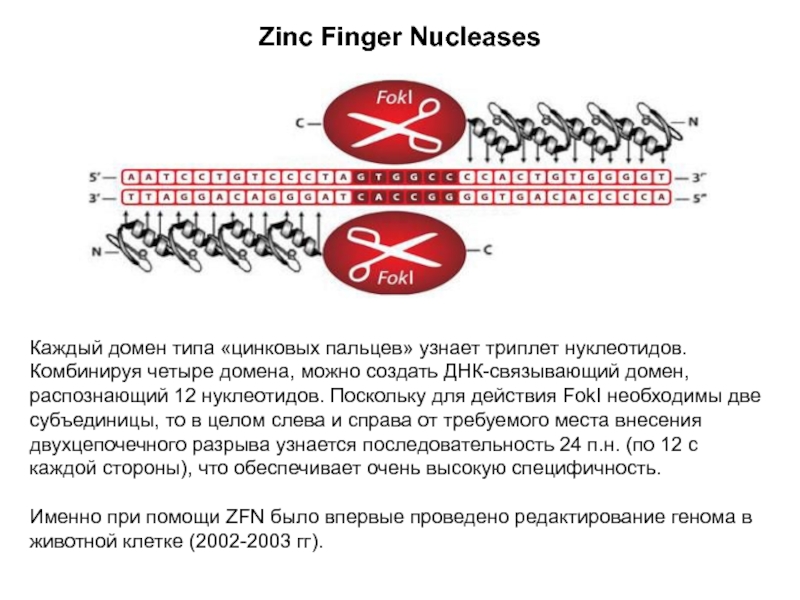
Слайд 10Zinc Finger Nucleases
(ZFN, нуклеазы типа «цинковые пальцы»)
В 1992
году было показано, что эндонуклеаза рестрикции FokI может быть легко
разделена на два отдельных домена: ДНК-связывающий и эндонуклеазный. Последний, как выяснилось, работает сиквенс-неспецифическим образом, то есть разрежет любой участок ДНК, с которым связался связывающий домен.
А в 1996 году были впервые опробованы на практике ZFN: химерные ферменты, состоящие из эндонуклеазного неспецифического домена FokI и ДНК-связывающих доменов типа «цинковые пальцы».
«Цинковый палец» длиной около 30 аминокислот взаимодействует с ионом цинка, формируя стабильную структуру, способную распознавать 3 п.н.
Для каждого нуклеотидного триплета существует свой «цинковый палец».
А значит, ZFN можно конструировать!
Слайд 11Zinc Finger Nucleases
Каждый домен типа «цинковых пальцев» узнает триплет нуклеотидов.
Комбинируя четыре домена, можно создать ДНК-связывающий домен, распознающий 12 нуклеотидов.
Поскольку для действия FokI необходимы две субъединицы, то в целом слева и справа от требуемого места внесения двухцепочечного разрыва узнается последовательность 24 п.н. (по 12 с каждой стороны), что обеспечивает очень высокую специфичность.
Именно при помощи ZFN было впервые проведено редактирование генома в животной клетке (2002-2003 гг).
Слайд 12Zinc Finger Nucleases
В ноябре 2017 года в США впервые в
мире отредактировали геном живого взрослого человека! И использовали они не
CRISPR/Cas9, а именно ZFN!!!
44-летний Брайан Мадо согласился на эксперимент, так как, по его словам, «страдал от боли каждый день». За свою жизнь ему пришлось перенести 26 операций, чтобы справиться с симптомами своей болезни, синдрома Хантера — грыжами, деформацией первых пальцев стоп, прорастанием кости в спинной мозг, проблемами с глазами, ушами и желчным пузырем.
Были использованы вирусные средства доставки конструкций в клетки печени.
В сентябре 2018 года были обнародованы промежуточные результаты: метод лечения работает!!! Правда, не совсем так, как ожидали ученые, но все же людям реальное становится легче!
Слайд 13Zinc Finger Nucleases
Недостатки:
Относительная дороговизна и сложность процесса конструирования.
Неидеальная специфичность. Некоторые
ZFN способны связываться с участками ДНК, несколько отличающимися от целевого.
Отдельные ZFN делают это достаточно часто, в результате чего приобретают цитотоксичность и становятся непригодными для редактирования геномов.
ZFN были реальной революцией в геномной инженерии (это понятие вообще родилось благодаря им), но достаточно быстро стало ясно, что нужны какие-то новые, более удачные методы.
И они, конечно же, были найдены!
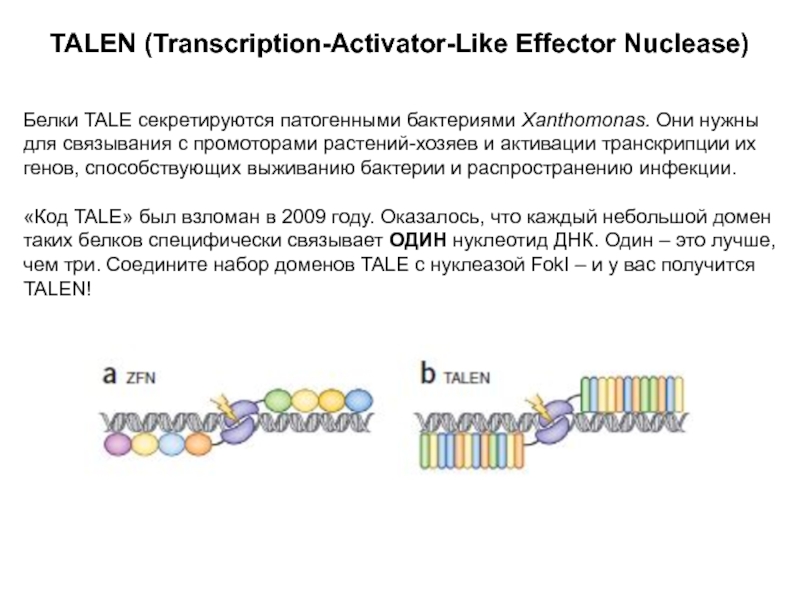
Слайд 14TALEN (Transcription-Activator-Like Effector Nuclease)
Белки TALE секретируются патогенными бактериями Xanthomonas. Они
нужны для связывания с промоторами растений-хозяев и активации транскрипции их
генов, способствующих выживанию бактерии и распространению инфекции.
«Код TALE» был взломан в 2009 году. Оказалось, что каждый небольшой домен таких белков специфически связывает ОДИН нуклеотид ДНК. Один – это лучше, чем три. Соедините набор доменов TALE с нуклеазой FokI – и у вас получится TALEN!
Слайд 15Можно сконструировать практически на любую последовательность в геноме
Более эффективны,
выше уровень трансгенеза
Уровень неспецифической активности значительно ниже
Процесс инжиниринга
TALEN занимает значительно меньше времени, менее трудоемкий и значительно дешевле
TALEN – первая технология редактирования генома, которая сработала для митохондриальной ДНК клеток человека!
Ее очень сложно редактировать, поскольку если в ядро любая ДНК после трансфекции полезет по определению, то в митохондрию ее еще поди засунь.
TALEN
Преимущества над ZFN:
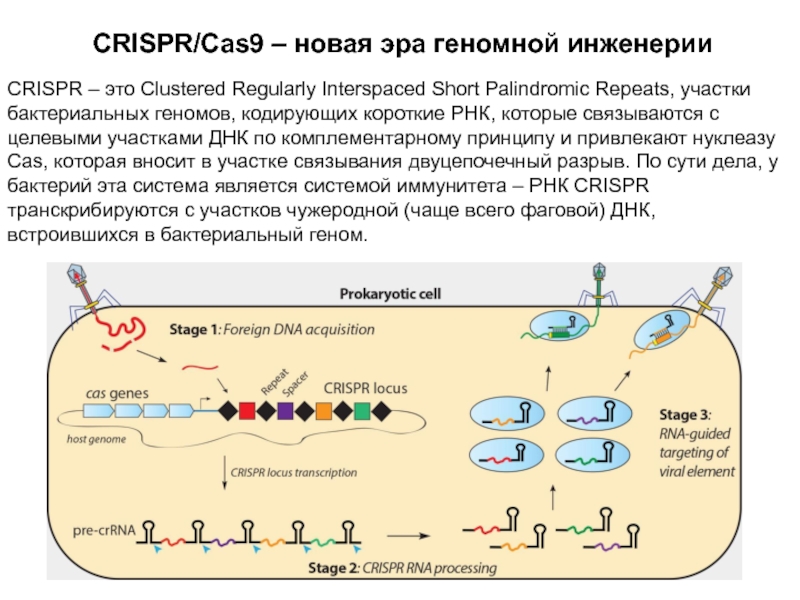
Слайд 16CRISPR/Cas9 – новая эра геномной инженерии
CRISPR – это Clustered Regularly
Interspaced Short Palindromic Repeats, участки бактериальных геномов, кодирующих короткие РНК,
которые связываются с целевыми участками ДНК по комплементарному принципу и привлекают нуклеазу Cas, которая вносит в участке связывания двуцепочечный разрыв. По сути дела, у бактерий эта система является системой иммунитета – РНК CRISPR транскрибируются с участков чужеродной (чаще всего фаговой) ДНК, встроившихся в бактериальный геном.
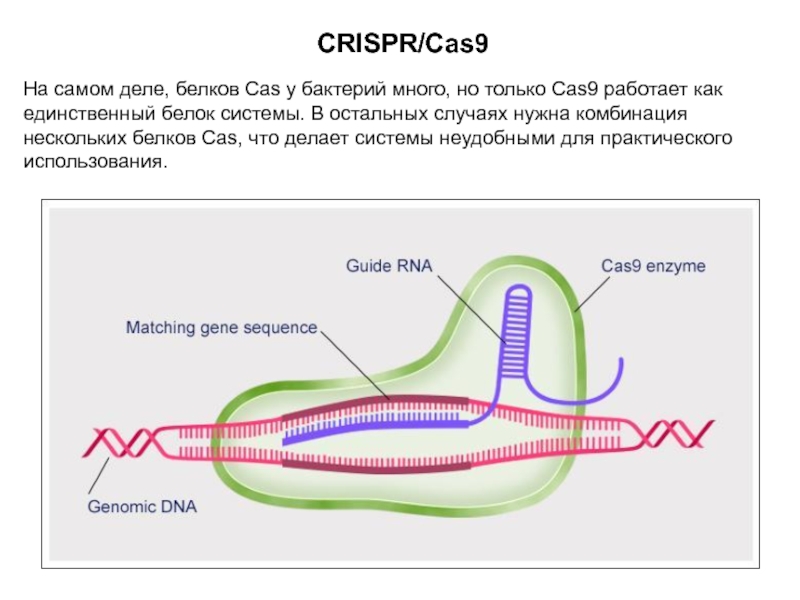
Слайд 17CRISPR/Cas9
На самом деле, белков Cas у бактерий много, но только
Cas9 работает как единственный белок системы. В остальных случаях нужна
комбинация нескольких белков Cas, что делает системы неудобными для практического использования.
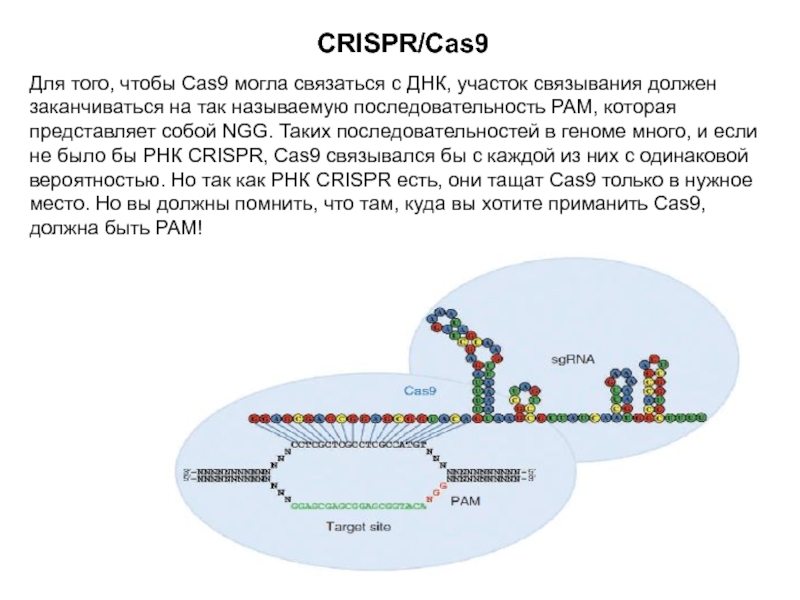
Слайд 18CRISPR/Cas9
Для того, чтобы Cas9 могла связаться с ДНК, участок связывания
должен заканчиваться на так называемую последовательность PAM, которая представляет собой
NGG. Таких последовательностей в геноме много, и если не было бы РНК CRISPR, Cas9 связывался бы с каждой из них с одинаковой вероятностью. Но так как РНК CRISPR есть, они тащат Cas9 только в нужное место. Но вы должны помнить, что там, куда вы хотите приманить Cas9, должна быть РАМ!
Слайд 19CRISPR/Cas9
Главное преимущество метода:
В качестве ДНК-узнающих элементов используются не белки, как
в ZFN и TALEN, а РНК! Это невероятно облегчает работу.
Конструирование белковых доменов – дело долгое и достаточно дорогое, а тут и конструировать ничего не надо – возьми сиквенс целевого участка ДНК, замени T на U, добавь сиквенс Cas9-связывающей шпильки – вот тебе и гидовая РНК!
При помощи этой системы уже очень много чего сделали:
исправление патогенных мутаций в клетках человека,
создание новых пород животных и сортов растений для сельского хозяйства,
направленное редактирование геномов микробных сообществ для биотехнологии,
редактирование генома эмбриона человека (эксперимент был прекращен на стадии 4 бластомеров по этическим соображениям),
свеженькие китайские близняшки с отредактированный геномом, невосприимчивые к ВИЧ (скорее всего, фейк).
Слайд 20CRISPR/Cas9
И все считают, что за этой системой будущее биоинженерии и
науки вообще.
И я тоже так считаю. Но наряду с этим,
имеется несколько очень серьезных проблем, которые в настоящее время не позволяют выводить CRISPR/Cas9 в медицину и затрудняют ее использование в с/х и биотехнологии.
Главный недостаток метода:
Эффект off-target, или неспецифичное действие системы.
Cas9 – мономер, а FokI – димер. Поэтому ZFN и TALEN специфичнее.
Связывание ДНК «цинковыми пальцами» и TALE гораздо более специфично, чем РНК CRISPR. Cas9 – по определению неспецифическая нуклеаза, которая должна расщепить в труху чужеродную ДНК в бактериальной клетке. Соответственно она ведет себя и в клетках высших эукариот. Неспецифические двуцепочечные разрывы залечиваются NHEJ с ошибками.
Все это приводит к тому, что система реально неспецифичная. По последним оценкам, в геноме мыши при использовании технологии CRISPR/Cas9 появляется более сотни точечных мутаций и десятки делеций или вставок! Понятно, что большинство из них ни на что не повлияют, но как такую систему внедрять в медицину?! Да никак просто-напросто.

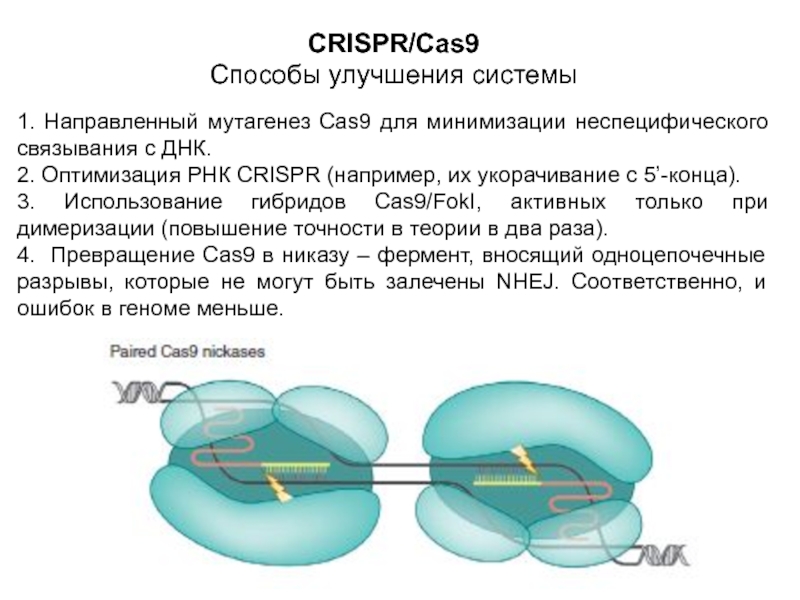
Слайд 21CRISPR/Cas9
Способы улучшения системы
1. Направленный мутагенез Cas9 для минимизации неспецифического связывания
с ДНК.
2. Оптимизация РНК CRISPR (например, их укорачивание с 5’-конца).
3.
Использование гибридов Cas9/FokI, активных только при димеризации (повышение точности в теории в два раза).
4. Превращение Cas9 в никазу – фермент, вносящий одноцепочечные разрывы, которые не могут быть залечены NHEJ. Соответственно, и ошибок в геноме меньше.
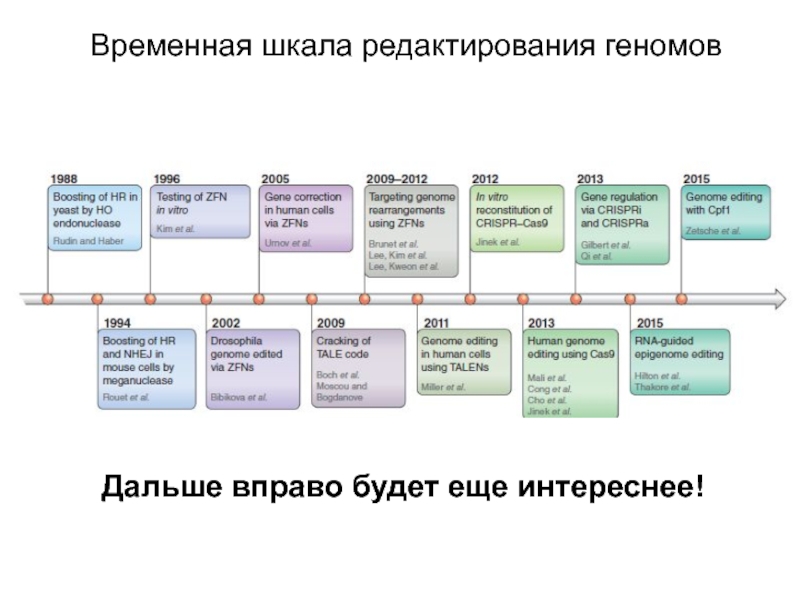
Слайд 22Временная шкала редактирования геномов
Дальше вправо будет еще интереснее!