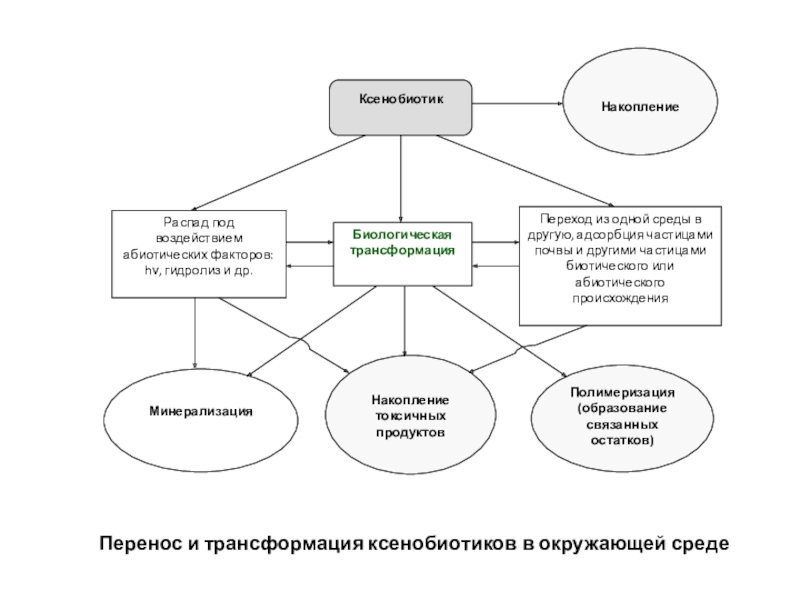
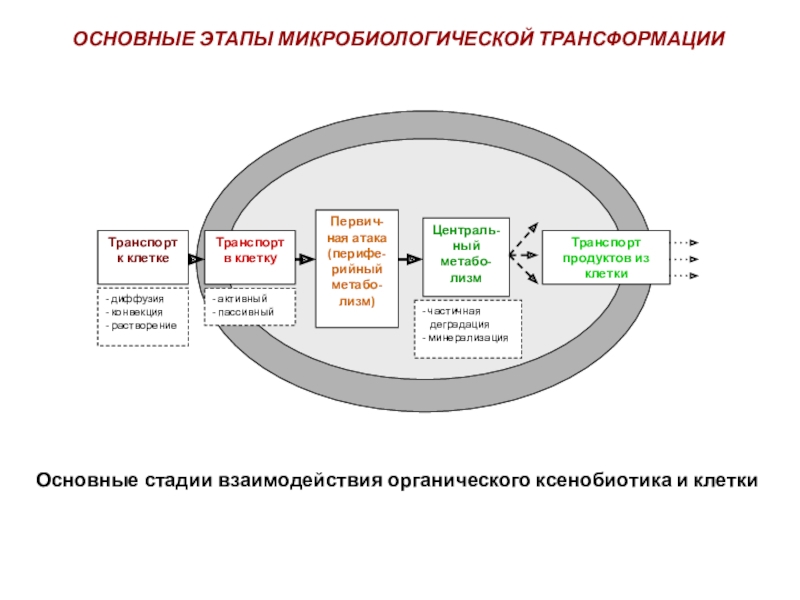
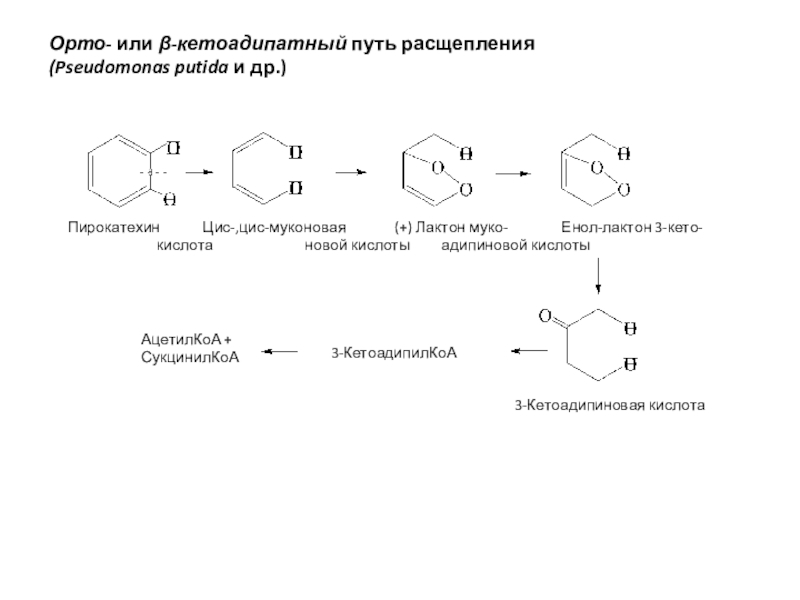
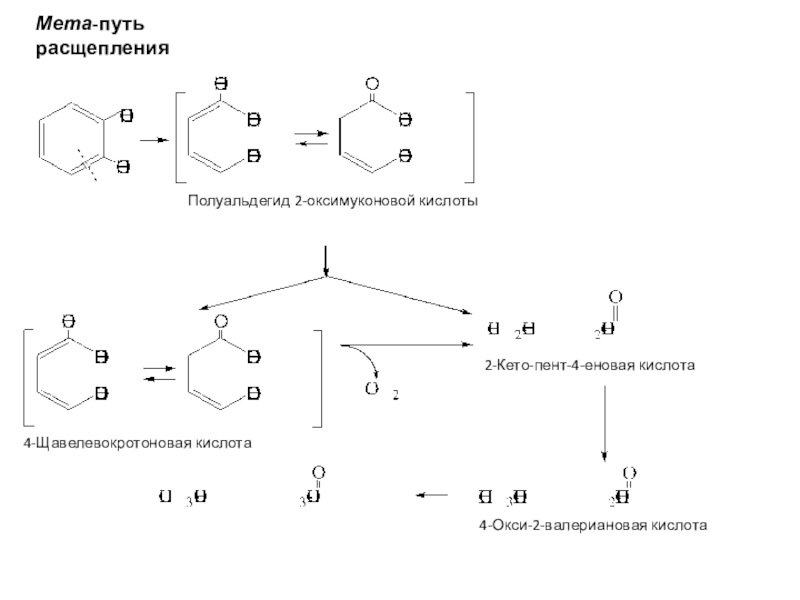
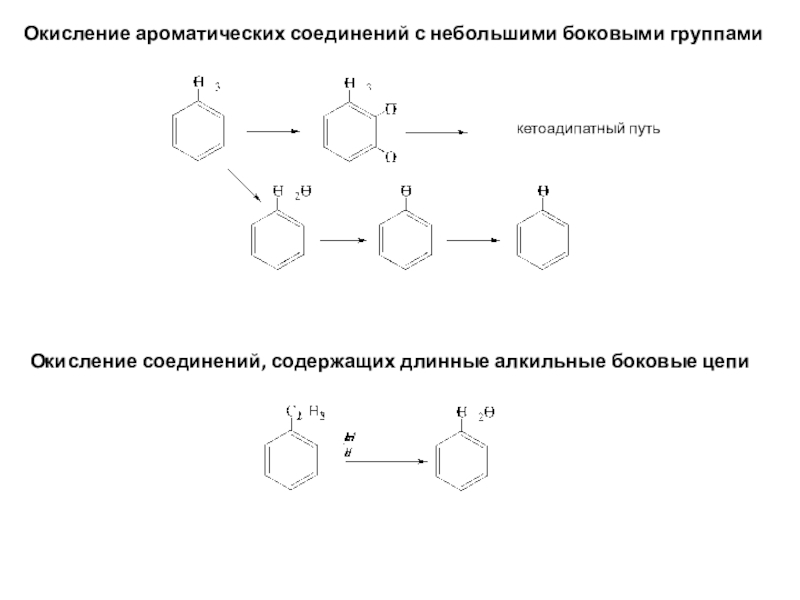
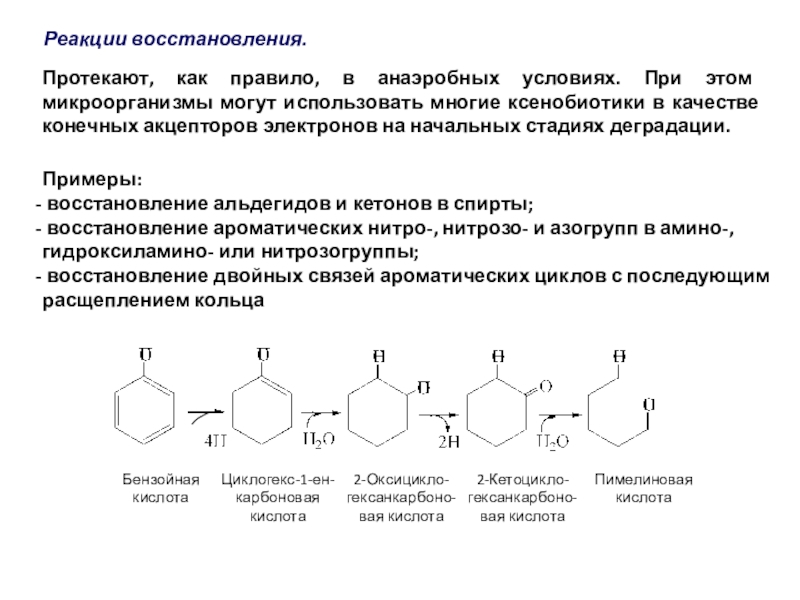
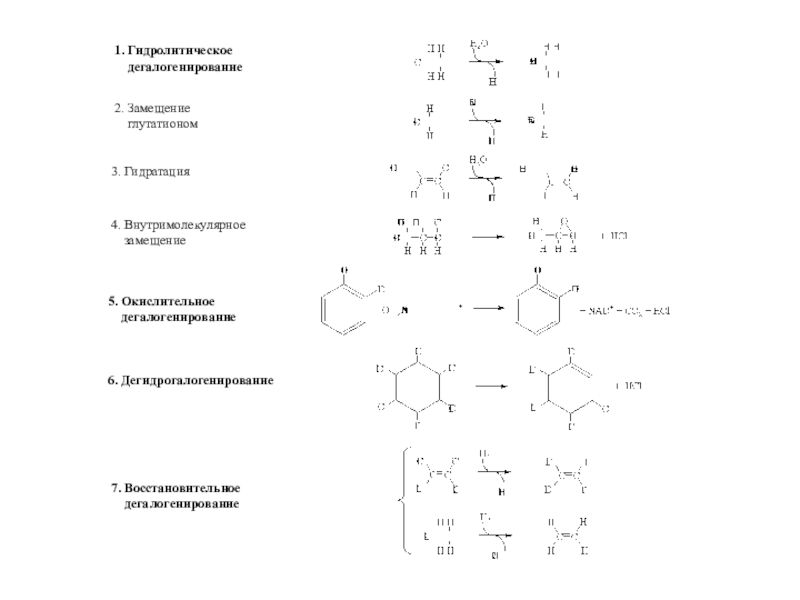
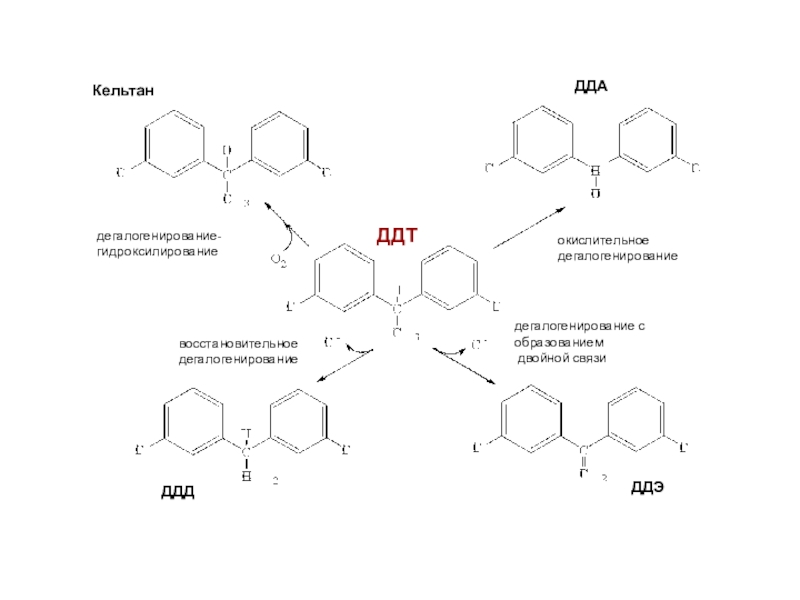
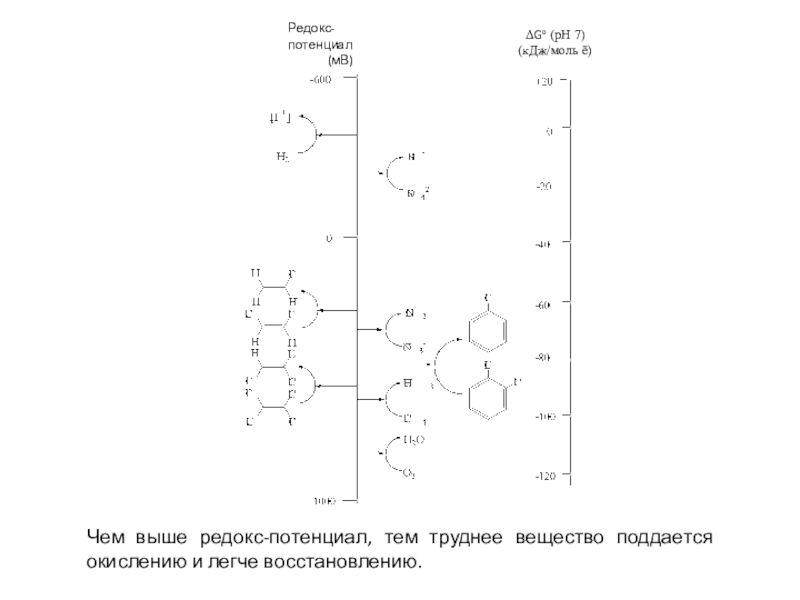
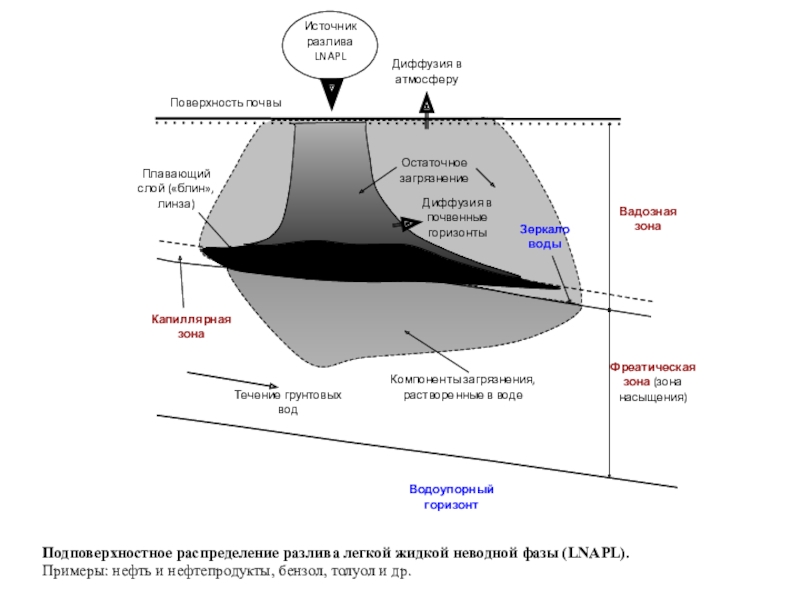
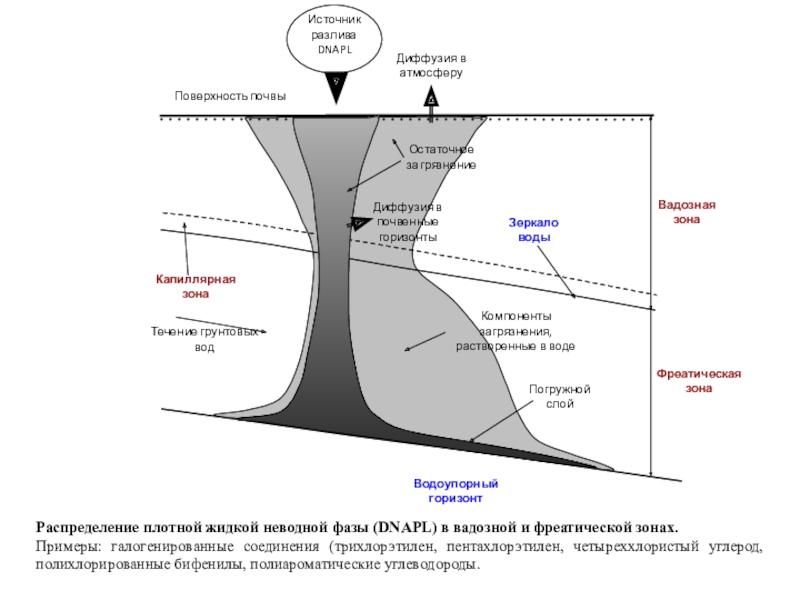
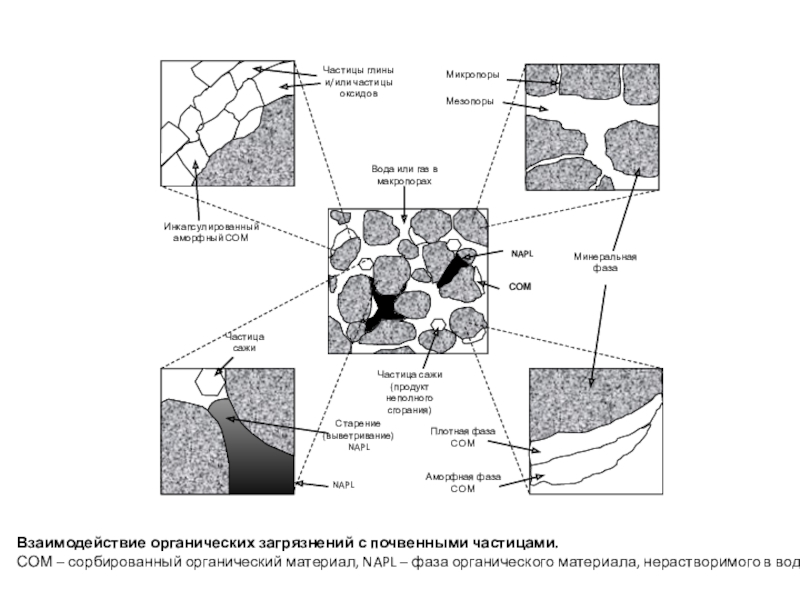
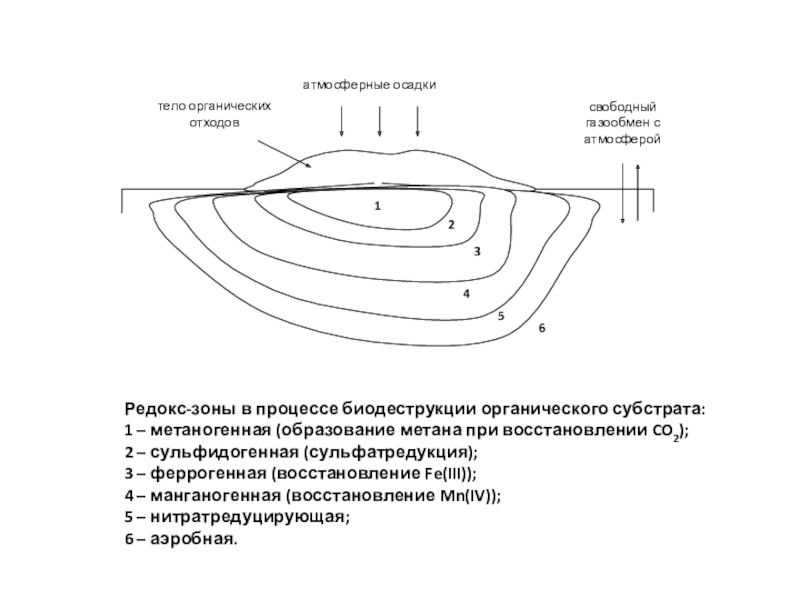
полная деструкция);
Неполная деградация (трансформация, частичная минерализация, частичная деструкция);
Связывание поллютантов или
их метаболитов с другим веществом-матрицей (полимеризация, конъюгация, конденсация).В природных условиях полное разрушение стойких органических ксенобиотиков происходит, как правило, в результате совместного действия сообщества организмов и абиотических факторов.