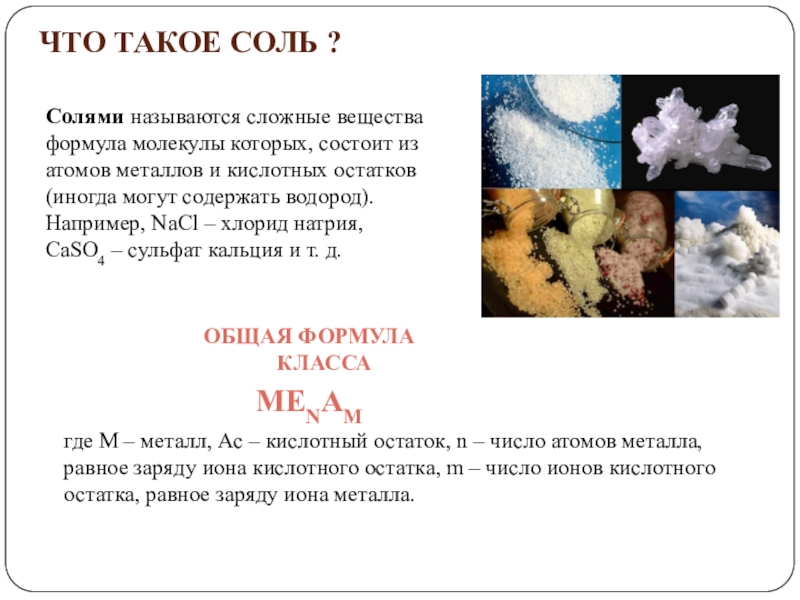
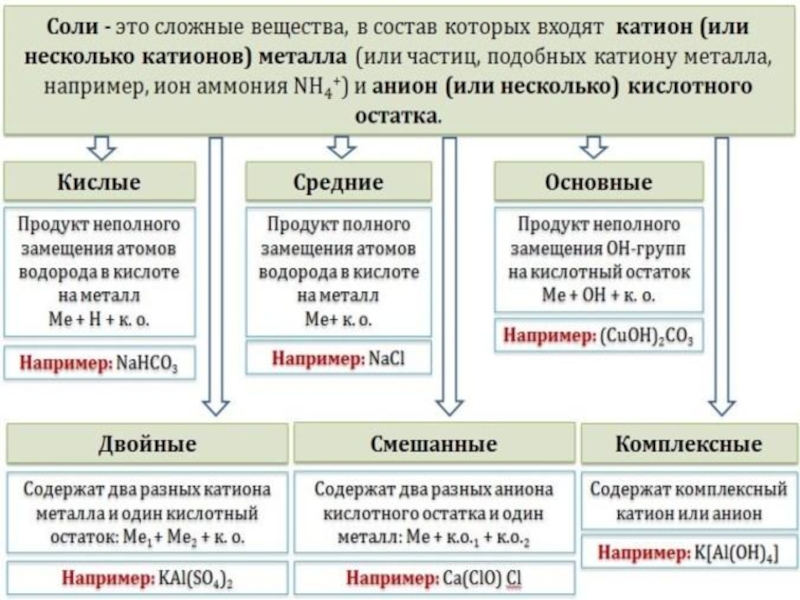
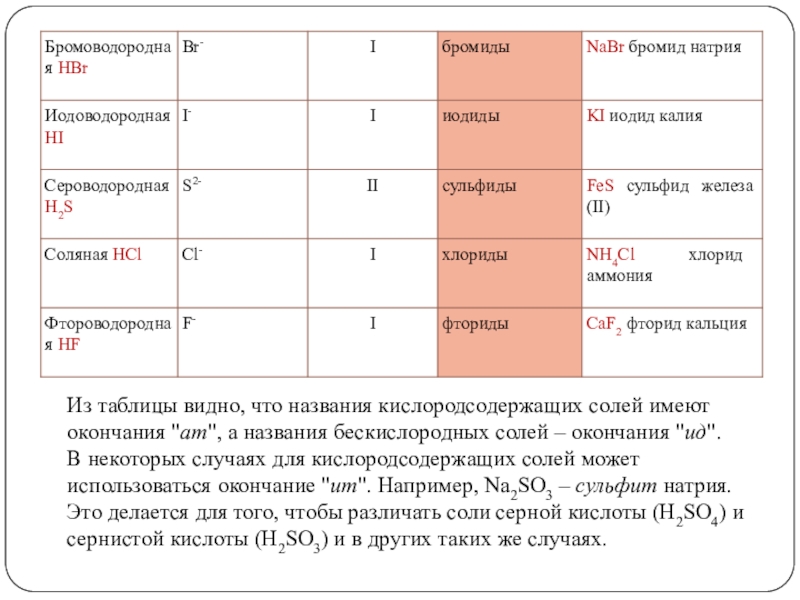
«Химия»
Тема: Соли. Классификация солей. Способы получения. Физические и химические свойства.
Применение солей в народном хозяйстве.Выполнил: Студент Группы 127
Стоматологического факультета
Гладышева И.Е,
Проверил: Киселева О.Н
Самара, 2019г.