Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что общего у достопримечательностей?
Содержание
- 1. Что общего у достопримечательностей?
- 2. Царь-пушка1586 годАвтор Андрей Чохов.Масса ствола – 40
- 3. Царь-колокол1733 – 1735 гАвторы Иван и Михаил
- 4. «Медный всадник» (Памятник Петру I
- 5. каменный → медный → бронзовый → железный
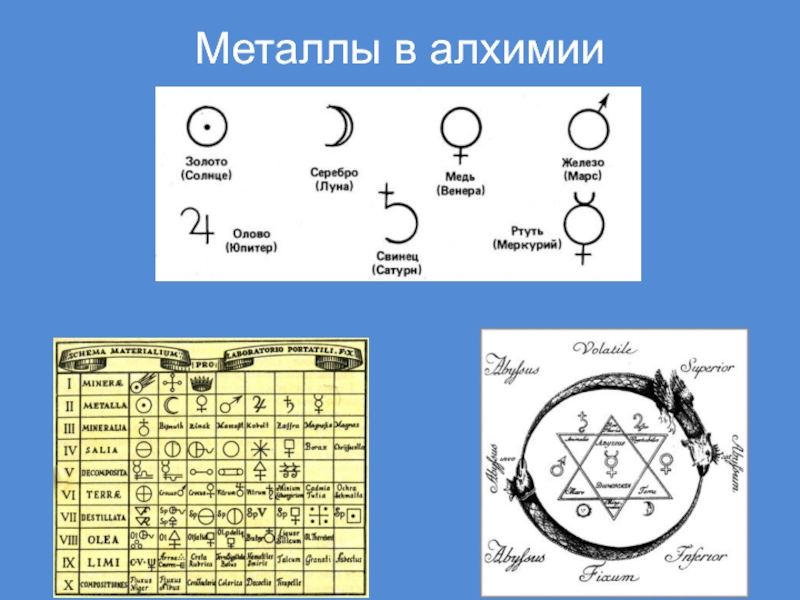
- 6. Металлы в алхимии
- 7. Представления о металлахСуществует гипотеза, что термин «металлы»
- 8. Ни едино художество, ни едино ремесло
- 9. Металлы
- 10. ОпределенияХимический элемент – это определённый вид атомов.Простое
- 11. Строение атомовПоложение в периодической системе
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
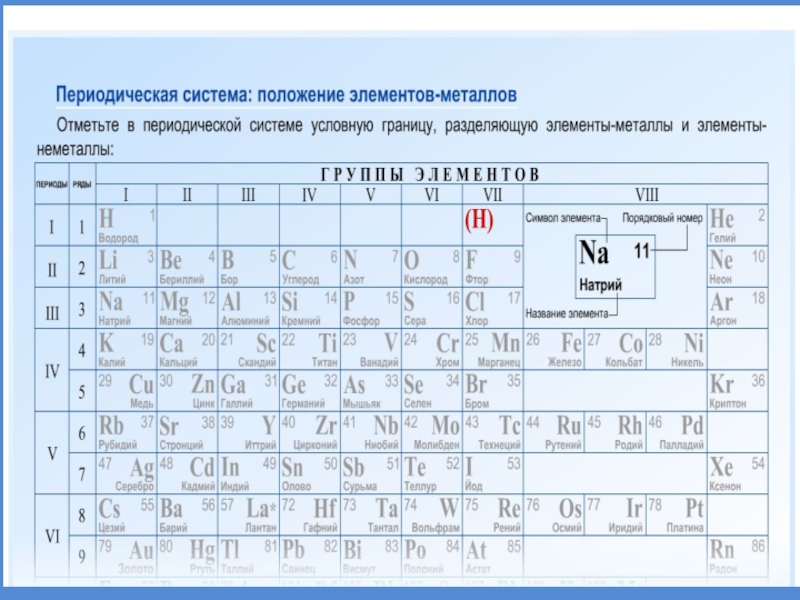
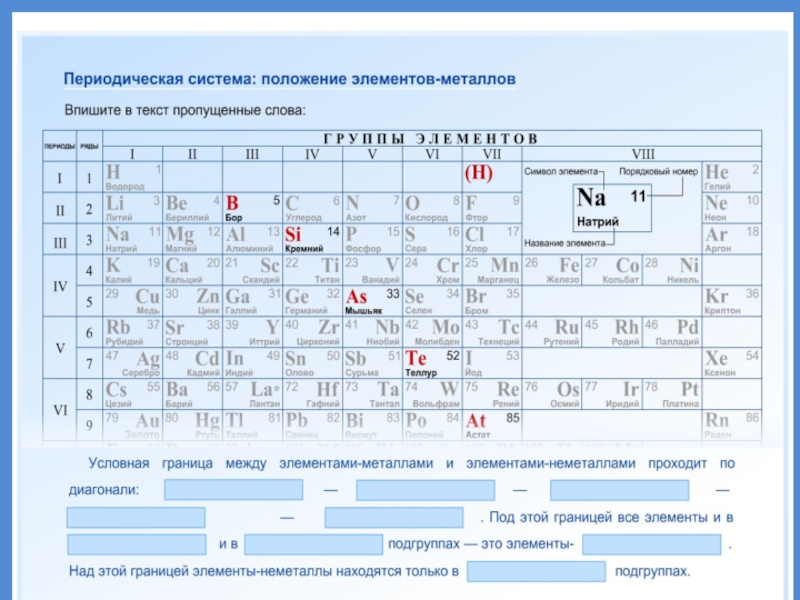
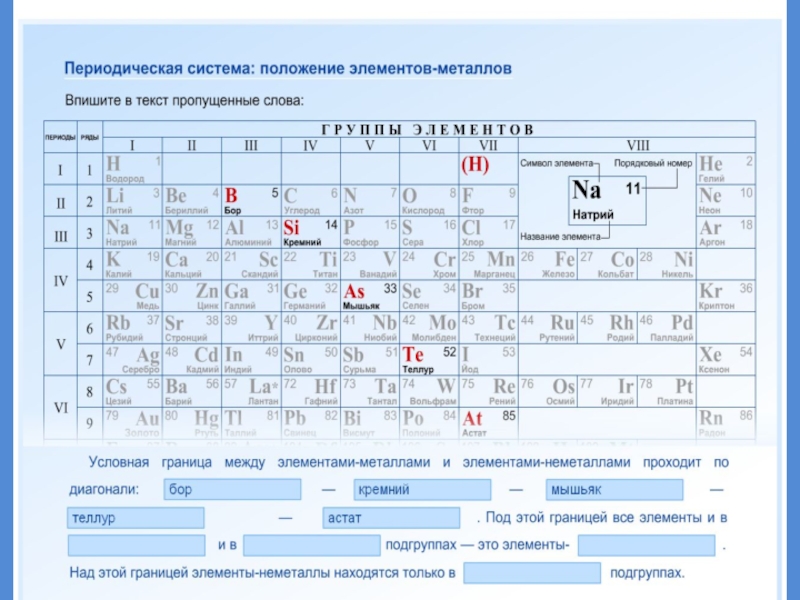
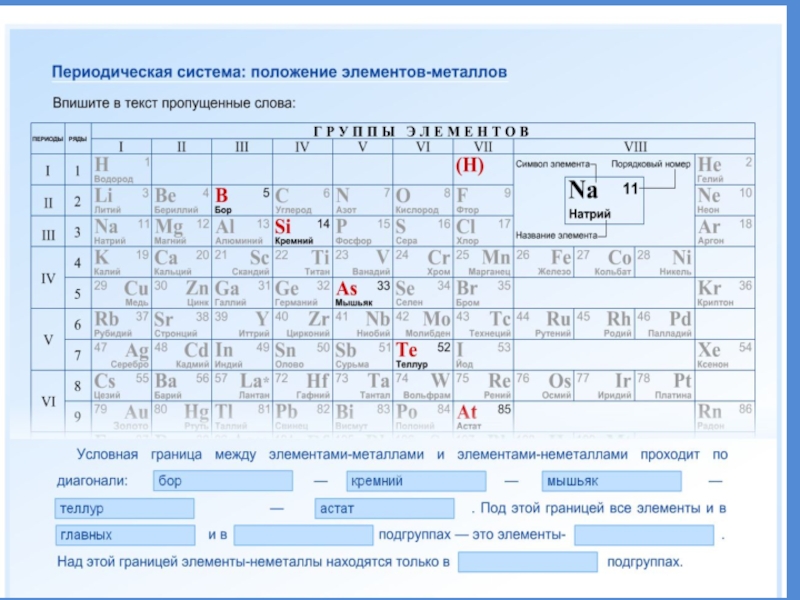
- 19. Положение металлов в ПСХЭ
- 20. Положение металлов в ПСХЭГруппы металловЩелочные металлы. Свое
- 21. Положение элемента в ПС отражает строение его атомов
- 22. 92 элемента из 114 известных - МЕТАЛЛЫМЕТАЛЛЫ
- 23. Строение атомов металлов Особенности строения атомов металлов:На внешнем
- 24. ЭЛЕКТРОННОЕ СТРОЕНИЕ МЕТАЛЛОВs – элементы :
- 25. ЗАДАНИЕ:Напишите электронные формулы лития калия хрома Li 1s²2s¹K 1s²2s²2p⁶3s²3p⁶4s¹Cr 1s²2s²p⁶3s²p⁶3d⁵4s¹
- 26. ИЗМЕНЕНИЕ СВОЙСТВВ главной подгруппе:
- 27. 1) В ряду химических элементов Li
- 28. 3) Наиболее ярко выражены металлические свойства у
- 29. 5. Наименьший радиус имеет атом элементакальция
- 30. Строение кристаллов металлов? Какой вид химической связи характерен
- 31. Металлическая химическая связьХимическая связь между атомами металла,
- 32. Металлическая решетка Металлическими называют решётки, в узлах
- 33. Слайд 33
- 34. Типы кристаллических решетокМеталлы имеют три типа кристаллических
- 35. Физические свойства металловМеталлическая кристаллическая решетка и металлическая
- 36. Слайд 36
- 37. Металлический блескГладкая поверхность металла или металлического изделия
- 38. Пластичность и ковкость Пластичность –
- 39. Электропроводность и теплопроводность Обусловлены наличием
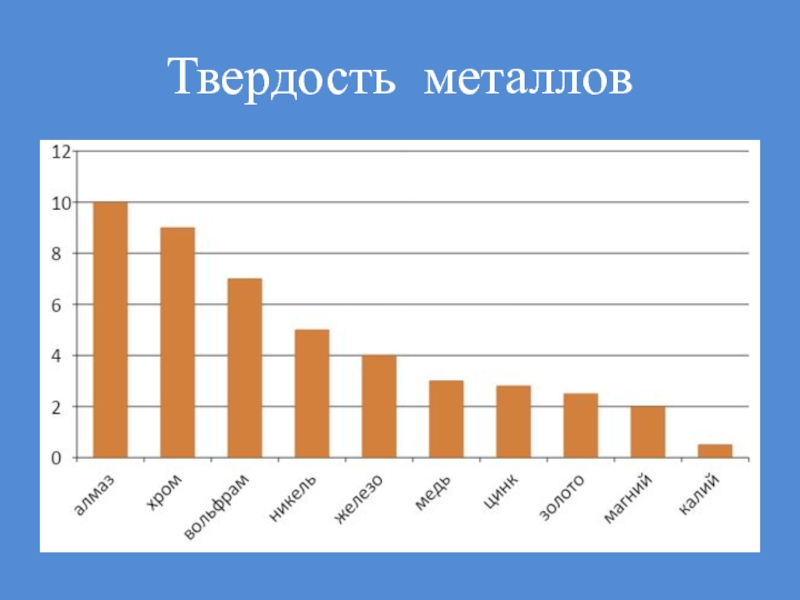
- 40. Твердость металлов
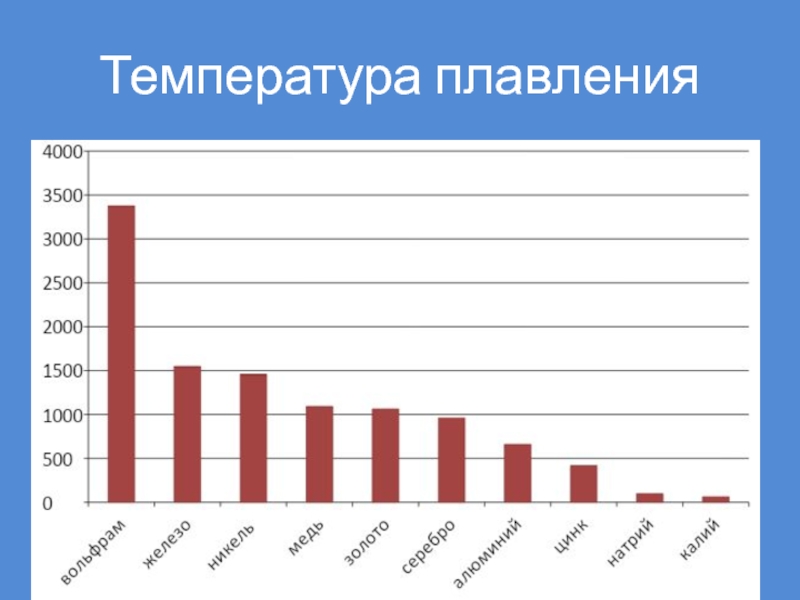
- 41. Температура плавления
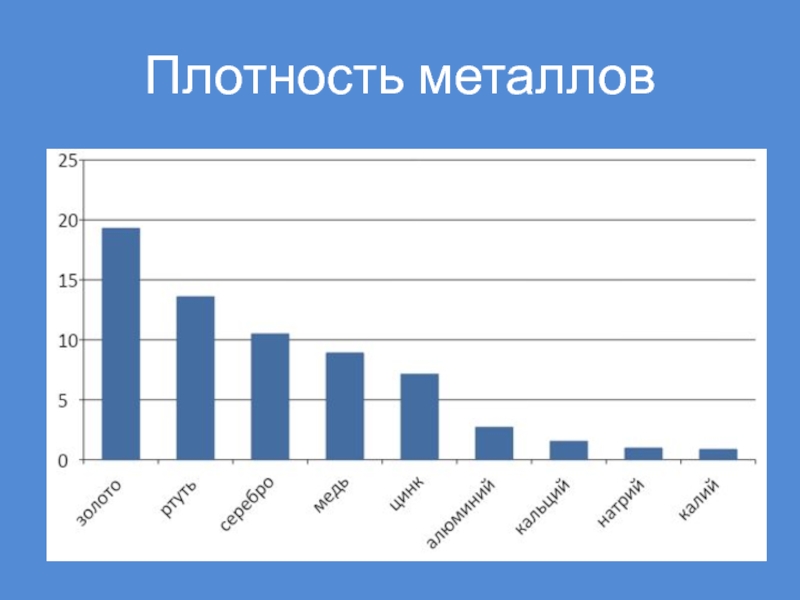
- 42. Плотность металлов
- 43. Na, K, Li - 1 валентный электрон
- 44. Металлы – это группа веществ с общими свойствами.
- 45. Вывод: 1. Металлы– элементы, имеющие на
- 46. Распространение металлов в земной кореВ свободном
- 47. Домашнее задание§4- прочитать §5, ?2 стр. 29§6Записи в тетрадиЗаполнить таблицу «Физические свойства металлов»
- 48. Контрольное тестирование 1(А). Металлические свойства наиболее сильно
- 49. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Царь-пушка
1586 год
Автор Андрей Чохов.
Масса ствола – 40 т, масса с
лафетом – 80 т.
ствола украшена барельефами, в том числе изображением царя Федора Ивановича, в правление которого была изготовлена.Слайд 3Царь-колокол
1733 – 1735 г
Авторы Иван и Михаил Моторины.
Вес 200 т.
Высота 6,14 м. Диаметр 6,6 м.
Сильно пострадал во время тушения
пожара в Московском Кремле в 1737 году, вес отколовшейся части – 11,5 т.Водружен на постамент в 1836 году.
Слайд 4
«Медный всадник»
(Памятник Петру I в Санкт-Петербурге)
1765 – 1782 гг.
Автор Этьен Морис Фальконе
Масса скалы 275 т, масса статуи 50
т, высота 5,3 мСлайд 5каменный → медный → бронзовый → железный
век
век век векIV – III тыс. до н.э. конец IV – нач. I тыс. до н.э. I тыс. до н.э.
В медном веке медные орудия труда не вытеснили каменные. Медь обрабатывалась с помощью каменных орудий труда методом холодной ковки. Самородки меди таким образом превращались в изделия.
Позже появилось литье, а потом человек стал добавлять к меди олово или сурьму, делать бронзу, более долговечную, прочную, легкоплавкую.
«Железный век» – тот век, в котором мы и сейчас живем. Ведь в настоящее время железные сплавы составляют почти 90% всего количества металлов и металлических сплавов.
Слайд 7Представления о металлах
Существует гипотеза, что термин «металлы» произошел от греч.
«металлон», которое в первоначальном переводе означало «копи», «рудники»
Более 200 лет
назад М.В.Ломоносов в труде «Первые основы металлургии» дал металлам такое определение: «Металлы суть ковкие блестящие тела»Слайд 8Ни едино художество, ни едино ремесло простое употребления металлов миновать
не может.
М.В. Ломоносов
Тема урока: Положение металлов в Периодической системе Д.И.
Менделеева, строение их атомов. Физические свойства металлов.Слайд 10Определения
Химический элемент –
это определённый вид атомов.
Простое вещество – это
вещество,
образованное атомами одного химического элемента
Вопрос: Укажите, где о железе
говорится как о химическом элементе, а где – как о простом веществе:Железо входит в состав гемоглобина крови.
Железо легко окисляется на воздухе, покрывается ржавчиной
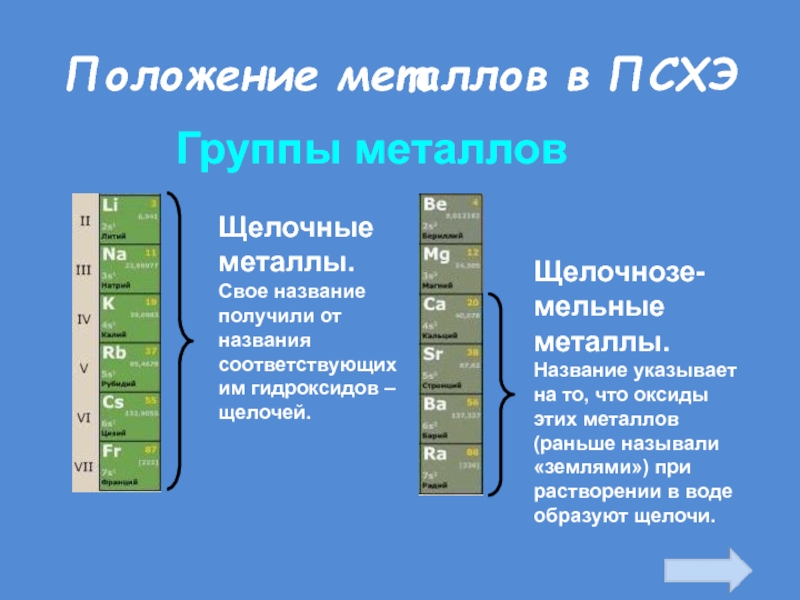
Слайд 20Положение металлов в ПСХЭ
Группы металлов
Щелочные металлы.
Свое название получили от названия
соответствующих им гидроксидов – щелочей.
Щелочнозе-мельные металлы.
Название указывает на то, что
оксиды этих металлов (раньше называли «землями») при растворении в воде образуют щелочи.Слайд 2292 элемента из 114 известных - МЕТАЛЛЫ
МЕТАЛЛЫ - это химические
элементы, атомы которых отдают электроны внешнего (предвнешнего)
электронного уровня, превращаясь
в положительные ионы.Na⁰ - 1e → Na⁺ Mg⁰ - 2e → Mg⁺²
ПРИЧИНА: положение металлов в ПСХЭ
Слайд 23Строение атомов металлов
Особенности строения атомов металлов:
На внешнем энергетическом уровне 1
– 3 электрона.
Относительно большой радиус атомов.
Металлы могут проявлять только восстановительные
свойства.Слайд 24ЭЛЕКТРОННОЕ СТРОЕНИЕ МЕТАЛЛОВ
s – элементы :
Na 1s²2s²2p⁶3s¹
Mg 1s²2s²2p⁶3s² 2. p – элементы: Al 1s²2s²2p⁶3s²3p¹
3. d - элементы: Fe 1s²2s²2p⁶3s²3p⁶4s²3d⁶
4. f - элементы: La ……. 5d¹6s²
Слайд 25ЗАДАНИЕ:
Напишите электронные формулы
лития
калия
хрома
Li 1s²2s¹
K
1s²2s²2p⁶3s²3p⁶4s¹
Cr 1s²2s²p⁶3s²p⁶3d⁵4s¹
Слайд 26ИЗМЕНЕНИЕ СВОЙСТВ
В главной подгруппе:
В периоде:
число электронов на внешнем
- заряды ядер атомовслое не изменяется увеличиваются
- радиус атома увеличивается - число электронов на
внешнем слое
увеличивается
- ЭО уменьшается - ЭО увеличивается
восстановительные свойства - восстановительные
усиливаются свойства уменьшаются
металлические свойства - металлические
усиливаются ослабевают
( с увеличением порядкового номера элемента)
Слайд 271) В ряду химических элементов Li – Na –
K – Rb
металлические свойства: а) усиливаются; б)
ослабевают; в) не изменяются; г) изменяются периодически2) Усиление металлических свойств элементов в
А-группах периодической системы с увеличением
порядкового номера обусловлено:
а) увеличением атомной массы элементов
б) увеличением общего числа электронов в) увеличением атомного радиуса элемента
г) увеличением номера периода
ОТВЕТ: а
ОТВЕТ: в
Слайд 283) Наиболее ярко выражены металлические свойства у вещества с электронной
формулой:
а) 2,1 б) 2,8,1
в) 2,8,8,1 г) 2,8,24) Наиболее активный металл:
а) 1s²2s²2p⁶3s¹ б) 1s²2s¹
в) 1s²2s²2p⁶3s²3p¹ г) 1s²2s²2p⁶3s²3p⁶4s¹
ОТВЕТ: в
ОТВЕТ: г
Слайд 295. Наименьший радиус имеет атом элемента
кальция
2) стронция
3) бария 4) радия
6. Символ и формула высшего оксида элемента, электронная формула внешнего и предвнешнего энергетических уровней атома которого …..3s23p63d54s1:
1) Cr и CrO3 2) K и K2O
3) Mn и Mn2O7 4) Se и SeO3
7. Металл М образует высший оксид состава М2О3. Электронная формула валентного энергетического уровня атома М
ns2np1 2) ns2np2
3) ns2np3 4) ns2np5
ОТВЕТ: 5 - 1 6 - 2 7 - 1
Слайд 30Строение кристаллов металлов
?
Какой вид химической связи характерен для металлов?
?
Какой вид
кристаллической решетки в металлах?
Металлическая химическая связь (мет.х.св.)
Металлическая кристаллическая решетка (мет.кр.реш.)
Слайд 31Металлическая химическая связь
Химическая связь между атомами металла, осуществляемая посредством общих
свободно перемещающихся электронов называется металлической связью.
Эта связь характерна для
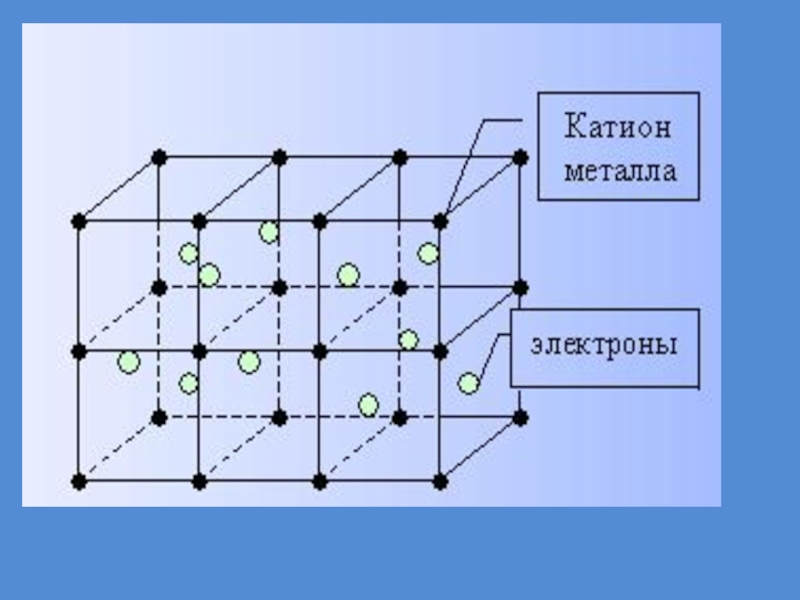
типичных металлов, для их сплавов и их интерметаллических соединений, образованных атомами разные металлов. Слайд 32Металлическая решетка
Металлическими называют решётки, в узлах которых находятся атомы
и ионы металла, между ними - свободные электроны.
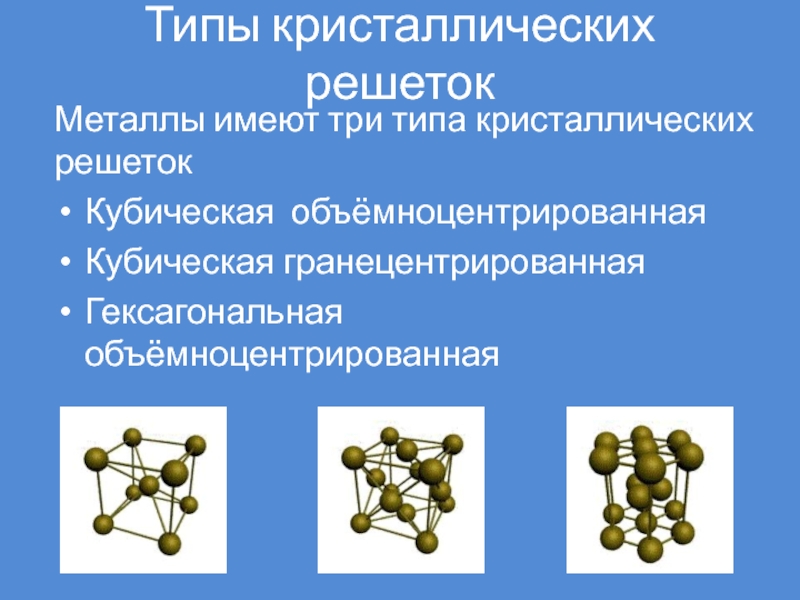
Слайд 34Типы кристаллических решеток
Металлы имеют три типа кристаллических решеток
Кубическая объёмноцентрированная
Кубическая
гранецентрированная
Гексагональная объёмноцентрированная
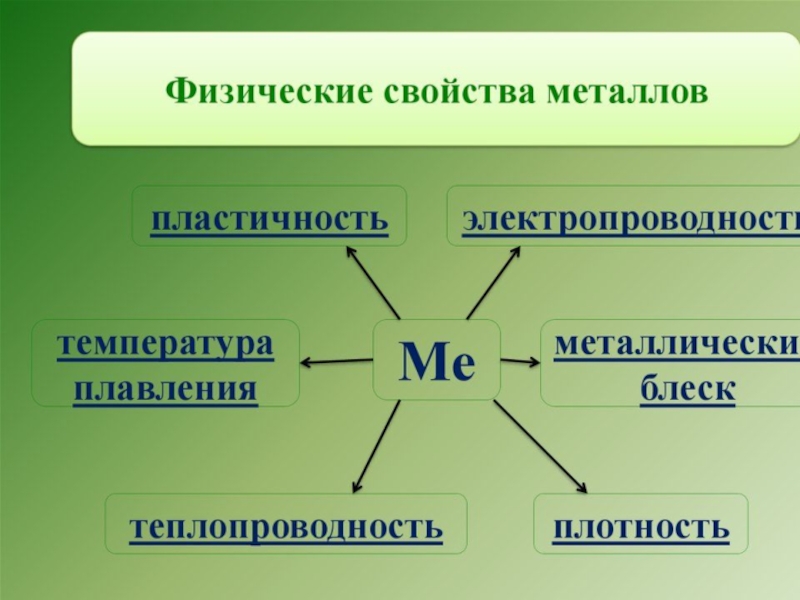
Слайд 35Физические свойства металлов
Металлическая кристаллическая решетка и металлическая химическая связь определяют
все наиболее характерные физические свойства металлов:
Металлический блеск
Ковкость и пластичность
Электропроводность и
теплопроводность Слайд 37Металлический блеск
Гладкая поверхность металла или металлического изделия имеет металлический блеск,
который является результатом отражения световых лучей.
Высокой отражательной способностью обладает ртуть
- раньше её использовали для изготовления венецианских зеркал (почему теперь их производство прекратили?), серебро, палладий и алюминий.Слайд 38
Пластичность и ковкость
Пластичность – это способность металлов деформироваться под
действием механической нагрузки.
Под внешним воздействием одни слои ионов в кристаллах
легко смещаются, как бы скользят друг относительно друга без разрыва связи между ними. Наиболее пластичны золото, серебро, медь.
Слайд 39
Электропроводность и теплопроводность
Обусловлены наличием в металлах подвижных электронов, которые
под действием электрического поля приобретают направленное движение.
Лучшие проводники электрического тока
серебро, медь, алюминий.Слайд 43Na, K, Li - 1 валентный электрон - мягкие, легкие,
легкоплавкие.
W
- 5 валентных электронов - твердый, тугоплавкий,тяжелый.
Слайд 45Вывод: 1. Металлы– элементы, имеющие на внешнем энергетическом уровне 1-3
электрона, реже 4-6. 2. Металлы – это химические элементы атомы которых
отдают электроны внешнего (а иногда предвнешнего) электронного слоя превращаясь в положительные ионы. 3. Металлы – восстановители. Это обусловлено небольшим числом электронов внешнего слоя, большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.Слайд 46Распространение металлов
в земной коре
В свободном (самородном) состоянии встречаются только
малоактивные металлы (медь, серебро, золото, платина и некоторые другие)
Остальные металлы
встречаются в природе в виде соединений - оксидов или солей: сульфидов, сульфатов, карбонатов, хлоридов, фосфатов, нитратов.Слайд 47Домашнее задание
§4- прочитать
§5, ?2 стр. 29
§6
Записи в тетради
Заполнить таблицу
«Физические свойства металлов»
Слайд 48Контрольное тестирование
1(А). Металлические свойства наиболее сильно выражены у
1) бария 2) кальция
3) стронция 4) магния2(А). Электронную формулу 1s22s22p63s23p64s2 имеет атом элемента
1) Na 2) Ca 3) Cu 4) Zn
3(А). В каком ряду элементы расположены в порядке ослабления восстановительных свойств?
1) Mg – Ca – Sr – Ba 3) Si – AI – Mg – Na
2) Fr – Cs – Rb – K 4) O – S – Se – Te
4*(В). В ряду Be – Mg – Ca химические элементы расположены в порядке
1) усиления металлических свойств
2) уменьшения числа электронных слоев в атоме
3) уменьшения заряда ядер атомов
4) увеличения числа электронов во внешнем электронном слое атомов
5) увеличения радиусов атомов