Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Делокал изованная связь. Метод молекулярных орбиталей
Содержание
- 1. Делокал изованная связь. Метод молекулярных орбиталей
- 2. Многоцентровые связиМетод ВС: общая электронная пара принадлежит
- 3. Как изображать многоцентровые связи структурными формулами?Должно быть:
- 4. Химический смысл резонансных структурДля изображения делокализованных
- 5. Как составлять резонансные структуры?Во всех структурах
- 6. Зачем все это нужно?Чем более делокализован заряд
- 7. Метод молекулярных орбиталей (МО)Молекула – единое целое,
- 8. Приближение МО ЛКАОЛКАО = линейная комбинация атомных
- 9. Различные виды МОРазрыхляющая МОНесвязывающие МОСвязывающие МОАО кислородаАО водородаМолекулярно-орбитальная диаграмма воды
- 10. МО молекул водорода и гелияH2He2Кратность связи:Кратность связи:МОМОАОАОАОАОН2 устойчиваНе2 неустойчива
- 11. Проблема молекулы кислородаОписание по методу ВС::ö=ö:Двойная связь,
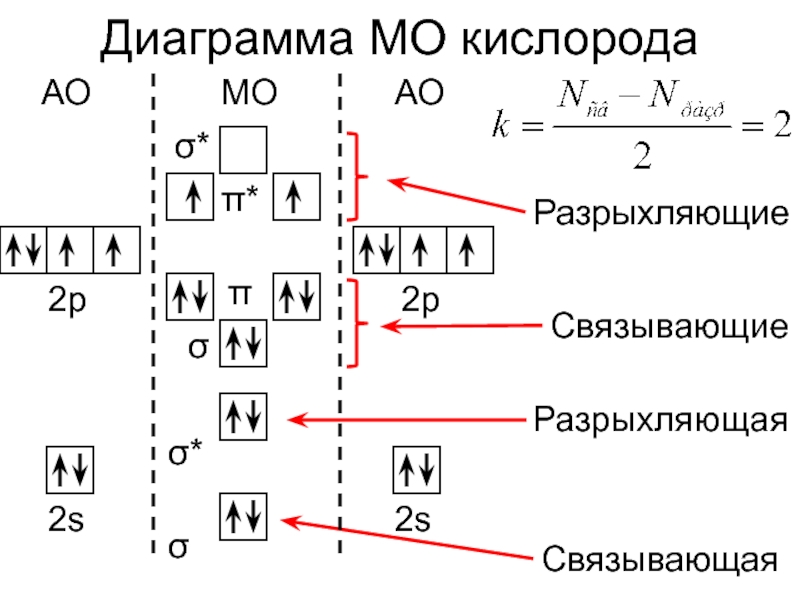
- 12. Диаграмма МО кислородаСвязывающаяСвязывающиеРазрыхляющаяРазрыхляющиеАОАОМО2s2s2p2pσσ*σσ*π*π
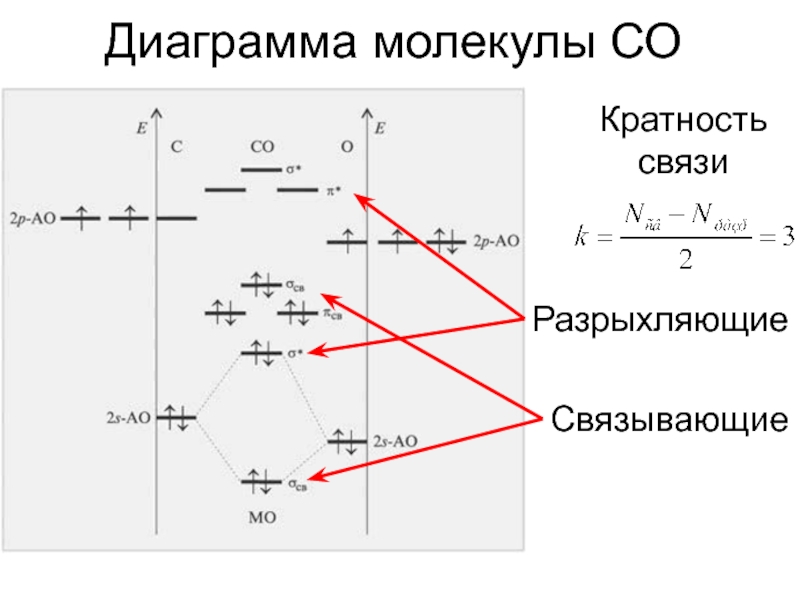
- 13. Диаграмма молекулы СОКратность связиСвязывающиеРазрыхляющие
- 14. Скачать презентанцию
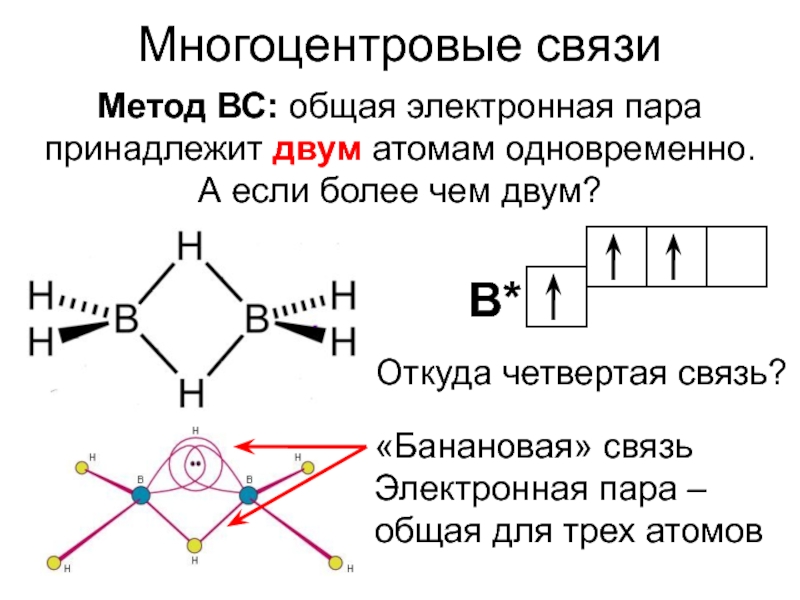
Многоцентровые связиМетод ВС: общая электронная пара принадлежит двум атомам одновременно. А если более чем двум?В*Откуда четвертая связь?«Банановая» связьЭлектронная пара – общая для трех атомов
Слайды и текст этой презентации
Слайд 2Многоцентровые связи
Метод ВС: общая электронная пара принадлежит двум атомам одновременно.
общая для трех атомов
Слайд 3Как изображать многоцентровые связи структурными формулами?
Должно быть:
N–O: 140-145 пм
N=O:
110-115 пм
Реально:
обе связи по 120 пм!
Что означает такая стрелка?
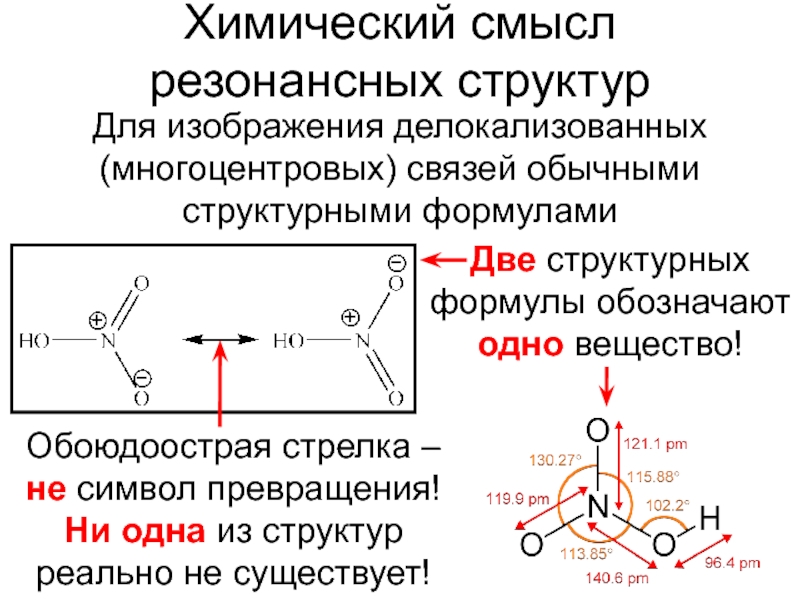
Слайд 4Химический смысл
резонансных структур
Для изображения делокализованных (многоцентровых) связей обычными структурными
формулами
Обоюдоострая стрелка –
не символ превращения!
Ни одна из структур реально
не существует!Две структурных формулы обозначают одно вещество!
Слайд 5Как составлять
резонансные структуры?
Во всех структурах расположение атомов
одно и
то же!
Для превращения одной структуры в другую:
Выбираем кратную связь и
соседний с ней атом с зарядом (или неспаренным электроном): X=Y–Z–Заряд – в сторону кратной связи через 1 атом, а связь – на 1 положение «навстречу» заряду: X=Y–Z– –X–Y=Z
Повторяем операцию, пока не переберем все возможные структуры
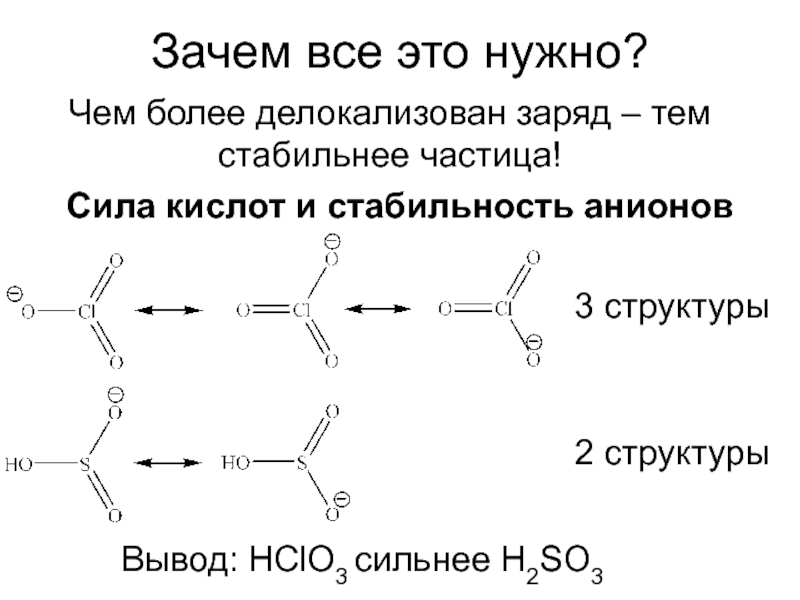
Слайд 6Зачем все это нужно?
Чем более делокализован заряд – тем стабильнее
частица!
Сила кислот и стабильность анионов
3 структуры
2 структуры
Вывод: HClO3 сильнее H2SO3
Слайд 7Метод молекулярных орбиталей (МО)
Молекула – единое целое, отдельных атомов в
ней нет
В молекуле есть разрешенные состояния для электронов – молекулярные
орбитали (МО), принадлежащие всей молекуле (многоцентровые).Заполнение МО – по тем же правилам, что и АО (принцип Паули, правило Хунда, принцип наименьшей энергии)
Слайд 8Приближение МО ЛКАО
ЛКАО = линейная комбинация атомных орбиталей
Любую МО можно
представить как ЛКАО: МО = С1АО1 + С2АО2 + …
+ СnАОn (С1, C2, … Cn – коэффициенты)Комбинировать можно АО, близкие по энергии.
МО, полученные при ЛКАО, делятся на:
связывающие (ЕМО < ЕАО)
несвязывающие (ЕМО ≈ ЕАО)
разрыхляющие (ЕМО > ЕАО)
Слайд 9Различные виды МО
Разрыхляющая МО
Несвязывающие МО
Связывающие МО
АО кислорода
АО
водорода
Молекулярно-орбитальная диаграмма воды
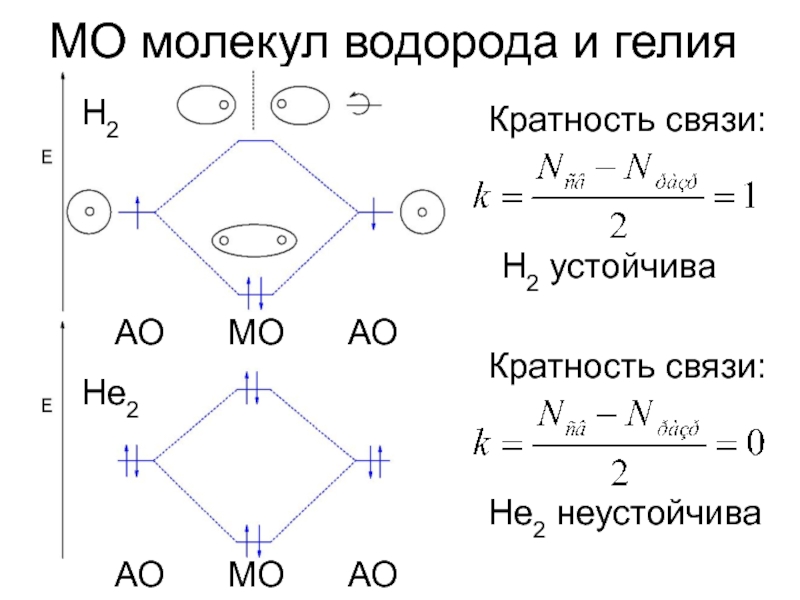
Слайд 10МО молекул водорода и гелия
H2
He2
Кратность связи:
Кратность связи:
МО
МО
АО
АО
АО
АО
Н2 устойчива
Не2 неустойчива
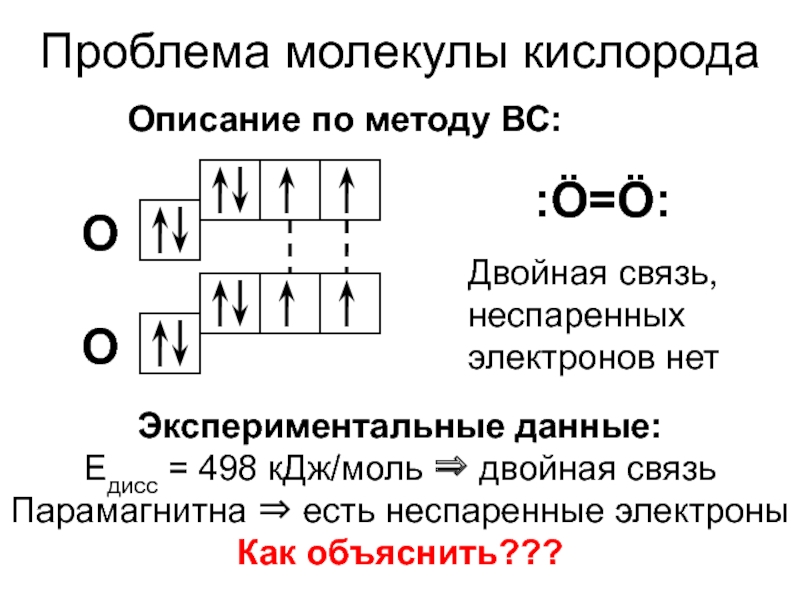
Слайд 11Проблема молекулы кислорода
Описание по методу ВС:
:ö=ö:
Двойная связь, неспаренных электронов нет
Экспериментальные
данные:
Eдисс = 498 кДж/моль двойная связь
Парамагнитна есть неспаренные
электроныКак объяснить???