Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Детский технопарк Альтаир РТУ МИРЭА Москва 2020 Преподаватель: Рябков Егор
Содержание
- 1. Детский технопарк Альтаир РТУ МИРЭА Москва 2020 Преподаватель: Рябков Егор
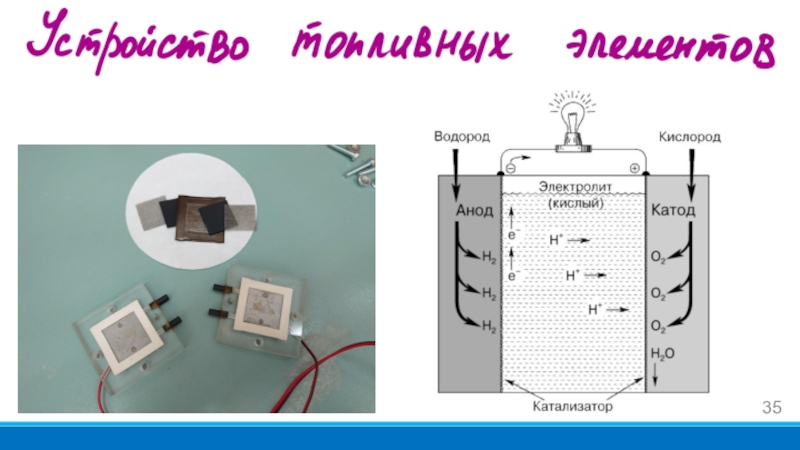
- 2. Вольтамперометрический метод анализаЭлектрокатализТопливные элементы
- 3. Слайд 3
- 4. Метод основан на регистрации зависимостей между силой
- 5. ПолярографияЦиклическая постояннотоковая вольтамперометрия (ЦВА)Переменнотоковая вольтамперометрияАмперометрияИнверсионная вольтамперометрия
- 6. Применение вольтамперных кривых в аналитических целях началось
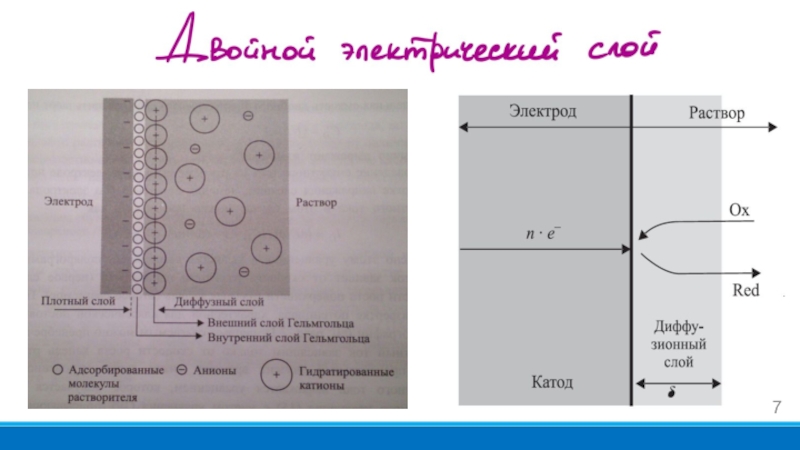
- 7. Слайд 7
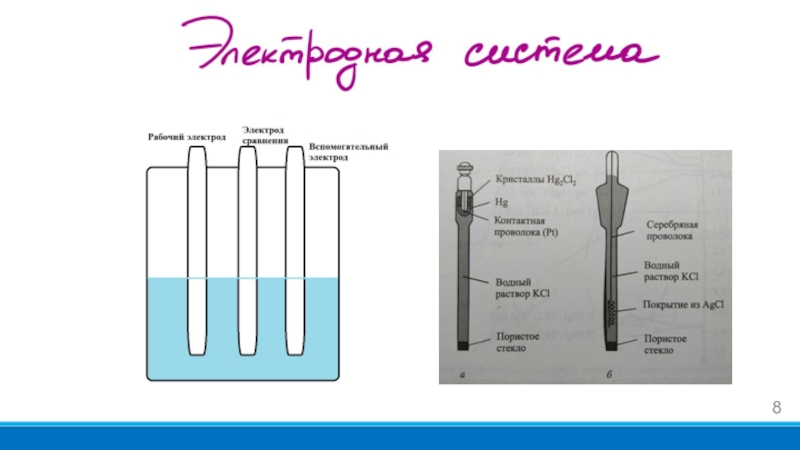
- 8. Слайд 8
- 9. Характерные особенности:Линейная развертка потенциалаИспользуется для изучения протекания реакций окисления-восстановления электроактивных веществ на рабочем электроде
- 10. Вид циклических вольтамперограмм для электродных процессов:обратимых (а)квазиобратимых (б)необратимых (в)
- 11. 127543Параметры:Фоновый электролит – 0,1М NaOHИндикаторный электрод – медный дисковый плоский6
- 12. 127543Параметры:Фоновый электролит – 0,1М NaOHИндикаторный электрод – медный-никелевый дисковый плоский68
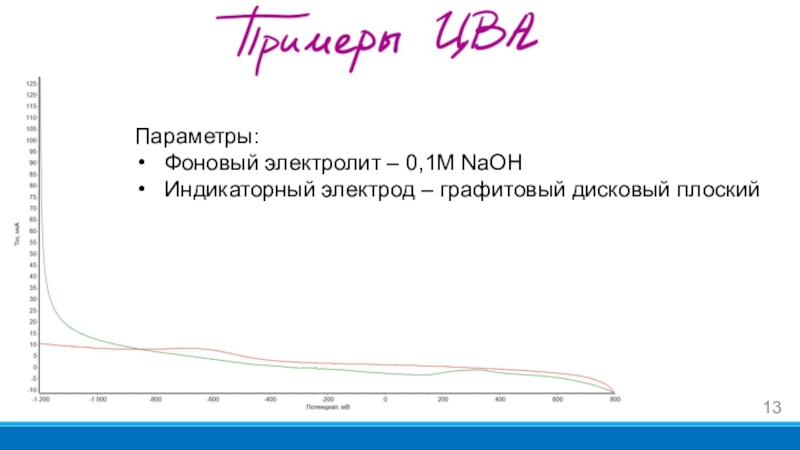
- 13. Параметры:Фоновый электролит – 0,1М NaOHИндикаторный электрод – графитовый дисковый плоский
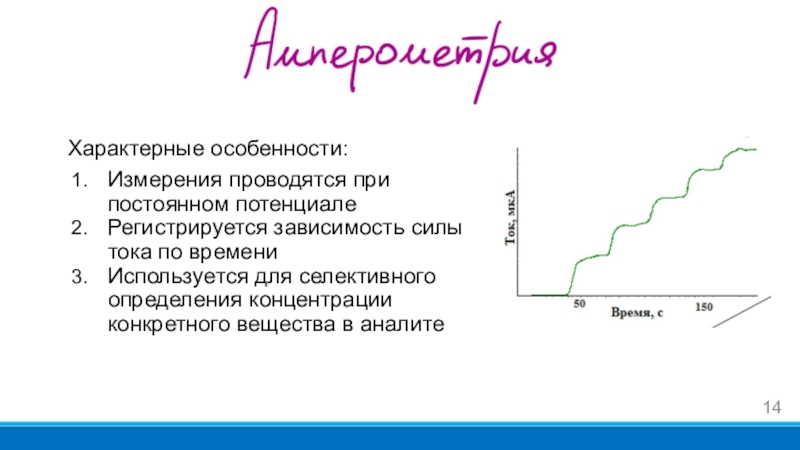
- 14. Характерные особенности:Измерения проводятся при постоянном потенциалеРегистрируется зависимость
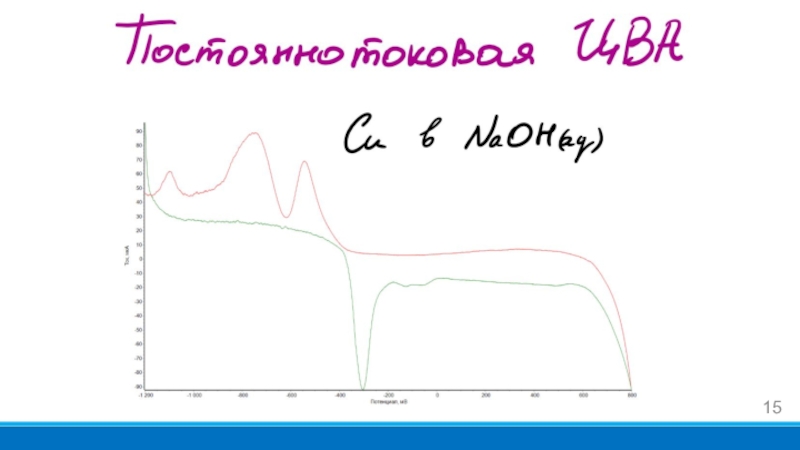
- 15. Слайд 15
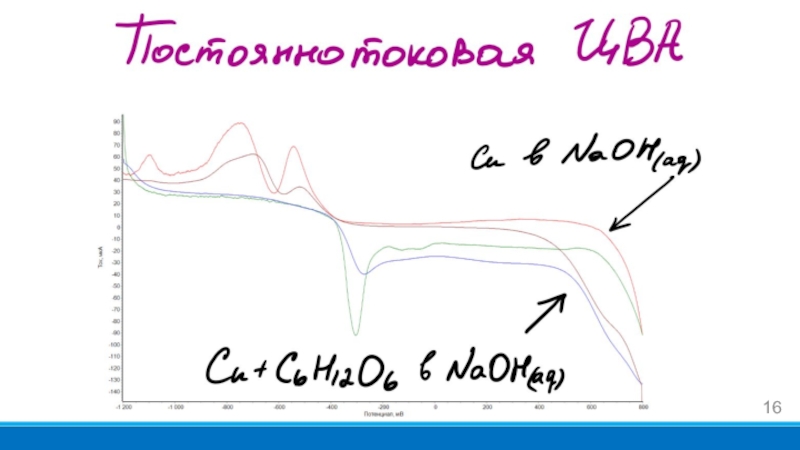
- 16. Слайд 16
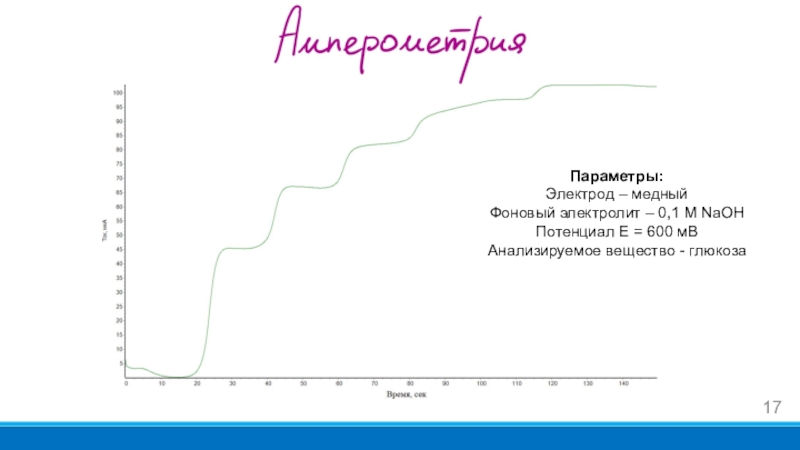
- 17. Параметры:Электрод – медныйФоновый электролит – 0,1 М NaOHПотенциал Е = 600 мВАнализируемое вещество - глюкоза
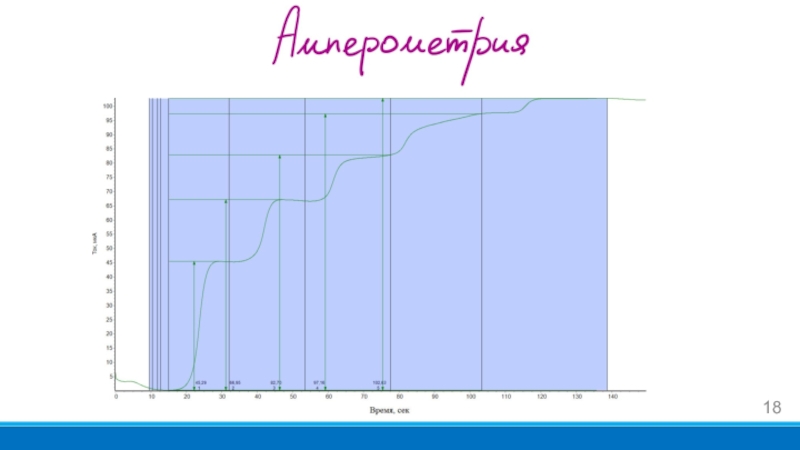
- 18. Слайд 18
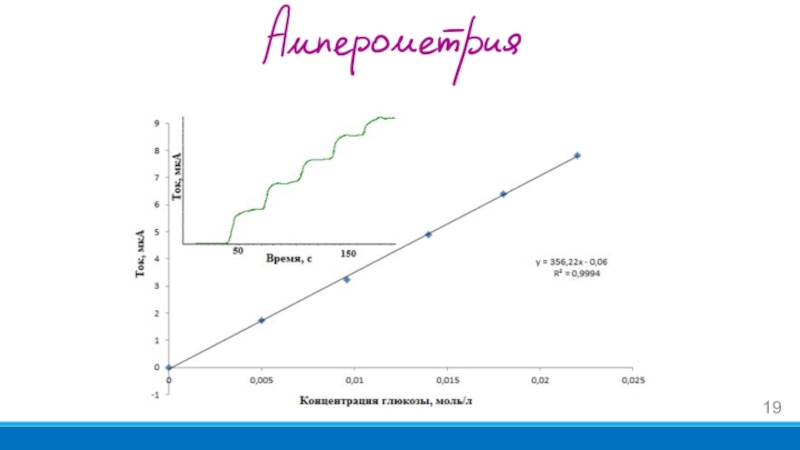
- 19. Слайд 19
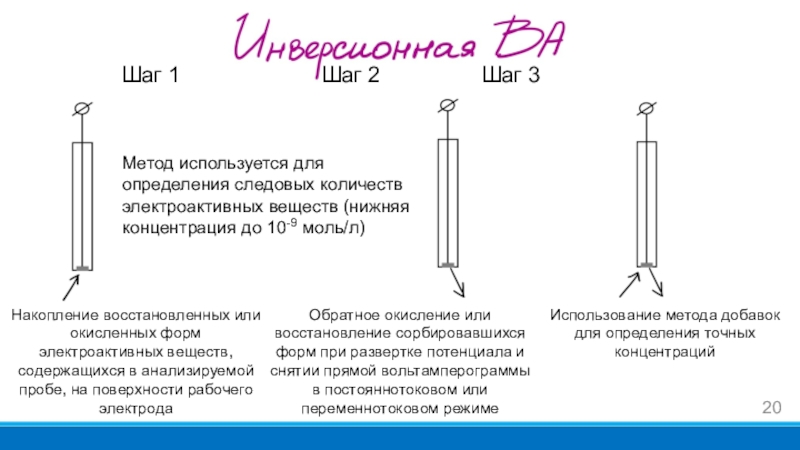
- 20. Шаг 1 Шаг 2 Шаг 3Накопление восстановленных или
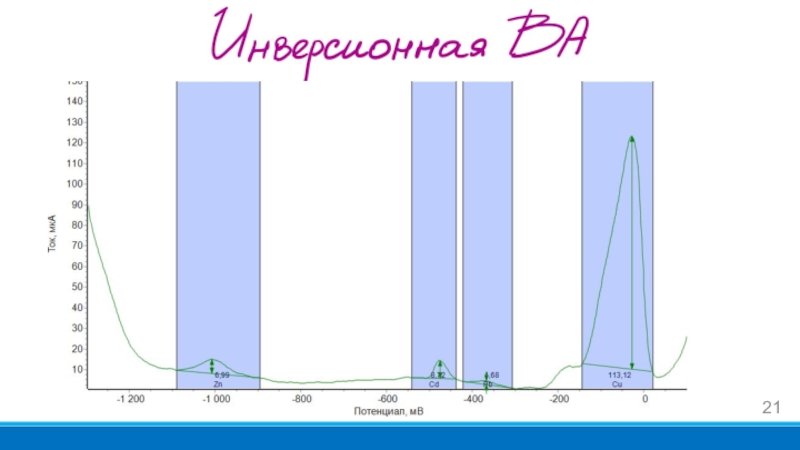
- 21. Слайд 21
- 22. Слайд 22
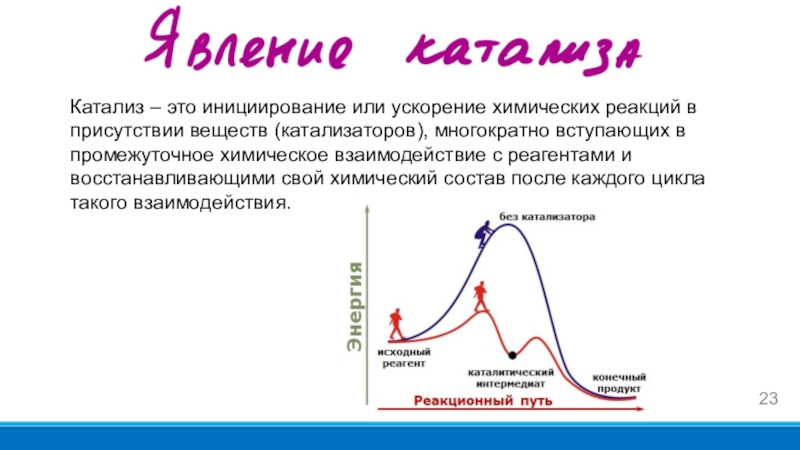
- 23. Катализ – это инициирование или ускорение химических
- 24. Явление ускорения электрохимических реакций при помощи катализаторов,
- 25. Электрокатализаторы:Устойчивы к воздействию окислителей или восстановителей, используемых
- 26. МеталлическиеПлатинаПалладийРутенийНикельМедьК активным металлическим катализаторам для многих электрохимических
- 27. Основываются на электрохимическом измерении скорости ферментно-каталитической реакции,
- 28. Слайд 28
- 29. Слайд 29
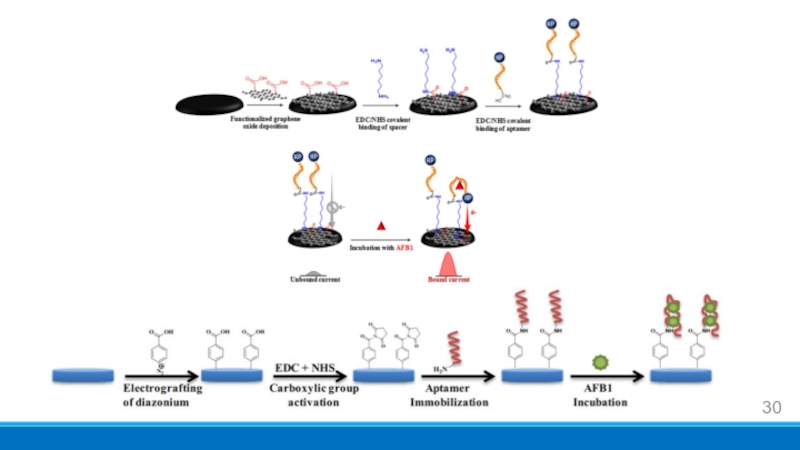
- 30. Слайд 30
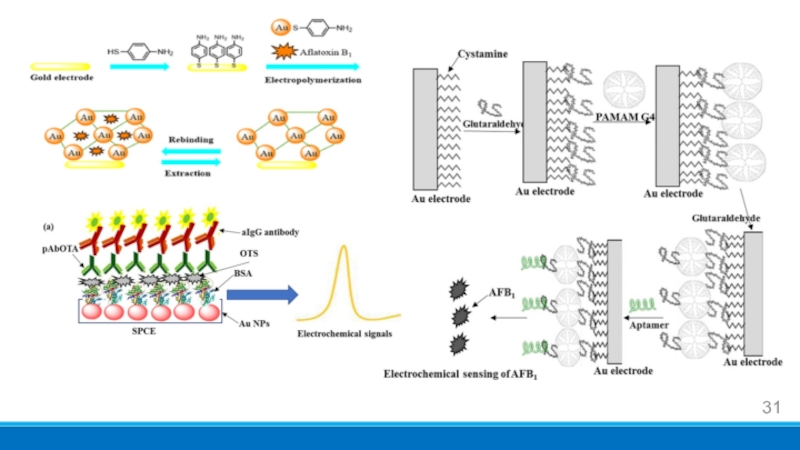
- 31. Слайд 31
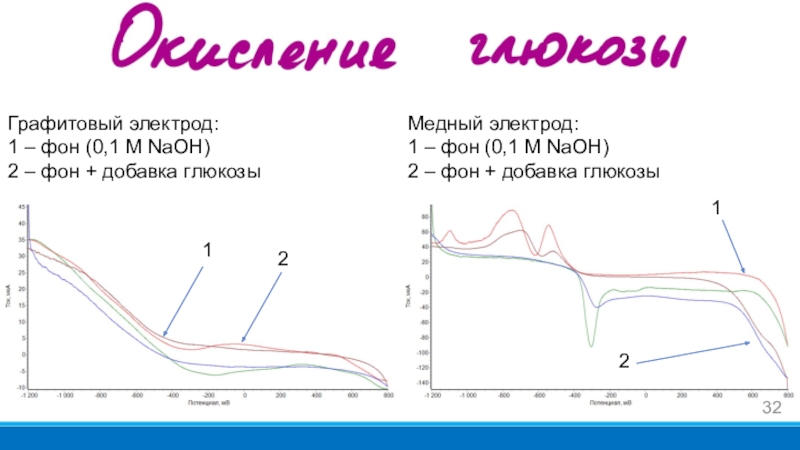
- 32. Графитовый электрод: 1 – фон (0,1 М
- 33. В сильнощелочной среде Cu(III) реагирует с гидроксид-ионами
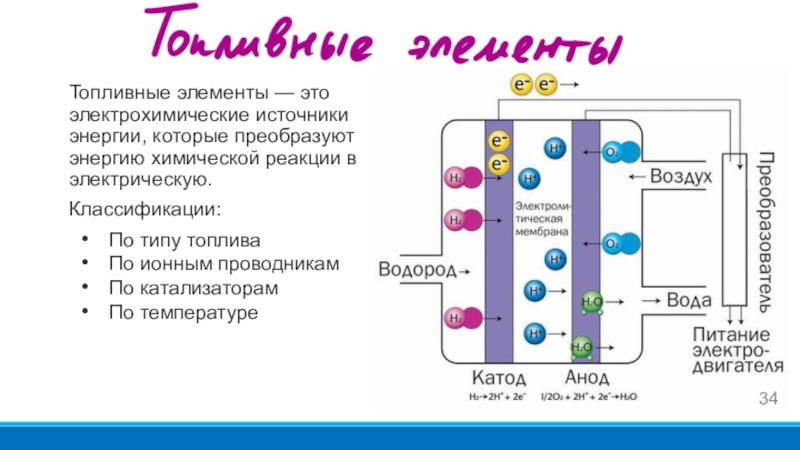
- 34. Топливные элементы — это электрохимические источники энергии,
- 35. Слайд 35
- 36. Слайд 36
- 37. Слайд 37
- 38. Скачать презентанцию
Слайды и текст этой презентации
Слайд 5Полярография
Циклическая постояннотоковая вольтамперометрия (ЦВА)
Переменнотоковая вольтамперометрия
Амперометрия
Инверсионная вольтамперометрия
Слайд 6Применение вольтамперных кривых в аналитических целях началось с разработки в
1922 г. чешским ученым Я. Гейровским полярографического метода анализа.
За открытие
и развитие этого метода Я. Гейровскому была присуждена Нобелевская премия в 1959 году. Особенности: рабочий электрод – ртутный капающий электрод с малой скоростью истечения ртути, а электрод сравнения – слой ртути, находящийся на дне электрохимической ячейки.
Слайд 9Характерные особенности:
Линейная развертка потенциала
Используется для изучения протекания реакций окисления-восстановления электроактивных
веществ на рабочем электроде
Слайд 10Вид циклических вольтамперограмм для электродных процессов:
обратимых (а)
квазиобратимых (б)
необратимых (в)
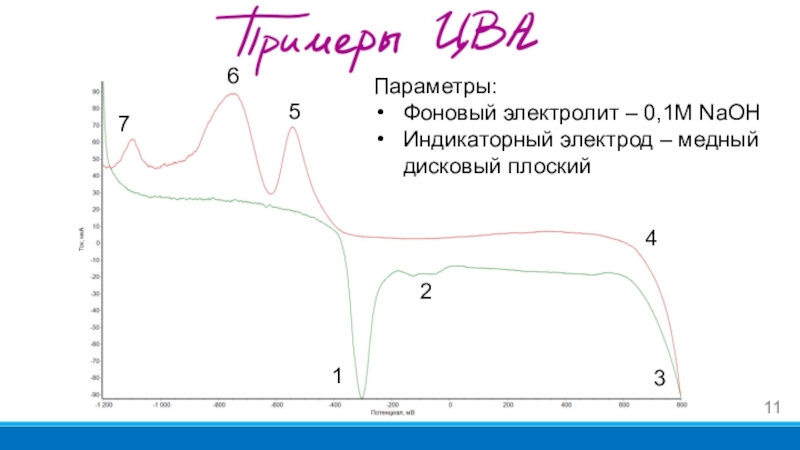
Слайд 111
2
7
5
4
3
Параметры:
Фоновый электролит – 0,1М NaOH
Индикаторный электрод – медный дисковый плоский
6
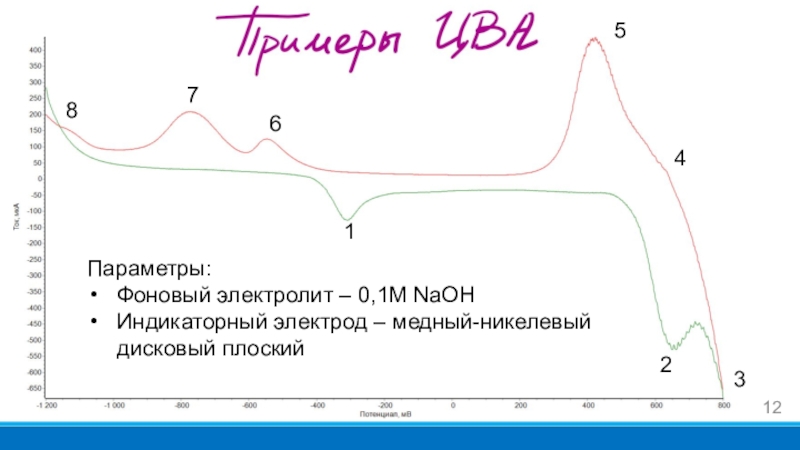
Слайд 121
2
7
5
4
3
Параметры:
Фоновый электролит – 0,1М NaOH
Индикаторный электрод – медный-никелевый дисковый плоский
6
8
Слайд 14Характерные особенности:
Измерения проводятся при постоянном потенциале
Регистрируется зависимость силы тока по
времени
Используется для селективного определения концентрации конкретного вещества в аналите
Слайд 17Параметры:
Электрод – медный
Фоновый электролит – 0,1 М NaOH
Потенциал Е =
600 мВ
Анализируемое вещество - глюкоза
Слайд 20Шаг 1 Шаг 2 Шаг 3
Накопление восстановленных или окисленных форм электроактивных
веществ, содержащихся в анализируемой пробе, на поверхности рабочего электрода
Обратное окисление
или восстановление сорбировавшихся форм при развертке потенциала и снятии прямой вольтамперограммы в постояннотоковом или переменнотоковом режимеИспользование метода добавок для определения точных концентраций
Метод используется для определения следовых количеств электроактивных веществ (нижняя концентрация до 10-9 моль/л)
Слайд 23Катализ – это инициирование или ускорение химических реакций в присутствии
веществ (катализаторов), многократно вступающих в промежуточное химическое взаимодействие с реагентами
и восстанавливающими свой химический состав после каждого цикла такого взаимодействия.Слайд 24Явление ускорения электрохимических реакций при помощи катализаторов, входящих в состав
электродов, получило название электрокатализа. Вещества, ускоряющие электрохимические реакции, называются электрокатализаторами.
Не смещают равновесие
Увеличивают константу прямых и обратных реакций
Снижают энергию активации
Изменяют предэкспоненциальный множитель уравнения Аррениуса
Электрокатализатор изменяет не только скорость, но и механизм реакции, и может влиять на состав продуктов реакции.
k = Ae-Ea/RT
Слайд 25Электрокатализаторы:
Устойчивы к воздействию окислителей или восстановителей, используемых или выделяющихся в
элементах или ячейках
Имеют и сохраняют развитую поверхность
Не дефицитные и не
дорогиеЧем больше поверхность катализатора, тем больше может подойти частиц реагента для реакции - тем быстрее будут образовываться продукты.
Носители:
Должны проводить электрический ток
Химически стойкие металлы или углеродистые материалы.
Слайд 26Металлические
Платина
Палладий
Рутений
Никель
Медь
К активным металлическим катализаторам для многих электрохимических реакций относятся d-элементы
I-VIII групп Периодической системы Менделеева.
Неметаллические
Неорганические соединения
Углеродистые материалы
Органические соединения и катализаторы
Биокатализаторы
Слайд 27Основываются на электрохимическом измерении скорости ферментно-каталитической реакции, которая зависит от
концентрации определяемого вещества в анализируемом растворе.
Специфический фермент при этом нанесен
на твердый носитель и находится в электрохимической ячейке на электродах.Слайд 32Графитовый электрод:
1 – фон (0,1 М NaOH)
2 – фон +
добавка глюкозы
Медный электрод:
1 – фон (0,1 М NaOH)
2 – фон
+ добавка глюкозы1
1
2
2