Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Дисциплина Химия. Общая химия
Содержание
- 1. Дисциплина Химия. Общая химия
- 2. Дисциплина Химия. Общая химия.Тема. Соли как электролиты. Соли средние, кислые и основные, двойные, смешанные, комплексные.
- 3. Темы для презентаций (можете выбрать любую, поставить
- 4. СолиСоли – это электролиты, в результате диссоциации
- 5. Виды солей
- 6. Виды солейСредние соли состоят из катионов металла
- 7. Физические свойства солейВ обычных условиях все соли
- 8. Физические свойства солейРастворимость солей может быть различной.
- 9. Дисциплина Химия. Общая химия.Тема. Химические свойства солей в свете теории электролитической диссоциации.
- 10. Химические свойства средних солей1. Взаимодействие с металламиБолее
- 11. Химические свойства средних солейОднако щелочные и щелочноземельные
- 12. Химические свойства средних солей2. Реагируют со щелочамиNa2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH
- 13. Химические свойства средних солей3. Реакция с кислотами
- 14. Химические свойства средних солей4. Реагируют с кислотами
- 15. Химические свойства средних солей5. Реагируют с солямиNa2SO4 + Ba(NO3)2 = BaSO4↓+2NaNO3
- 16. Химические свойства средних солей6. ГидролизНекоторые соли способны
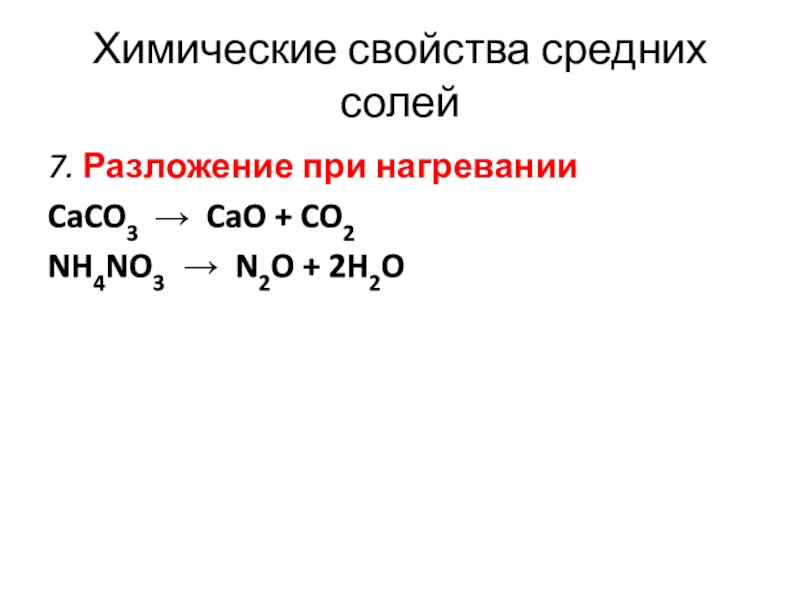
- 17. Химические свойства средних солей7. Разложение при нагреванииCaCO3 → CaO + CO2NH4NO3 → N2O + 2H2O
- 18. Скачать презентанцию
Дисциплина Химия. Общая химия.Тема. Соли как электролиты. Соли средние, кислые и основные, двойные, смешанные, комплексные.
Слайды и текст этой презентации
Слайд 2Дисциплина Химия.
Общая химия.
Тема. Соли как электролиты. Соли средние, кислые и
основные, двойные, смешанные, комплексные.
Слайд 3Темы для презентаций (можете выбрать любую, поставить меня в известность!)
1.
Гидрокарбонат натрия NaHCO3 (пищевая сода), ее свойства, применение, получение.
2. Карбонат
кальция CaCO3 (мел, известняк), его свойства, применение, получение.3. Фосфат кальция Ca3(PO4)2, его свойства, применение, получение.
Слайд 4Соли
Соли – это электролиты, в результате диссоциации их водных растворов
образуются катионы металлов и анионы кислотных остатков.
Слайд 6Виды солей
Средние соли состоят из катионов металла (или аммония) и
анионов кислотных остатков.
Кислые соли содержат катионы металла, катионы водорода
и анион кислотного остатка. Основные соли в своем составе содержат гидроксид-анионы.
Если соль образована двумя видами катионов металлов и одним анионом, то ее называют двойной. Например, сульфат алюминия-калия KAl(SO4)2.
Соли с двумя разными анионами и одним катионом называют смешанными. Например, Са(OCl)Cl – хлорид-гипохлорит кальция.
В комплексных солях содержится сложный ион, который принято заключать в квадратные скобки.
Слайд 7Физические свойства солей
В обычных условиях все соли – это твердые
бесцветные вещества. Но некоторые ионы придают им окраску. Например, соли
двухвалентной меди, трехвалентного хрома и никеля окрашены в зеленый цвет. Перманганаты – фиолетовые. Бихроматы – красно-оранжевые, а хроматы – желтые, соли кобальта – розовые.Слайд 8Физические свойства солей
Растворимость солей может быть различной.
Хорошо растворимы нитраты,
почти все соли щелочных металлов и аммония.
Слайд 9Дисциплина Химия.
Общая химия.
Тема. Химические свойства солей в свете теории электролитической
диссоциации.
Слайд 10Химические свойства средних солей
1. Взаимодействие с металлами
Более активные восстановители вытесняют
менее активные из раствора их солей. Активность металла можно определить
в электрохимическом ряду напряжения металлов.Zn+ СuCl2 = ZnCl2+ Сu
Слайд 11Химические свойства средних солей
Однако щелочные и щелочноземельные металлы реагируют с
растворами солей иначе.
Эти металлы сначала реагируют с водой. При этом
образуется щелочь и выделяется водород.2K + 2H2O =2KOH + H2↑, образующаяся щелочь реагирует с раствором соли, если получается нерастворимый гидроксид.
CuSO4 + 2КOH = Cu(OH)2↓ + К2SO4
Слайд 13Химические свойства средних солей
3. Реакция с кислотами (если образуется осадок
или газ)
AgNO3 + HBr = AgBr↓ + HNO3 (качественная реакция
на галогеноводородные кислоты)BaCl2+ H2SO4 = BaSO4↓ + 2HCl (качественная реакция на серную кислоту и её соли)
CaCO3+ 2HCl = CaCl2+ H2O + CO2↑ (качественная реакция на карбонаты)
Слайд 14Химические свойства средних солей
4. Реагируют с кислотами (с более сильными
или менее летучими)
NaCl (тв.) + H2SO4(конц.) = NaHSO4 +
HCl ↑Ca3(PO4)2(тв.) +3H2SO4(конц.) =3CaSO4 + 2H3PO4
Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2↑