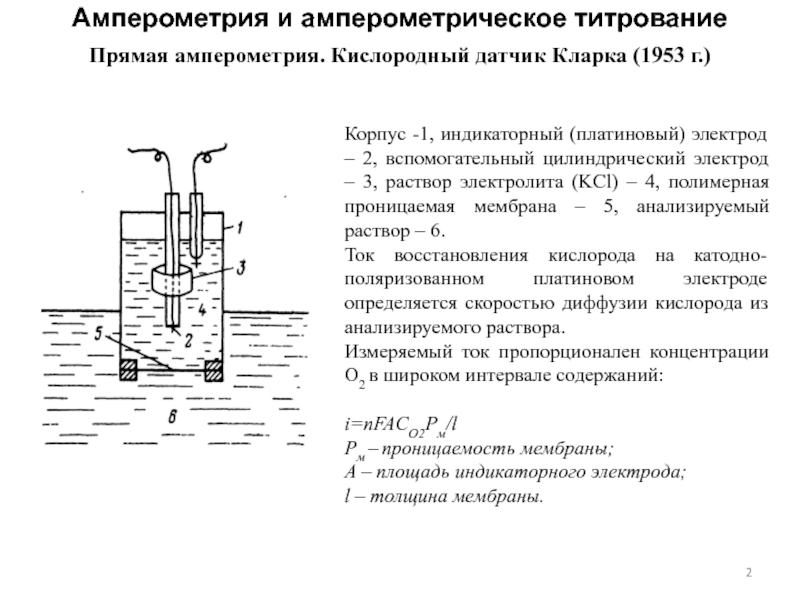
Слайд 2Прямая амперометрия. Кислородный датчик Кларка (1953 г.)
Корпус -1, индикаторный (платиновый)
электрод – 2, вспомогательный цилиндрический электрод – 3, раствор электролита
(KCl) – 4, полимерная проницаемая мембрана – 5, анализируемый раствор – 6.
Ток восстановления кислорода на катодно-поляризованном платиновом электроде определяется скоростью диффузии кислорода из анализируемого раствора.
Измеряемый ток пропорционален концентрации O2 в широком интервале содержаний:
i=nFACO2Pм/l
Pм – проницаемость мембраны;
A – площадь индикаторного электрода;
l – толщина мембраны.
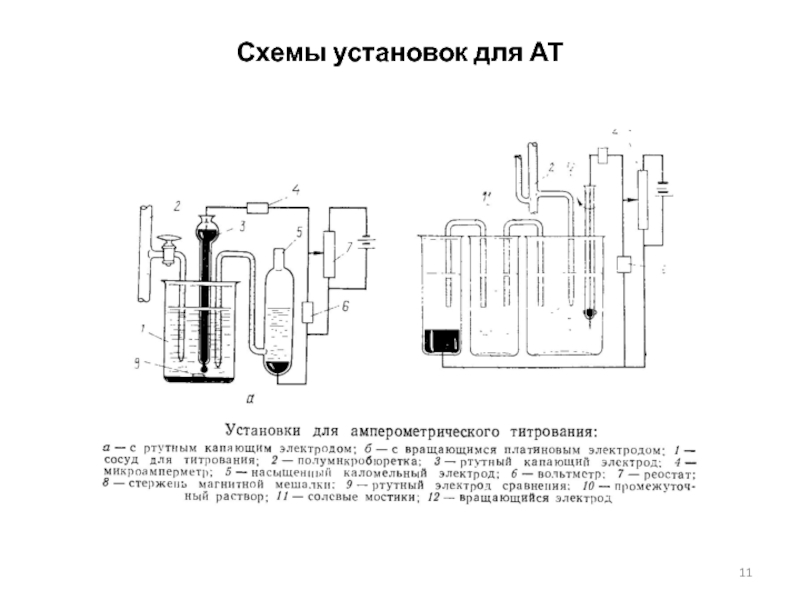
Амперометрия и амперометрическое титрование
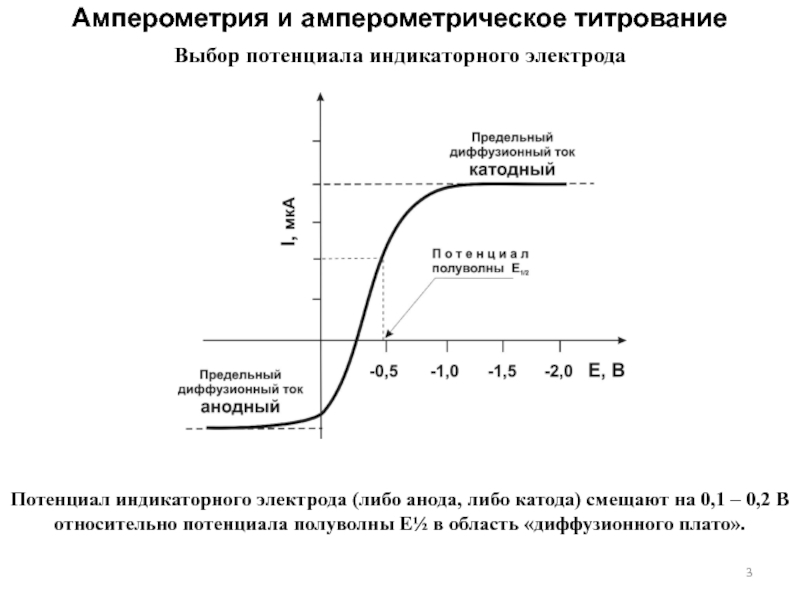
Слайд 3Выбор потенциала индикаторного электрода
Амперометрия и амперометрическое титрование
Потенциал индикаторного электрода
(либо анода, либо катода) смещают на 0,1 – 0,2 В
относительно потенциала полуволны Е½ в область «диффузионного плато».
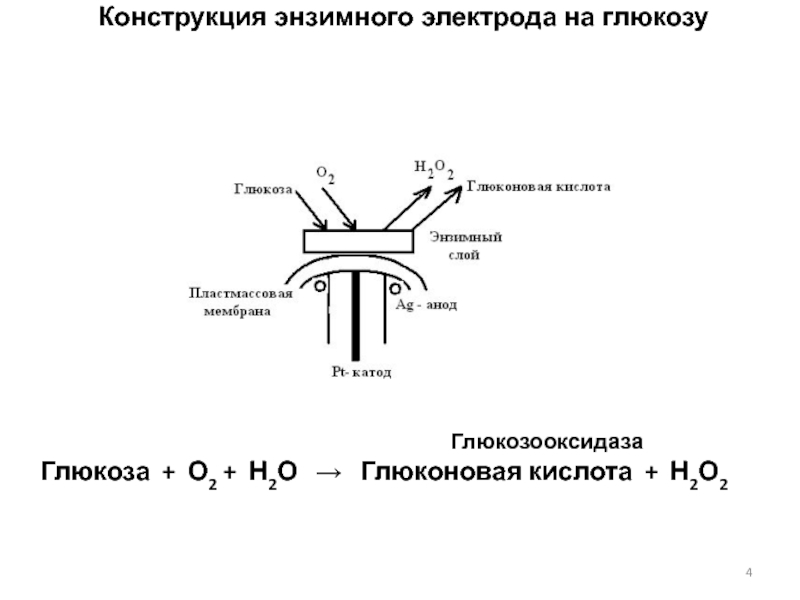
Слайд 4 Конструкция энзимного электрода на глюкозу
Слайд 5Пример
амперометрического
сенсора
Глюкометр
Accu-Check
Слайд 6H2O2 + 2H+ 2 Fe[Fe(CN)6]4- ↔ 2 Fe[Fe(CN)6]3- + 2
H2O
медиатор
Глюкоза, у.е.
Слайд 7Схема амперометрического
сенсора глюкозы
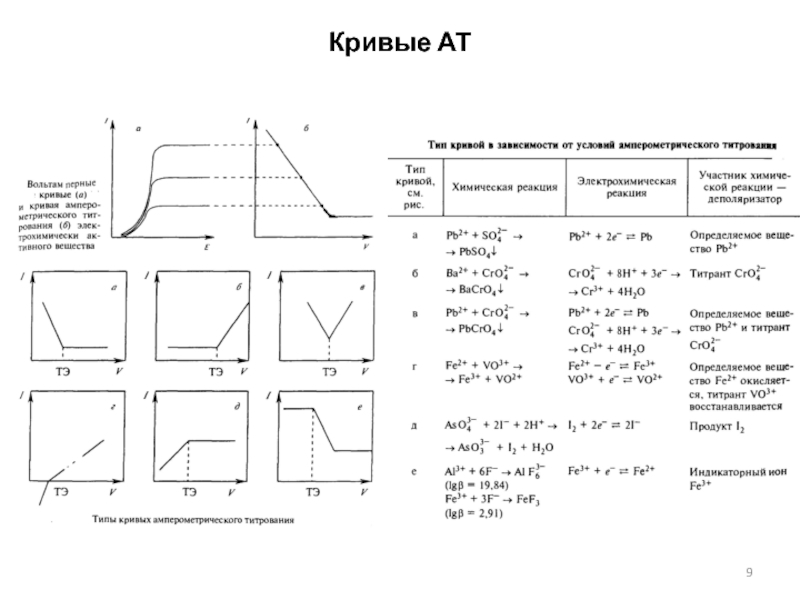
Слайд 8Амперометрическое титрование
Амперометрическое титрование (АТ) – это метод анализа, основанный на
измерении предельного диффузионного тока в процессе титрования, который меняется за
счет изменения концентрации титруемого вещества. Предельный диффузионный ток зависит от концентрации:
id = kC
Первый вариант метода предложен Гейровским (создателем полярографического метода) состоял в последовательном снятии полярограмм определяемого вещества после каждой добавленной порции титранта.
Современный вариант метода предложен Майером. Он показал, что при наложении постоянного потенциала на ртутный капающий электрод нет необходимости каждый раз снимать полярограмму.
Методы АТ
С одним индикаторным поляризованным электродом. По IUPAC метод АТ.
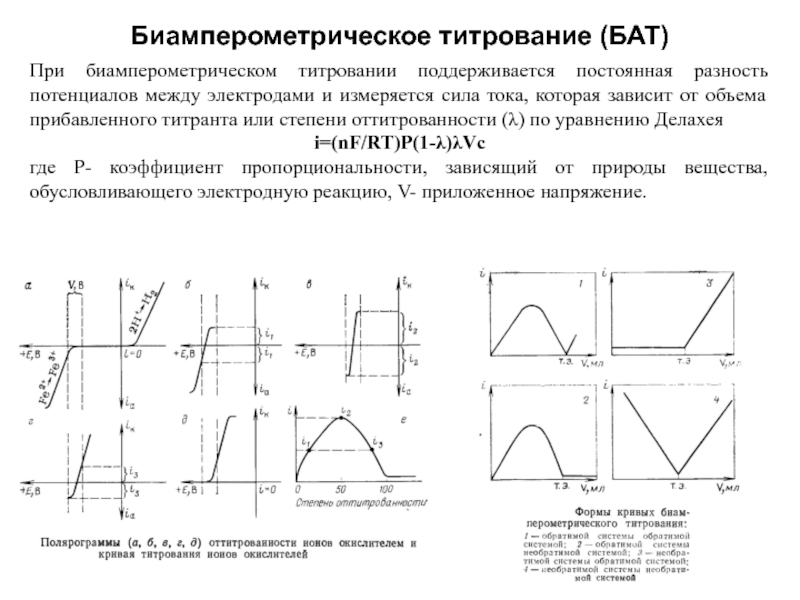
С двумя индикаторными поляризованными электродами. По IUPAC метод биамперометрического титрования.
Можно титровать как электроактивные, так и неактивные вещества, которые вступают в реакции осаждения, окисления-восстановления, комплексообразования, кислотно-основного взаимодействия и др.
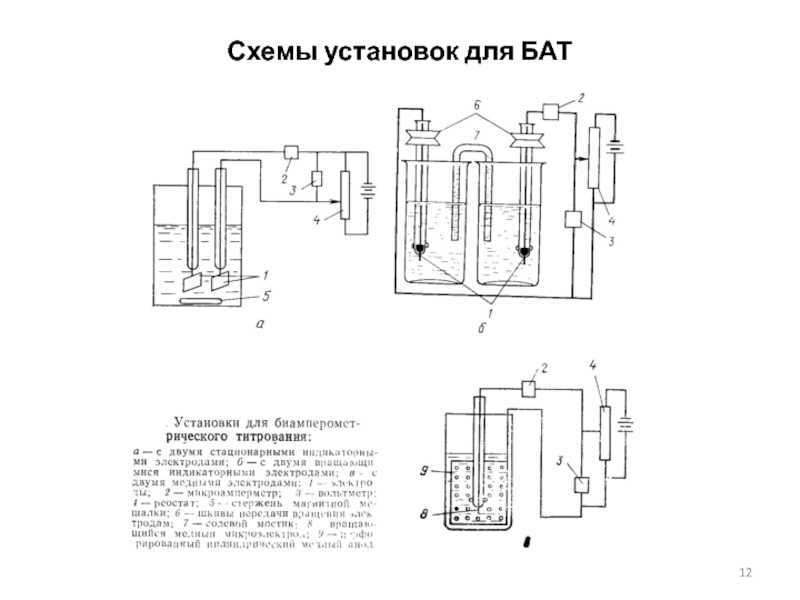
Слайд 10Биамперометрическое титрование (БАТ)
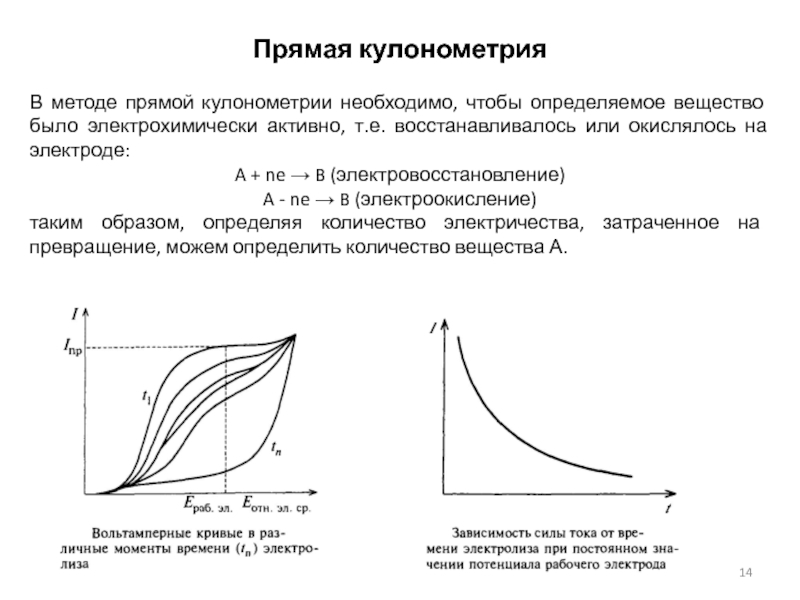
Слайд 13Кулонометрия
Кулонометрия объединяет методы, основанные на измерении количества электричества, израсходованного на
электрохимические реакции, приводящие к количественному электроокислению или электровосстановлению определяемого вещества
или же к получению промежуточного продукта, который количественно взаимодействует с определяемым веществом. В основе метода лежит обобщенный закон Фарадея:
m=MQ/(nF)
где m - масса электрохимически превращенного вещества, M - его молярная масса, Q – количество электричества, затраченного на превращение вещества.
Различают прямую кулонометрию и кулонометрическое титрование, которые могут выполняться при контролируемом токе и контролируемом потенциале.
Обычно прямую кулонометрию проводят с контролируемым потенциалом, а кулонометрическое титрование - с контролируемым током.
Необходимое условие применения реакции в кулонометрии – 100% выход по току, т.е. отсутствие побочных реакций.
Достоинства: определение больших и малых концентраций, низкая погрешность (0,01%), исключение стандартных растворов, экспрессность.
Слайд 15Оценка количества электричества: задачи 1 типа.
Слайд 16Сколько времени потребуется для того, чтобы выделить на электроде 99
% присутствующего в растворе кадмия, если при электролизе в потенциостатических
условиях концентрация CdSO4 за 10 мин уменьшилась в 3 раза?
Слайд 17Определить потенциал, при котором следует вести электролиз: задачи 2 типа.
Ox
и Red растворимы. Если Red первоначально в растворе не было,
то
Е = Е0’ + (RT/nF)ln[C0(1-x)/C0x]
Если необходимо, чтобы восстановление произошло на 99%, то
Red переходит в амальгаму:
Е = Е0’ + (RT/nF)ln[C0Vp(1-x)/(C0Vaмх)] = Е0’ + (RT/nF)ln[Vp/Vaм] + (RT/nF)ln[(1-x)/х];
Металл восстанавливается и осаждается на его поверхности:
Е = Е0’ + (RT/nF)ln[0C0/{a(Red)=1}]
Слайд 19Применение кулонометрии с КП
Кулонометрия с контролируемым потенциалом применяется для определения
как органических, так и неорганических веществ. Возможно определение практически всех
элементов периодической системы, в том числе редкоземельных, трансурановых, платиновых элементов. Метод позволяет изучать механизм электроокисления и электровосстановления различных органических веществ, определять нитро-, нитрозо- и азосоединения, хиноны, фенолы и многие другие. Кулонометрические детекторы применяются для определения экстремально малых количеств электроактивных соединений при их анализе методом ВЭЖХ и проточно-инжекционным методом.
Слайд 20Кулонометрическое титрование
Этот метод основан на электрогенерации при постоянном токе электролиза
титранта, который количественно реагирует с определяемым веществом. Так как при
электролизе с постоянным током происходит изменение потенциала рабочего электрода, то для предупреждения затрат электричества на побочные электрохимические реакции в анализируемый раствор вводят электроактивный вспомогательный реагент, который участвует в электродной реакции – электрогенерированный титрант – количественно химически взаимодействует с определяемым веществом.
Возможны два случая:
Определяемое вещество электронеактивно. На рабочем электроде происходит электропревращение только вспомогательного реагента.
Пример. Определение тиосульфата в присутствии вспомогательного реагента KI: На аноде 2I- - 2e → I2; В растворе 2S2O32- + I2 → S4O62- + 2I-
Определяемое вещество электроактивно. На генераторном электроде происходит превращение как вспомогательного реагента. Так и определяемого вещества.
Пример. Определение Ce(IV) в присутствии вспомогательного реагента Fe(II) (железоаммонийных квасцов).
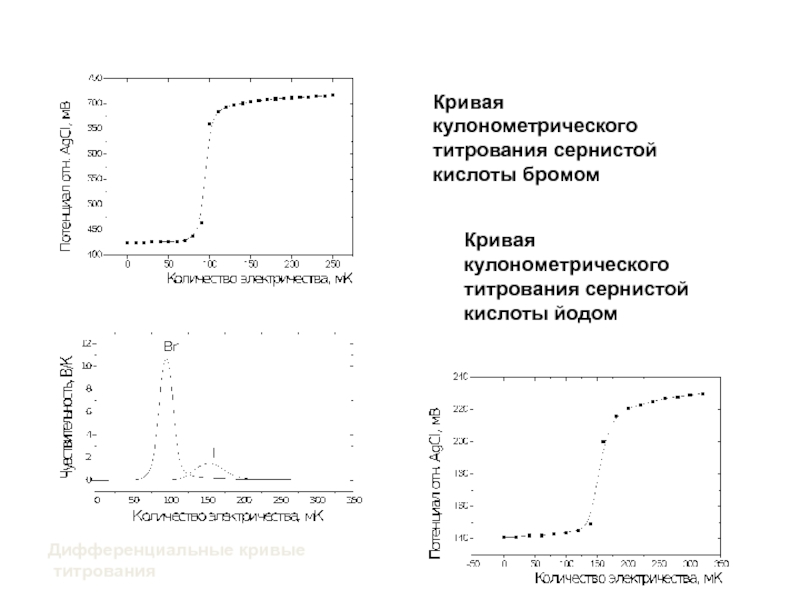
Слайд 22Кривая кулонометрического титрования сернистой кислоты бромом
Кривая кулонометрического титрования сернистой кислоты
йодом
Дифференциальные кривые
титрования
Слайд 23Определение воды по Фишеру
Ещё одно важное применение кулонометрического титрования
– определение воды в органических растворителях по методу Фишера.
SO2(пиридин, метанол)
+ I2 (электрогенерированный) + 2H2O →
→ SO4-- + 2I- + 4 H+
Биамперометрическая индикация конечной точки титрования.
Метод позволяет определить воду в органических растворителях в концентрациях от 1 до 1000 мг/л.
В новых модификациях реактива Фишера вместо пиридина используются диэтаноламин или имидазол, а вместо метанола – эфиры этиленгликоля, что позволяет повысить чувствительность и точность определения.
Слайд 24Индикация КТТ
Для обнаружения конечной точки титрования (КТТ) пригодны практически все
методы, используемые в титриметрии, - визуальные и инструментальные. Наибольшее применение
нашли потенциометрический и амперометрический методы с двумя индикаторными электродами. В качестве химической реакции между кулонометрическим титрантом и определяемым веществом может быть использована любая реакция, применяемая в титриметрии: кислотно-основного взаимодействия, окисления-восстановления, осаждения, комплексообразования.
Кулонометрическое определение можно вести для всех веществ, которые можно оттитровать стандартными растворами титрантов.
Наибольшее распространение получило кулонометрическое титрование в ред-окс определениях, что обусловлено легкостью электрогенерирования титрантов-окислителей, таких как: I2, Br2, Cl2, Ce(IV), Mn(III), Ag(II), Pb(IV), IO-, BrO- и других титрантов-восстановителей: Fe(II), Sn(II), Cu(I), Ti(III), Cr(II), V(II), V(III), V(IV).
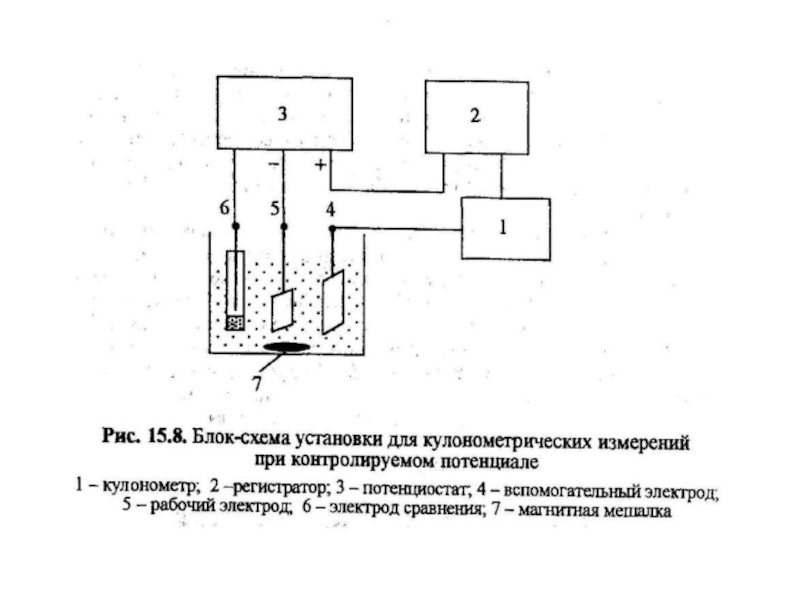
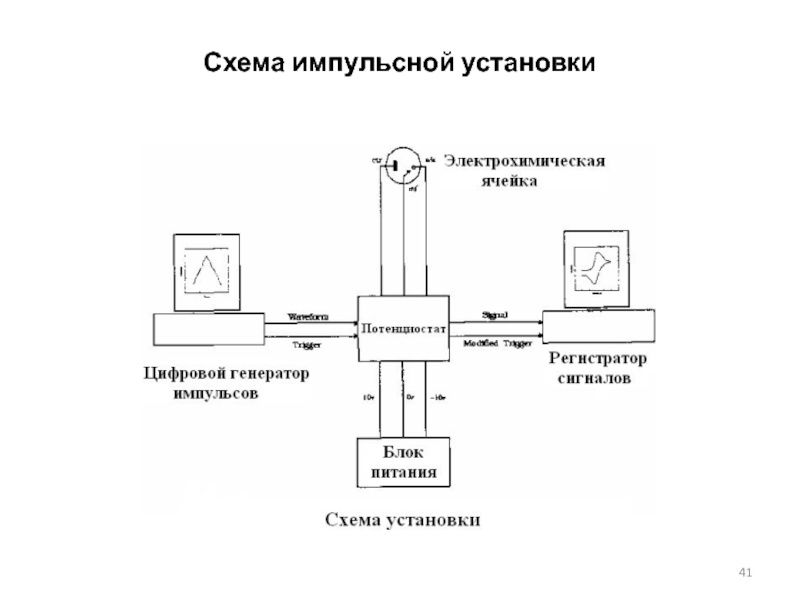
Слайд 25Установка для кулонометрического титрования
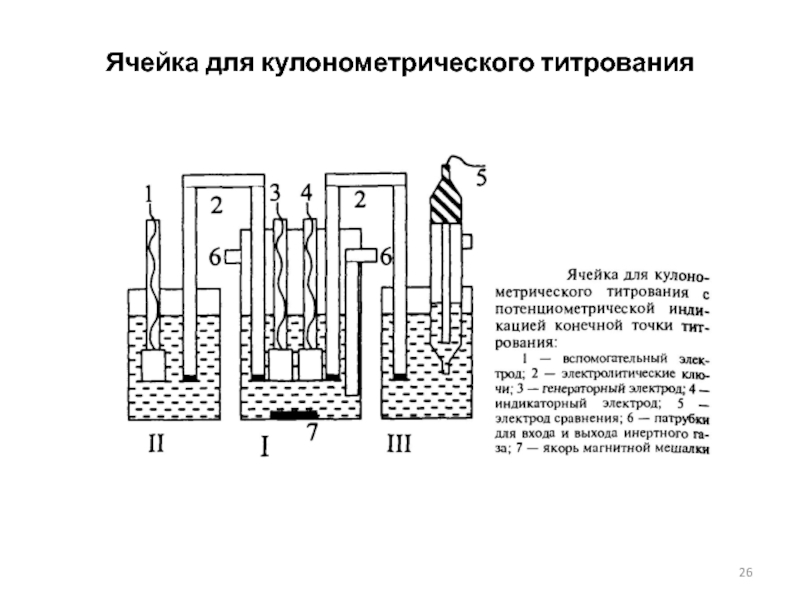
Слайд 26Ячейка для кулонометрического титрования
Слайд 27Электрогравиметрия
Электровесовой метод. Один из самых старых физико-химических методов анализа. Раствор
соли металла подвергают столь длительному электролизу, что металл практически полностью
осаждается на катоде. Количество металла определяют путем взвешивания до и после электролиза.
Пример: определение меди.
Слайд 28Метод вращающегося дискового электрода.
Уравнение Левича
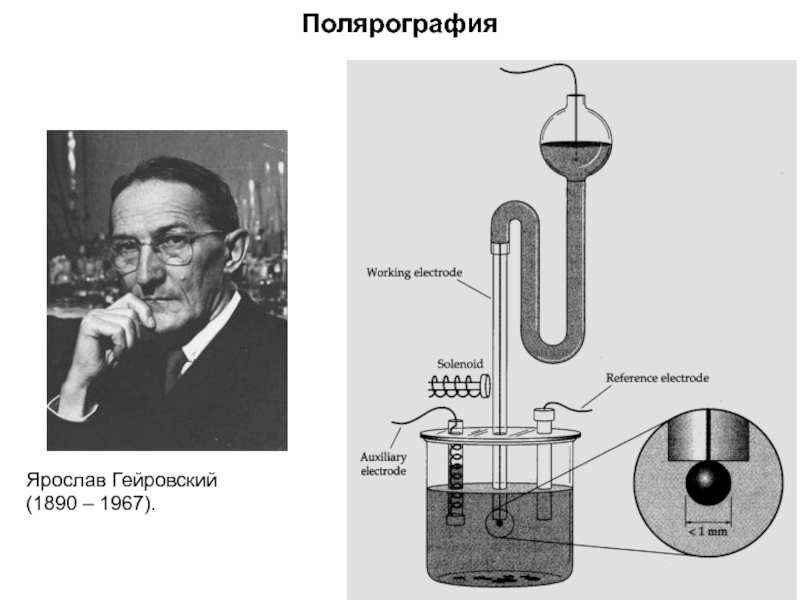
Слайд 29Ярослав Гейровский
(1890 – 1967).
Полярография
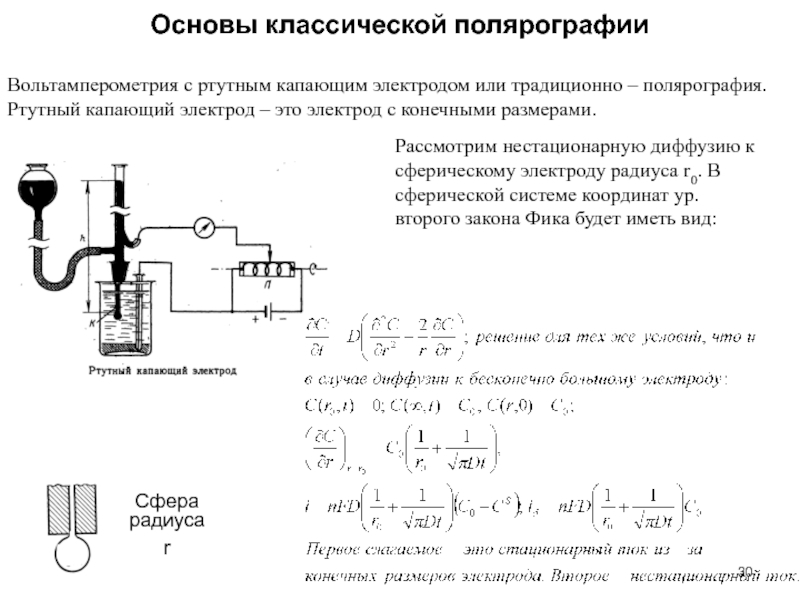
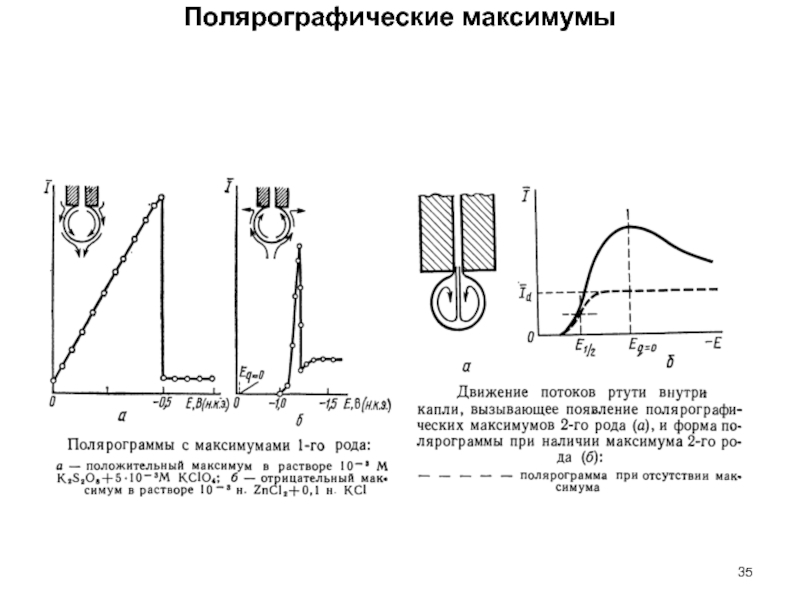
Слайд 30Основы классической полярографии
Слайд 31Соотношение между нестационарным и стационарным токами
В расчетах принималось r0=1 мм,
D=10-9 м2/с. Отсюда для практических задач, когда период капания составляет
2-6 с, можно принять приближенно, что ток определяется нестационарной частью, т.е. ур. Коттрела
Чтобы определить полный ток, необходимо учесть площадь поверхности капли, при том, что поверхность связана с весом капли
Учет движения поверхности навстречу раствору приводит к коэффициенту (7/3)1/2 и уравнению Ильковича
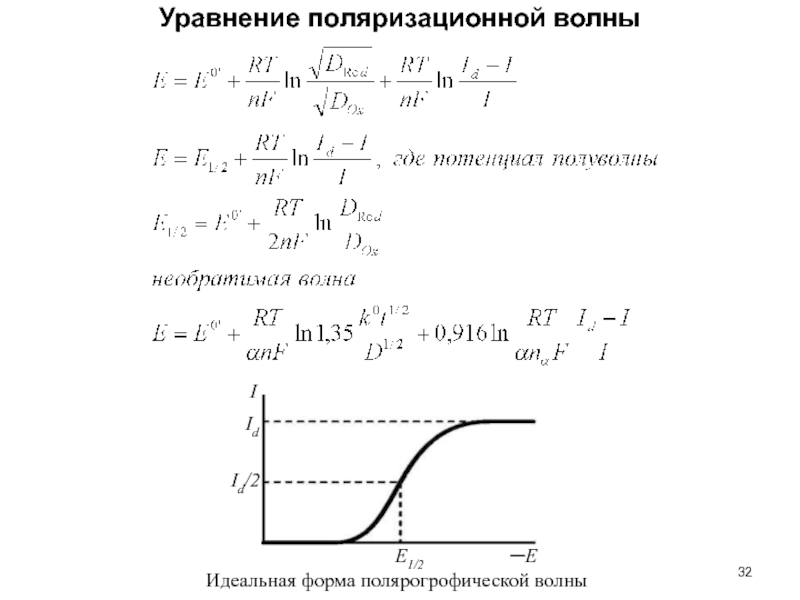
Слайд 32Уравнение поляризационной волны
E1/2
─E
I
Id
Id/2
Идеальная форма полярогрофической волны
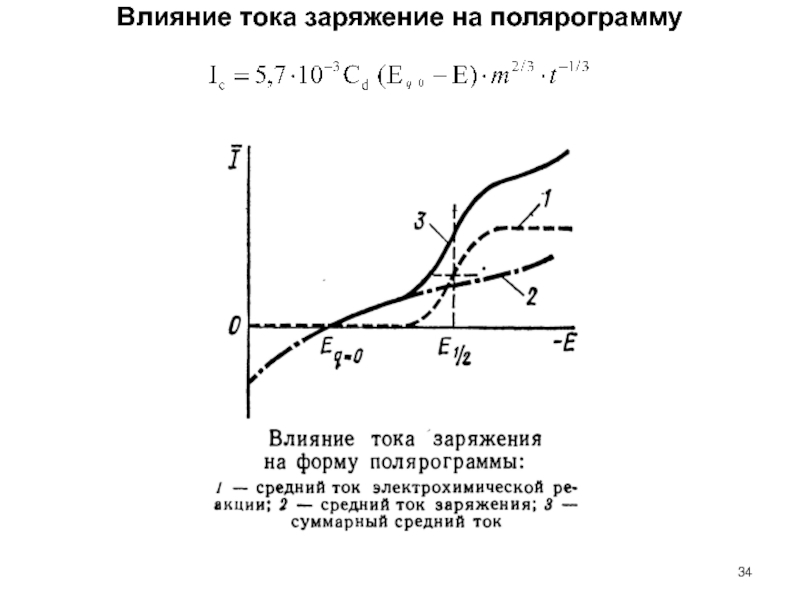
Слайд 34Влияние тока заряжение на полярограмму
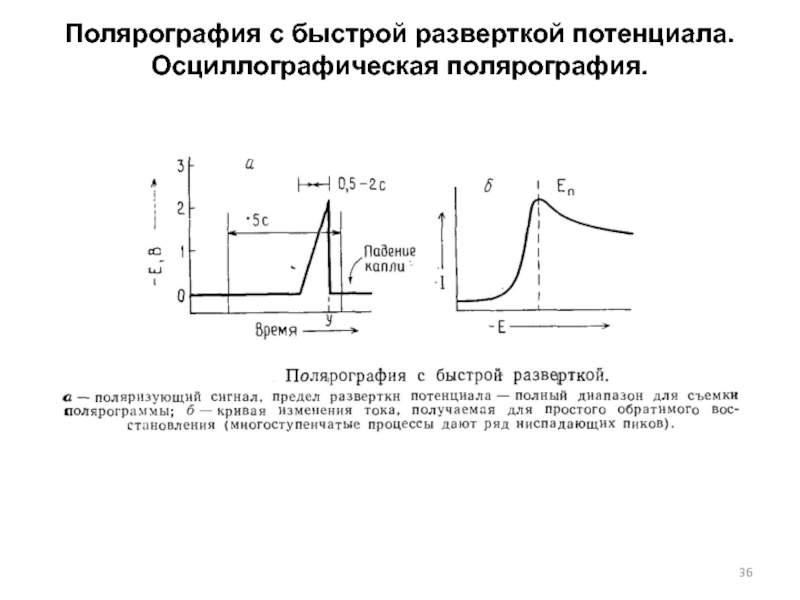
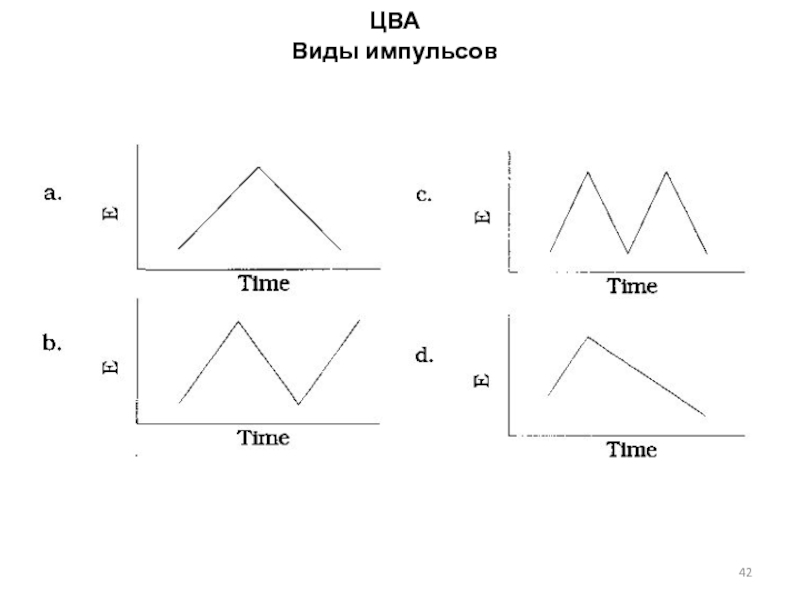
Слайд 36Полярография с быстрой разверткой потенциала. Осциллографическая полярография.
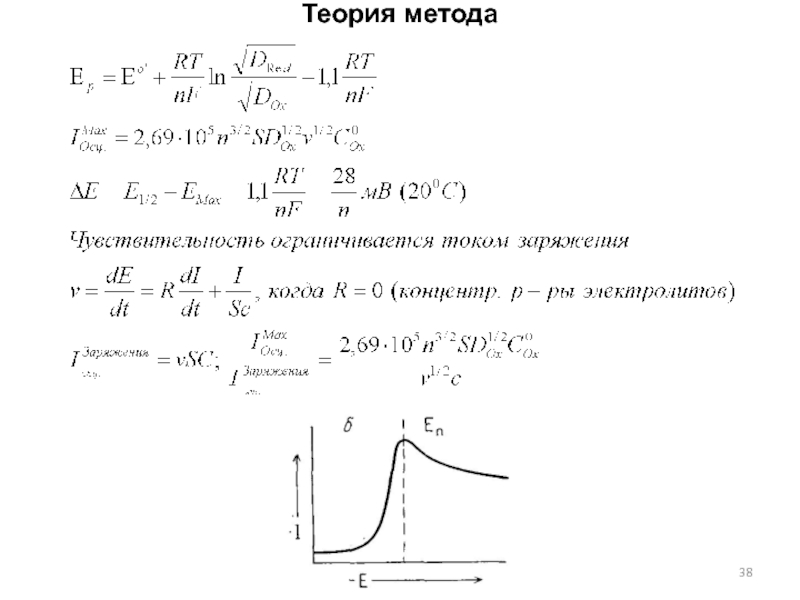
Слайд 37Теория метода
На ртутный капающий электрод (РКЭ) в конце жизни капли
подается линейная развертка потенциала:
Е=Ен-vt
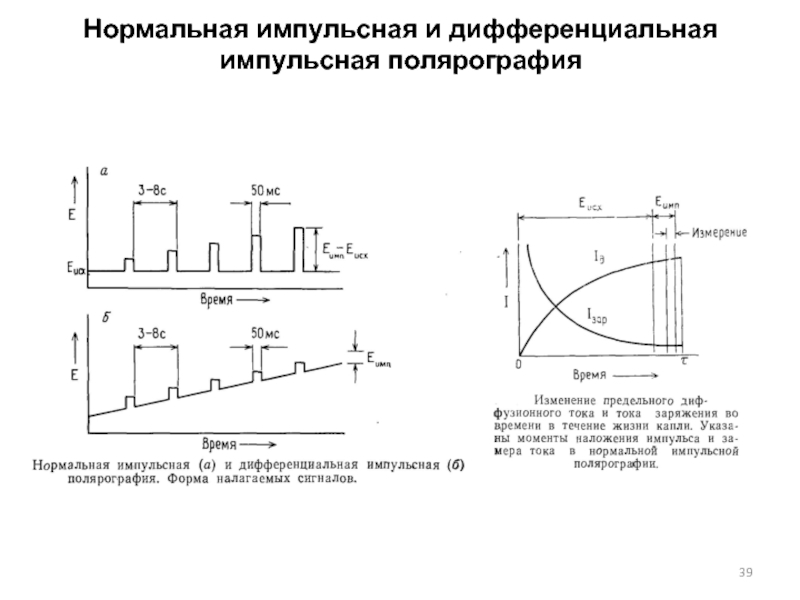
Слайд 39Нормальная импульсная и дифференциальная импульсная полярография
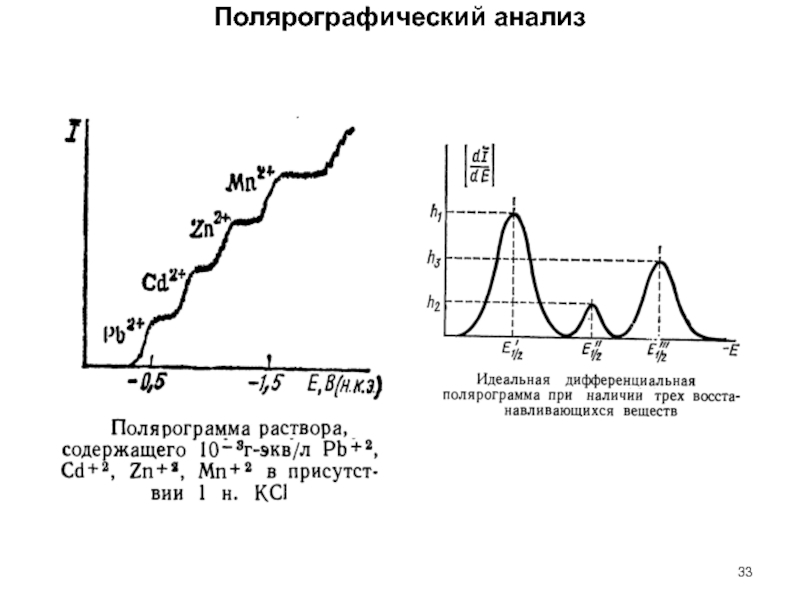
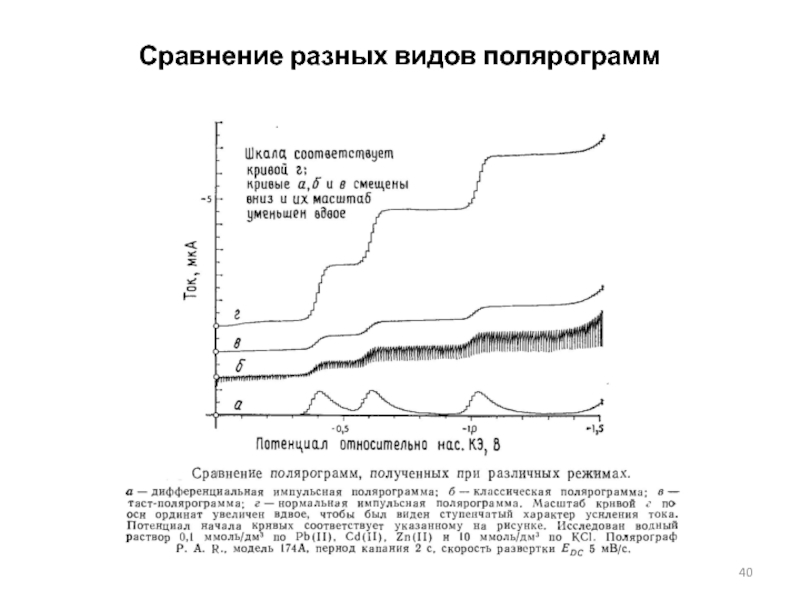
Слайд 40Сравнение разных видов полярограмм
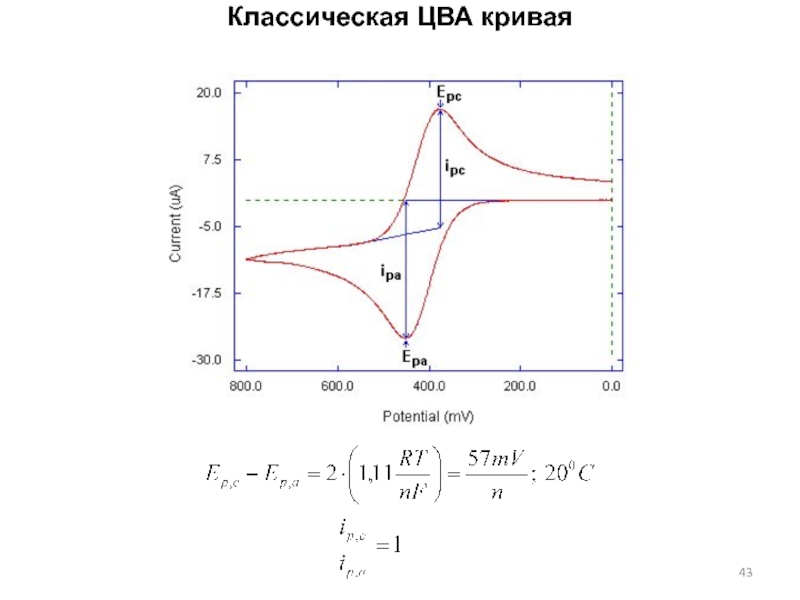
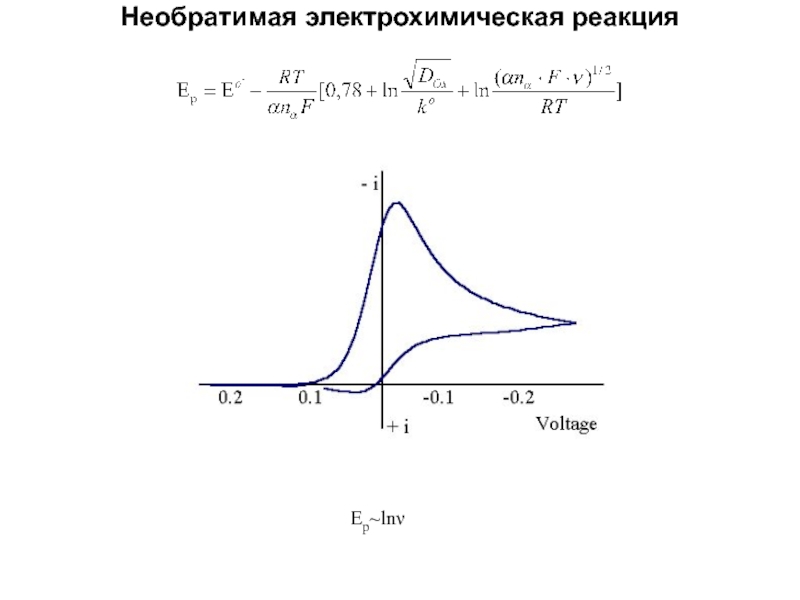
Слайд 44Необратимая электрохимическая реакция
Ep~ln
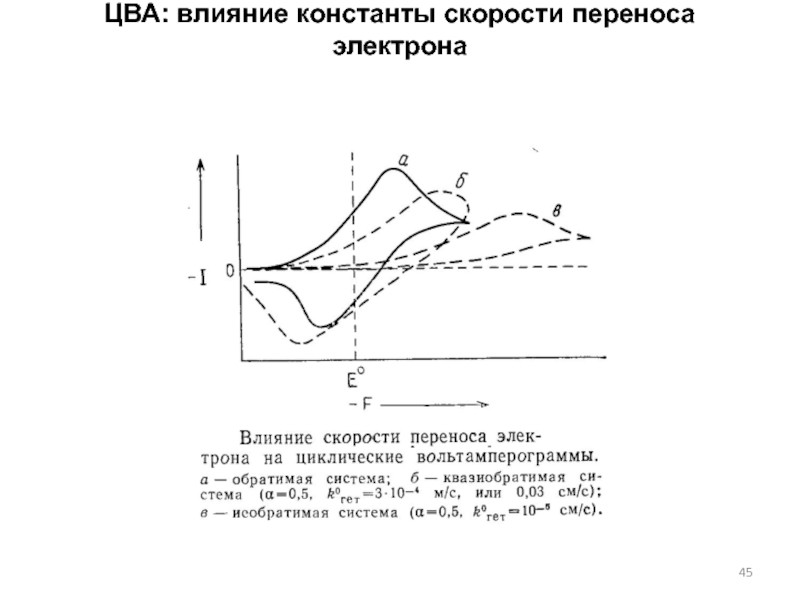
Слайд 45ЦВА: влияние константы скорости переноса электрона
Слайд 46 Метод электрохимического анализа, в котором для снижения нижней границы определяемых
концентраций используется предварительное концентрирование определяемого компонента на рабочем электроде с
помощью различных электрохимических или химических реакций, в том числе за счет адсорбции, с последующей регистрацией вольтамперной кривой растворения концентрата.
Анодная
Катодная
Адсорбционная
Реализуется на различных электродах.
DME - капающая Hg;
SMDE - неподвижная Hg капля;
HMDE – подвешенная Hg капля;
Ртутнографитовые электроды;
Металлические инертные электроды.
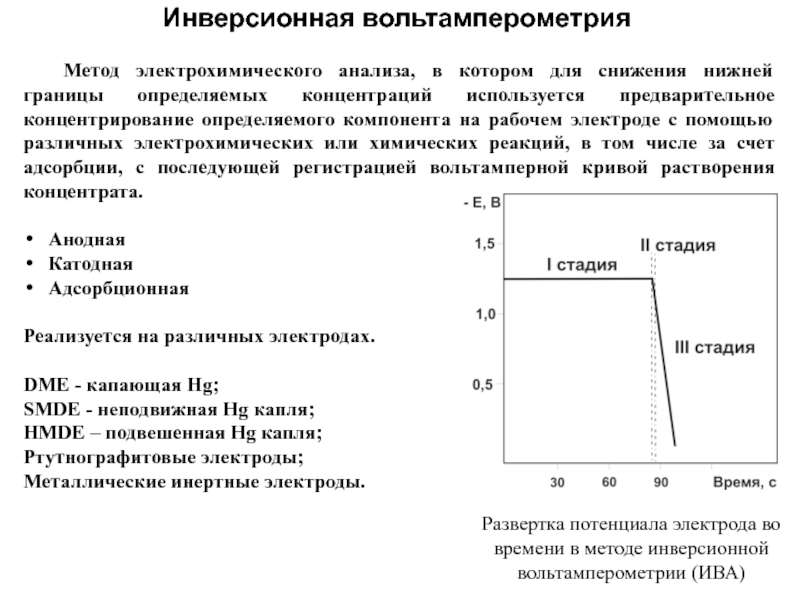
Инверсионная вольтамперометрия
Развертка потенциала электрода во времени в методе инверсионной вольтамперометрии (ИВА)
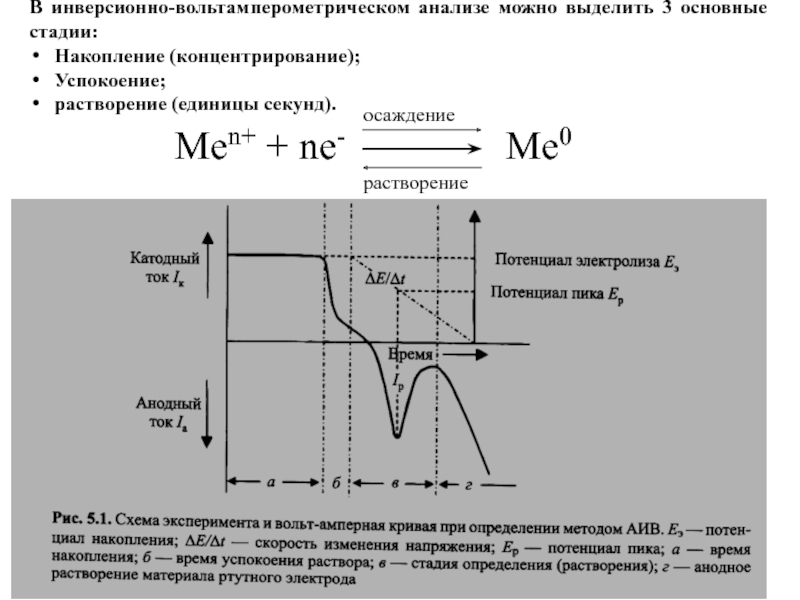
Слайд 47В инверсионно-вольтамперометрическом анализе можно выделить 3 основные стадии:
Накопление (концентрирование);
Успокоение;
растворение (единицы
секунд).
Men+ + ne-
Me0
осаждение
растворение
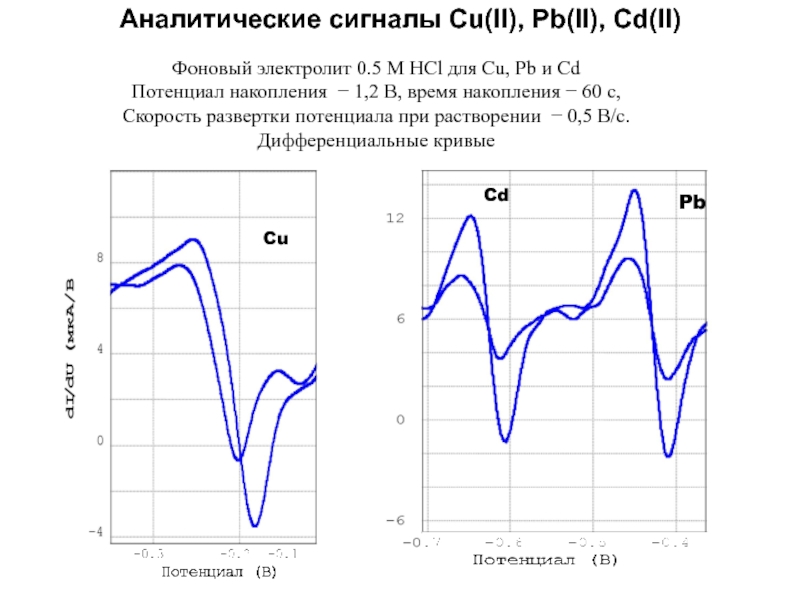
Слайд 48Аналитические сигналы Cu(II), Pb(II), Cd(II)
Фоновый электролит 0.5 M HCl
для Cu, Pb и Cd
Потенциал накопления − 1,2 В, время
накопления − 60 с,
Скорость развертки потенциала при растворении − 0,5 В/с.
Дифференциальные кривые
Cu
Cd
Pb
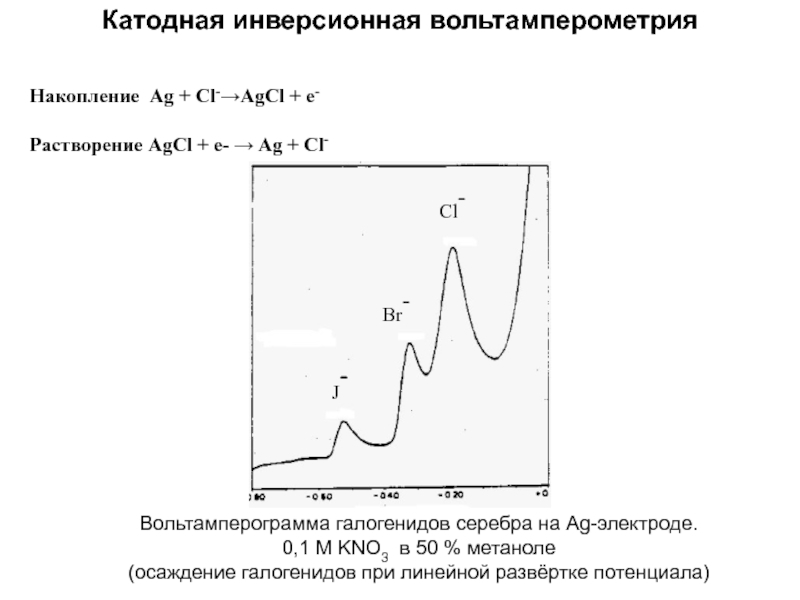
Слайд 49Катодная инверсионная вольтамперометрия
Накопление Ag + Cl-→AgCl + e-
Растворение AgCl +
e- → Ag + Cl-
J-
Br-
Cl-
Вольтамперограмма галогенидов серебра на Ag-электроде.
0,1
М KNO3 в 50 % метаноле
(осаждение галогенидов при линейной развёртке потенциала)

![ЭХ_4 H2O2 + 2H+ 2 Fe[Fe(CN)6]4- ↔ 2 Fe[Fe(CN)6]3- + 2 H2OмедиаторГлюкоза, у.е. H2O2 + 2H+ 2 Fe[Fe(CN)6]4- ↔ 2 Fe[Fe(CN)6]3- + 2 H2OмедиаторГлюкоза, у.е.](/img/thumbs/3fa349434a14ade31d66cf816d5d71ca-800x.jpg)