Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролитическая диссоциация
Содержание
- 1. Электролитическая диссоциация
- 2. вещества, растворы и расплавы которых проводят электрический
- 3. Термины «электролит» в переводе с греческого разлагаемый
- 4. Аррениус занимался изучением электропроводности сильно разбавленных водных
- 5. Причины электролитической диссоциацииСторонники физической теории растворов (Вант-Гофф,
- 6. Причины электролитической диссоциацииИ.А. Каблуков и В.А. Кистяковский
- 7. Причины распада вещества на ионы в расплавах
- 8. Причины диссоциации веществ в воде Вода -
- 9. Механизм диссоциации веществ с ионной связьюОриентация молекул
- 10. В раствор переходят гидратированные ионы, свойства которых отличаются от свойств негидратированных
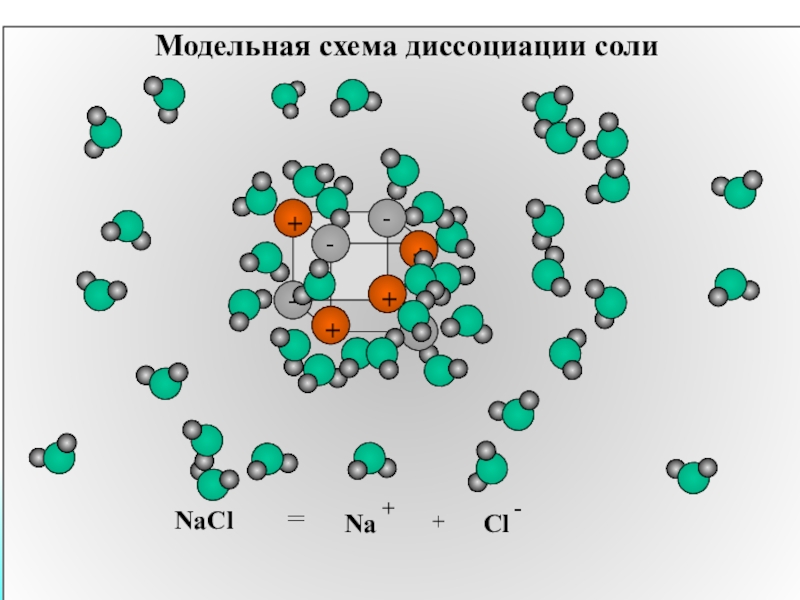
- 11. Модельная схема диссоциации солиNaCl = + Na+
- 12. Механизм диссоциации веществ с ковалентной полярной связьюОриентация
- 13. Ионная или сильнополярная ковалентная связьКислотыОснованияСолиКовалентная неполярная или слабополярная связьМногие органические соединенияГазы. Неметаллы Дистиллированная водаЭлектролитыНеэлектролиты
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Количественная характеристика электролитической диссоциацииα = n/NСила электролитаСтепень
- 18. практически полностью диссоцируют н ионы. Сильные минеральные
- 19. Основные положения ТЭДЭлектролитическая диссоциация для слабых электролитов
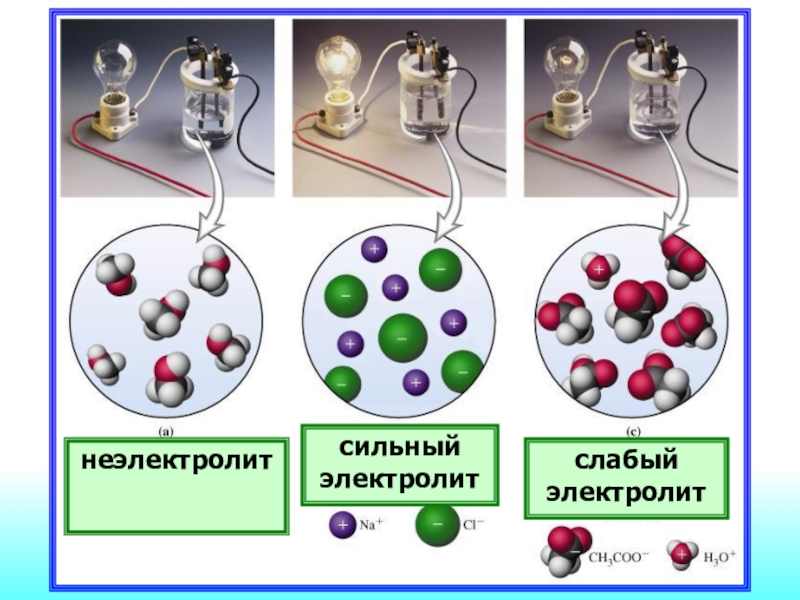
- 20. неэлектролитсильный электролитслабый электролит
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Значение теории электролитической диссоциацииТЭД позволила объяснить свойства
- 25. Значение теории электролитической диссоциацииОбосновала механизм многих органических
- 26. ВыводыТЭД была предложена в 1887 году шведским
- 27. ВыводыСтепень диссоциации зависит от природы электролита и
- 28. Скачать презентанцию
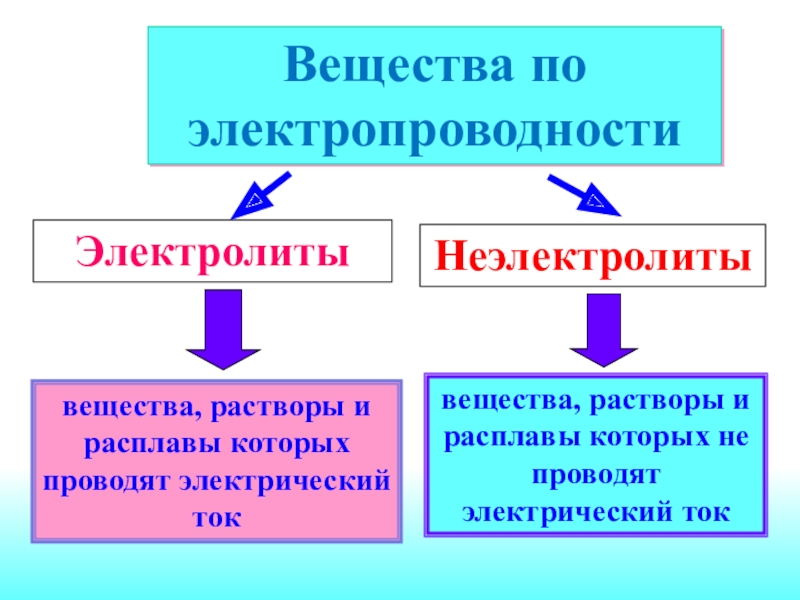
вещества, растворы и расплавы которых проводят электрический токВещества по электропроводности ЭлектролитыНеэлектролитывещества, растворы и расплавы которых не проводят электрический ток
Слайды и текст этой презентации
Слайд 2вещества, растворы и расплавы которых проводят электрический ток
Вещества по электропроводности
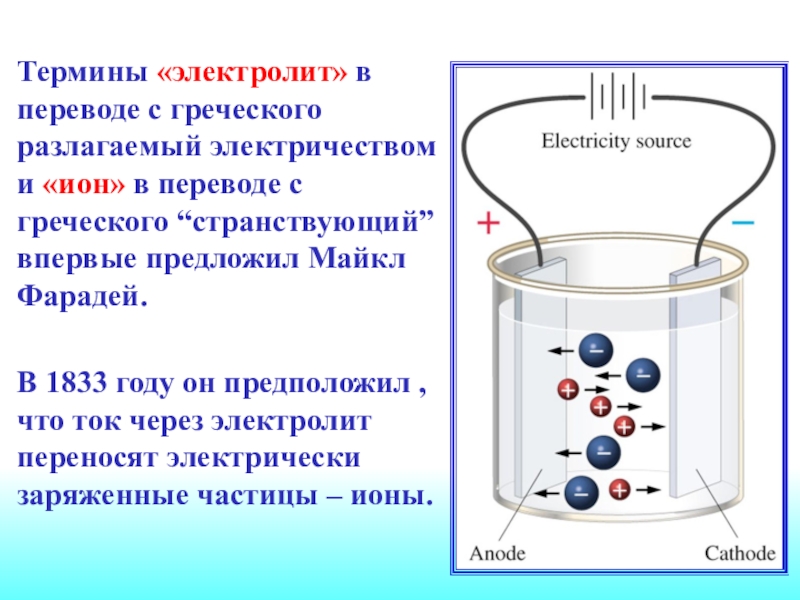
Слайд 3Термины «электролит» в переводе с греческого разлагаемый электричеством и «ион»
в переводе с греческого “странствующий” впервые предложил Майкл Фарадей.
В
1833 году он предположил , что ток через электролит переносят электрически заряженные частицы – ионы.Слайд 4Аррениус занимался изучением электропроводности сильно разбавленных водных растворов. В мае
1883 года после длительной экспериментальной проверки он пришел к выводу,
что причиной увеличения электропроводности растворов при разбавлении является вода.Вывод: молекулы электролита диссоциируют на ионы без воздействия тока, причем степень диссоциации растет с разбавлением.
В 1887 году появилась статья Аррениуса «О диссоциации растворенных в воде веществ». Он превратил чисто качественную гипотезу в количественную теорию, которая могла быть проверена экспериментально.
Слайд 5Причины электролитической диссоциации
Сторонники физической теории растворов (Вант-Гофф, Аррениус и Освальд)
считали, что процесс растворения - результат диффузии, т.е. проникновения растворенного
вещества в промежутки между молекулами воды. В растворах находятся ионы.Д.И. Менделеев и его сторонники доказывали, что растворение – результат химического взаимодействия растворенного вещества с молекулами воды.
В результате химического взаимодействия с водой образуются соединения – гидраты.
Слайд 6Причины электролитической диссоциации
И.А. Каблуков и В.А. Кистяковский применили химическую теорию
Д.И. Менделеева и доказали что в растворе находятся не свободные
ионы а гидратированные.Они показали, что растворение — физико-химический процесс, включающий в себя как образование ионов (теория электролитической диссоциации), так и гидратацию веществ (гидратная теория) молекулами воды.
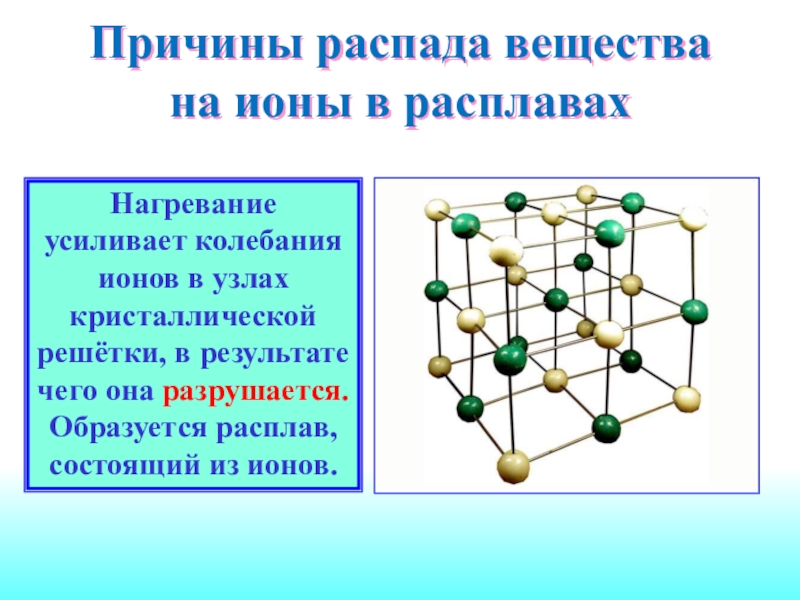
Слайд 7Причины распада вещества на ионы в расплавах
Нагревание усиливает колебания
ионов в узлах кристаллической решётки, в результате чего она разрушается.
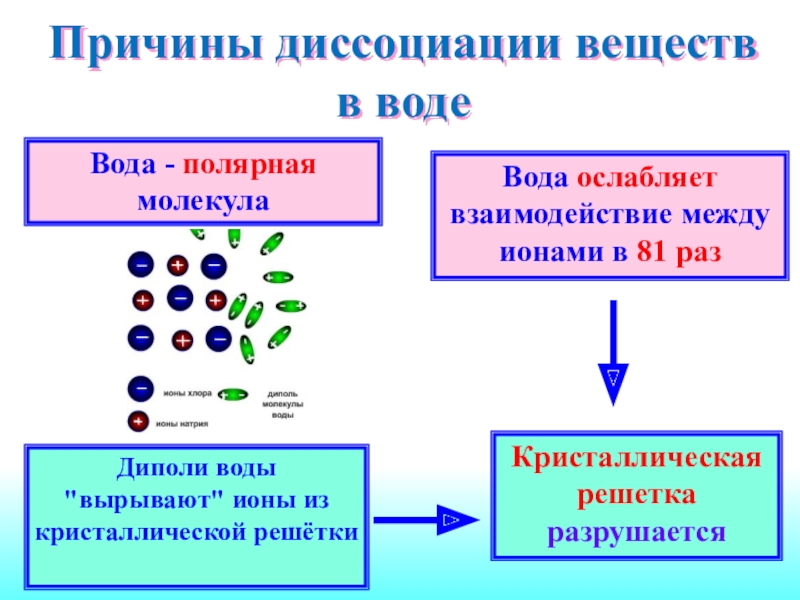
Образуется расплав, состоящий из ионов.Слайд 8Причины диссоциации веществ в воде
Вода - полярная молекула
Вода
ослабляет взаимодействие между ионами в 81 раз
Диполи воды "вырывают" ионы
из кристаллической решёткиКристаллическая решетка разрушается
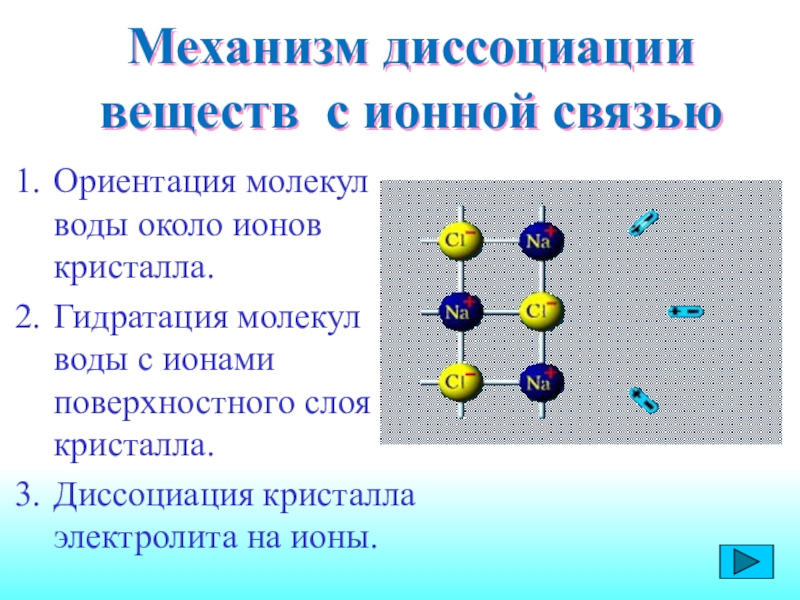
Слайд 9Механизм диссоциации веществ с ионной связью
Ориентация молекул воды около ионов
кристалла.
Гидратация молекул воды с ионами поверхностного слоя кристалла.
Диссоциация кристалла электролита
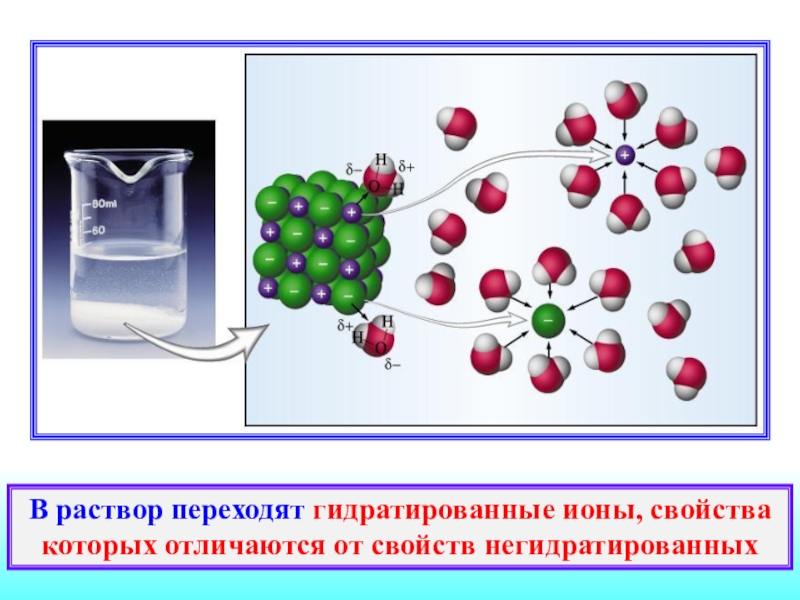
на ионы.Слайд 10В раствор переходят гидратированные ионы, свойства которых отличаются от свойств
негидратированных
Слайд 12Механизм диссоциации веществ с ковалентной полярной связью
Ориентация молекул воды около
полюсов молекул вещества.
Гидратация молекул воды с молекулами вещества.
Ионизация молекул вещества.
Диссоциация
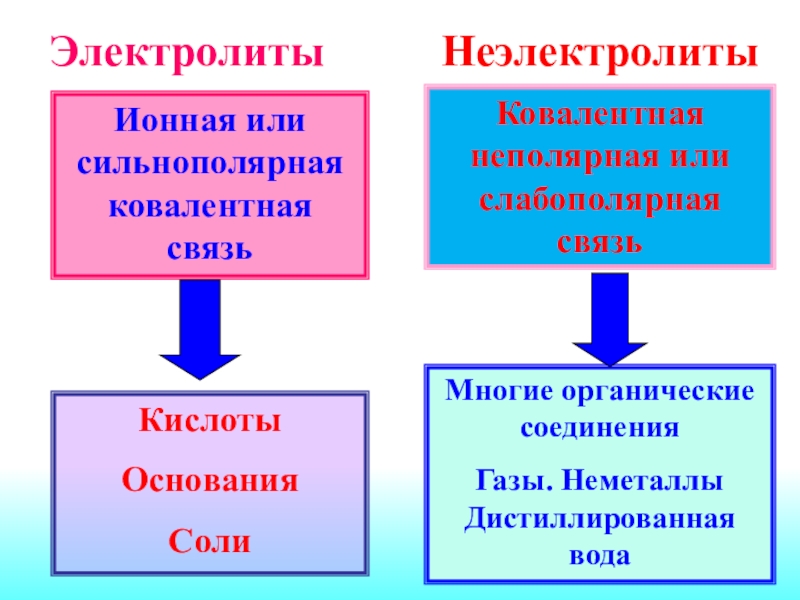
молекул вещества на гидратированные ионыСлайд 13Ионная или сильнополярная ковалентная связь
Кислоты
Основания
Соли
Ковалентная неполярная или слабополярная связь
Многие органические
соединения
Газы. Неметаллы Дистиллированная вода
Электролиты
Неэлектролиты
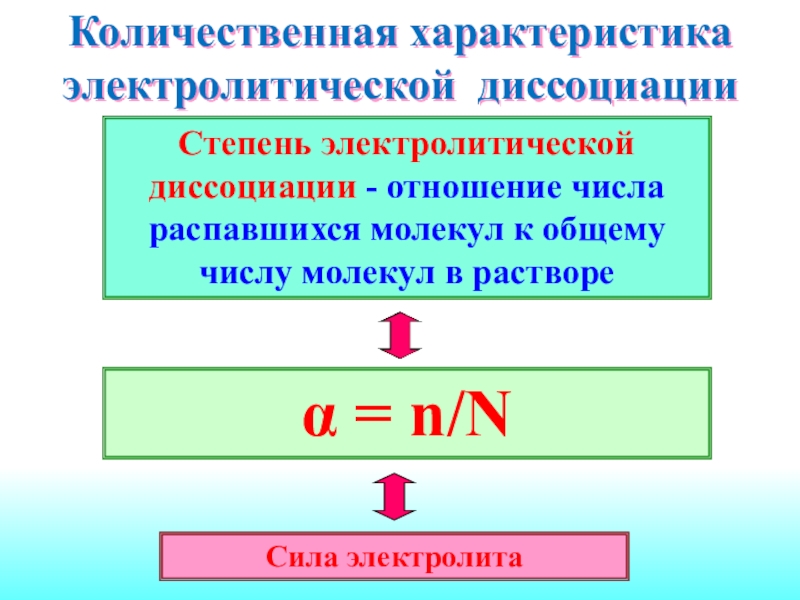
Слайд 17Количественная характеристика электролитической диссоциации
α = n/N
Сила электролита
Степень электролитической диссоциации -
отношение числа распавшихся молекул к общему числу молекул в растворе
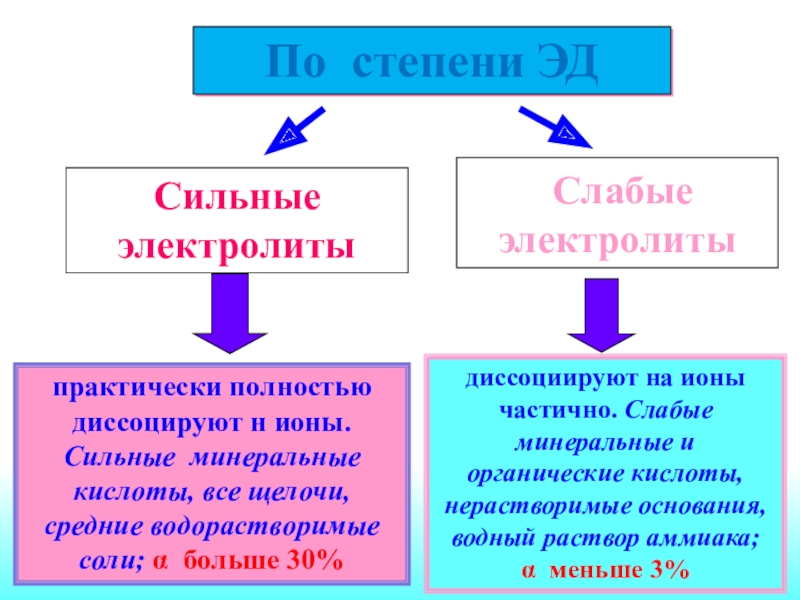
Слайд 18практически полностью диссоцируют н ионы. Сильные минеральные кислоты, все щелочи,
средние водорастворимые соли; α больше 30%
По степени ЭД
Сильные электролиты
Слабые электролитыдиссоциируют на ионы частично. Слабые минеральные и органические кислоты, нерастворимые основания, водный раствор аммиака; α меньше 3%
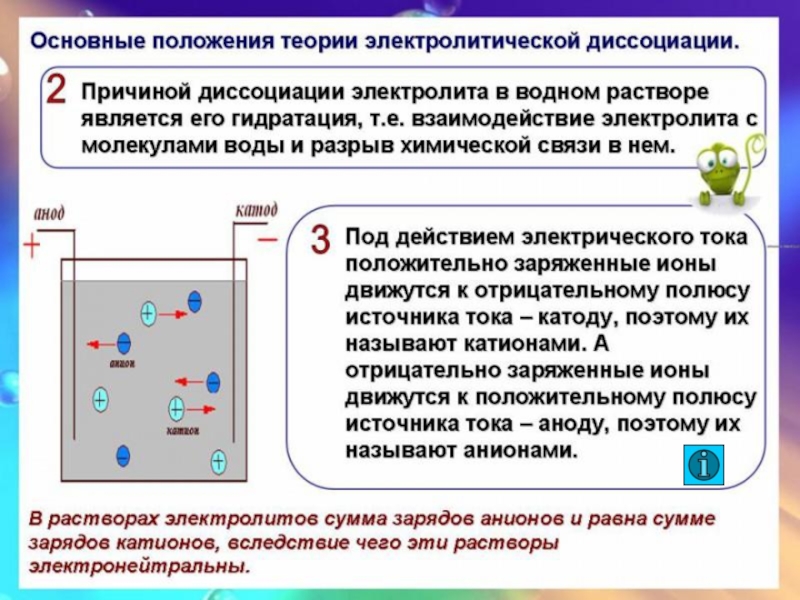
Слайд 19Основные положения ТЭД
Электролитическая диссоциация для слабых электролитов – процесс обратимый.
Обратный процесс – ассоциация.
Не все электролиты в одинаковой мере диссоциируют
на ионы.Химические свойства электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Слайд 24Значение теории электролитической диссоциации
ТЭД позволила объяснить свойства водных растворов электролитов
и объяснила теорию кислот и оснований. Она была широко и
плодотворно применена для объяснения многочисленных физических и химических явлений в расплавах и даже твердых телах.Вместе с законом действующих масс она позволила объяснить все известные практические способы, условия и механизм аналитических реакций (качественный анализ).
Слайд 25Значение теории электролитической диссоциации
Обосновала механизм многих органических реакций и помогла
физиологам в изучении состава и свойств кровяных телец, мембранного равновесия
и окислительно-восстановительного потенциала биологических реакций.Оказала сильное влияние на развитие химического языка и в целом сыграла фундаментальную роль в современном естествознании.
Слайд 26Выводы
ТЭД была предложена в 1887 году шведским ученым Сванте Августом
Аррениусом. Классическая теория электролитический диссоциации применима лишь к разбавленным растворам
слабых электролитов.Современная теория водных растворов электролитов кроме ТЭД Аррениуса включает представления о
гидратации ионов (И.А. Каблуков, В.А. Кистяковский)
и теорию сильных электролитов (П. Й. Дебай, Э.А.
Хюккель).
Легче всего диссоциируют вещества с ионной связью.
Слайд 27Выводы
Степень диссоциации зависит от природы электролита и его концентрации. По
степени диссоциации электролиты делят на сильные и слабые.
По характеру образующихся
ионов различают три типа электролитов: кислоты, основания и соли.С помощью ТЭД дают определения и описывают свойства кислот, оснований и солей.