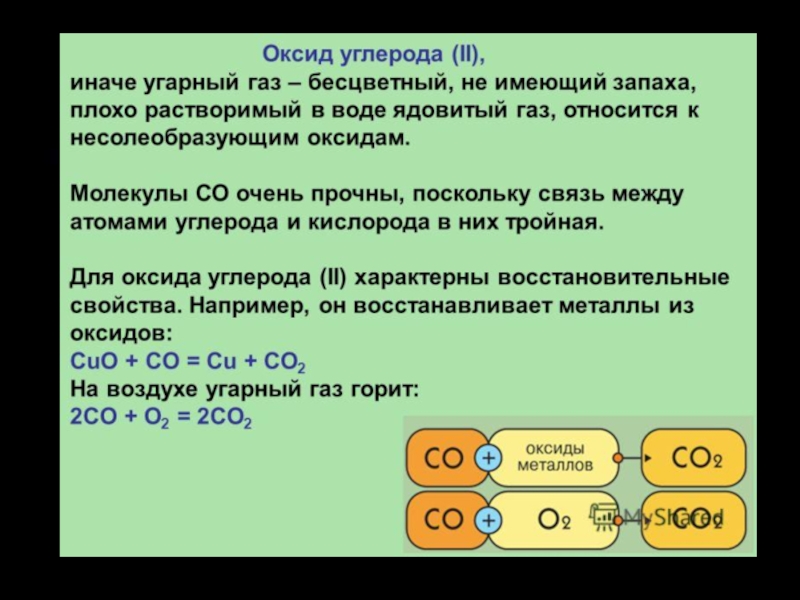
и положение в ПСХЭ.
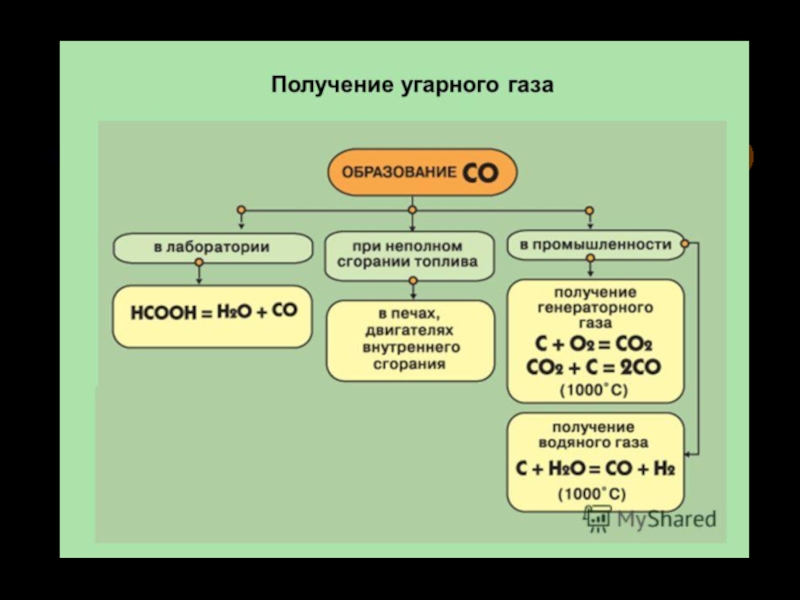
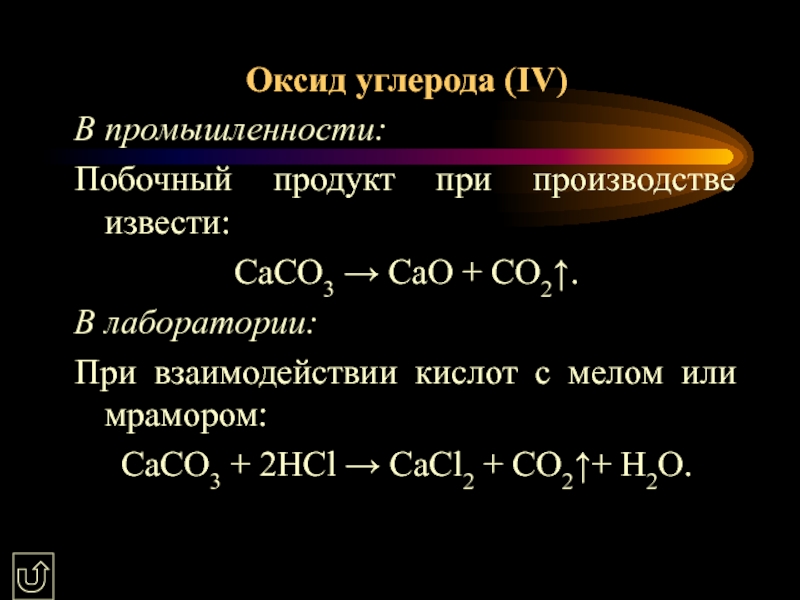
3. Методы получения: лабораторные и промышленные.
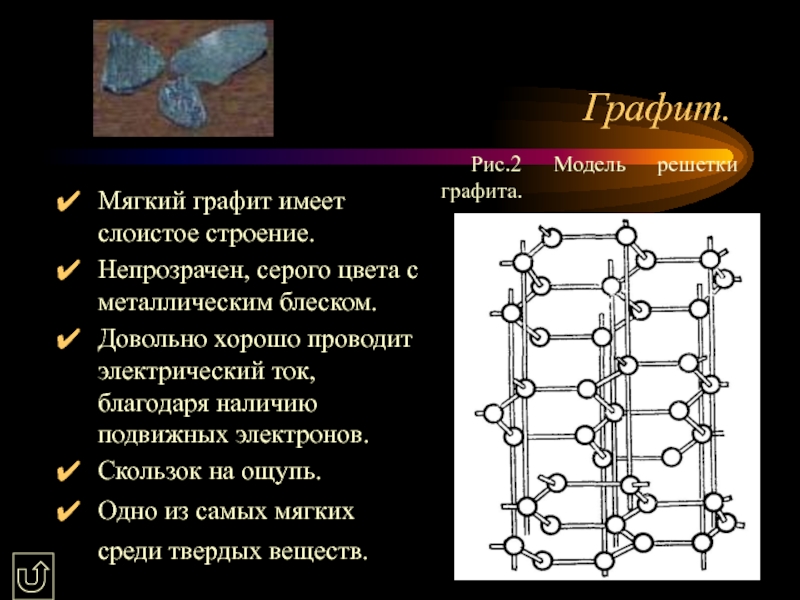
4. Аллотропные
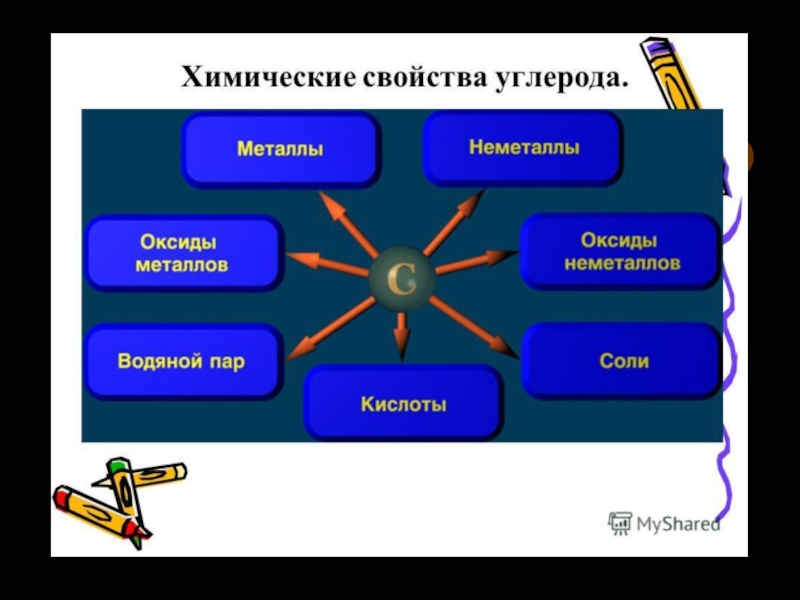
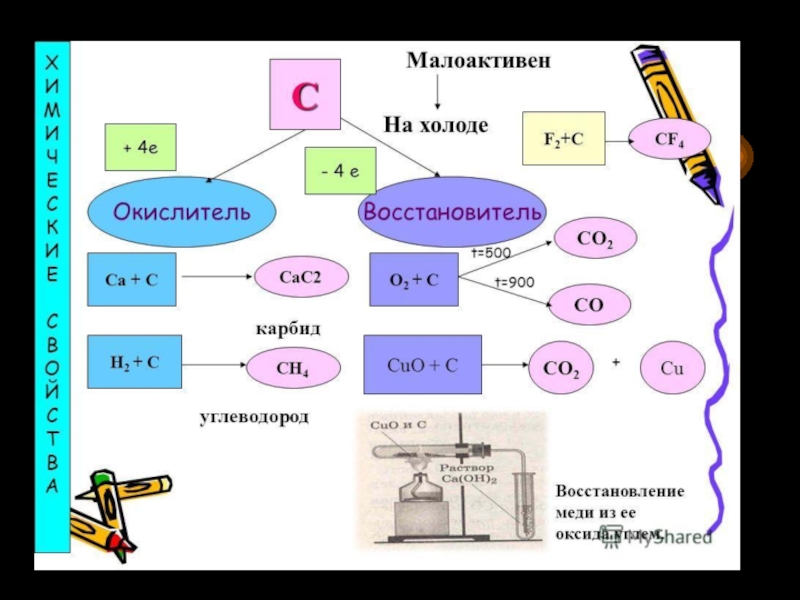
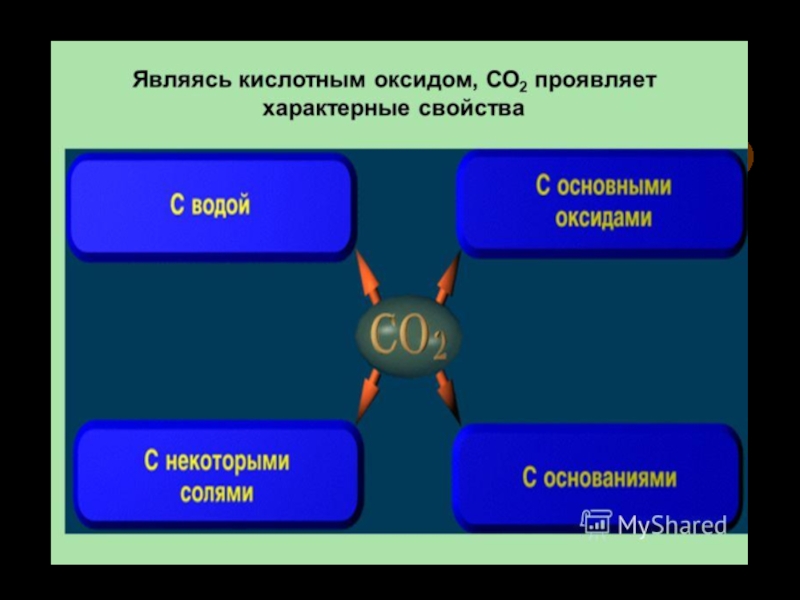
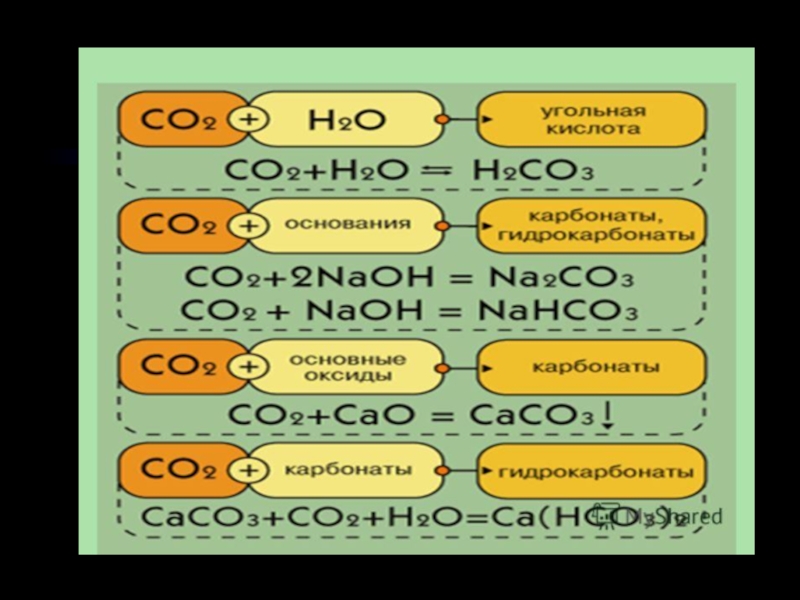
видоизменения углерода.5. Химические свойства. Карбиды.
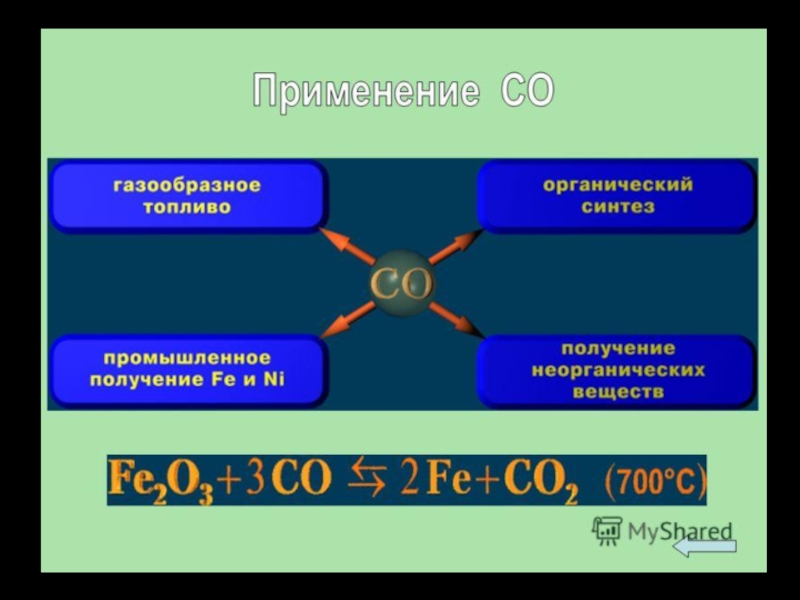
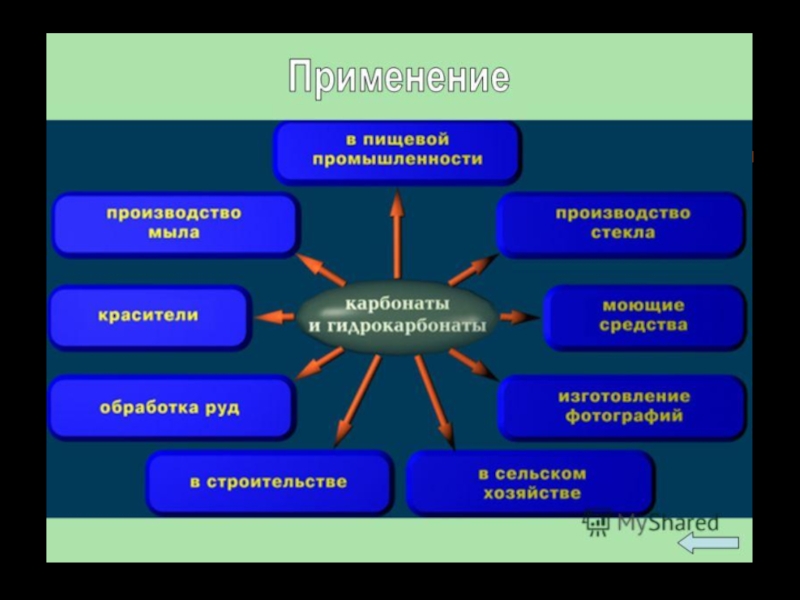
6. Применение. Токсичность.
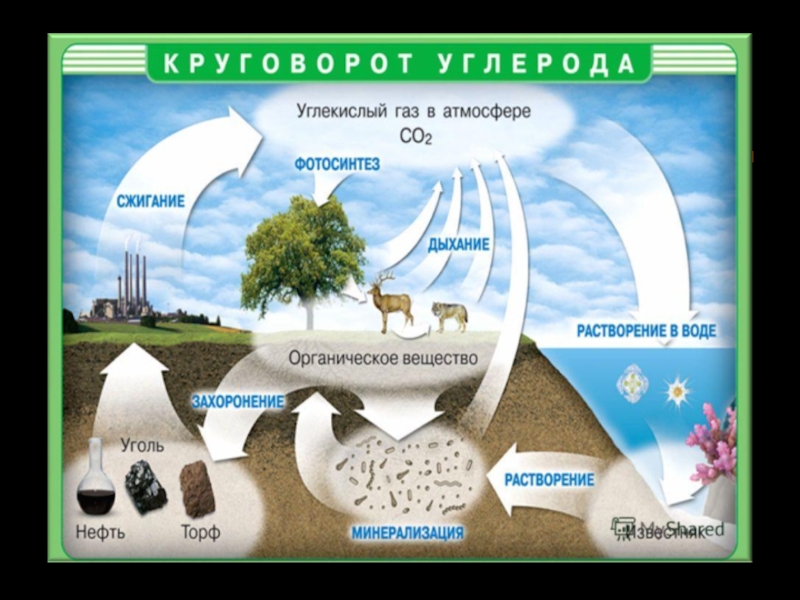
7. Интересное об углероде.