Слайд 1ЭЛЕМЕНТЫ КВАНТОВОЙ БИОФИЗИКИ
КВАНТОВАЯ БИОФИЗИКА РАССМАТРИВАЕТ НА
МОЛЕКУЛЯРНОМ УРОВНЕ ПРОЦЕССЫ, ПРОТЕКАЮЩИЕ
В ЖИВЫХ ОРГАНИЗМАХ
ПРИ ВЗАИМОДЕЙСТВИИ
С ЭЛЕКТРОМАГНИТНЫМ ИЗЛУЧЕНИЕМ.
ЕЕ ЗАКОНОМЕРНОСТИ –
В
ОСНОВЕ СПЕКТРОСКОПИЧЕСКИХ
МЕТОДОВ ИССЛЕДОВАНИЯ.
ТЕОРЕТИЧЕСКАЯ ОСНОВА КВАНТОВОЙ БИОФИЗИКИ -
КВАНТОВАЯ МЕХАНИКА,
НАУКА О ДВИЖЕНИИ МИКРОЧАСТИЦ.
Слайд 2Квантовая механика
НАЧАЛО КВАНТОВОЙ МЕХАНИКИ -
ИДЕЯ ПЛАНКА (1900 Г.)
О
ПРЕРЫВИСТОСТИ
ИЗЛУЧЕНИЯ И
РАСПРОСТРАНЕНИЯ СВЕТА.
РАЗВИТИЕ ЭТОЙ ИДЕИ -
ПОСТУЛАТЫ БОРА,
ФУНДАМЕНТ СОВРЕМЕННОЙ КВАНТОВОЙ МЕХАНИКИ.
Слайд 3Первая лекция раздела
Лекция
ИЗЛУЧЕНИЕ И
ПОГЛОЩЕНИЕ
СВЕТА
АТОМАМИ И
МОЛЕКУЛАМИ
1. КВАНТОВАНИЕ ЭНЕРГИИ.
2. ЭНЕРГЕТИЧЕСКИЕ УРОВНИ АТОМА.
КВАНТОВЫЕ ЧИСЛА.
3. СИСТЕМА ЭНЕРГЕТИЧЕС-
КИХ УРОВНЕЙ И
ПОДУРОВНЕЙ МОЛЕКУЛЫ.
4. ВИДЫ СТАЦИОНАРНЫХ СОСТОЯНИЙ.
5. СПОСОБЫ РАСХОДОВА-НИЯ МОЛЕКУЛОЙ
ЭНЕРГИИ ВОЗБУЖДЕНИЯ.
6. СПЕКТРЫ ПОГЛОЩЕНИЯ
И ЛЮМИНЕСЦЕНЦИИ.
Слайд 41. КВАНТОВАНИЕ ЭНЕРГИИ
ВНУТРЕННЯЯ ЭНЕРГИЯ АТОМА И МОЛЕКУЛЫ
ДИСКРЕТНА, ИЛИ
КВАНТУЕТСЯ:
ОНА МОЖЕТ ПРИНИМАТЬ
ЛИШЬ ОПРЕДЕЛЕННЫЕ ЗНАЧЕНИЯ,
ИЛИ УРОВНИ.
Е2 _____________ *
Е1
______________ *
Е0 ____________осн
ЭНЕРГЕТИЧЕСКИЙ УРОВЕНЬ С НАИМЕНЬШЕЙ ЭНЕРГИЕЙ - ОСНОВНОЙ.
ОСТАЛЬНЫЕ - ВОЗБУЖДЕННЫЕ.
Слайд 5Постулаты Бора
КАЖДОМУ ЭНЕРГЕТИЧЕСКОМУ УРОВНЮ
СООТВЕТСТВУЕТ ОПРЕДЕЛЕННОЕ
СТАЦИОНАРНОЕ
СОСТОЯНИЕ ЧАСТИЦЫ.
В СТАЦИОНАРНОМ СОСТОЯНИИ ЧАСТИЦЫ
ЕЕ ЭНЕРГИЯ НЕ МЕНЯЕТСЯ.
║
ПЕРВЫЙ ПОСТУЛАТ БОРА.
ПРИ ПЕРЕХОДЕ ИЗ
ОДНОГО СТАЦИОНАРНОГО СОСТОЯНИЯ В ДРУГОЕ
(В СИСТЕМЕ
ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ)
ЭНЕРГИЯ ЧАСТИЦЫ ИЗМЕНЯЕТСЯ
НА СТРОГО ОПРЕДЕЛЕННУЮ ВЕЛИЧИНУ -
КВАНТ:
Слайд 6Постулаты Бора
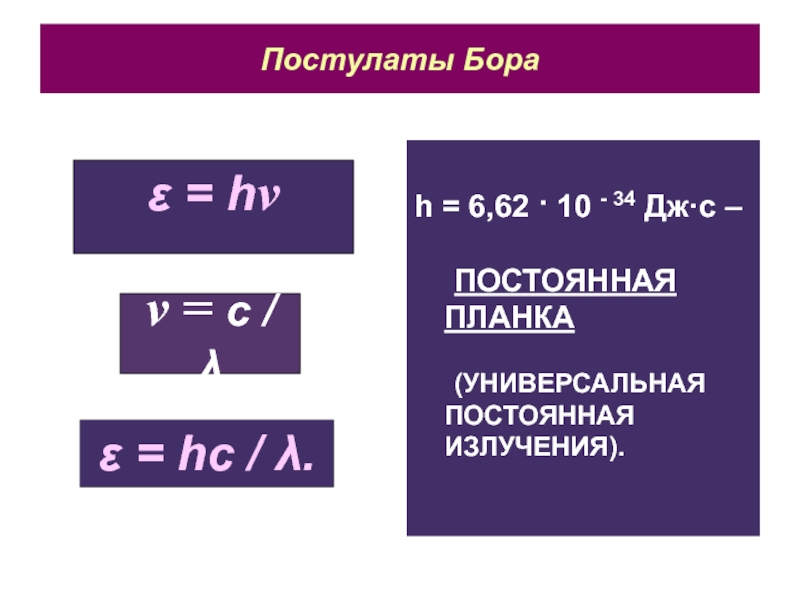
h = 6,62 · 10 - 34 Дж·с –
ПОСТОЯННАЯ
ПЛАНКА
(УНИВЕРСАЛЬНАЯ ПОСТОЯННАЯ ИЗЛУЧЕНИЯ).
ε = hν
ν = с / λ
ε
= hс / λ.
Слайд 7Постулаты Бора
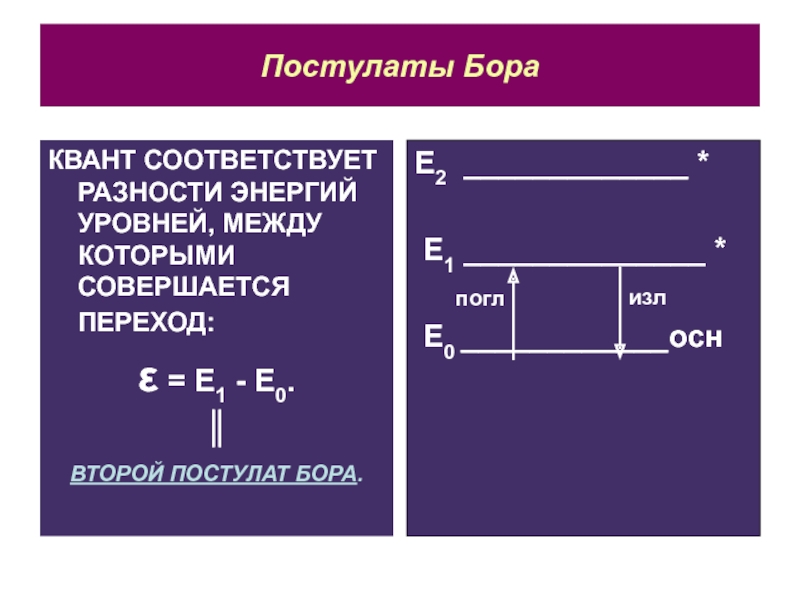
КВАНТ СООТВЕТСТВУЕТ РАЗНОСТИ ЭНЕРГИЙ УРОВНЕЙ, МЕЖДУ КОТОРЫМИ СОВЕРШАЕТСЯ ПЕРЕХОД:
ε = Е1 - Е0.
║
ВТОРОЙ ПОСТУЛАТ БОРА.
Е2 _____________
*
Е1 ______________ *
Е0 ____________осн
погл
изл
Слайд 82. ЭНЕРГЕТИЧЕСКИЕ УРОВНИ АТОМА.
КВАНТОВЫЕ ЧИСЛА
Энергетическое состояние атома
определяется состоянием его
электронов.
ЭЛЕКТРОН - ДВИЖУЩАЯСЯ ЗАРЯЖЕННАЯ ЧАСТИЦА
ЧЕТЫРЕ ВЕЛИЧИНЫ:
ДВА МЕХАНИЧЕСКИХ МОМЕНТА ИМПУЛЬСА,
ДВА МАГНИТНЫХ
МОМЕНТА.
ОРБИТАЛЬНЫЙ МОМЕНТ ИМПУЛЬСА
и
ОРБИТАЛЬНЫЙ МАГНИТНЫЙ МОМЕНТ
ОБУСЛОВЛЕНЫ ВРАЩЕНИЕМ ЭЛЕКТРОНА ВОКРУГ ЯДРА.
Слайд 9Квантовые числа
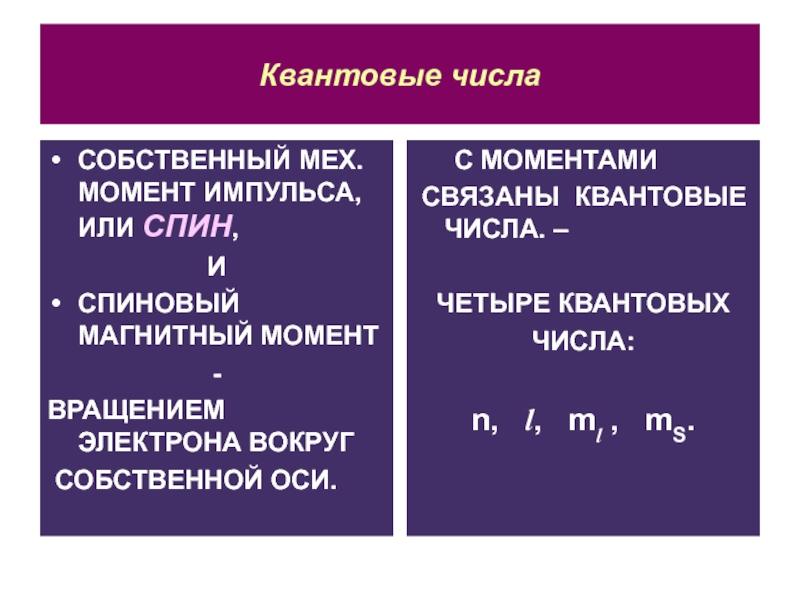
СОБСТВЕННЫЙ МЕХ. МОМЕНТ ИМПУЛЬСА, ИЛИ СПИН,
И
СПИНОВЫЙ МАГНИТНЫЙ
МОМЕНТ
-
ВРАЩЕНИЕМ ЭЛЕКТРОНА ВОКРУГ
СОБСТВЕННОЙ ОСИ.
С МОМЕНТАМИ
СВЯЗАНЫ КВАНТОВЫЕ ЧИСЛА. –
ЧЕТЫРЕ
КВАНТОВЫХ
ЧИСЛА:
n, l, ml , mS.
Слайд 10Главное квантовое число
n - главное
квантовое число.
n = 1, 2,
3, ...
(числа натурального ряда)
Характеризует местонахождение электрона в атоме,
его удаленность от
ядра.
В модели
РЕЗЕРФОРДА-БОРА
определяет радиусы круговых орбит
вращения электронов вокруг ядра.
+
.
.
-
-
ядро
Слайд 11Условие квантования
Радиусы орбит
должны удовлетворять
УСЛОВИЮ КВАНТОВАНИЯ:
m νn rn = n·h
/ 2 = n h.
ОРБИТАЛЬНЫЙ МОМЕНТ ИМПУЛЬСА ЭЛЕКТРОНА
КРАТЕН ПОСТОЯННОЙ
ПЛАНКА h.
m – масса электрона,
Vn – скорость его на данной орбите,
rn- радиус орбиты.
ЧЕМ БОЛЬШЕ n,
ТЕМ ДАЛЬШЕ ОТ ЯДРА ОРБИТА,
БОЛЬШЕ СКОРОСТЬ И ЭНЕРГИЯ ЭЛЕКТРОНА НА ЭТОЙ ОРБИТЕ
И ЭНЕРГИЯ АТОМА В ЦЕЛОМ.
Слайд 12Современная коррекция
БОРОВСКАЯ МОДЕЛЬ
АТОМА –
УДОБНОЕ ПРИБЛИЖЕНИЕ.
НЕВОЗМОЖНО ТОЧНО
УКАЗАТЬ
ОДНОВРЕМЕННО ЭНЕРГИЮ
ЭЛЕКТРОНА
И ЕГО МЕСТОНАХОЖДЕНИЕ.
ЭЛЕКТРОННАЯ ОРБИТА –
НАИБОЛЕЕ ВЕРОЯТНАЯ ОБЛАСТЬ ЛОКАЛИЗАЦИИ
ЭЛЕКТРОНА В АТОМЕ.
СОВОКУПНОСТЬ ВСЕХ ЭЛЕКТРОНОВ С ОДИНАКО-ВЫМ КВАНТОВЫМ ЧИСЛОМ «n» -
ЭЛЕКТРОННЫЙ СЛОЙ.
ИЗМЕНЕНИЕ «n» –
ПЕРЕХОД ИЗ ОДНОГО ЭЛЕКТРОННОГО СЛОЯ В ДРУГОЙ.
Слайд 13Орбитальное квантовое число
l - орбитальное
квантовое число.
l = 0, 1,
2, …, n-1
(целые числа от «0» по «n-1»)
В рамках Боровской
модели характеризует ФОРМУ электронной орбиты.
Слайд 14Магнитное квантовое число
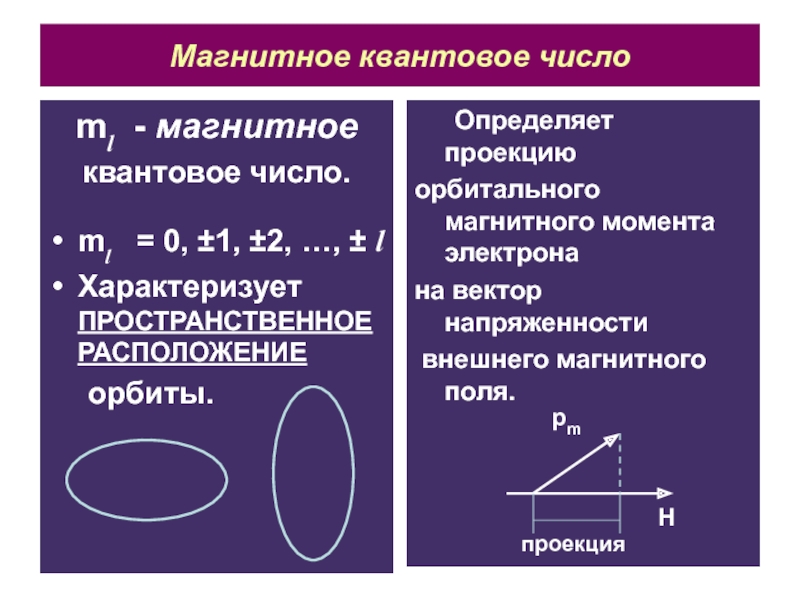
ml - магнитное
квантовое число.
ml = 0, ±1,
±2, …, ± l
Характеризует ПРОСТРАНСТВЕННОЕ РАСПОЛОЖЕНИЕ
орбиты.
Определяет проекцию
орбитального магнитного момента
электрона
на вектор напряженности
внешнего магнитного поля.
pm
H
проекция
Слайд 15Спиновое число
ms – спиновое число.
ms = ± 1/2
Определяет проекцию СПИНОВОГО
магнитного момента электрона
на вектор
напряженности внешнего магнитного поля.
ПРИ ИЗМЕНЕНИИ
ЛЮБОГО
ИЗ ЧЕТЫРЕХ КВАНТОВЫХ ЧИСЕЛ
МЕНЯЕТСЯ
ЭНЕРГЕТИЧЕСКОЕ СОСТОЯНИЕ
КАК ЭЛЕКТРОНА, ТАК И АТОМА В ЦЕЛОМ.
Система энергетических уровней (электронных)
атома
Слайд 163. СИСТЕМА
ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ
И ПОДУРОВНЕЙ МОЛЕКУЛЫ
Внутренняя энергия молекулы включает
следующие составляющие:
А) ЭНЕРГИЯ ДВИЖЕНИЯ ЭЛЕКТРОНОВ
В АТОМАХ;
Б) ЭНЕРГИЯ КОЛЕБАТЕЛЬНОГО
ДВИЖЕНИЯ АТОМОВ В
МОЛЕКУЛЕ;
В) ЭНЕРГИЯ ВРАЩАТЕЛЬНОГО
ДВИЖЕНИЯ
САМОЙ МОЛЕКУЛЫ
КАК ЦЕЛОГО.
EM = EЭЛ + ЕКОЛ + ЕВР
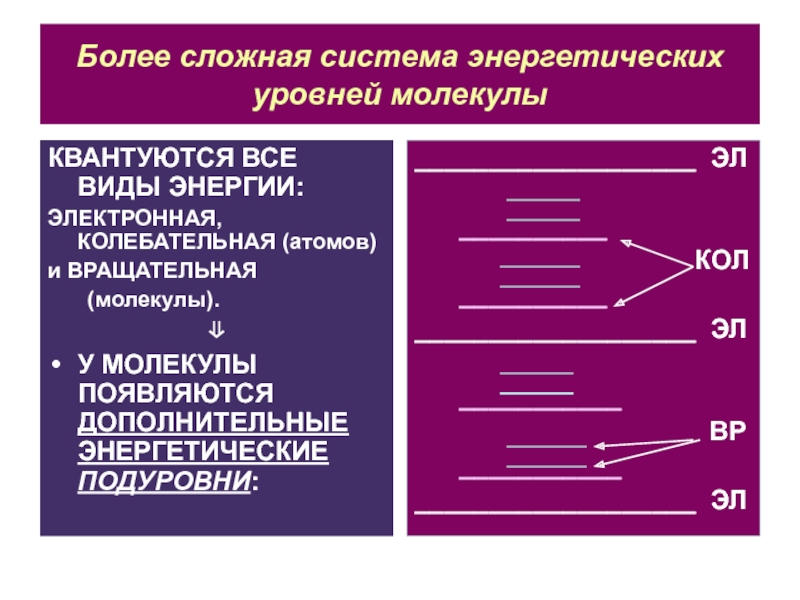
Слайд 17Более сложная система энергетических уровней молекулы
КВАНТУЮТСЯ ВСЕ ВИДЫ ЭНЕРГИИ:
ЭЛЕКТРОННАЯ, КОЛЕБАТЕЛЬНАЯ
(атомов)
и ВРАЩАТЕЛЬНАЯ
(молекулы).
У МОЛЕКУЛЫ ПОЯВЛЯЮТСЯ ДОПОЛНИТЕЛЬНЫЕ ЭНЕРГЕТИЧЕСКИЕ ПОДУРОВНИ:
___________________ ЭЛ
__________
КОЛ
__________
___________________ ЭЛ
___________
ВР
___________
___________________ ЭЛ
Слайд 18Величина квантов
КВАНТЫ УМЕНЬШАЮТСЯ
В РЯДУ
ЕЭЛ ЕКОЛ
ЕВР.
ПОЭТОМУ
РАДИОВОЛНЫ СВЧ-ДИАПАЗОНА И
ДАЛЬНИЙ ИК-СВЕТ
ВОЗБУЖДАЮТ ЛИШЬ ПЕРЕХОДЫ МЕЖДУ
ВРАЩАТЕЛЬНЫМИ УРОВНЯМИ.
БЛИЗКИЙ ИК-СВЕТ -
ПЕРЕХОДЫ МЕЖДУ КОЛЕБАТЕЛЬНЫМИ И ВРАЩАТЕЛЬНЫМИ
УРОВНЯМИ.
В ОБЛАСТИ ВИДИМОГО И УФ-СВЕТА -
ВСЕ ТРИ ВИДА ПЕРЕХОДОВ
(МЕЖДУ
ЭЛЕКТРОННЫМИ, КОЛЕБАТЕЛЬНЫМИ
И ВРАЩАТЕЛЬНЫМИ УРОВНЯМИ).
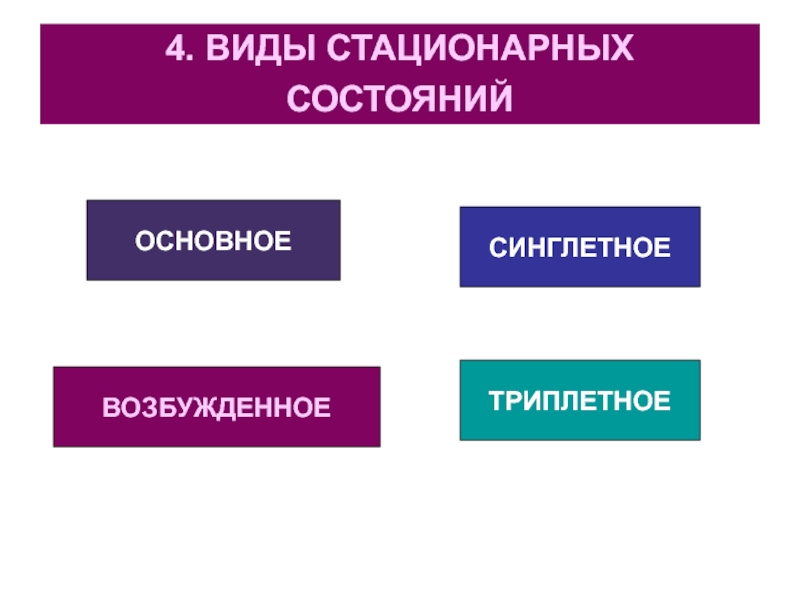
Слайд 194. ВИДЫ СТАЦИОНАРНЫХ СОСТОЯНИЙ
ОСНОВНОЕ
ВОЗБУЖДЕННОЕ
СИНГЛЕТНОЕ
ТРИПЛЕТНОЕ
Слайд 20Синглетное и триплетное состояния
ЧАСТИЦА
В ОСНОВНОМ СОСТОЯНИИ, ЕСЛИ ОНА
НЕ
ПОДВЕРГАЕТСЯ ВНЕШНИМ ВОЗДЕЙСТВИЯМ.
ЧАСТИЦА ПЕРЕХОДИТ
В ВОЗБУЖДЕННОЕ СОСТОЯНИЕ
ПРИ СООБЩЕНИИ ЕЙ
ПОРЦИИ ЭНЕРГИИ.
СИНГЛЕТНОЕ (S) СОСТОЯНИЕ:
ВСЕ ЭЛЕКТРОНЫ СПАРЕНЫ -
ИМЕЮТ ПОПАРНО АНТИПАРАЛЛЕЛЬНЫЕ
СПИНЫ.
ТРИПЛЕТНОЕ (T) СОСТОЯНИЕ:
ИМЕЕТСЯ ДВА
НЕСПАРЕННЫХ ЭЛЕКТРОНА
- С ПАРАЛЛЕЛЬНЫМИ И ОДНОНАПРАВЛЕННЫМИ СПИНАМИ.
Слайд 21ОСНОВНОЕ СОСТОЯНИЕ БОЛЬШИНСТВА ОРГАНИЧЕСКИХ МОЛЕКУЛ - СИНГЛЕТНОЕ.
ПРИ ВОЗБУЖДЕНИИ - ПЕРЕХОД
ТАКЖЕ НА СИНГЛЕТНЫЙ ВОЗБУЖДЕННЫЙ УРОВЕНЬ.
ЗАСЕЛЕНИЕ ТРИПЛЕТНОГО ВОЗБУЖДЕННОГО УРОВНЯ - ПУТЕМ
РАСТРАТЫ ЧАСТИ ЭНЕРГИИ СИНГЛЕТНОГО ВОЗБУЖДЕННОГО В ТЕПЛО.
Т-УРОВЕНЬ ВСЕГДА НИЖЕ СООТВЕТСТВУ-ЮЩЕГО S-УРОВНЯ.
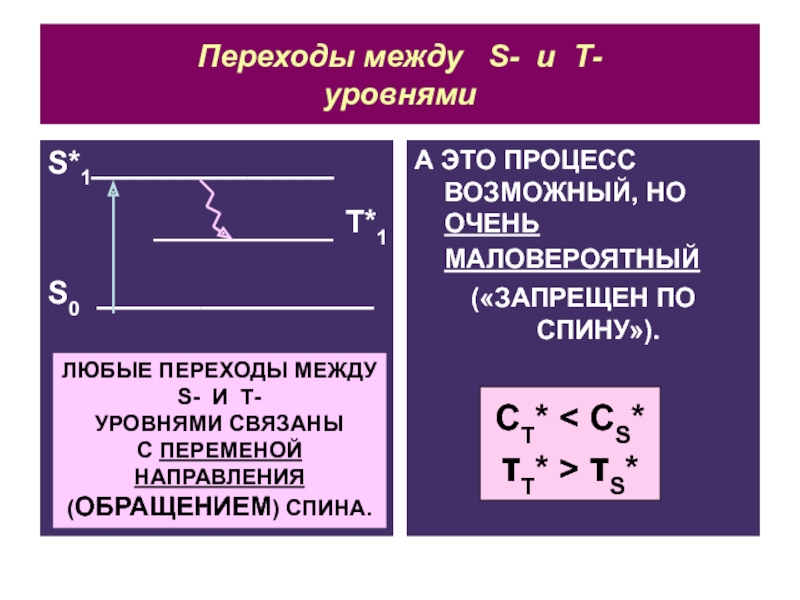
Слайд 22Переходы между S- и Т-
уровнями
S*1______________
S0 ________________
А ЭТО
ПРОЦЕСС ВОЗМОЖНЫЙ, НО ОЧЕНЬ МАЛОВЕРОЯТНЫЙ
(«ЗАПРЕЩЕН ПО СПИНУ»).
T*1
ЛЮБЫЕ ПЕРЕХОДЫ МЕЖДУ
S- И Т-
УРОВНЯМИ СВЯЗАНЫ
С ПЕРЕМЕНОЙ НАПРАВЛЕНИЯ
(ОБРАЩЕНИЕМ) СПИНА.
CT < CS
T > S
Слайд 235. СПОСОБЫ РАСХОДОВАНИЯ МОЛЕКУЛОЙ
ЭНЕРГИИ ВОЗБУЖДЕНИЯ
Молекула в возбужден-
ном состоянии
неустойчива.
Она стремится растратить энергию возбуждения и перейти на нижний энергетический
уровень.
ПЕРЕХОДЫ
С ВЕРХНИХ УРОВНЕЙ НА НИЖНИЕ -
ИЗЛУЧАТЕЛЬНЫЕ
(растрата энергии
в виде электромаг-нитного излучения)
И
БЕЗИЗЛУЧАТЕЛЬНЫЕ
(растрата энергии другими способами).
Слайд 24Способы БЕЗИЗЛУЧАТЕЛЬНОГО перехода
А) РАСТРАТА ЭНЕРГИИ В ВИДЕ ТЕПЛА:
А А0
+ тепло.
Именно так растрачивается энергия высших возбужденных уровней,
а также избыток
энергии при переходе из S в T - состояние.
Б) ВСТУПЛЕНИЕ ВОЗБУЖДЕННОЙ
МОЛЕКУЛЫ В ХИМИ- ЧЕСКУЮ РЕАКЦИЮ:
А продукты
В) ПЕРЕДАЧА ЭНЕРГИИ ВОЗБУЖДЕНИЯ ОКРУЖАЮЩИМ МОЛЕКУЛАМ:
А + Вo Аo + В
Слайд 25ИЗЛУЧАТЕЛЬНЫЙ переход
С ВЫСВЕЧИВАНИЕМ
КВАНТОВ ИЗЛУЧЕНИЯ -
ЛЮМИНЕСЦЕНЦИИ:
А А0 + hν.
ВИДЫ
ЛЮМИНЕСЦЕНЦИИ:
СПОНТАННАЯ ИЛИ ИНДУЦИРОВАННАЯ;
ФОТО-, ЭЛЕКТРО-, ХЕМИ-, …
ФЛУОРЕСЦЕНЦИЯ ИЛИ ФОСФОРЕСЦЕНЦИЯ
КЛАССИФИКАЦИЯ –
ПО РАЗНЫМ
ПРИЗНАКАМ:
БЕЗ ВНЕШНЕГО ВОЗДЕЙ-СТВИЯ НА УЖЕ ВОЗБУЖ-ДЕННУЮ ЧАСТИЦУ ИЛИ С ТАКОВЫМ;
ПО СПОСОБУ ПРЕДВАРИ-ТЕЛЬНОГО ВОЗБУЖДЕНИЯ МОЛЕКУЛЫ;
ПО МЕХАНИЗМУ ИЗЛУЧЕНИЯ.
Слайд 26Определения
СПОНТАННАЯ – самопроизвольная;
ИНДУЦИРОВАННАЯ, ВЫНУЖДЕННАЯ –
при воздействии на уже возбужденную частицу
нового фотона
(лежит в основе устройства лазеров).
После перевода молекулы в возбужденное
состояние светом – ФОТО-;
электрическим полем – ЭЛЕКТРО-;
за счет энергии экзергонической химической реакции –
ХЕМИ- .
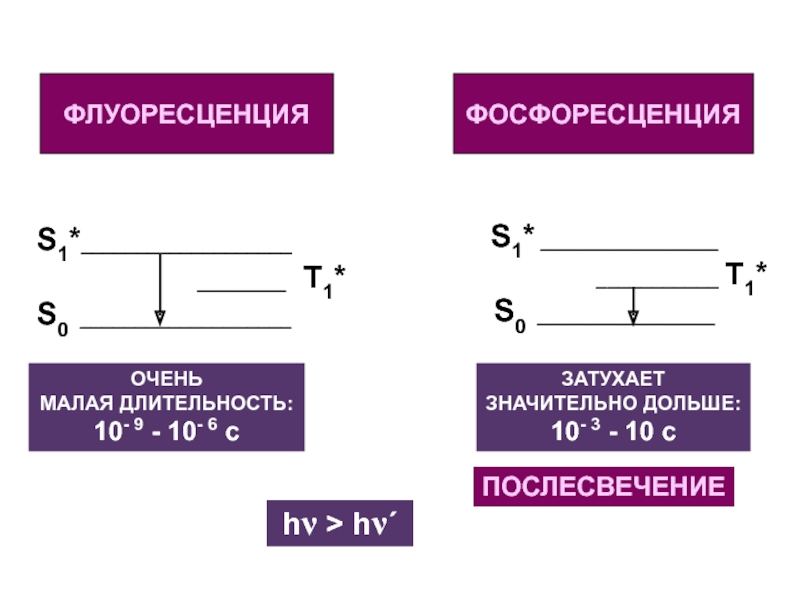
Слайд 27Флуоресценция и фосфоресценция
ФЛУОРЕСЦЕНЦИЯ -
испускание фотона
при переходе
С ПЕРВОГО СИНГЛЕТНОГО
ВОЗБУЖДЕННОГО УРОВНЯ
НА ОСНОВНОЙ:
S1 S0 + hν
(КВАНТ
ФЛУОРЕСЦЕНЦИИ)
ФОСФОРЕСЦЕНЦИЯ –
испускание фотона
при переходе
С ПЕРВОГО ТРИПЛЕТНОГО
ВОЗБУЖДЕННОГО УРОВНЯ
НА ОСНОВНОЙ:
Т1 S0 + hν΄
(КВАНТ
ФОСФОРЕСЦЕНЦИИ)
Слайд 28ФЛУОРЕСЦЕНЦИЯ
ФОСФОРЕСЦЕНЦИЯ
S1*___________________
________ T1*
S0 ___________________
S1* ________________
___________ T1*
S0 ________________
ОЧЕНЬ
МАЛАЯ ДЛИТЕЛЬНОСТЬ:
10- 9 - 10- 6 c
ЗАТУХАЕТ
ЗНАЧИТЕЛЬНО ДОЛЬШЕ:
10- 3 - 10 c
ПОСЛЕСВЕЧЕНИЕ
hν > hν΄
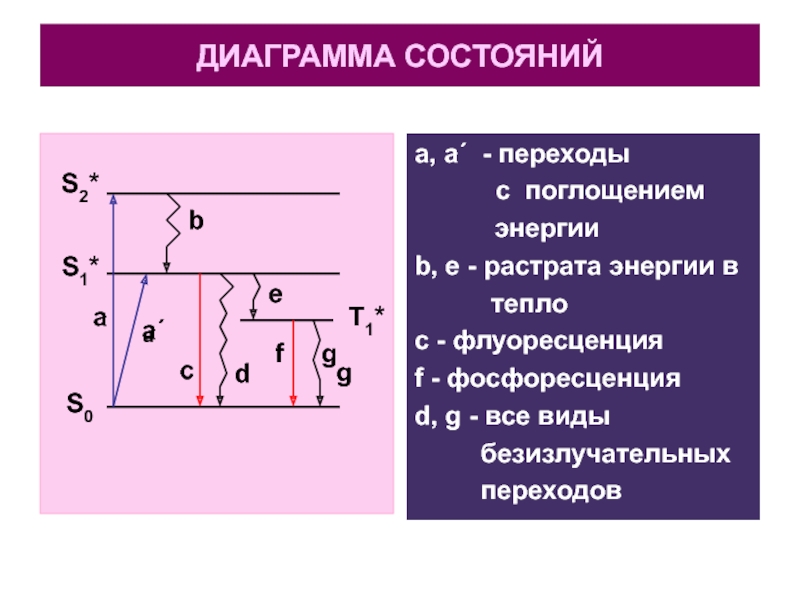
Слайд 29ДИАГРАММА СОСТОЯНИЙ
ЭТО
СХЕМА, НА КОТОРОЙ ПРЕДСТАВЛЕНЫ
ОСНОВНЫЕ ТИПЫ ПЕРЕХОДОВ
МЕЖДУ ЭНЕРГЕТИЧЕСКИМИ УРОВНЯМИ.
НА СХЕМЕ
ПРЯМЫЕ СТРЕЛКИ –
ИЗЛУЧАТЕЛЬНЫЕ ПЕРЕХОДЫ,
ВОЛНИСТЫЕ (ЗИГЗАГООБРАЗНЫЕ)
–
БЕЗИЗЛУЧАТЕЛЬНЫЕ ПЕРЕХОДЫ.
Слайд 30ДИАГРАММА СОСТОЯНИЙ
a, a΄ - переходы
с поглощением
энергии
b, e - растрата энергии в
тепло
с - флуоресценция
f - фосфоресценция
d, g - все виды
безизлучательных
переходов
S2*
S1*
S0
T1*
a
a
a΄
b
c
d
e
f
g
g
Слайд 316. СПЕКТРЫ ПОГЛОЩЕНИЯ
И ЛЮМИНЕСЦЕНЦИИ
У КАЖДОГО ВЕЩЕСТВА –
ХАРАКТЕРНАЯ СИСТЕМА ЭНЕРГЕТИЧЕСКИХ
УРОВНЕЙ.
ИЗЛУЧЕНИЯ РАЗНЫХ ДЛИН ВОЛН
ИСПУСКАЮТСЯ И ПОГЛОЩА-
ЮТСЯ
ПО-РАЗНОМУ.
СПЕКТРАЛЬНЫЙ СОСТАВ
ИСПУСКАЕМОГО И
ПОГЛОЩАЕМОГО ИЗЛУЧЕНИЯ –
ВАЖНЕЙШАЯ ХАРАКТЕРИ-СТИКА ВЕЩЕСТВА.
СПЕКТР ПОГЛОЩЕНИЯ –
ГРАФИК ЗАВИСИМОСТИ ОПТИЧЕСКОЙ ПЛОТНОСТИ ОБРАЗЦА
ОТ ДЛИНЫ ВОЛНЫ ПАДАЮЩЕГО СВЕТА:
D = f ().
СПЕКТР ЛЮМИНЕСЦЕНЦИИ -
ГРАФИК ЗАВИСИМОСТИ ИНТЕНСИВНОСТИ ЛЮМИНЕСЦЕНЦИИ
ОТ ДЛИНЫ ВОЛНЫ ЛЮМИНЕСЦЕНЦИИ:
IЛ = f (Л).
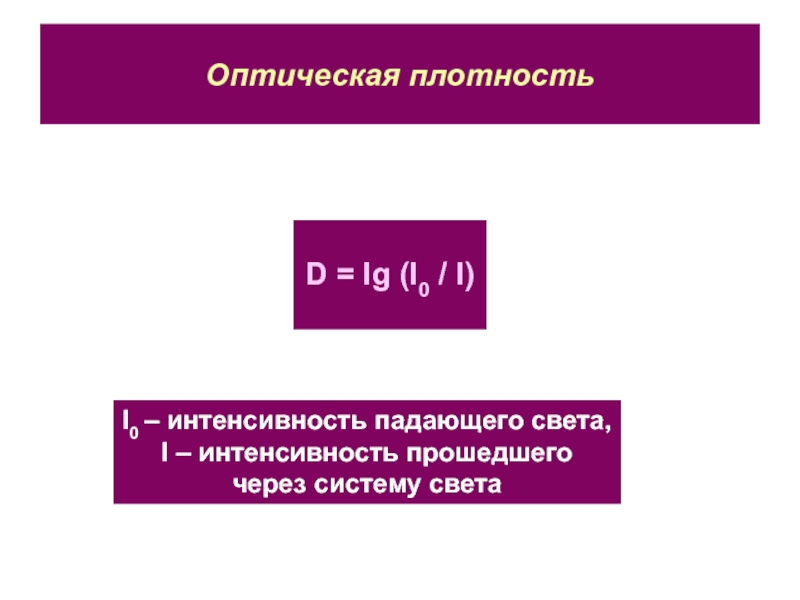
Слайд 32Оптическая плотность
D = lg (I0 / I)
I0 – интенсивность падающего
света,
I – интенсивность прошедшего
через систему света
Слайд 33ПРАВИЛО СТОКСА
Так как часть энергии
высших возбужденных
уровней растрачивается в виде тепла,
ЭНЕРГИЯ
КВАНТОВ ЛЮМИНЕСЦЕНЦИИ
МЕНЬШЕ ЭНЕРГИИ ПОГЛОЩЕННЫХ
КВАНТОВ.
(ε =
hс/λ)
ДЛИНА ВОЛНЫ ЛЮМИНЕСЦЕНЦИИ
БОЛЬШЕ ДЛИНЫ ВОЛНЫ
ПОГЛОЩЕННОГО ИЗЛУЧЕНИЯ.
ПОЭТОМУ
ДЛЯ СПОНТАННОЙ ЛЮМИНЕСЦЕНЦИИ
СПРАВЕДЛИВО ПРАВИЛО СТОКСА:
«СПЕКТРЫ
ЛЮМИНЕСЦЕНЦИИ
СДВИНУТЫ В СТОРОНУ БОЛЬШИХ ДЛИН ВОЛН
ОТНОСИТЕЛЬНО
СПЕКТРА ПОГЛОЩЕНИЯ
ТОГО ЖЕ ВЕЩЕСТВА».
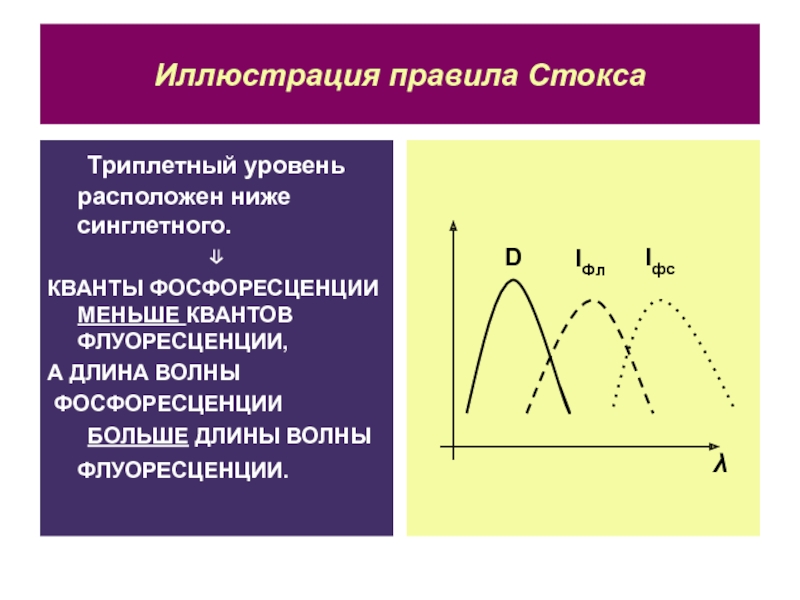
Слайд 34Иллюстрация правила Стокса
Триплетный уровень расположен ниже синглетного.
КВАНТЫ ФОСФОРЕСЦЕНЦИИ МЕНЬШЕ КВАНТОВ
ФЛУОРЕСЦЕНЦИИ,
А ДЛИНА ВОЛНЫ
ФОСФОРЕСЦЕНЦИИ
БОЛЬШЕ ДЛИНЫ ВОЛНЫ ФЛУОРЕСЦЕНЦИИ.
λ
D
IФл
Iфс