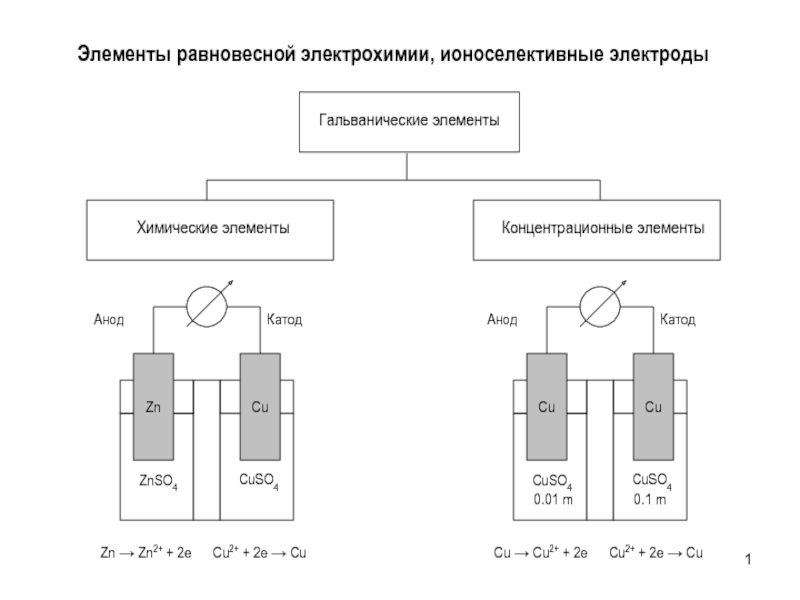
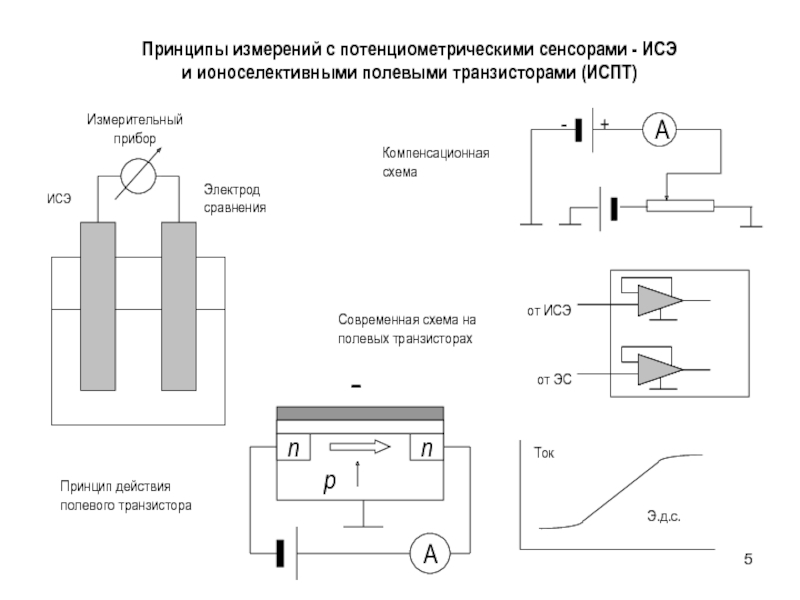
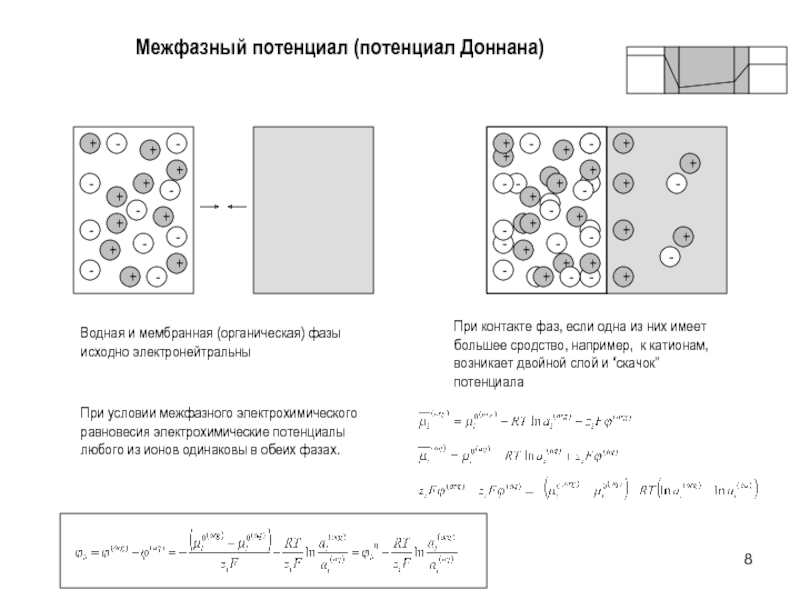
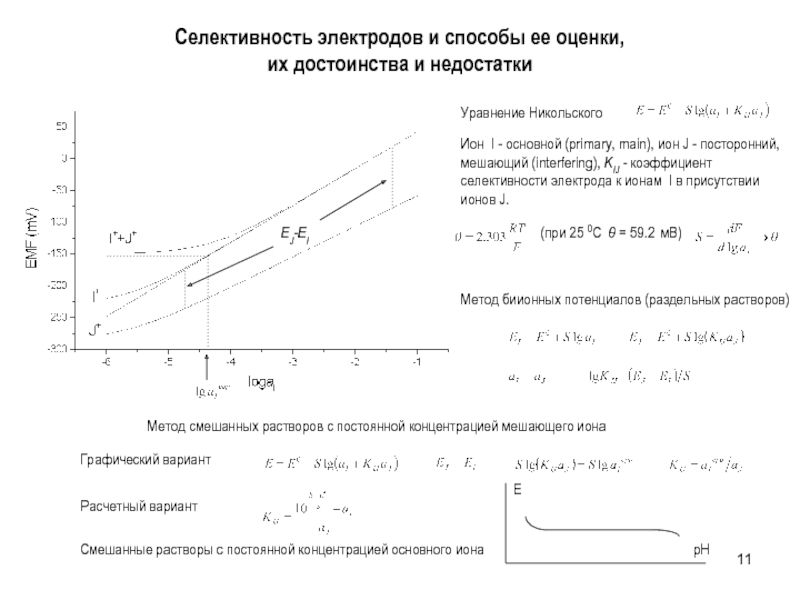
aK=CKK=CKCl K aCl=CClCl =CKCl Cl
a KCl=(aK aCl)1/2 =
(CKCl K CKCl Cl )1/2= CKCl KCl Смешанный раствор KCl+NaCl:
aK=CKK=CKCl K aCl=CClCl=(CKCl +CNaCl)Cl
a KCl=(aK aCl)1/2 = (CKCl(CKCl +CNaCl))1/2 KCl
Пример
0.01 m KCl: a KCl=0.010.91=0.0091
0.01 m KCl + 0.1 m NaCl
a KCl= (0.01(0.01+0.1))1/2 KCl=0.0330.79=0.026