Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Элементы химической кинетики. Основные факторы, влияющие на скорость реакции. Кинетические уравнения реакций 0, I, II порядков
Содержание
- 1. Элементы химической кинетики. Основные факторы, влияющие на скорость реакции. Кинетические уравнения реакций 0, I, II порядков
- 2. Кинетика − раздел химии, изучающий механизмы химических
- 3. Для реакции в общем виде aA + bB
- 4. 1. Природа реагирующих веществ: определяется видом частиц
- 5. 3. Температура: описывается правилом Вант-ГоффаДля химических реакцийγ
- 6. Факторы, влияющие на скорость
- 7. Для эффективного взаимодействия частицы должны: 1. столкнуться; 2. иметь
- 8. Слайд 8
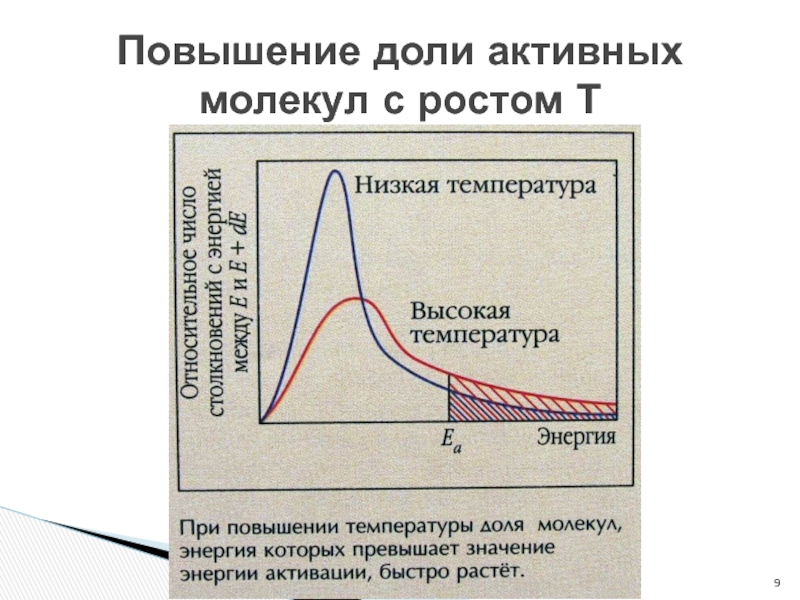
- 9. Повышение доли активных молекул с ростом Т
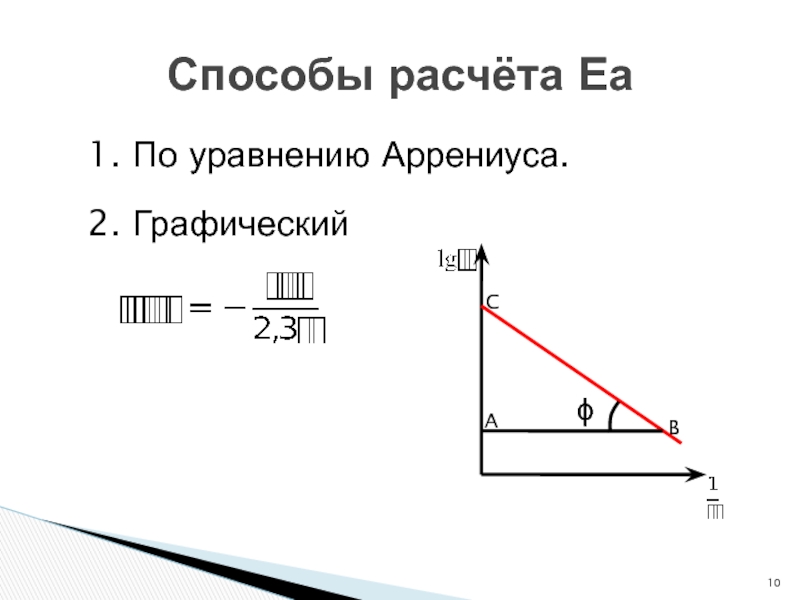
- 10. 1. По уравнению Аррениуса. 2. Графический Способы расчёта ЕаϕCAB
- 11. Число молекул реагентов, участвующих в простой одностадийной
- 12. … ∑ всех показателей степеней концентраций реагирующих
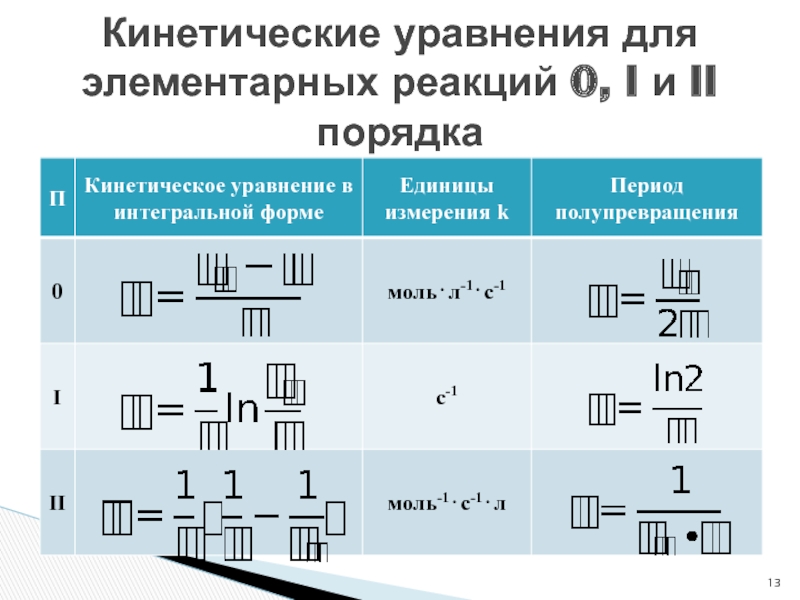
- 13. Кинетические уравнения для элементарных реакций 0, I и II порядка
- 14. 1. Метод изолирования Оствальда. 2. Метод подбора кинетических уравнений. 3. Графический tgϕ = ПМетоды определения ПϕCAB
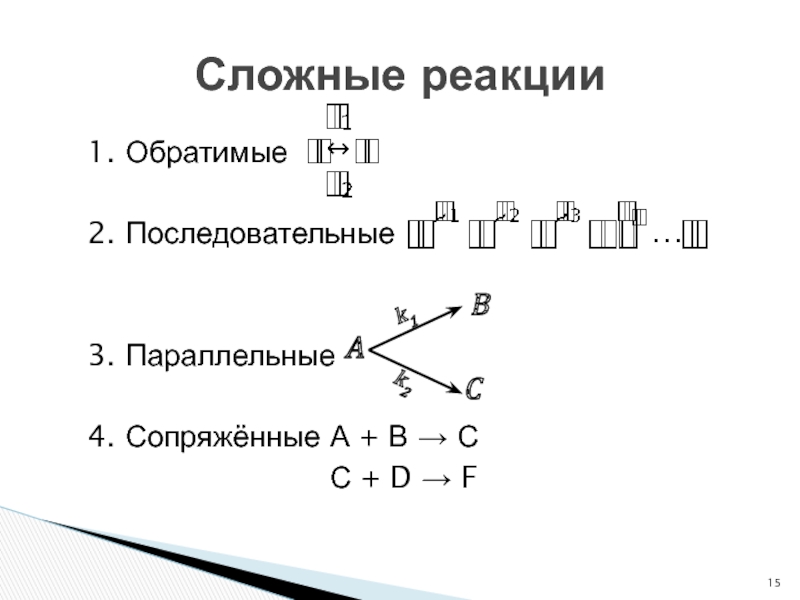
- 15. 1. Обратимые 2. Последовательные 3. Параллельные 4. Сопряжённые А + В → СС + D → FСложные реакции
- 16. 5. Цепные реакции − следующие друг за другом реакции, в которых участвуют свободные радикалы. Сложные реакции(ПАН)
- 17. Москва 2002
- 18. Пекин 2005Нью-Йорк 2008London 2006
- 19. Singapor 2006
- 20. СПАСИБО ЗАВНИМАНИЕ!
- 21. Скачать презентанцию
Кинетика − раздел химии, изучающий механизмы химических реакций и скорости их протекания. Скорость − основное понятие кинетики.Основные понятия кинетики
Слайды и текст этой презентации
Слайд 1Элементы химической кинетики. Основные факторы, влияющие на скорость реакции. Кинетические
уравнения реакций 0, I, II порядков
Иванова Надежда СемёновнаСлайд 2 Кинетика − раздел химии, изучающий механизмы химических реакций и скорости
их протекания.
Скорость − основное понятие кинетики.
Основные понятия кинетики
Слайд 3
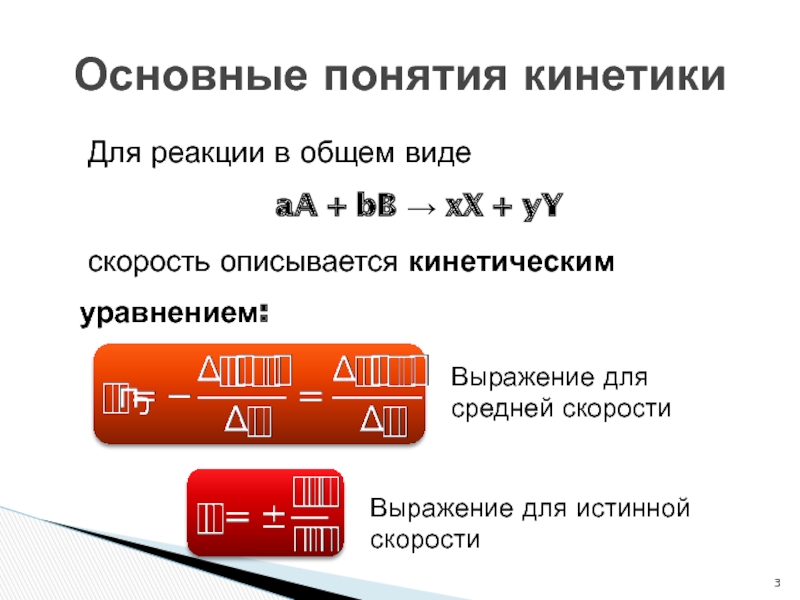
Для реакции в общем виде
aA + bB → xX +
yY
скорость описывается кинетическим уравнением:
Основные понятия кинетики
Выражение для средней скорости
Выражение для
истинной скоростиСлайд 4
1. Природа реагирующих веществ: определяется видом частиц (атомы, молекулы, ионы).
2.
Концентрация реагирующих веществ: описывается законом действующих масс (ЗДМ)
,где k − const скорости реакции.
Факторы, влияющие на скорость
Слайд 5
3. Температура: описывается правилом Вант-Гоффа
Для химических реакций
γ = 2-4, для
ферментативных
γ = 7-9.
Факторы, влияющие на скорость
Якоб Хендрик Вант-Гофф
(1852-1911)
Слайд 7 Для эффективного взаимодействия частицы должны:
1. столкнуться;
2. иметь благоприятную ориентацию;
3. обладать
достаточной
энергией.
Основные положения теории активных соударений
СВАНТЕ АВГУСТ АРРЕНИУС
(1859-1927)
Слайд 8
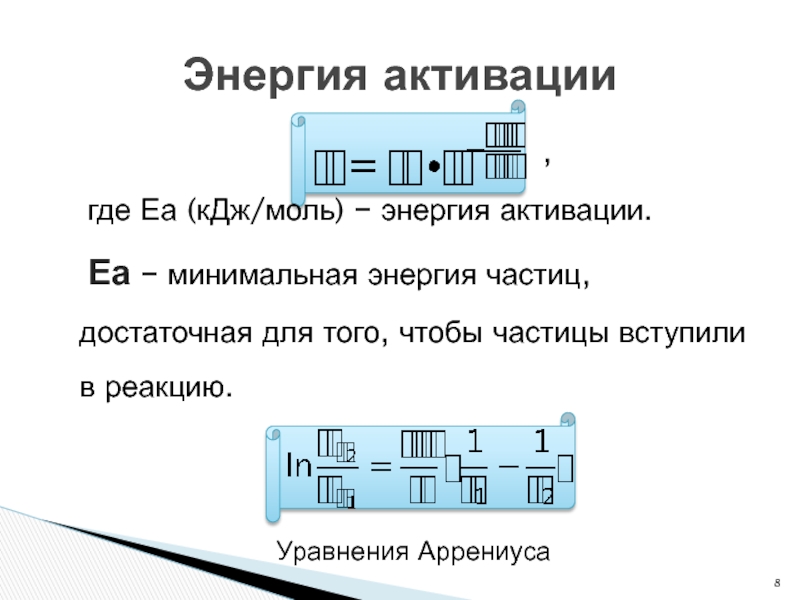
,
где Еа (кДж/моль) − энергия активации.
Еа − минимальная энергия частиц, достаточная для того, чтобы частицы вступили в реакцию.
Энергия активации
Уравнения Аррениуса
Слайд 11 Число молекул реагентов, участвующих в простой одностадийной реакции, состоящей из
одного элементарного акта, называется МОЛЕКУЛЯРНОСТЬЮ реакции.
Мономолекулярная реакция: C2H6 → 2CH3⋅
Бимолекулярная
реакция: CH3⋅ + CH3⋅ → C2H6Пример относительно редкой тримолекулярной реакции: 2NO + O2 → 2NO2
Молекулярность связана с механизмом реакции!
Молекулярность реакции
Слайд 12
… ∑ всех показателей степеней концентраций реагирующих веществ в ЗДМ.
; П = a + b
Порядок реакции по веществу A равен a.
Порядок реакции отражает общую зависимость скорости от концентрации и часто не совпадает с молекулярностью.
Порядок реакции − …