Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Энергетика химических реакций
Содержание
- 1. Энергетика химических реакций
- 2. Основные понятия термодинамики ТЕРМОДИНАМИКА (ТД) – это наука о взаимных превращениях различных видов энергии.
- 3. Химическая термодинамика изучает: Переходы химической энергии в
- 4. Основные понятия ТДОбъектом изучения в термодинамике является
- 5. Основные понятия ТД
- 6. Основные понятия ТДФаза - это часть системы,
- 7. Основные понятия ТД
- 8. Термодинамические параметрыТемпература – ТДавление – РПлотность –
- 9. Параметры химической термодинамикиU - внутренняя энергияН - энтальпияS - энтропияG - энергия Гиббса
- 10. Внутренняя энергия системы (U) представляет собой ее
- 11. Единицы измерения внутренней энергии:[U] = Дж, кДж.
- 12. Внутренняя энергия системыВнутренняя энергия - это функция
- 13. Термодинамический процесс- это изменение состояния системы, сопровождающийся изменением хотя бы одного из параметров системы во времени.
- 14. Термодинамический процессВ зависимости от условий перехода системы
- 15. Теплота - является мерой энергии переданной от
- 16. Работа - является мерой энергии, переданной от
- 17. Первый закон термодинамикиВыражает количественное соотношение между изменением
- 18. Закон сохранения энергии- энергия не исчезает и
- 19. Изохорный процесс Первый закон ТД:Q = ΔU
- 20. Изобарный процесс Для изобарного процесса Р =
- 21. Тепловой эффект реакции- это количество теплоты, которое выделяется или поглощается системой после протекания химической реакции
- 22. Тепловой эффект реакции равен изменению энтальпии системы:
- 23. Энтальпия образования - количество теплоты, которое выделяется
- 24. Стандартная энтальпия образованияДля сравнения энтальпий образования различных
- 25. Единицы измеренияЕдиницы измерения энтальпии образования:Значения стандартных энтальпий
- 26. ПРИМЕР
- 27. ПРАВИЛО!энтальпии образования устойчивых простых веществ равны нулю
- 28. Термохимические уравнения это уравнения химической реакции в
- 29. Виды агрегатного состояния веществат – твердоек –
- 30. ПРИМЕР
- 31. Особенности термохимических уравненийв термохимических уравнениях могут быть дробные стехиометрические коэффициенты.
- 32. Особенности термохимических уравненийС термохимических уравнениями можно производить
- 33. Закон ГессаТепловой эффект химической реакции определяется лишь
- 34. Пример. Получение СО21 путь:С + О2 =
- 35. Следствие из закона ГессаТеплота химической реакции равна
- 36. Тепловой эффект реакциистандартная энтальпия образования веществаколичество вещества
- 37. Пример. Рассчитать ΔН0 химической реакции
- 38. Пример. Рассчитать ΔН0 MgO
- 39. ЗадачаВычислите ΔН0 SO3 если при сгорании 64г
- 40. ЗадачаСколько тепла выделится при взаимодействии 4,48 литров
- 41. Возможность и направление протеканияхимическихреакций
- 42. Самопроизвольность протекания реакцииПри изучении химических взаимодействий важно
- 43. Второй закон термодинамикиОпределяет критерий самопроизвольного протекания процесса в изолированных системах - энтропию
- 44. Энтропия это параметр характеризующий хаотичность движения частиц, является мерой молекулярного, атомного и ионного беспорядка.
- 45. Уравнение БольцманаУравнение Больцмана придало энтропии физический смысл.
- 46. Основные положенияЭнтропия- это мера термодинамической вероятности состояния
- 47. Изменение энтропииΔS = S2 –S1если ΔS >
- 48. Энтропия химической реакциистандартная энтропия образования веществаколичество вещества
- 49. Основные положениязначения стандартных энтропий приведены в таблице; значение энтропий зависит от агрегатного состояния веществ.
- 50. Пример:
- 51. ПримерСграфит тв. + СО2 = 2СОгаз ΔS=175,4 1моль 2 моль ΔS>0твердые и жидкие
- 52. Пример2Н2(г) + О2(г) = 2Н2О(г) ΔS
- 53. Факторы неизолированных систем1.Энтальпийный ΔН- отражает стремление системы
- 54. Энергия ГиббсаЭнтропийный и энтальпийный факторы обычно действуют
- 55. Уравнение энергии Гиббса
- 56. Величина и знак ΔG позволяют судить о
- 57. ПримерFe2O3(тв) +3Н2 (г) = 2Fe (тв) +3Н2О(г) ΔН
- 58. ПримерПри какой температуре начнется эта реакция?Решение:Найдем температуру
- 59. Значение ΔG можно определить приблизительно:
- 60. Энергия Гиббса химической реакциистандартная энергия Гиббса образования веществаколичество вещества
- 61. Стандартная энергия Гиббса образования химического соединения ΔG°
- 62. ВАЖНО!Любая реакция при постоянных температуре и давлении протекает самопроизвольно в направлении убыли энергии Гиббса.
- 63. На основании стандартных теплот образования и абсолютных
- 64. Химическое равновесие и константа равновесия
- 65. Состояние равновесия это такое состояние системы при
- 66. Константа равновесияхарактеризует количественное состояние равновесия
- 67. ПРИМЕР
- 68. Связь Кр и ΔG° Константа равновесия связана
- 69. Смещение равновесияПри изменении внешних условий меняются равновесные
- 70. Принцип Ле–ШательеПри внешнем воздействии равновесие смещается в сторону ослабления этого воздействия.
- 71. 1. Влияние температуры на равновесие химической реакцииПовышение
- 72. 2. Влияние давления на равновесие химической реакцииПовышение
- 73. 3. Влияние концентрации на равновесие химической реакцииПовышение
- 74. 4. Влияние катализатора на равновесие химической реакцииВведение
- 75. Равновесие реакции 2H2(г) + O2(г) = 2H2O(г) ; ΔH
- 76. Как сместится равновесие в системе: 2H2S(г) +
- 77. В состоянии равновесия обратимой реакции:
- 78. Константа равновесия системы при некоторой температуре равна
- 79. Для обратимой реакции константа равновесия при Т
- 80. Пользуясь справочными данными, определить равновесную концентрацию N2O4(г)
- 81. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Основные понятия термодинамики
ТЕРМОДИНАМИКА (ТД) – это наука о взаимных
превращениях различных видов энергии.
Слайд 3Химическая термодинамика изучает:
Переходы химической энергии в другие формы -
тепловую, электрическую и. т.д.
Каковы энергетические эффекты химических реакций
Возможность
и направление самопроизвольно протекающей реакции, Состояние химического равновесия и условия его смещения.
Слайд 4Основные понятия ТД
Объектом изучения в термодинамике является система.
Система - это
совокупность веществ находящихся во взаимодействии, мысленно (или фактически) обособленная от
окружающей среды.Слайд 6Основные понятия ТД
Фаза - это часть системы, однородная во всех
точках по составу и свойствам и отделенная от других частей
системы поверхностью раздела.Слайд 8Термодинамические параметры
Температура – Т
Давление – Р
Плотность – ρ
Концентрация - С
Изменение
хотя бы одного параметра приводит к изменению состояния системы в
целомСлайд 9Параметры химической термодинамики
U - внутренняя энергия
Н - энтальпия
S - энтропия
G
- энергия Гиббса
Слайд 10Внутренняя энергия системы (U)
представляет собой ее полную энергию,
которая складывается из кинетической и потенциальной энергий молекул, атомов, атомных
ядер и электронов.Она не включает потенциальную энергию положения системы в пространстве и кинетическую энергию движения системы как целого.
Слайд 11Единицы измерения
внутренней энергии:
[U] = Дж, кДж.
Абсолютное значение внутренней
энергии определить невозможно, однако можно измерить ее изменение ΔU при
переходе из одного состояния в другое.Слайд 12Внутренняя энергия системы
Внутренняя энергия - это функция состояния, которая характеризует
полный запас энергии системы.
Изменение внутренней энергии не зависит от
пути и способа перехода системы из одного состояния в другое. ΔU=U2 –U1
U2 и U1 - внутренняя энергия системы в конечном и начальном состояниях соответственно.
Слайд 13Термодинамический процесс
- это изменение состояния системы, сопровождающийся изменением хотя бы
одного из параметров системы во времени.
Слайд 14Термодинамический процесс
В зависимости от условий перехода системы из одного состояния
в другое в термодинамике различают следующие процессы:
изотермические Т-
const, изобарные Р-const,
изохорные V-const.
Слайд 15Теплота
- является мерой энергии переданной от одного тела к
другому, за счет разницы температур этих тел.
Слайд 16Работа
- является мерой энергии, переданной от одного тела к
другому за счет перемещения масс под действием каких-либо сил.
Слайд 17Первый закон термодинамики
Выражает количественное соотношение между изменением внутренней энергии, теплотой
и работой:
Q = ΔU +A
Т.е. теплота Q, подведенная
к системе, расходуется на увеличение ее внутренней энергии ΔU и на совершение системой работы А.работа расширения A=P×ΔV
Слайд 18Закон сохранения энергии
- энергия не исчезает и не возникает, она
переходит из одной формы в другую в строго определенных, всегда
в эквивалентных количествах.Слайд 19Изохорный процесс
Первый закон ТД:
Q = ΔU + A =
ΔU + P×ΔV
Для изохорного процесса
V=const , тогда ΔV=0
A=0 Q = ΔU
Слайд 20Изобарный процесс
Для изобарного процесса Р = const.
В изобарных процессах
тепловой эффект химической реакции равен изменению энтальпии (Н).
Первый закон ТД:
Qр
= ΔU+P×ΔV = (U2-U1) + P(V2-V1) = (U2+PV2)-(U1+PV1) обозначим через Н = U+PV
Тогда Qр = H2-H1 = ΔН.
Величина Н характеризует теплосодержание системы.
Слайд 21Тепловой эффект реакции
- это количество теплоты, которое выделяется или поглощается
системой после протекания химической реакции
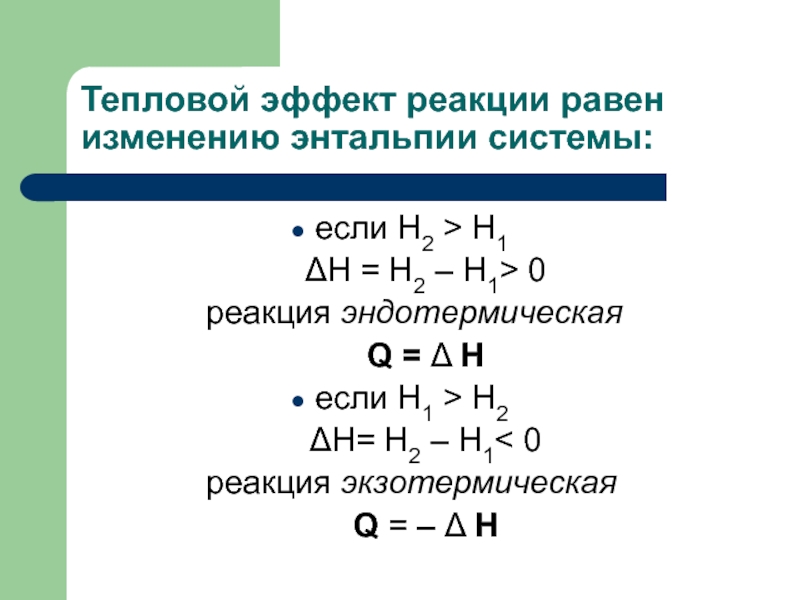
Слайд 22Тепловой эффект реакции равен изменению энтальпии системы:
если H2 >
H1
ΔH = H2 – H1> 0
реакция эндотермическая
Q = Δ H
если H1 > H2 ΔH= H2 – H1< 0
реакция экзотермическая
Q = – Δ H
Слайд 23Энтальпия образования
- количество теплоты, которое выделяется или поглощается при
образовании 1 моля сложного вещества из простых веществ.
Слайд 24Стандартная энтальпия образования
Для сравнения энтальпий образования различных соединений их определяют
при одинаковых стандартных условиях:
Т=298 К
Р=101,3 КПа, 1 атм.,
760 мм.рт.ст.Энтальпия образования определенная при стандартных условиях называется стандартной энтальпией образования вещества и обозначается
Слайд 25Единицы измерения
Единицы измерения энтальпии образования:
Значения стандартных энтальпий образования приведены в
таблицах, необходимо обращать внимание на агрегатные состояния веществ
Слайд 27ПРАВИЛО!
энтальпии образования устойчивых простых веществ равны нулю
Например:
Для твердого йода
энтальпия образования равна нулю, а для газообразного йода не равна
нулю.Слайд 28Термохимические уравнения
это уравнения химической реакции в котором указан
тепловой эффект химической реакции и агрегатные состояния.
Слайд 29Виды агрегатного состояния вещества
т – твердое
к – кристаллическое,
ам. –
аморфное,
ж – жидкое,
г – газообразное,
р – растворимое
Слайд 31Особенности термохимических уравнений
в термохимических уравнениях могут быть дробные стехиометрические коэффициенты.
Слайд 32Особенности термохимических уравнений
С термохимических уравнениями можно производить алгебраические действия. Их
можно складывать, вычитать, умножать на любые коэффициенты вместе с тепловым
эффектомСлайд 33Закон Гесса
Тепловой эффект химической реакции определяется лишь начальным и конечным
состояниями системы реагирующих веществ и не зависит от пути ее
протекания.Слайд 34Пример. Получение СО2
1 путь:
С + О2 = СО2 ΔН1
2 путь:
С +
1/2О2 = СО ΔН2
СО + 1/2О2 = СО2 ΔН3
ΔН1 = ΔН2 +
ΔН3Слайд 35Следствие из закона Гесса
Теплота химической реакции равна разности между суммой
энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ.
Необходимо учитывать стехиометрические коэффициенты.
Слайд 39Задача
Вычислите ΔН0 SO3 если при сгорании 64г серы выделилось 790
кДж тепла.
Решение:
S + 3/2O2 = SO3
64 г S – 790 кДж
32 г S – Х кДж
Х
= 395 кДж теплаΔН0(SO3) = - 395кДж/моль
Слайд 40Задача
Сколько тепла выделится при взаимодействии 4,48 литров N2 (н.у.) с
Н2 , если ΔН0 (NH3)= –46 кДж/моль.
Решение:
½N2 +3/2H2 =NH3
11,2 л N2 – –
46 кДж4,48 л N2 – Х кДж
Х=18,4кДж тепла.
Слайд 42Самопроизвольность протекания реакции
При изучении химических взаимодействий важно оценить возможность или
невозможность их самопроизвольного протекания при данных условиях.
Самопроизвольно могут протекать
как экзотермические, так и эндотермические реакции.Самопроизвольный процесс протекает без затраты энергии извне (смешение газов, передача тепла от горячего к холодному, вода стекает с крыши)
Слайд 43Второй закон термодинамики
Определяет критерий самопроизвольного протекания процесса в изолированных системах
- энтропию
Слайд 44Энтропия
это параметр характеризующий хаотичность движения частиц, является мерой молекулярного,
атомного и ионного беспорядка.
Слайд 46Основные положения
Энтропия- это мера термодинамической вероятности состояния веществ и систем.
Любая
изолированная система предоставленная самой себе, изменяется в направлении состояния обладающего
максимальной вероятностью.Все процессы в изолированной системе происходят в направлении увеличения энтропии.
Слайд 47Изменение энтропии
ΔS = S2 –S1
если ΔS > 0, то процесс
протекает в прямом направлении,
если ΔS < 0, то процесс
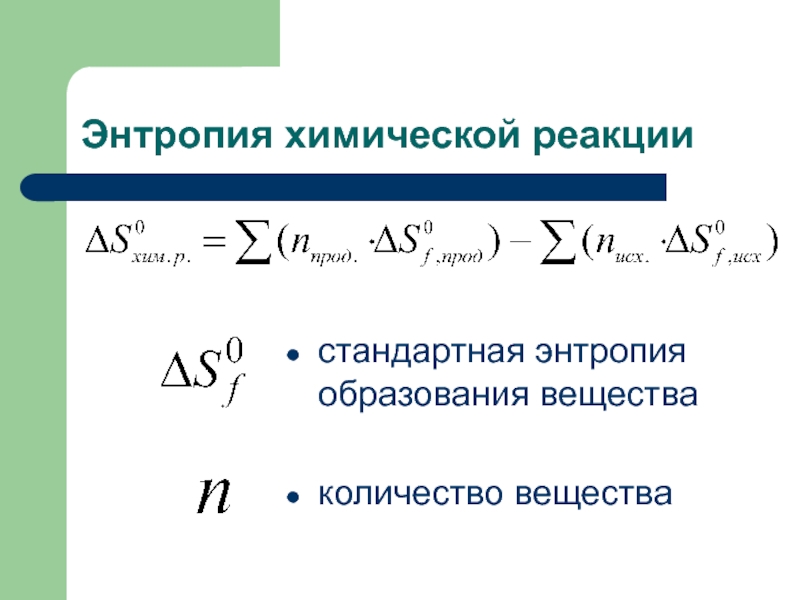
протекает в обратном направлении. Слайд 49Основные положения
значения стандартных энтропий приведены в таблице;
значение энтропий зависит
от агрегатного состояния веществ.
Слайд 51Пример
Сграфит тв. + СО2 = 2СОгаз ΔS=175,4
1моль 2 моль ΔS>0
твердые и жидкие вещества не учитываются
, в данной реакции объем увеличивается, беспорядок системы возрастает ΔS>0.
Слайд 53Факторы неизолированных систем
1.Энтальпийный ΔН- отражает стремление системы к образованию связей
в результате взаимного притяжения частиц, что приводит к их усложнению.
Энергия при этом выделяется и ΔН<0. (Стремление системы перейти в состояние с минимальной Е, при этом выделяется тепло ΔН<0.)2. Энтропийный (TΔS) – отражает стремление к усилению процессов диссоциации сложных частиц на более простые и их менее упорядоченному состоянию в результате ΔS>0. (Стремление системы перейти в состояние с большим беспорядком ΔS>0.)
Слайд 54Энергия Гиббса
Энтропийный и энтальпийный факторы обычно действуют в противоположных направлениях
и общее направление реакции определяется влиянием преобладающего фактора.
В неизолированных
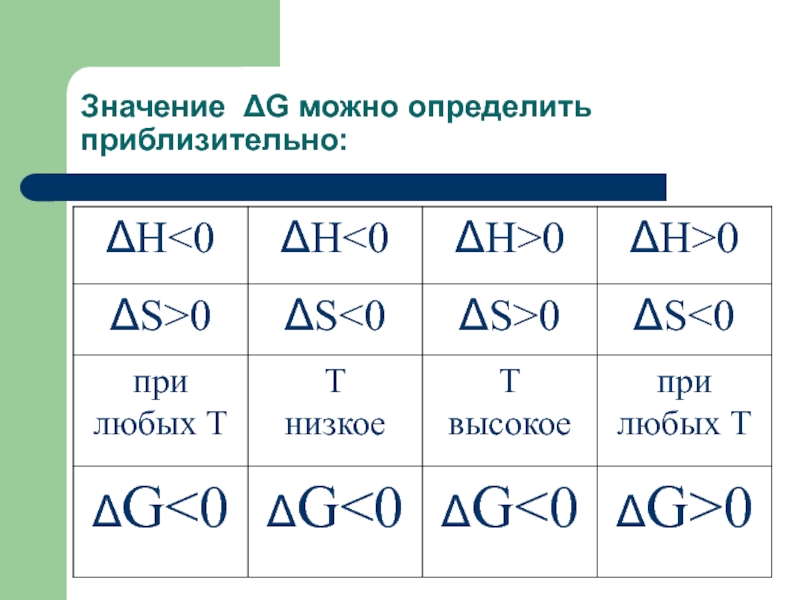
системах критерием является ΔG –энергия Гиббса, ее рассчитывают при разных температурах. Слайд 56Величина и знак ΔG позволяют судить о возможности и направлении
процесса.
ΔG0 прямая реакция невозможна
и протекает в обратном направлении, Δ G=0 реакция находится в состоянии равновесия, т.е. скорость прямой реакции равна скорости обратной.
Слайд 57Пример
Fe2O3(тв) +3Н2 (г) = 2Fe (тв) +3Н2О(г)
ΔН х.р. = 96,61
кДж
Возможна ли данная реакция при стандартных условиях, если ΔSх.р. =
138,7 Дж/град? Решение:
Вычисляем : ΔG = ΔH – T ΔS
ΔG = 96,61 - 298×138,7×10–3 = 55,28 кДж,
т.к. Δ G>0 ,то реакция при стандартных условиях невозможна, в этих условиях идет обратная реакция.
Слайд 58Пример
При какой температуре начнется эта реакция?
Решение:
Найдем температуру при которой ΔG=0?
ΔH
=T ΔS
T = ΔH/ ΔS = 96,61/0,1387 =
696.5 KСледовательно при температуре >696,5K начнется реакция восстановления Fe2O3 водородом.
Слайд 60Энергия Гиббса химической реакции
стандартная энергия Гиббса образования вещества
количество вещества
Слайд 61Стандартная энергия Гиббса образования химического соединения ΔG°
это энергия Гиббса
реакции образования одного моля этого соединения находящегося в стандартных условиях,
из простых веществΔG° простых веществ так же как ΔH°, ΔS° равны нулю
Единицы измерения ΔG° - кДж/моль
Стандартная энергия Гиббса образования химического соединения ΔG° приведена в справочниках
Слайд 62ВАЖНО!
Любая реакция при постоянных температуре и давлении протекает самопроизвольно в
направлении убыли энергии Гиббса.
Слайд 63На основании стандартных теплот образования и абсолютных стандартных энтропий вещества
вычислите реакции, протекающей по уравнению
СО (г) + Н2О (ж) = СО2 (г)
+ Н2 (г)Решение. и S – функции состояния, поэтому
Слайд 65Состояние равновесия
это такое состояние системы при которой ΔG =
0, а скорость прямой реакции равна скорости обратной:
аА + вВ
= сС + dD V прямой = V обратной
Слайд 68Связь Кр и ΔG°
Константа равновесия связана со стандартной энергией
Гиббса следующим соотношением:
Зная значения ΔG° для химической реакции можно
рассчитать константу равновесия и равновесные концентрации. Слайд 69Смещение равновесия
При изменении внешних условий меняются равновесные концентрации, происходит смещение
равновесия. Направление смещения химического равновесия при изменении внешних условий определяется
правиломЛе-Шателье.
Слайд 70Принцип Ле–Шателье
При внешнем воздействии равновесие смещается в сторону ослабления этого
воздействия.
Слайд 711. Влияние температуры на равновесие химической реакции
Повышение температуры - смещает
равновесие в сторону эндотермической реакции
Понижение температуры - смещает равновесие в
сторону экзотермической реакции. Слайд 722. Влияние давления на равновесие химической реакции
Повышение давления смещает равновесие
в сторону меньшего объема.
3Н2 + N2 → 2NH3
3 1
→ 2 Если равные объемы, то давление не влияет на смещение равновесия.
Слайд 733. Влияние концентрации на равновесие химической реакции
Повышение концентрации исходных веществ
смещает равновесие в сторону продуктов реакции.
Повышение концентрации продуктов реакции
смещает равновесие в сторону исходных веществ. Слайд 744. Влияние катализатора на равновесие химической реакции
Введение катализатора не влияет
на смещение равновесия, но ускоряет процесс достижения равновесия.
Слайд 75Равновесие реакции 2H2(г) + O2(г) = 2H2O(г) ; ΔH
при: 1) повышении температуры; 2) уменьшении давления; 3) увеличении давления?
Решение.
Все вещества в
системе – газы. В соответствии с принципом Ле Шателье, повышение давления приводит к смещению равновесия в сторону реакции, приводящей к меньшему количеству молей газов, т.е. в сторону образования Н2О. Следовательно, повышение давления в системе смещает равновесие реакции вправо.Ответ: при увеличении давления.
Слайд 76Как сместится равновесие в системе:
2H2S(г) + SO2(г) 2H2O(г)
+ 3S(т) + Q,
если : а) повысить
температуру; б) понизить давление; в) ввести катализатор; г) повысить концентрацию сероводорода; д) понизить концентрацию оксида серы (IV).Как необходимо изменить условия в системе: 2SO2(г) + O2(г) 2SO3(г) + Q, находящейся в равновесии, чтобы добиться максимальной концентрации оксида серы (IV)?
Слайд 77В состоянии равновесия обратимой реакции:
N2 + 3Н2 2NH3 концентрации веществ равны: [N2]=1,5 моль/л; [Н2]=4,5 моль/л; [NH3]=2 моль/л. Чему равны исходные концентрации водорода и азота и константа химического равновесия?
Решение: Исходя из уравнения реакции, константа химического равновесия
.
Далее, из уравнения реакции следует, что 1 моль азота реагирует с 3 молями водорода. Это значит, что изменение концентрации водорода и изменение концентрации азота связаны соотношением: Δ[Н2] = 3Δ[N2]. С другой стороны, из уравнения реакции следует, что 2Δ[N2] = [NH3] = 2 моль/л (по условию задачи). Откуда получаем: Δ[N2] = 1 моль/л, а Δ[Н2] = 3Δ[N2] = 3 моль/л. Выразим теперь исходные концентрации азота и водорода через равновесные и через изменения концентраций:
[H2]исх - Δ[Н2] = 4,5 моль/л;
[N2]исх - Δ[N2] = 1,5 моль/л;
Тогда:
[Н2]исх = 4,5 моль/л + Δ[Н2] = 4,5 моль/л +3 моль/л = 7,5 моль/л;
[N2]исх = 1,5 моль/л + Δ[N2] = 1,5 моль/л + 1 моль/л = 2,5 моль/л.
Ответ: [Н2]исх = 7,5 моль/л; [N2]исх = 2,5 моль/л; K = 0,03.
Слайд 78Константа равновесия системы при некоторой температуре равна 0,5. FeO(k) + CO(Г) Fe(k) + CO2(Г). Найти равновесные
концентрации СО и СО2, если начальные концентрации этих веществ составлялиС0(CO) =
0,05 моль/л,С0 (CO2) = 0,01 моль/л.Решение. Поскольку FeO и Fe – твердые вещества, их концентрации остаются постоянными и не входят в выражение константы равновесия:
.
Выразим равновесные концентрации веществ через исходные и уменьшение концентрации СО к моменту наступления равновесия.
Пусть х – это уменьшение концентрации СО. Тогда равновесная концентрация [CO] = С0(CO) – x = (0,05 – x) моль/л. Из уравнения реакции видно, что из одного моля СО образуется 1 моль СО2. Следовательно, равновесная концентрация [CO2] = С0(CO2) + x = (0,01 + x) моль/л.
Для вычисления х подставим числовые значения равновесных концентраций в выражение константы равновесия: ; х = 0,01 моль/л.
[CO2] = С0(CO2) + x = 0,01 + 0,01 = 0,02 моль/л;
[CO] = С0(CO) – x = 0,05 - 0,01 = 0,04 моль/л.
Слайд 79Для обратимой реакции константа равновесия при Т = 300 К
составляет 0,030, a DS0 составляет 119 Дж/К. Найти DН0 для
указанного процесса.Решение. Зная константу равновесия, легко найти DG0 процесса
DG0 = -RT lnKравн = -RT ln0,030 = 8,7 кДж.
Затем по известному термодинамическому соотношению находим DH0этого процесса:
DG0 = DH0 - TDS0;
DH0 = DG0 + TDS0= 8,7 + 119·300/1000 = 44,4 кДж.
Слайд 80Пользуясь справочными данными, определить равновесную концентрацию N2O4(г) при 298,15 К
в системе если начальные концентрации составляли: [NO2]нач = 5 моль/л.;
[N2O4]нач = 2 моль/л.Решение. Определим первоначально константу равновесия в указанной системе на основе соотношения
DG° = DG0обр N2O4 (г) – 2DG°o6p NO2 (г) = 98,4 – 2·51,6 =–4,8 кДж.
DG0 = -RT lnKравн= – 8,31·298,15 lnKравн
Пусть к моменту равновесия концентрация N2О4 (г) повысилась на Х моль/л по сравнению с исходной. Соответственно равновесные концентрации веществ составят: [N2O4] равн= (2+x) моль/л; [NO2] равн= (5–2x) моль/л.
Подставляем эти величины в выражение для константы равновесия:
Решением полученного уравнения будут корни x1=2,92 и x2=2,12. Условию задачи удовлетворяет только значение 2,12, таким образом, равновесная концентрация N2O4(г) составит 2 + 2,12 = 4,12 моль/л.










![Энергетика химических реакций Единицы измерения внутренней энергии:[U] = Дж, кДж. Абсолютное значение внутренней энергии Единицы измерения внутренней энергии:[U] = Дж, кДж. Абсолютное значение внутренней энергии определить невозможно, однако можно измерить ее](/img/thumbs/eb5bf351235cf780491bfb8eb0821523-800x.jpg)

















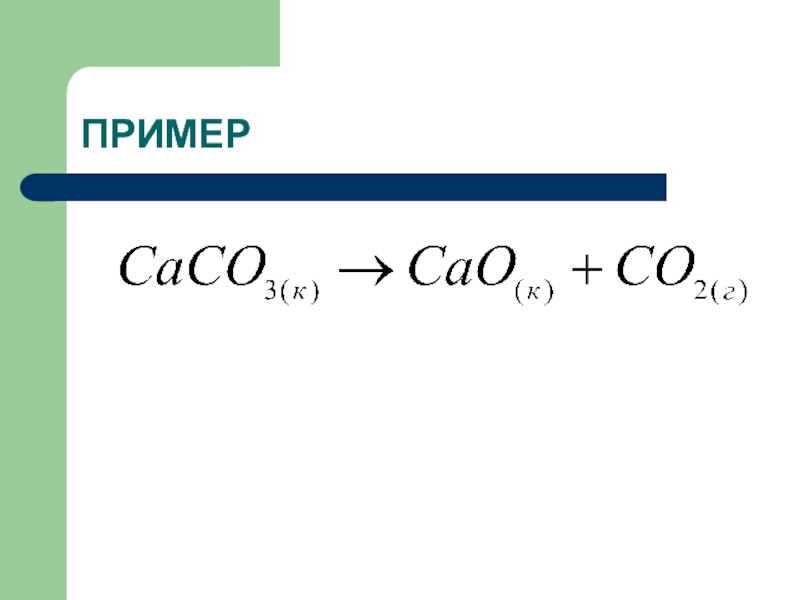















































![Энергетика химических реакций Пользуясь справочными данными, определить равновесную концентрацию N2O4(г) при 298,15 К в Пользуясь справочными данными, определить равновесную концентрацию N2O4(г) при 298,15 К в системе если начальные концентрации составляли: [NO2]нач](/img/thumbs/71bef66bdf19edc02d860240a313e279-800x.jpg)



















