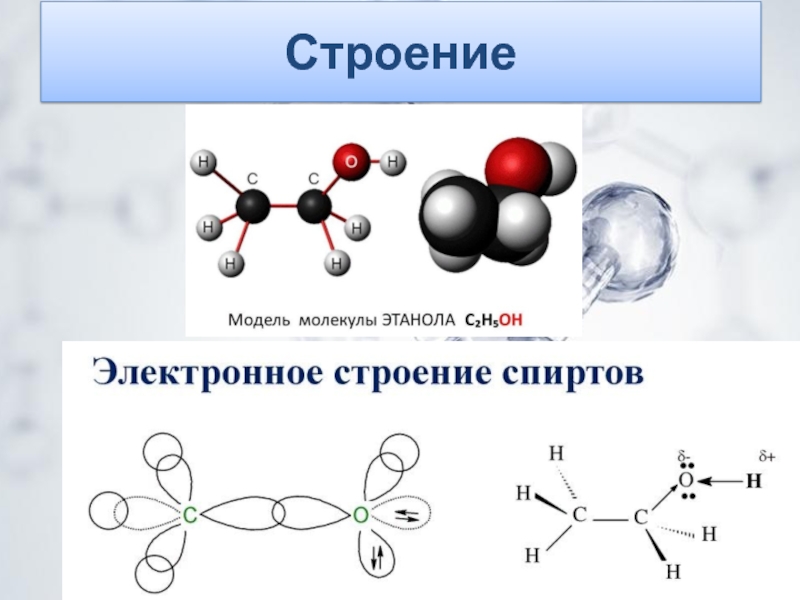
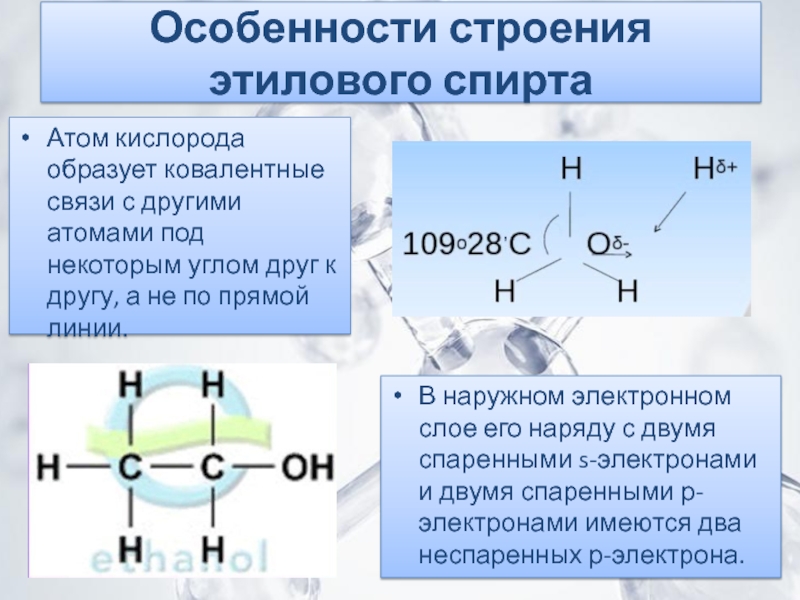
имеет своеобразный запах и кипит при температуре 78,3 °C. Этиловый
спирт легче воды – его плотность 0,8 г/см3. Этанол неограниченно смешивается с водой.Действующий компонент алкогольных напитков. Является депрессантом — психоактивным веществом, угнетающим центральную нервную систему человека
Этиловый спирт также используется как топливо, в качестве растворителя, как наполнитель в спиртовых термометрах и как дезинфицирующее средство (или как компонент его).