Слайд 1федеральное государственное автономное образовательное учреждение высшего образования
Первый Московский государственный медицинский
университет имени И.М. Сеченова
Министерства здравоохранения Российской Федерации (Сеченовский Университет)
Отдаленные
последствия облучения организма.
Детерминированные и стохастические эффекты
Кафедра медицины труда, авиационной, космической и водолазной медицины
Лекция по дисциплине «Общая и медицинская радиобиология»
для специальностей
30.05.01 Медицинская биохимия
30.05.02 Медицинская биофизика
Выполнили студентки 5 курса медико-профилактического факультета:
Сучкова Анастасия
Кушнарева Яна
Слайд 2 Содержание
Определение лучевого поражения и его классификация;
Классификация радиобиологических эффектов;
Виды отдаленных
эффектов облучения организма.
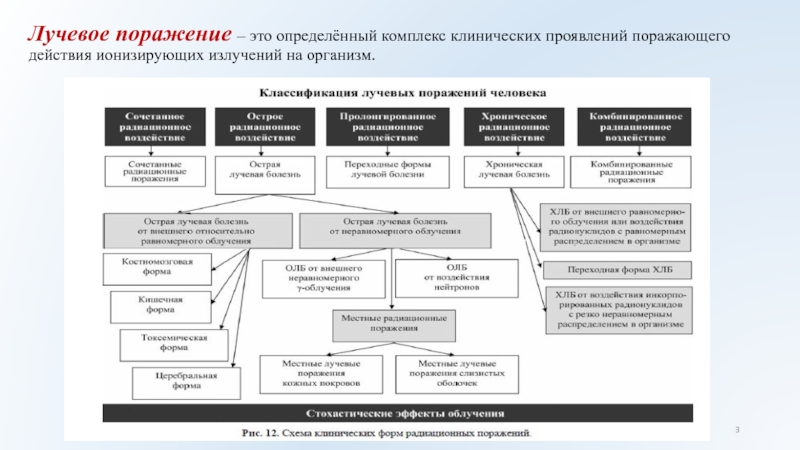
Слайд 3Лучевое поражение – это определённый комплекс клинических проявлений поражающего действия
ионизирующих излучений на организм.
Слайд 4 Радиобиологические эффекты
При действии на организм
ионизирующих излучений развиваются различные радиобиологические эффекты – изменения, возникающие в
биологических системах при действии на них ионизирующих излучений. Проявления этих эффектов, как и их выраженность, прямо зависят от физических факторов и биологических факторов(состояния организма).
К физическим факторам относятся:
место расположения источника излучения по отношению к облучаемому организму (внешнее облучение или внутреннее облучение от инкорпорированных в организм радионуклидов);
вид ионизирующего излучения (гамма-, бета-, альфа-излучение и др.);
пространственное распределение дозы в организме (равномерное, неравномерное, тотальное, субтотальное, парциальное, местное);
временнóе распределение дозы (мощность дозы, кратковременное, фракционированное, пролонгированное, хроническое облучение);
доза облучения.
Слайд 6 Радиобиологические эффекты
(по уровню формирования)
На молекулярном уровне наиболее важными
являются повреждения ДНК и биологических мембран. В их основе лежат
одиночные и двойные разрывы цепочек ДНК, повреждения ДНК-мембранного комплекса, разрушение связей ДНК-белок, повышающее уязвимость ДНК при атаке вторичными радикалами и ферментами, нарушения вторичной, третичной и четвертичной структуры этого биополимера. Некоторые из этих повреждений, в частности одиночные разрывы, могут подвергаться репарации с участием ферментов эндонуклеаз, экзонуклеаз, ДНК-полимераз, ДНК-лигаз.
Двунитиевый разрыв ДНК чаще всего не подвергается репарации и приводит к гибели клетки, а неправильная репарация приводит к появлению мутаций.
Однако многие клетки погибают после облучения еще до вступления в митоз, а следовательно, и до появления хромосомных аберраций.
Радиобиологические эффекты
(по уровню формирования)
На клеточном уровне воздействие ионизирующих излучений вызывает интерфазную или репродуктивную гибель клеток, временный блок митозов, нелетальные мутации и нарушения функциональной активности клеток.
На уровне тканей, органов и систем действие радиации характеризуется цитопеническим эффектом, в основе которого лежат, преимущественно, гибель клеток и радиационный блок митозов.
Радиобиологические эффекты, возникающие на уровне организма, проявляются в формировании различных заболеваний, а на уровне популяции – в изменении демографических характеристик и пр.
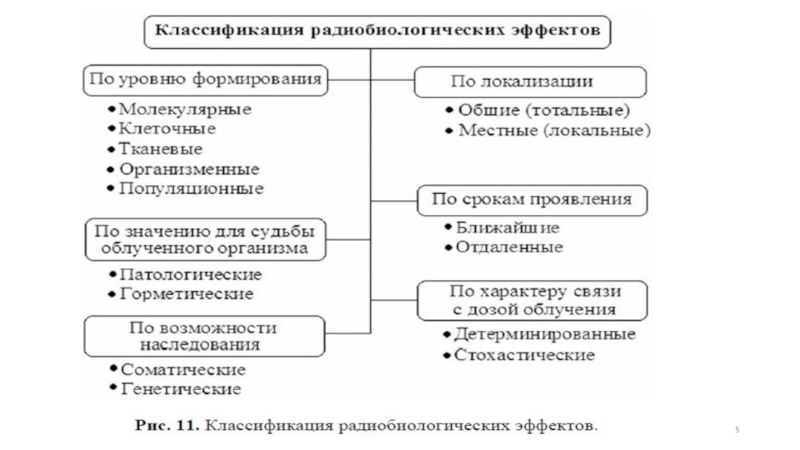
Слайд 8 По значению для судьбы облученного организма
радиобиологические эффекты можно разделить на:
патологические – это
эффекты, возникающие в организме при воздействии патогенного фактора и включающие (в различных соотношениях) нарушение нормального течения жизненных процессов и защитно-приспособительных реакций;
горметические – это эффекты от воздействующего фактора, увеличивающие жизнеспособность организма.
Как правило, радиобиологические эффекты неблагоприятным образом сказываются на биологическом объекте. Исключением из этого правила является эффект гормезиса, который проявляется повышением жизнеспособности организмов под влиянием облучения в малых дозах.
Этот эффект используют в медицине: прием радоновых ванн, сопровождающийся облучением организма в малых дозах, улучшает функциональное состояние и повышает резистентность организма.
Слайд 9 По возможности передачи по наследству последующим поколениям радиобиологические эффекты
делятся на:
соматические эффекты (от греч. sṓma – тело) – вредные
биологические эффекты, вызванные ионизирующим излучением в соматических (т.е. не половых) тканях облученного организма;
генетические (наследственные) эффекты – вызванные ионизирующим излучением биологические эффекты, обусловленные повреждением генома (появление доминантных и рецессивных генных мутаций) половых клеток облученного организма и проявляющиеся у его потомства.
Следует подчеркнуть, что все генетические эффекты облучения проявляются в виде врожденных признаков. В то же время, далеко не все врожденные признаки являются проявлением генетических эффектов облучения. Наблюдения за лицами, родители которых были облучены до зачатия во время атомных бомбардировок Японии, не выявили значимого возрастания частоты врожденных дефектов.
В то же время, риск таких дефектов чрезвычайно высок при равном по дозе лучевом воздействии на эмбрион или плод – особенно при облучении беременной женщины в сроки с 8-ю по 15-ю неделю беременности. В последнем случае врожденными являются изменения, обусловленные не генетическими, а соматическими эффектами облучения плода.

Слайд 10 Детерминированные и стохастические эффекты
облучения
Детерминированные (нестохастические) эффекты облучения (детерминированный – определенный, причинно обусловленный предшествующими событиями; от лат. determino – определяю) – биологические эффекты, вызванные ионизирующим излучением в облученном организме, которые возникают при достижении определенного дозового порога, а выше дозового порога вероятность их появления и степень проявления (т.е. тяжесть) увеличиваются с дальнейшим повышением дозы.
Стохастические эффекты облучения (стохастический – случайный, вероятностный; от греч. stochastikós – умеющий угадывать) – биологические эффекты, вызванные ионизирующим излучением в облученном организме или его потомстве, не имеющие дозового порога возникновения, вероятность появления которых увеличивается при повышении доз, а тяжесть проявления не зависит от дозы.
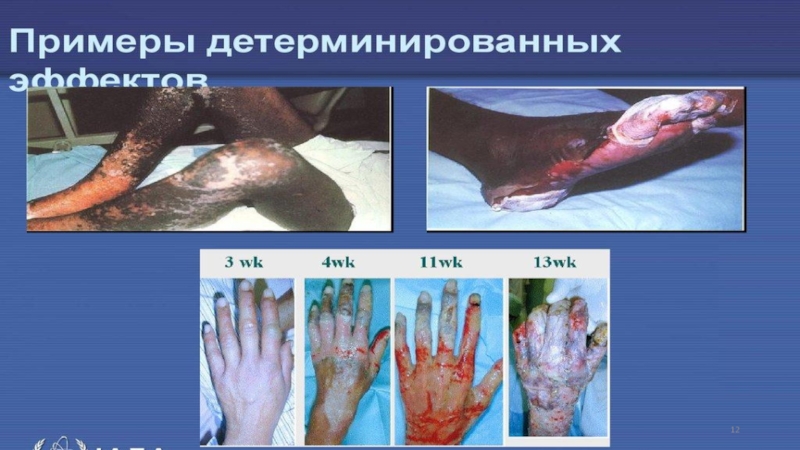
Слайд 11Детерминированные эффекты облучения
Детерминированные эффекты облучения возникают, главным образом, в
результате гибели клеток, приводящей к нарушению функции ткани, которую они
составляют.
К ним относятся, в частности, - непосредственные проявления острого лучевого поражения, радиационные синдромы, нарушение репродуктивной функции, поражение кожи, возникновение катаракты.
Наблюдаются в основном в ближайшие сроки после облучения, реже – в отдаленные сроки (например, катаракта).
Порог для разных детерминированных эффектов может наблюдаться при дозах от 0,1 Гр до нескольких десятков грей. Так, например:
порог для временной (обратимой) стерильности мужчин при однократном облучении семенников составляет около 0,15 Гр;
порог для постоянной (необратимой) стерильности мужчин– 3,5‑6 Гр;
порог для постоянной стерильности женщин при остром облучении – 2,5‑6 Гр.
Порог возникновения катаракты у человека при остром воздействии:
для рентгеновского излучения - 2‑6 Гр;
для нейтронного излучения - в 3-9 раз меньше.
Порог достоверного подавления кроветворения в красном костном мозге человека при остром облучении наблюдается при 0,15 Гр?.

Слайд 13 Стохастические эффекты облучения
Стохастические эффекты облучения возникают в
результате мутагенного действия ионизирующего излучения, т.е. когда клетка под действием
излучения не погибает, но в ней происходит повреждение генома.
Стохастические эффекты облучения могут возникать как в самом облученном организме, так и у потомства облученного организма.
К стохастическим эффектам облучения относятся радиоиндуцированные опухоли, возникающие в различных тканях облученного организма. Наиболее часто встречаются злокачественные опухоли кожи, костей, молочной и щитовидной желез, яичников, легких, а также лейкозы.
Стохастические эффекты возникают через длительное время после облучения, т.е. являются отдаленными последствиями облучения.
Поскольку существуют механизмы клеточного восстановления, стохастические эффекты при малых дозах маловероятны, однако с увеличением дозы облучения их вероятность возрастает. Тяжесть же этих эффектов не зависит от дозы.
Лучевые изменения половых клеток могут привести к возникновению стохастических эффектов в виде наследственных болезней или уродств у потомства облученного организма.

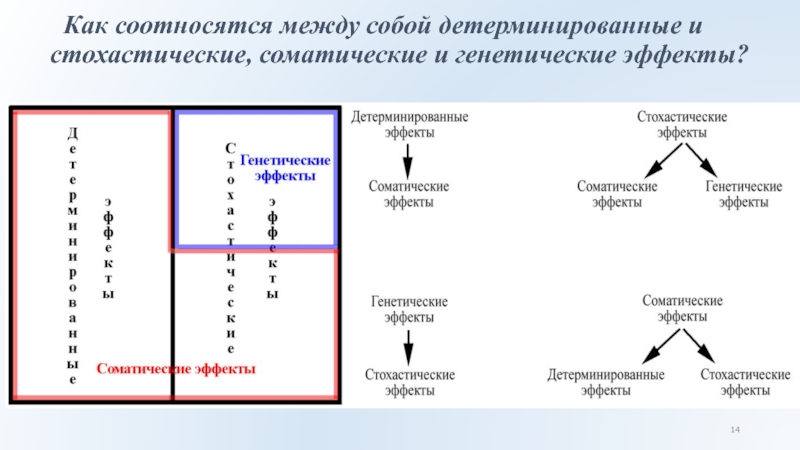
Слайд 14 Как соотносятся между собой детерминированные и стохастические, соматические и
генетические эффекты?
Слайд 15ближайшие эффекты проявляются в сроки до нескольких месяцев после облучения
и связаны с развитием цитопенических состояний в различных тканевых системах
организма. Примерами ближайших эффектов облучения могут быть острая лучевая реакция, острая лучевая болезнь, лучевая алопеция (облысение), лучевой дерматит;
отдаленные последствия облучения — это развитие новых патологических процессов, признаки которых в остром периоде лучевого поражения отсутствовали: склеротические и дистрофические процессы, катаракта, новообразования и др.
Кроме того, у потомства облученных родителей в результате мутаций в герминативных клетках могут проявиться генетические последствия.
Радиобиологические эффекты (по срокам проявления):
Слайд 16 неопухолевые отдаленные последствия;
канцерогенные эффекты;
сокращение продолжительности жизни.
Среди форм отдаленной лучевой патологии выделяют:
Слайд 17 Неопухолевые отдаленные последствия
- относятся к числу детерминированных эффектов
облучения, тяжесть которых зависит главным образом от степени лучевого повреждения
клеток соответствующих тканей и органов.
Неопухолевые отдаленные последствия могут проявляться в виде:
функциональных расстройств регуляторных систем (астеноневротический синдром, вегетососудистая дистония и т. п.);
склеротических и дистрофических процессов (цирроз печени, нефросклероз, атеросклероз, лучевая катаракта);
гиперпластических процессов (гиперплазия тканей щитовидной железы и т. п.).
Слайд 18 Еще одним видом неопухолевых последствий облучения является лучевая катаракта
– пострадиационное помутнение хрусталика глаза, возникающее вследствие тотального облучения всего
организма или местного облучения хрусталика.
Лучевая катаракта может развиться после облучения области глаза при лучевой терапии опухолей лица и головы, у лиц, профессионально связанных с возможностью длительного воздействия потоков частиц и фотонных излучений, а также при радиационных авариях.
Пороговая доза для возникновения катаракты после однократного рентгеновского облучения для глаза человека составляет 2 Гр, но при фракционировании дозы величина порога увеличивается.
Наибольшей катарактогенной эффективностью обладают нейтроны (ОБЭ нейтронов по этому показателю в зависимости от их энергии оценивают от 4,5 до 9).
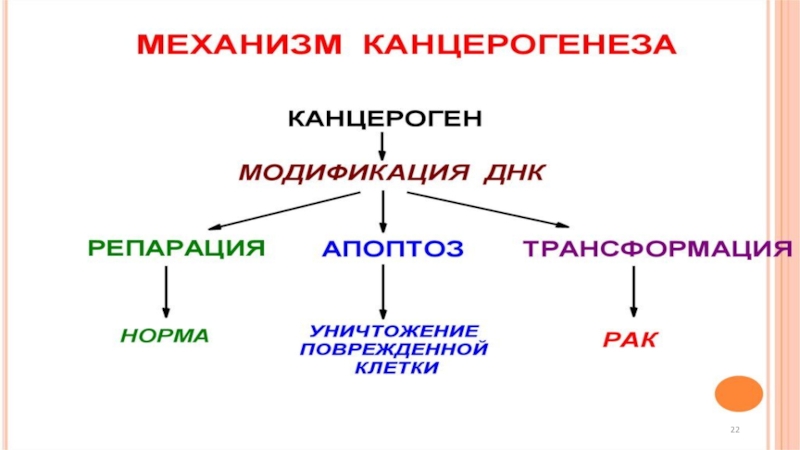
Слайд 19 Радиационный канцерогенез
Радиационный канцерогенез (лат. cancer - рак,
гр. genesis – происхождение) - это процесс превращения нормальных клеток
и тканей организма в опухолевые.
Радиационный канцерогенез относится к числу стохастических (или вероятностных) эффектов облучения.
Первый достоверно выявленный рак кожи, индуцированный рентгеновским излучением, был описан немецким рентгенологом X. Фрибеном в 1902 г., т. е. уже через 6 лет после открытия В. Рентгеном лучей, названных его именем. Несколько позже появились данные о возникновении злокачественных опухолей у медицинских работников - рентгенологов и радиологов (рак кожи), шахтеров урановых рудников ( рак легких), работниц, наносивших на циферблат часов флюоресцентную краску, содержащую радий.
Опыты на животных и клинические наблюдения показали, что ионизирующее излучение, независимо от вида и способа воздействия - внешнего или внутреннего, тотального или локального, однократного, фракционного ( дробного) или хронического, является неспецифическим канцерогенным фактором, т. к. вызывает опухоли или способствует их возникновению почти во всех тканях млекопитающих.

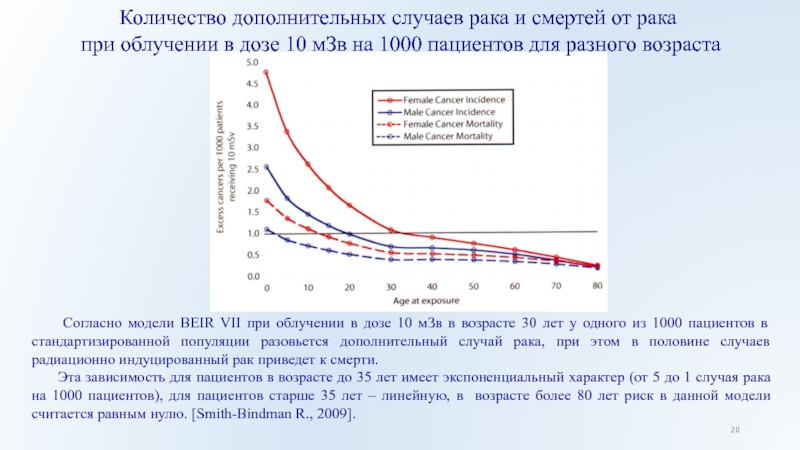
Слайд 20Количество дополнительных случаев рака и смертей от рака
при облучении
в дозе 10 мЗв на 1000 пациентов для разного возраста
Согласно модели BEIR VII при облучении в дозе 10 мЗв в возрасте 30 лет у одного из 1000 пациентов в стандартизированной популяции разовьется дополнительный случай рака, при этом в половине случаев радиационно индуцированный рак приведет к смерти.
Эта зависимость для пациентов в возрасте до 35 лет имеет экспоненциальный характер (от 5 до 1 случая рака на 1000 пациентов), для пациентов старше 35 лет – линейную, в возрасте более 80 лет риск в данной модели считается равным нулю. [Smith-Bindman R., 2009].
Слайд 21 Механизм радиационного концерогенеза не совсем ясен, но имеется ряд
предположений:
мутации, вызванные радиацией, могут активировать протоонкогены нормальных клеток;
радиационные мутации
могут повысить чувствительность клеток к канцерогенным влияниям другой природы;
радиация может привести к гибели клеток, однако, сохранившие жизнеспособность клетки пролиферируют и, следовательно, становятся чувствительными к онкогенному воздействию;
наличие длительного латентного периода в развитие опухолей при радиационном повреждении свидетельствует о наличии дополнительной мутации, возможно, под влиянием других факторов внешней среды.
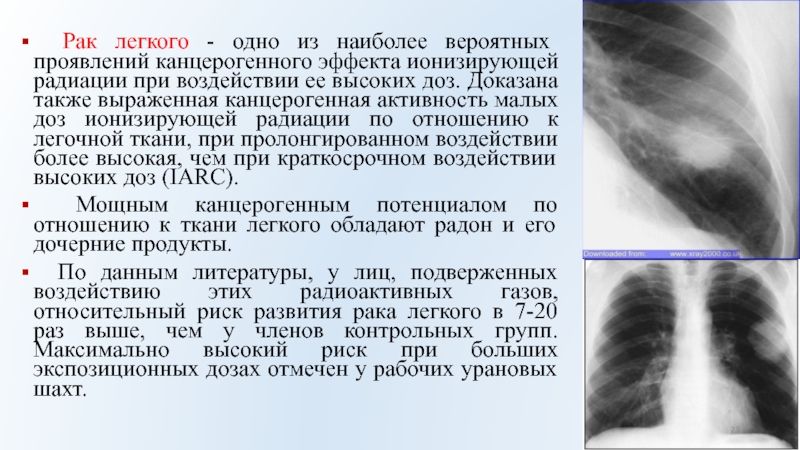
Слайд 23 Рак легкого - одно из наиболее вероятных проявлений канцерогенного
эффекта ионизирующей радиации при воздействии ее высоких доз. Доказана также
выраженная канцерогенная активность малых доз ионизирующей радиации по отношению к легочной ткани, при пролонгированном воздействии более высокая, чем при краткосрочном воздействии высоких доз (IARC).
Мощным канцерогенным потенциалом по отношению к ткани легкого обладают радон и его дочерние продукты.
По данным литературы, у лиц, подверженных воздействию этих радиоактивных газов, относительный риск развития рака легкого в 7-20 раз выше, чем у членов контрольных групп. Максимально высокий риск при больших экспозиционных дозах отмечен у рабочих урановых шахт.
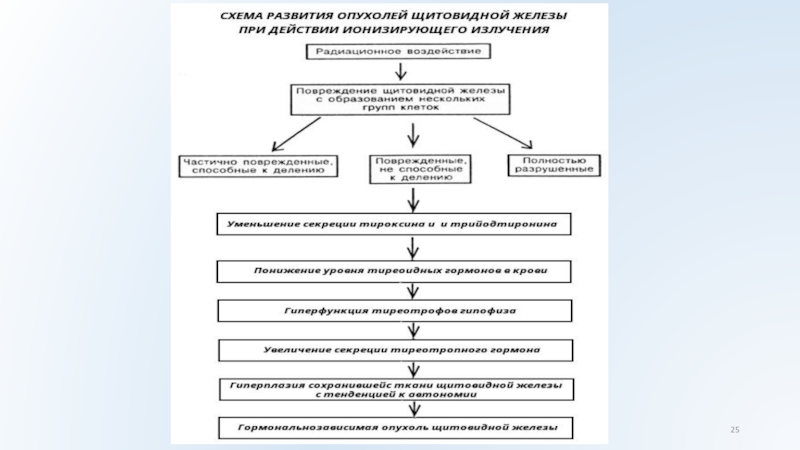
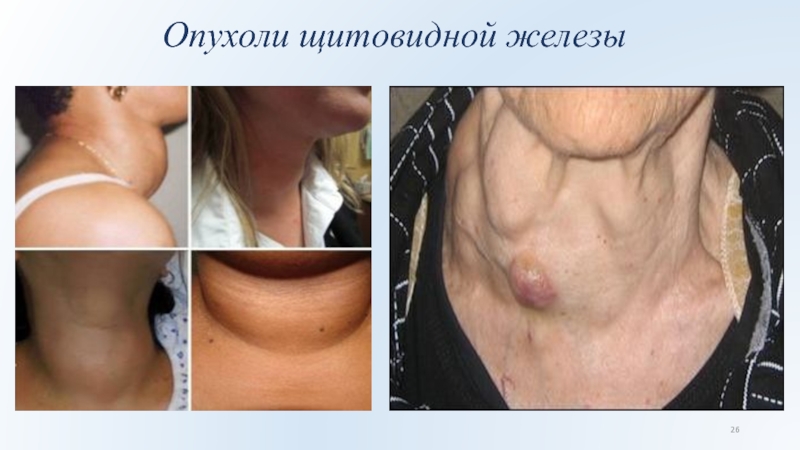
Слайд 24 Особое место занимает вопрос о радиационном поражении щитовидной
железы в результате испытаний ядерного оружия и аварии на реакторах.
При аварии на ЧАЭС в атмосферу было выброшено около 670 x 1018 Бк 131J. Кроме того, в атмосферу попали короткоживущие изотопы радиоактивного йода - 132J, 133J, 135J с временем полураспада соответственно 2,25, 2,03; 6,7 ч. Эти изотопы оказывают большое деструктивное действие на ткань железы вследствие более высокой пенетрации β-частиц и быстроты дозовой нагрузки. В числе других выброшенных из реактора изотопов, обнаруженных в воздухе над Западной Европой, следует отметить 137Cs и 134Cs с временем полураспада соответственно 30 и 2,5 г, 132Те, 103Ru,106Rh, 99Mo, 90Sr.
Повышение частоты доброкачественных и злокачественных опухолей щитовидной железы было установлено у жителей Хиросимы и Нагасаки, переживших ядерный взрыв. Большая частота рака обнаружена у пациентов в возрасте 10-19 лет, находящихся в зоне менее 1400 м от эпицентра взрыва. В этом случае также имелось сочетание наружного и внутреннего (в том числе за счет инкорпорации коротко-живущих изотопов) лучевого поражения щитовидной железы.

Слайд 27Продолжительность жизни после облучения
Облучение ионизирующим излучением при достаточно высоких
дозах вызывает гибель облученных организмов. Эта гибель происходит не сразу,
а через определенные сроки после облучения, т.е. облучение фактически вызывает сокращение продолжительности жизни.
Впервые детальные исследования зависимости средней продолжительности жизни (СПЖ) погибших животных от дозы облучения были проведены в 1940-50-х годах Б. Раевским в экспериментах на мышах, подвергнутых общему однократному облучению рентгеновским излучением.
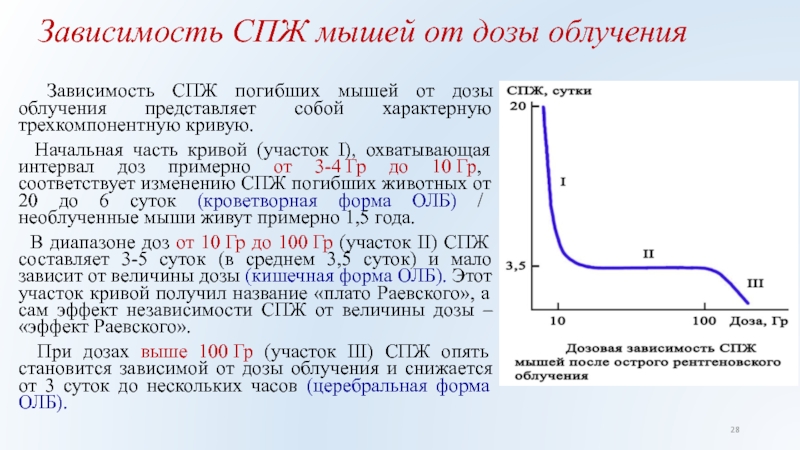
Слайд 28Зависимость СПЖ мышей от дозы облучения
Зависимость СПЖ погибших мышей
от дозы облучения представляет собой характерную трехкомпонентную кривую.
Начальная часть
кривой (участок I), охватывающая интервал доз примерно от 3-4 Гр до 10 Гр, соответствует изменению СПЖ погибших животных от 20 до 6 суток (кроветворная форма ОЛБ) / необлученные мыши живут примерно 1,5 года.
В диапазоне доз от 10 Гр до 100 Гр (участок II) СПЖ составляет 3-5 суток (в среднем 3,5 суток) и мало зависит от величины дозы (кишечная форма ОЛБ). Этот участок кривой получил название «плато Раевского», а сам эффект независимости СПЖ от величины дозы – «эффект Раевского».
При дозах выше 100 Гр (участок III) СПЖ опять становится зависимой от дозы облучения и снижается от 3 суток до нескольких часов (церебральная форма ОЛБ).
Слайд 29
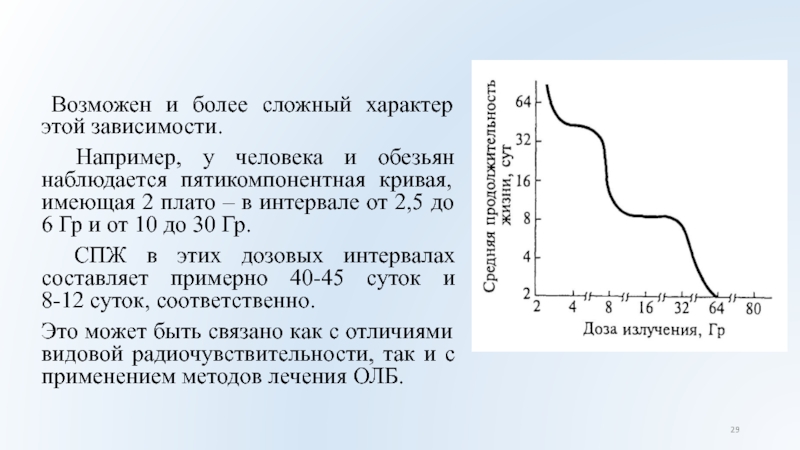
Возможен и более сложный характер этой зависимости.
Например,
у человека и обезьян наблюдается пятикомпонентная кривая, имеющая 2 плато
– в интервале от 2,5 до 6 Гр и от 10 до 30 Гр.
СПЖ в этих дозовых интервалах составляет примерно 40-45 суток и
8-12 суток, соответственно.
Это может быть связано как с отличиями видовой радиочувствительности, так и с применением методов лечения ОЛБ.
Слайд 30 Интегральным проявлением отдаленных последствий облучения является сокращение средней
продолжительности жизни.
По расчетным данным, радиационное воздействие
приводит к сокращению средней видовой продолжительности жизни на 5–6 % на каждый Зиверт эквивалентной дозы общего однократного облучения.
У человека сокращение продолжительности жизни может составить от 100 до 1000 сут на каждый 1 Гр острого облучения и порядка 8–10 сут на каждый 1 Зв хронического облучения.
Однако при дозах ниже 2 Гр само наличие сокращения продолжительности жизни признается не всеми исследователями.
Слайд 31Понятие критических систем или органов
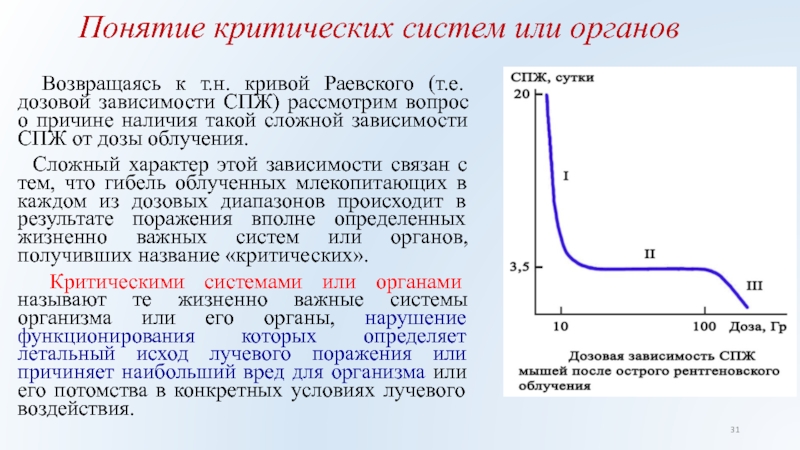
Возвращаясь к т.н. кривой Раевского
(т.е. дозовой зависимости СПЖ) рассмотрим вопрос о причине наличия такой
сложной зависимости СПЖ от дозы облучения.
Сложный характер этой зависимости связан с тем, что гибель облученных млекопитающих в каждом из дозовых диапазонов происходит в результате поражения вполне определенных жизненно важных систем или органов, получивших название «критических».
Критическими системами или органами называют те жизненно важные системы организма или его органы, нарушение функционирования которых определяет летальный исход лучевого поражения или причиняет наибольший вред для организма или его потомства в конкретных условиях лучевого воздействия.
Слайд 32СПЖ в разных диапазонах доз
В диапазоне доз от 3-4
до 10 Гр основной поражаемой в организме мелких лабораторных животных (мышей
и крыс) системой, нарушение которой определяет летальный исход (т.е. критической системой), является система кроветворения. Поэтому тип лучевого поражения, характерный для этого дозового интервала, получил название «кроветворного», или «костномозгового синдрома» (термин синдром означает совокупность симптомов с единым патогенезом).
В диапазоне доз от 10 до 100 Гр гибель происходит вследствие поражения слизистой кишечника – это т.н. «кишечный», или «желудочно-кишечный синдром».
В диапазоне доз от 100 и выше гибель происходит вследствие поражения клеток центральной нервной системы – это т.н. «церебральный синдром».
Слайд 33Список использованной литературы
Основы медицинской радиобиологии / Под ред. академика И.
Б. Ушакова - СПб: ООО «Издательство Фолиант», 2004 — С.
187-222.
Радиационная медицина: учебное пособие. Часть I. Основы биологического действия радиации под редакцией С.С. Алексанина и А.Н. Гребенюка; Всеросс. центр экстрем. и радиац. медицины им. А.М.Никифорова МЧС России. – СПб. : Политехника-сервис, 2013СПб. : Политехника-сервис, 2013. С. 55-56.
Гребенюк А. Н., Стрелова О. Ю., Легеза В. И., Степанова Е. Н. Основы радиобиологии и радиационной медицины: Учебное пособие. — СПб: ООО «Изд. ФОЛИАНТ», 2012. — 232 с.