Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ФЕНОЛЫ
Содержание
- 1. ФЕНОЛЫ
- 2. Физические свойстваБесцветные кристаллические вещества с характерным зпахомTпл=40,8
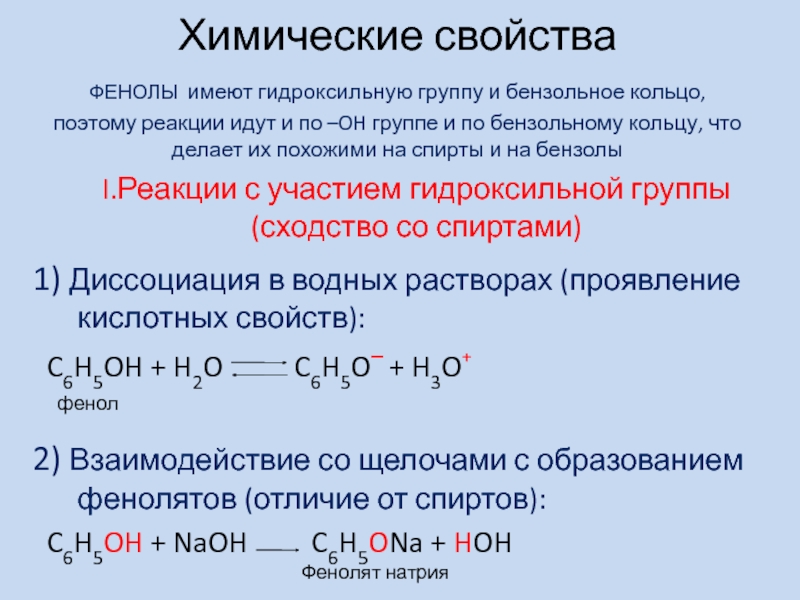
- 3. Химические свойства ФЕНОЛЫ имеют гидроксильную группу
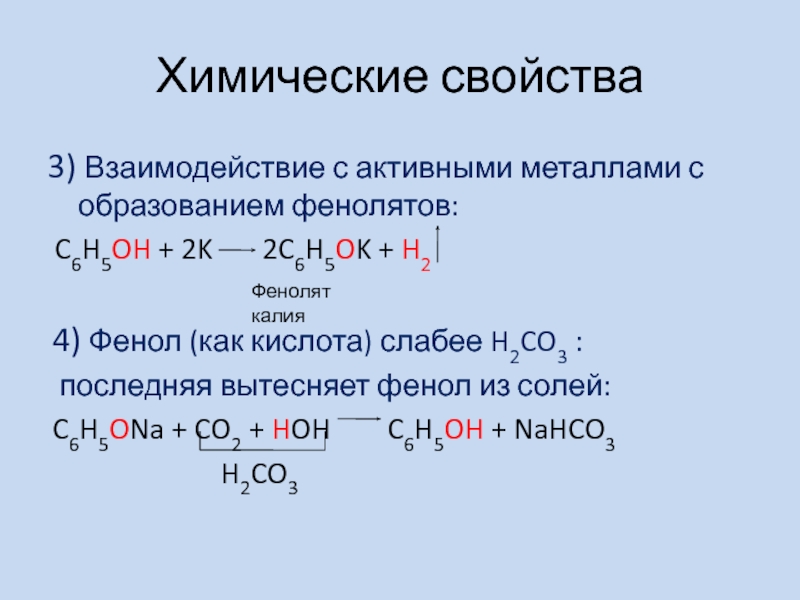
- 4. Химические свойства3) Взаимодействие с активными металлами с
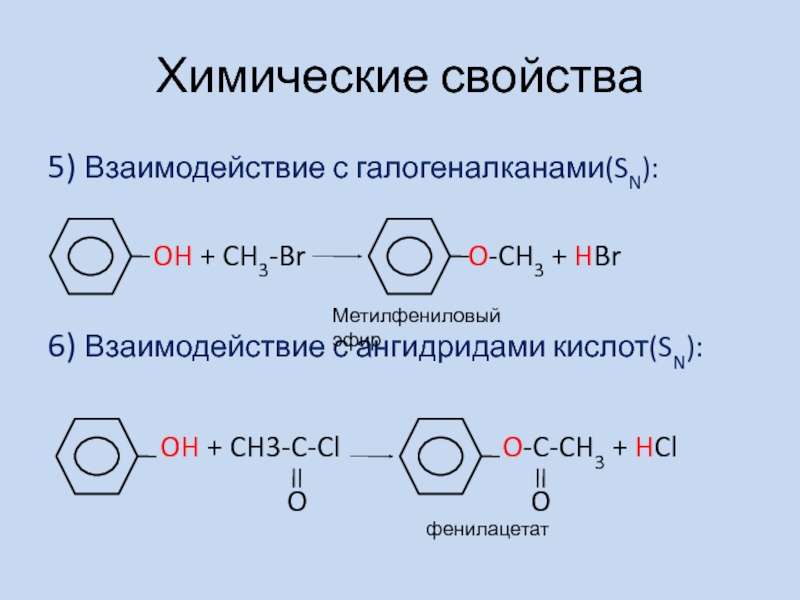
- 5. Химические свойства5) Взаимодействие с галогеналканами(SN):
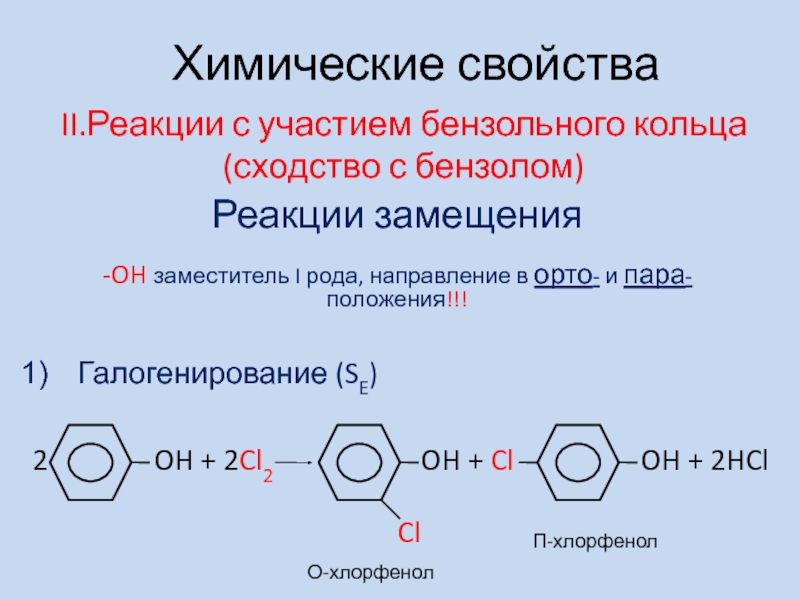
- 6. II.Реакции с участием бензольного кольца (сходство с
- 7. Химические свойства
- 8. Химические свойства2) Нитрование (SE) OH
- 9. Химические свойства3) Сульфирование (SE)
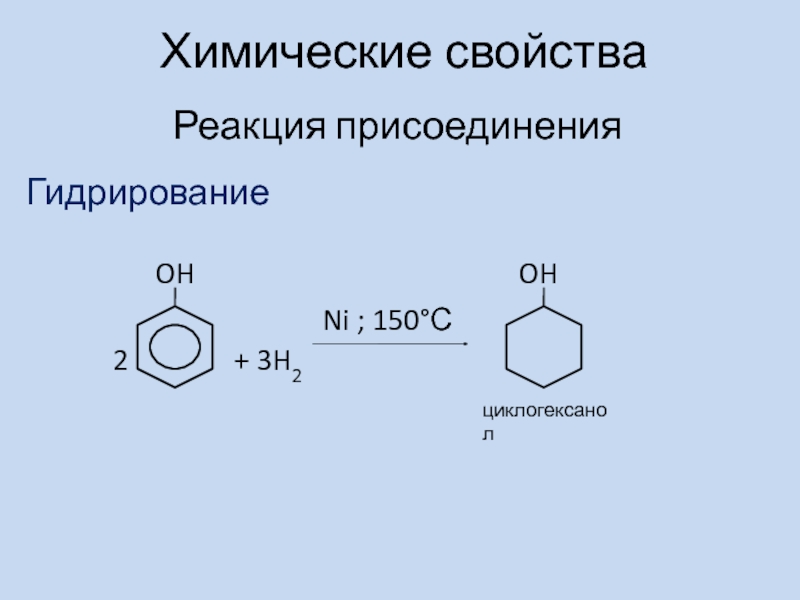
- 10. Химические свойстваРеакция присоединенияГидрирование
- 11. III.Качественные реакцииВзаимодействие с бромной водой
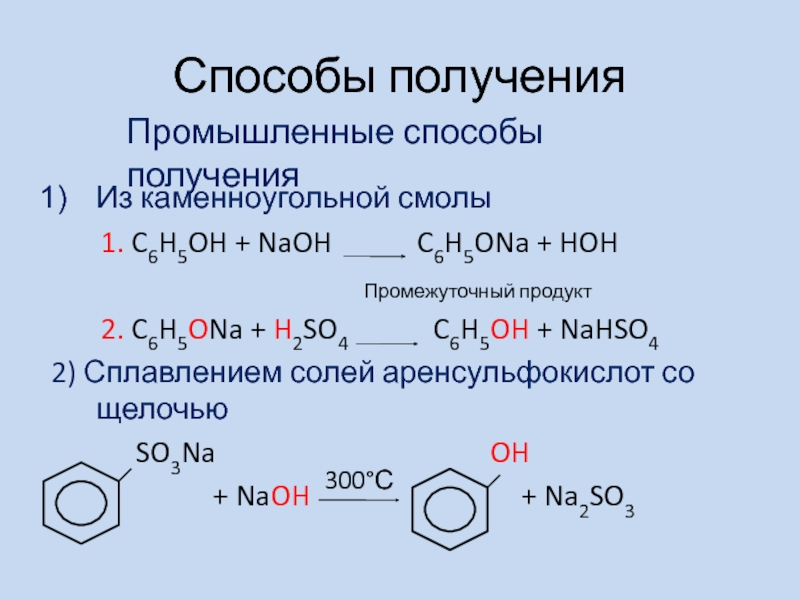
- 12. Способы получения Из каменноугольной смолы
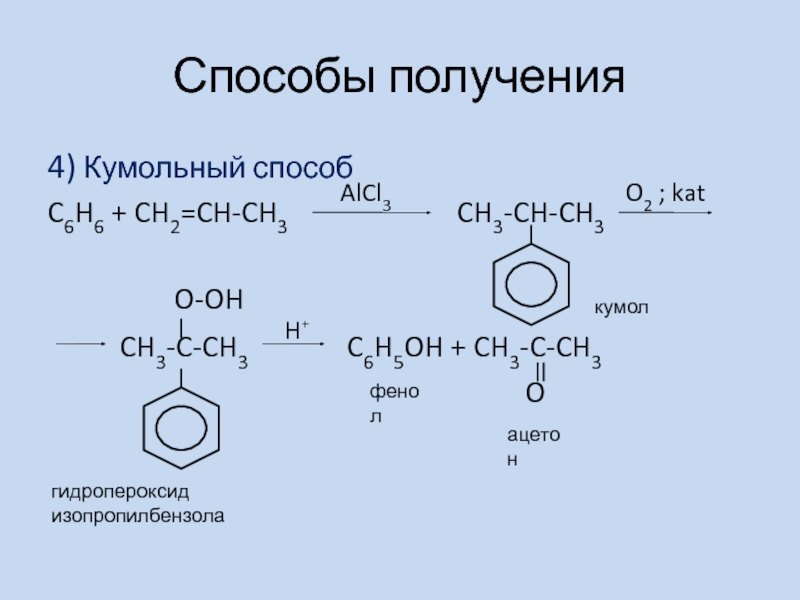
- 13. Способы получения4) Кумольный способ C6H6 + CH2=CH-CH3
- 14. Способы получения3) Взаимодействием галогенаренов со щелочью или
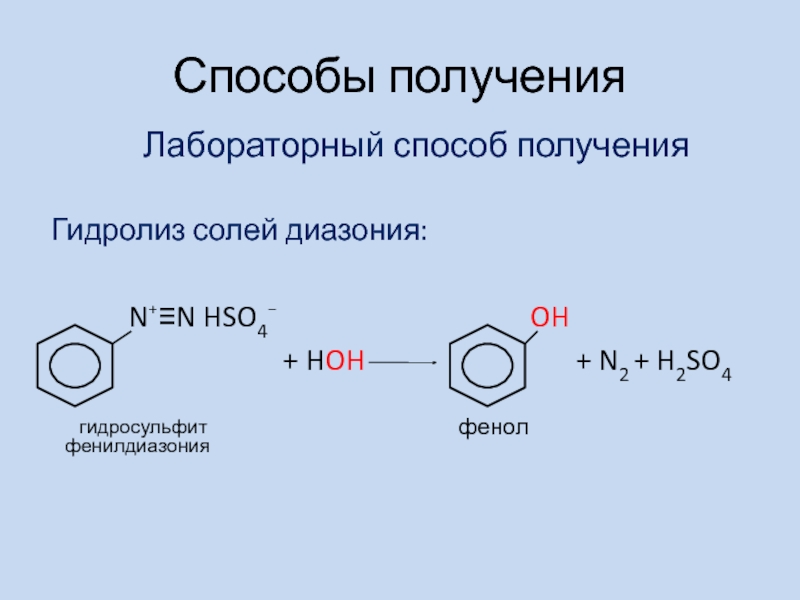
- 15. Способы получения Гидролиз солей диазония:
- 16. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Физические свойства
Бесцветные кристаллические вещества с характерным зпахом
Tпл=40,8 °C
Tкип=181,2°C
Малорастворимые в воде,
хорошо растворимы в органических растворителях
окисленияСлайд 3 Химические свойства ФЕНОЛЫ имеют гидроксильную группу и бензольное кольцо, поэтому реакции
идут и по –OH группе и по бензольному кольцу, что
делает их похожими на спирты и на бензолы1) Диссоциация в водных растворах (проявление кислотных свойств):
C6H5OH + H2O C6H5O‾ + H3O⁺
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов):
C6H5OH + NaOH C6H5ONa + HOH
I.Реакции с участием гидроксильной группы
(сходство со спиртами)
фенол
Фенолят натрия
Слайд 4Химические свойства
3) Взаимодействие с активными металлами с образованием фенолятов:
C6H5OH
+ 2K 2C6H5OK + H2
4) Фенол
(как кислота) слабее H2CO3 :последняя вытесняет фенол из солей:
C6H5ONa + CO2 + HOH C6H5OH + NaHCO3
H2CO3
Фенолят калия
Слайд 5Химические свойства
5) Взаимодействие с галогеналканами(SN):
OH + CH3-Br
O-CH3 + HBr6) Взаимодействие с ангидридами кислот(SN):
OH + CH3-C-Cl O-C-CH3 + HCl
O
O
Метилфениловый эфир
фенилацетат
Слайд 6II.Реакции с участием бензольного кольца (сходство с бензолом)
Галогенирование (SE)
2
OH + 2Cl2
OH + Cl OH + 2HClХимические свойства
Реакции замещения
-OH заместитель I рода, направление в орто- и пара- положения!!!
Cl
О-хлорфенол
П-хлорфенол
Слайд 8Химические свойства
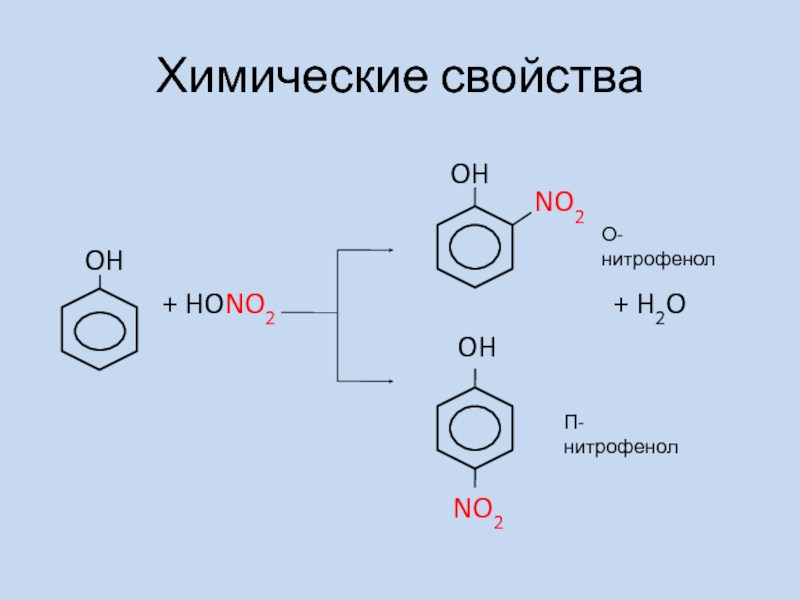
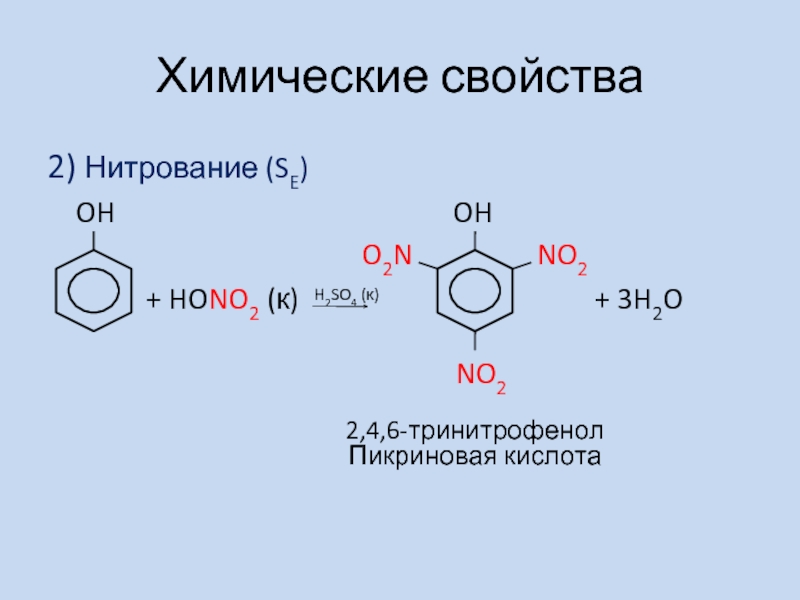
2) Нитрование (SE)
OH
OH
+ HONO2 (к) + 3H2O
NO2
NO2
O2N
H2SO4 (к)
2,4,6-тринитрофенол
Пикриновая кислота
Слайд 9Химические свойства
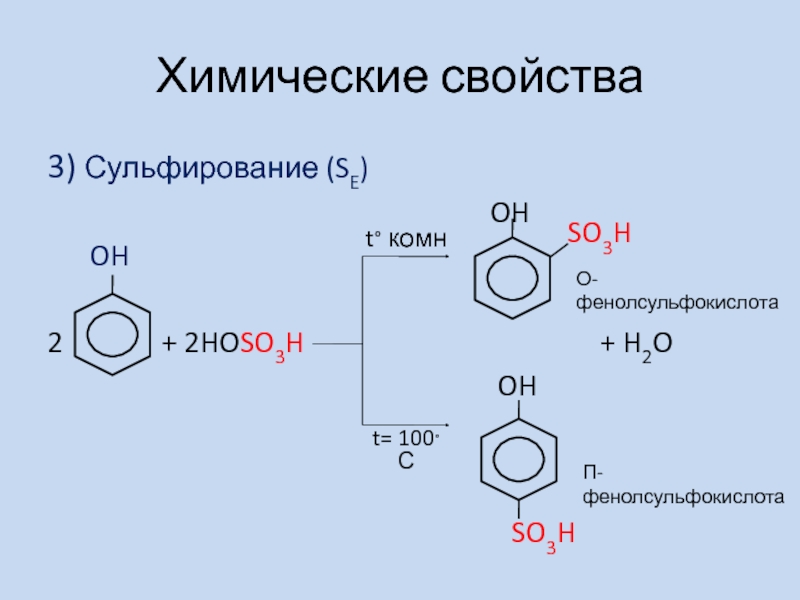
3) Сульфирование (SE)
OH
OH
2 + 2HOSO3H + H2O
OH
SO3H
SO3H
t° комн
t= 100°С
О-фенолсульфокислота
П-фенолсульфокислота
Слайд 11III.Качественные реакции
Взаимодействие с бромной водой
В результате
взаимодействия с бромной водой образуется 2,4,6-трибромфенол — твёрдое вещество белого
цвета.2) Взаимодействие с FeCl3
В результате образуется раствор фиолетового цвета
Химические свойства
Слайд 12Способы получения
Из каменноугольной смолы
1. C6H5OH
+ NaOH C6H5ONa + HOH
2. C6H5ONa + H2SO4 C6H5OH + NaHSO4
2) Сплавлением солей аренсульфокислот со щелочью
SO3Na OH
+ NaOH + Na2SO3
Промышленные способы получения
Промежуточный продукт
300°С
Слайд 13Способы получения
4) Кумольный способ
C6H6 + CH2=CH-CH3
CH3-CH-CH3
O-OHCH3-C-CH3 C6H5OH + CH3-C-CH3
O
AlCl3
O2 ; kat
H⁺
кумол
гидропероксид изопропилбензола
фенол
ацетон
Слайд 14Способы получения
3) Взаимодействием галогенаренов со щелочью или с водяным паром
Cl
OH+ NaOH + NaCl
Cl OH
+ HOH(пар) + HCl
300°С
450-500°С ; Al2O3
Слайд 15Способы получения
Гидролиз солей диазония:
N⁺≡N HSO4⁻
OH+ HOH + N2 + H2SO4
Лабораторный способ получения
гидросульфит фенилдиазония
фенол