Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ФИЗИЧЕСКАЯ ХИМИЯ БИОПОЛИМЕРОВ
Содержание
- 1. ФИЗИЧЕСКАЯ ХИМИЯ БИОПОЛИМЕРОВ
- 2. Растворы ВМС следует рассматривать как промежуточное звено
- 3. Структурной химической основой организмов являются природные высокомолекулярные
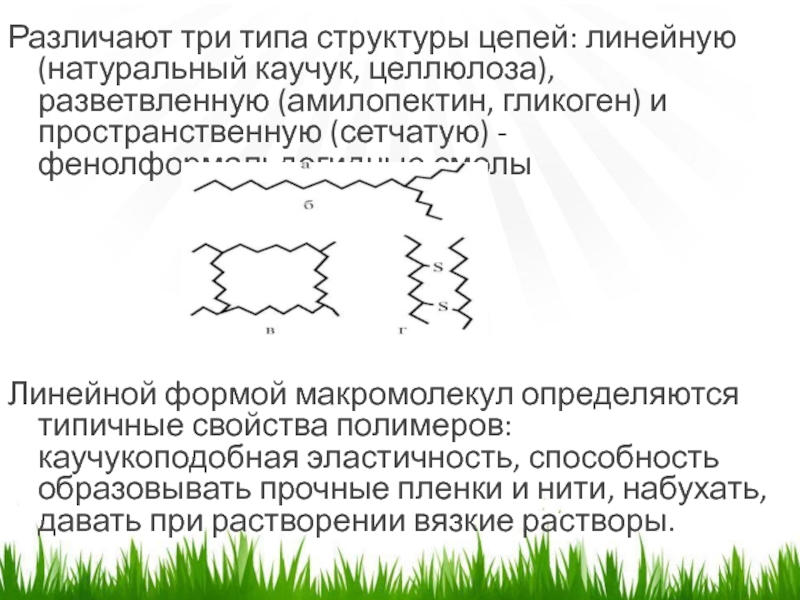
- 4. Различают три типа структуры цепей: линейную (натуральный
- 5. НАБУХАНИЕ ВМС Истинному растворению полимеров часто предшествует процесс
- 6. В зависимости от структуры полимера и температуры
- 7. ВЯЗКОСТЬ ВМСРазличают относительную, удельную, приведённую и характеристическую
- 8. С→0, можно получить величину, называемую предельной приведённой
- 9. Амфотерность аминокислот. В кислой среде будет подавляться
- 10. Белки1. Основным фактором, определяющим структуру белка, является
- 11. 3. Трёхмерная конфигурация полипептидной спирали или β-структуры
- 12. 4. По Берналу четвертичная структура представляет собой
- 13. Молекулярная масса белков и методы её определения.Миоглобин
- 14. Методы определения изоэлектрической точки белков.Изоэлектрическая точка белков
- 15. Свойства белка в ИЭТ.Минимальны:1/ вязкость;2/ гидратация;3/ набухание;4/ растворимость;5/ осмотическое давление;6/ электропроводность;7/ дзета-потенциал.Максимальны:1/ степень коагуляции;2/ желатинирование.
- 16. Закон Вант-Гоффа для неэлектролитов:Р = С
- 17. Биологическое значение онкотического давленияВ норме - 6-8%
- 18. Нарушение устойчивости растворов полимеровКройт - схему
- 19. Дегидратировать частицу можно двумя путями:1. Лишить частицу
- 20. При денатурации наблюдается:1. Изменение вторичной, третичной и
- 21. Денатурацию могут вызвать факторы:а/ нагревание свыше 60°;б/
- 22. В клинике для обнаружения белков -
- 23. Высаливание. - выделение белков путем добавления
- 24. Высаливание зависит от:1/ степени гидратации высаливающего иона-
- 25. Своеобразной формой коагуляции растворов некоторых ВМС, совершающейся
- 26. КОЛЛОИДНАЯ ЗАЩИТА Обладая большой устойчивостью
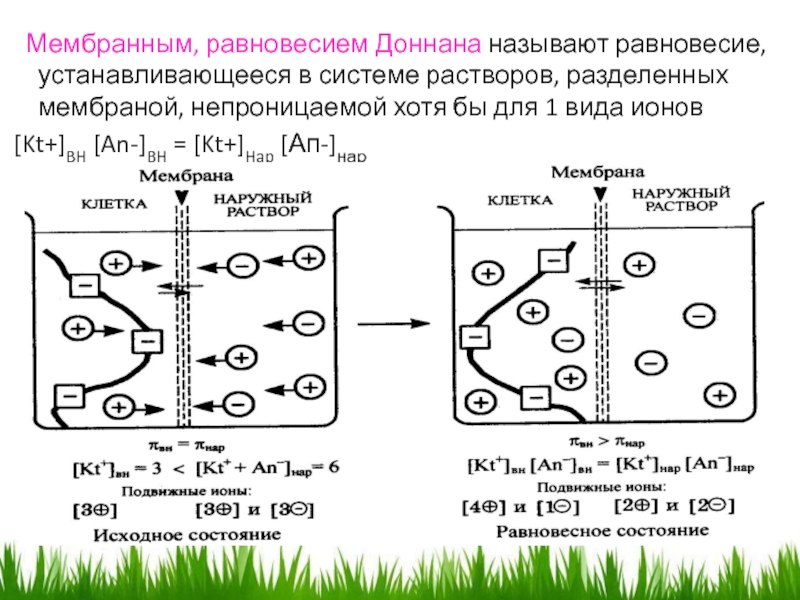
- 27. Мембранным, равновесием Доннана называют равновесие,
- 28. -сквозь мембрану будут проникать подвижные анионы
- 29. Скачать презентанцию
Растворы ВМС следует рассматривать как промежуточное звено между золями и истинными растворами низкомолекулярных веществ.Многие высокомолекулярные соединения (ВМС) являются полимерами с молекулярной массой > 104. Молекулы полимеров состоят из большого числа мономерных
Слайды и текст этой презентации
Слайд 2Растворы ВМС следует рассматривать как промежуточное звено между золями и
истинными растворами низкомолекулярных веществ.
молекулярной массой > 104. Молекулы полимеров состоят из большого числа мономерных звеньев − повторяющихся одинаковых групп атомов. Структурные единицы ВМС − макромолекулы (104-106 г/моль).Слайд 3Структурной химической основой организмов являются природные высокомолекулярные биополимеры: белки, нуклеиновые
кислоты, полисахариды, пектины, натуральный каучук. Природные ВМС характеризуются постоянным значением
молекулярной массы.Синтетические полимеры получаются в результате реакции полимеризации или поликонденсации. К ним относятся: полиэтилен, синтетический каучук, фенолформальдегидные смолы. Синтетические полимеры состоят из смеси макромолекул, различных по длине и массе. Таким образом, ВМС − это обычные органические вещества, молекулы которых имеют очень большой размер.
Слайд 4Различают три типа структуры цепей: линейную (натуральный каучук, целлюлоза), разветвленную
(амилопектин, гликоген) и пространственную (сетчатую) - фенолформальдегидные смолы
Линейной формой
макромолекул определяются типичные свойства полимеров: каучукоподобная эластичность, способность образовывать прочные пленки и нити, набухать, давать при растворении вязкие растворы. Слайд 5НАБУХАНИЕ ВМС
Истинному растворению полимеров часто предшествует процесс набухания. Он заключается
в увеличении объема и массы полимера за счет поглощения им
некоторого количества растворителя. При контакте полимера с растворителем начинается взаимная диффузия молекул растворителя в полимер, а макромолекул полимера − в растворитель. Резкое различие в подвижностях молекул растворителя и макромолекул ВМС является причиной набухания.Количественной мерой набухания является степень набухания α, которая может иметь объемное или массовое выражение:
где V0, V, m0, m – соответственно объемы и массы исходного и набухшего полимера.
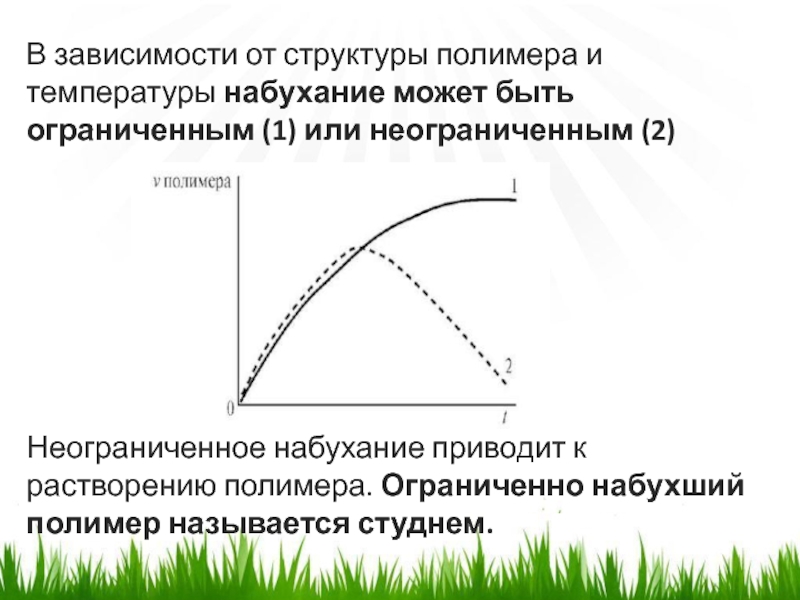
Слайд 6В зависимости от структуры полимера и температуры набухание может быть
ограниченным (1) или неограниченным (2)
Неограниченное набухание приводит к растворению полимера.
Ограниченно набухший полимер называется студнем. Слайд 7
ВЯЗКОСТЬ ВМС
Различают относительную, удельную, приведённую и характеристическую вязкость.
Относительная вязкость:
Удельная вязкость
:
или ηуд = ηотн – 1, где
η —
вязкость раствора;η0 — вязкость растворителя.
Приведённая вязкость:
Слайд 8С→0, можно получить величину, называемую предельной приведённой вязкостью или характеристической
вязкостью:
где [η] — характеристическая вязкость.
Штаудингер
ηуд = К •
М • С, гдеК — константа, характерная для данного гомологического ряда полимеров, не зависящая от природы растворителя.
Определяют М лишь только для коротких цепей или более жёстких.
Уравнение Эйнштейна:
η = η0(1+ 2,5 φ), где φ-объемная концентрация
Слайд 9Амфотерность аминокислот.
В кислой среде будет подавляться диссоциация карбоксильных
групп и белки будут заряжаться положительно, в щелочной среде белки
будут заряжены отрицательно:Заряд белковой молекулы будет зависеть от следующих факторов:
1. От реакции среды.
2. От соотношения свободных карбоксильных и аминных групп, которое у каждого белка будет индивидуальным.
3. От степени диссоциации ионогенных групп белка. Если взять показатели констант диссоциации рКСООН и рКNH2, то чем их величина меньше, тем больше будет соответствующая диссоциация.
Состояние белка, когда заряд равен нулю, называется изоэлектрическим состоянием белка [ИЭС].
Значение рН, при котором белок находится в изоэлектрическом состоянии, называется изоэлектрической точкой белка [ИЭТ].
Слайд 10Белки
1. Основным фактором, определяющим структуру белка, является последовательность аминокислот, -
первичная структуры белка. В первичной структуре белка атомы связаны прочными
ковалентными связями.2. Под вторичной структурой белка понимают конфигурацию полипептидной цепи в пространстве- В 1951 г. Полинг и Кори ( спиральная конфигурация).
Дисульфидные мостики, но основную роль играют водородные связи.
белки [β-кератин волос, фиброин шёлка] образуют не α-спираль, а β‑структуру. Они имеют несколько полипептидных цепей, расположенных параллельно.
Слайд 113. Трёхмерная конфигурация полипептидной спирали или β-структуры в пространстве определяет
её третичную структуру : закручивается в клубок α‑спираль, и β-структура.
Так образуется глобулярная структура [у глобулярных белков].У фибриллярных [нитевидных] белков третичная структура характеризуется:
а/ объединением α-спиралей в многожильный пучок —вторичную спираль;
б/ объединением лент β-структур в многослойную ленту.
Третичную структуру поддерживают:
1. Ионные связи.
2. Водородные связи.
3. Дисульфидные связи.
4. Ван-дер-Ваальсово взаимодействие.
5. Взаимодействие полярных групп с водой.
Слайд 124. По Берналу четвертичная структура представляет собой комплекс субъединиц, способных
к диссоциации. и поддерживается теми же связями и силами, что и
третичная структура.Слайд 13Молекулярная масса белков и методы её определения.
Миоглобин — 16 900
Гемоглобин
— 68 000
Растительный вирус — 10 600 000
Неточно М определяют:
π
осм.= CRT= m/M RTкриоскопический метод ∆t зам. = m/M∙Kкр; (Kкр=1.85 для Н2О)
Наиболее точными - рентгеноструктурный анализ и метод ультрацентрифугирования.
, где
R — газовая постоянная;
Т — абсолютная температура;
S — константа, выражающая скорость седиментации;
D — коэффициент диффузии;
ρ — плотность среды;
V — увеличение объёма при добавлении 1 г белка, или удельный объём
Слайд 14Методы определения изоэлектрической точки белков.
Изоэлектрическая точка белков может быть определена
следующими методами:
1. По величине набухания - Наименьшее набухание будет в
изоэлектрической точке.2. По скорости желатинирования. Быстрее всего желатинирование происходит в изоэлектрической точке.
3. По степени коагуляции -Наиболее выраженное помутнение раствора будет в изоэлектрической точке.
4. По электрофоретической подвижности -В растворе, где рН соответствует изоэлектрической точке белка, белок будет электронейтральным и перемещаться в электрическом поле не будет.
5. Потенциометрическое титрование в сочетании с определением максимальной степени коагуляции.
Слайд 15Свойства белка в ИЭТ.
Минимальны:
1/ вязкость;
2/ гидратация;
3/ набухание;
4/ растворимость;
5/ осмотическое давление;
6/
электропроводность;
7/ дзета-потенциал.
Максимальны:
1/ степень коагуляции;
2/ желатинирование.
Слайд 16Закон Вант-Гоффа для неэлектролитов:
Р = С R Т
для растворов ВМС не выполняется из-за теплового движения отдельных участков
молекул____
Онкотическое давление - часть осмотического давления крови, обусловленная ВМС(белками) [0,04105 Па]
Уравнение Галлера –
где
С — весовая концентрация полимера;
М — молекулярная масса,
К — константа.
1. ↑t в большей мере↑ P из-за увеличения числа частиц т.к.:
а/ повышается степень диссоциации ионогенных групп белков -- -соон ↔ -соо -+ Н+;
б/ нарушается 4-ая структура белков: макроглобулы распадаются на субъединицы.
2.рН среды - В ИЭТ Р min т.к. min диссоциация ионогенных групп
Слайд 17Биологическое значение онкотического давления
В норме - 6-8% белка. Ниже:
I. При
голодании,
2. При нарушении деятельности пищеварительного тракта, когда белки поступают
в организм, но недостаточно хорошо перевариваются и усваиваются.3. при заболеваниях почек, когда нарушается процесс ультрафильтрации и в мочу попадают альбумины крови и выводятся из организма.
Слайд 18
Нарушение устойчивости растворов полимеров
Кройт - схему осаждения коллоидов:
а/ удаление
водной оболочки частиц водоотнимающим средством [например, спиртом];
б/ снятие заряда частиц
при добавлении электролита, главным фактором устойчивости у них является водная оболочка
Слайд 19Дегидратировать частицу можно двумя путями:
1. Лишить частицу свойства гидрофильности, изменив,
перестроив структуру. Таким процессом является денатурация.
2. Отнять у частицы гидратационную
воду, не лишая частицу свойства гидрофильности. Таким процессом является высаливание белков.Денатурация — это любое негидролитическое нарушение структуры нативного белка, которое приводит к изменению физических, химических и биологических свойств, присущих данному белку.
Гидролитическое нарушение – разрушение первичной структуры
Слайд 20При денатурации наблюдается:
1. Изменение вторичной, третичной и четвертичной структуры белка
2. Уменьшение растворимости [за счет развертывания молекул и появления снаружи
гидрофобных гомополярных группировок].3. Изменение формы и размеров молекул.
4. Изменение удельной оптической активности.
5. Изменение реактивности некоторых химических группировок [например, сульфгидрильных групп, образующихся вместо дисульфидных групп].
6. Уменьшение или потеря биологической активности [в образовании активных центров ферментов участвует третичная структура, а при денатурации эта структура нарушается].
7. При денатурации увеличивается вязкость и
8. утрачивается способность к набуханию.
Слайд 21Денатурацию могут вызвать факторы:
а/ нагревание свыше 60°;
б/ ультразвук;
в/ многократное замораживание
и оттаивание;
г/ высокое давление;
д/ ультрафиолетовое и ионизирующее излучения;
е/ действие солей
тяжелых металлов;ж/ изменение рН среды;
з/ действие кислот;
и/ действие алкалоидных реактивов;
к/ действие мочевины и т.д.
Денатурации обычно сопровождается коагуляцией и седиментацией.
Слайд 22В клинике для обнаружения белков - денатурирующее действие органических и
неорганических кислот. -Чувствительной реакцией на белок является реакция с сульфосалициловой кислотой,
-на втором месте по чувствительности стоит реакция с концентрированной азотной кислотой.
-Алкалоидные реактивы [например, танин] т.к. в белках содержатся гетероциклы, характерные для алкалоидов.
- действием солей тяжелых металлов
-не применяют концентрированную соляную и концентрированную серную кислоту, так как образующиеся осадки растворяются в избытке растворителя.
Слайд 23
Высаливание. - выделение белков путем добавления высоких концентраций нейтральных
солей (не подвергающихся гидролизу)
Отличие от коагуляции - при высаливании частицы
осаждаются не укрупняясь. К высаливанию совершенно неприменимо правило Шульце-Гарди. Слайд 24Высаливание зависит от:
1/ степени гидратации высаливающего иона- от положения ионов
в лиотропных рядах Гофмейстера (все ионы слева от хлора обладают
высаливающим действием)C2O42- > SO42- > СН3СОО- > CI- > Br - > I- > CNS-
2/ от рН среды [в ИЭТ max - плотная глобулярная структура, плохо удерживающая воду — ионогенные группы и полярные группы спрятаны];
3/ от концентрации электролита;
4/ от температуры [при повышенной температуре дегидратируется и белок, и соль, тут важно, что больше.
Слайд 25Своеобразной формой коагуляции растворов некоторых ВМС, совершающейся при изменении температуры,
рН, под действием солей является процесс коацервации. От высаливания коацервация
отличается тем, что ВМС не выделяется сразу в виде хлопьев, которые уплотняются в осадок.Слайд 26КОЛЛОИДНАЯ ЗАЩИТА
Обладая большой устойчивостью по отношению к
действию электролитов, растворы ВМС, будучи прибавлены в определенном количестве к
золям, значительно повышают их агрегативную устойчивость. Это явление получило название защитного действия или защиты. Защитное действие растворов ВМС зависит от природы вещества и природы защищаемого им золя. Количественно оно характеризуется так называемым золотым числом, которое выражается минимальным числом миллиграммов сухого ВМС, которое предохраняет 10см3 красного гидрозоля золота от перемены окраски при добавлении к нему 1 см3 10%-ного раствора хлорида натрия.Слайд 27 Мембранным, равновесием Доннана называют равновесие, устанавливающееся в системе
растворов, разделенных мембраной, непроницаемой хотя бы для 1 вида ионов
[Kt+]BH [An-]BH = [Kt+]Hap [Ап-]нарСлайд 28 -сквозь мембрану будут проникать подвижные анионы ( Cl-), увлекая
за собой катионов Na+.
-движение катионов обусловлено не только диффузией,
но и их электростатическим взаимодействием с анионами. -этот переход будет осуществляться до тех пор, пока произведение количества подвижных ионов по обе стороны мембраны не выровняется
Количество ионов, которые проходят внутрь клетки
X= c2 нар. /2Снар + С внутр.
Эффект Доннана :
-к повышению осмотического давления в клетке и уменьшению его снаружи (поддерживается в состоянии тургора).
- за счет присутствия в клетке солей белка сумма концентраций подвижных ионов внутри клетки всегда будет больше, чем в наружном растворе - возникает мембранный потенциал..





![ФИЗИЧЕСКАЯ ХИМИЯ БИОПОЛИМЕРОВ С→0, можно получить величину, называемую предельной приведённой вязкостью или характеристической вязкостью: С→0, можно получить величину, называемую предельной приведённой вязкостью или характеристической вязкостью: где [η] — характеристическая вязкость.Штаудингер ηуд](/img/thumbs/2030fc3d802ce3eb24e0dac2fad7a845-800x.jpg)









![ФИЗИЧЕСКАЯ ХИМИЯ БИОПОЛИМЕРОВ Нарушение устойчивости растворов полимеровКройт - схему осаждения коллоидов:а/ удаление водной Нарушение устойчивости растворов полимеровКройт - схему осаждения коллоидов:а/ удаление водной оболочки частиц водоотнимающим средством [например, спиртом];б/](/img/thumbs/d074be4d5b85eab94a35b2718357412f-800x.jpg)