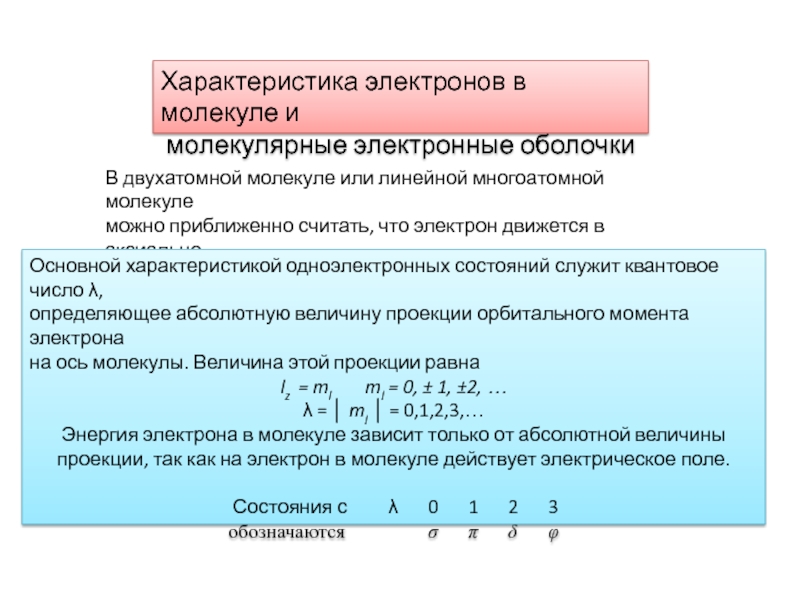
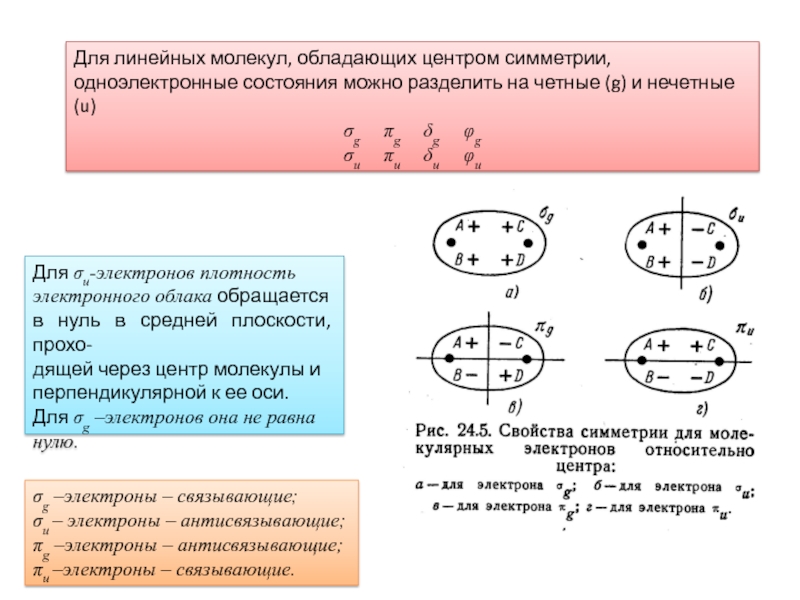
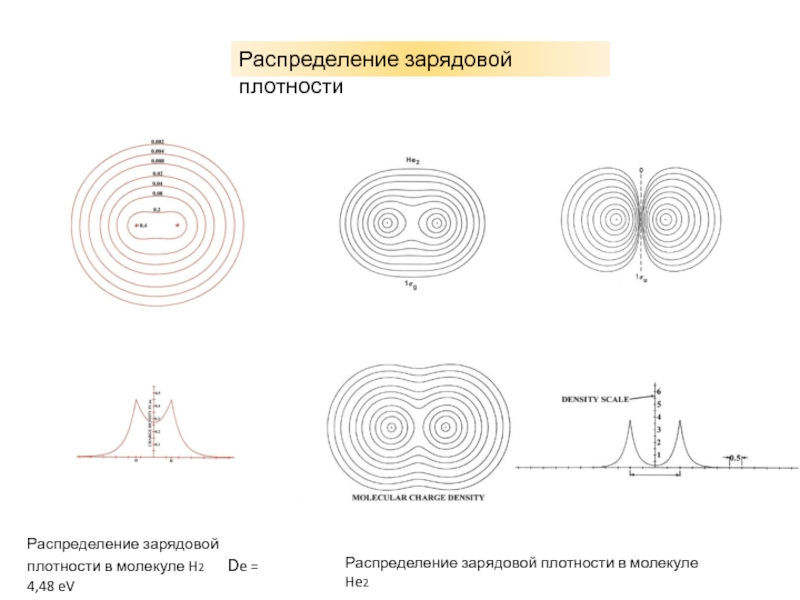
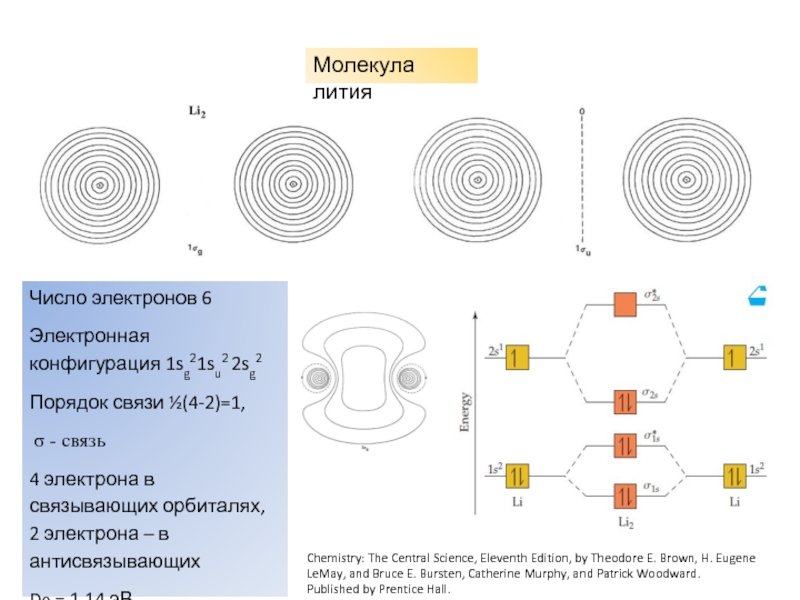
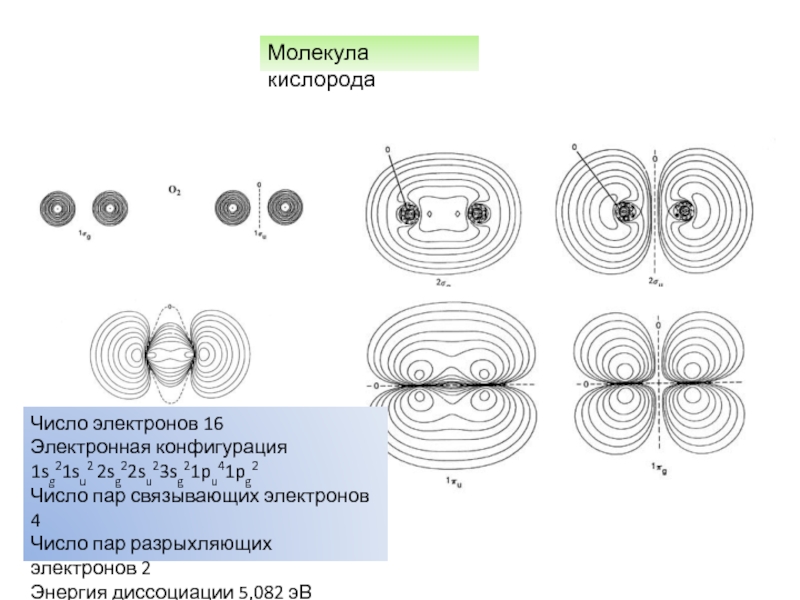
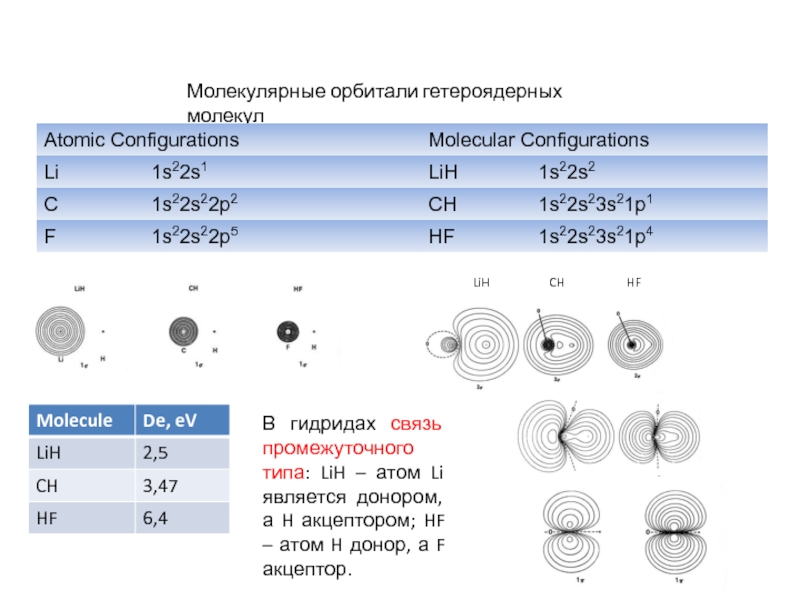
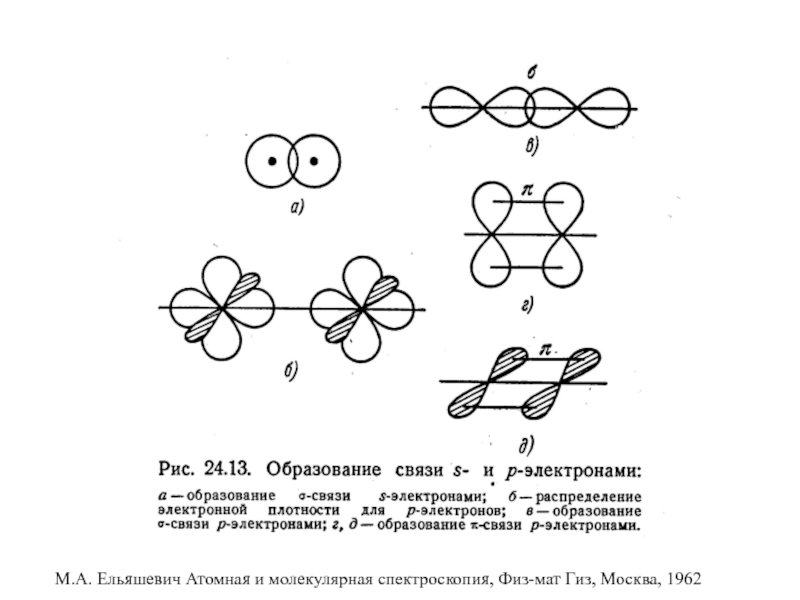
характеристики электронных состояний важны:
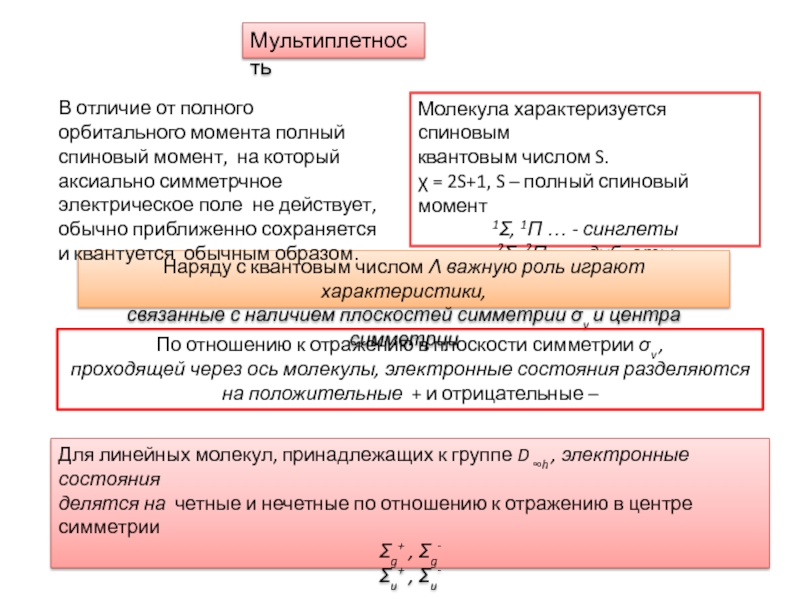
Свойства симметрии;
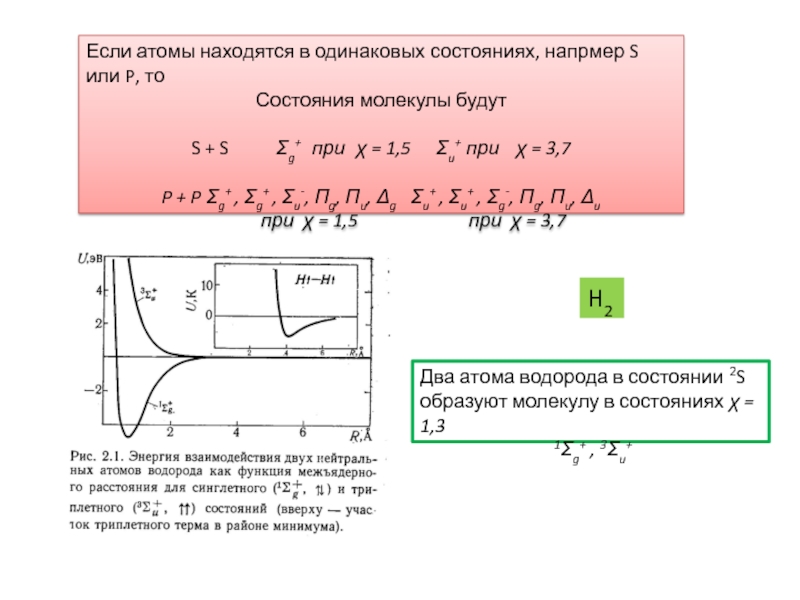
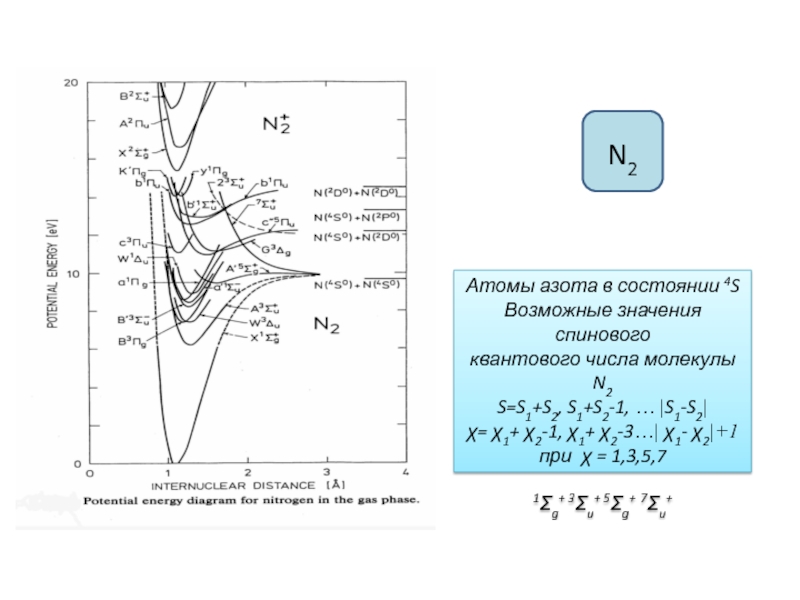
Зависимость электронной энергии от межъядерного расстояния,
т.е. потенциальные кривые.Два подхода, использующиеся при характеристике электронных состояний молекул
Рассмотрение состояний молекулы в целом
Определение молекулярных термов из состояний отдельных атомов