Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физика твердого тела Курс лекций 1.КВАНТОВАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА 2. ОСНОВНЫЕ
Содержание
- 1. Физика твердого тела Курс лекций 1.КВАНТОВАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА 2. ОСНОВНЫЕ
- 2. 1.КВАНТОВАЯ ТЕОРИЯ СТРОЕНИЯ АТОМАПервая, соответствующая известным
- 3. Квантовая теория атома Бора. Основана на двух
- 4. Расчет радиуса электронной орбиты для атома водорода.
- 5. Найдем r из этого равенства: Так как
- 6. Энергия электрона на основной орбитеЭнергия электрона в
- 7. Полная энергия : Подставим выражение для r
- 8. Второй постулат Бора.Если газ нагреть до температуры
- 9. На основе второго постулата Бора можно объяснить
- 10. Развитие теории Бора С развитием экспериментальной техники
- 11. 2 ОСНОВНЫЕ ПРИНЦИПЫ КВАНТОВОЙ МЕХАНИКИКорпускулярные и волновые
- 12. Для установившихся стоячих волн на круговой орбите
- 13. Если это предположение оправданное, то электроны должны
- 14. 2.2 ПРИНЦИП НЕОПРЕДЕЛЕННОСТИОдним из важнейших следствий корпускулярно-волнового
- 15. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Физика твердого тела
Курс лекций
1.КВАНТОВАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА
2. ОСНОВНЫЕ ПРИНЦИПЫ
КВАНТОВОЙ МЕХАНИКИ
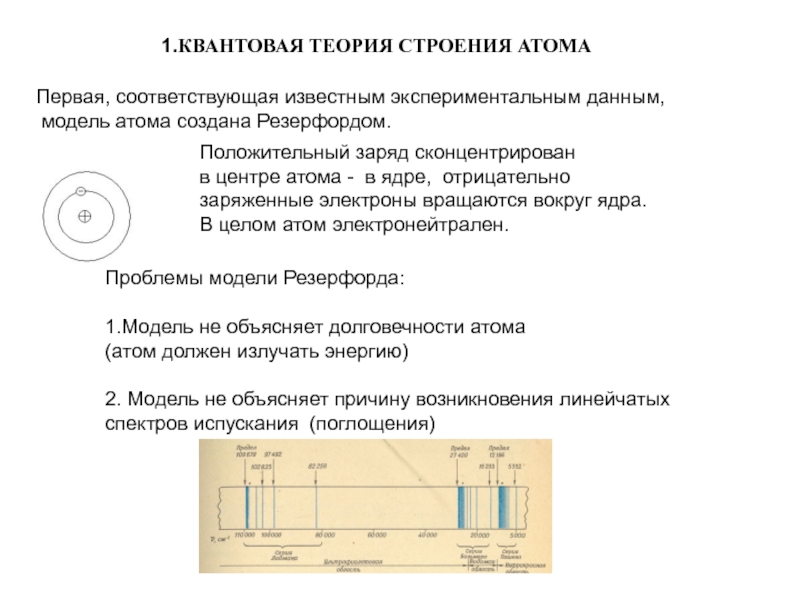
Слайд 2 1.КВАНТОВАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА
Первая, соответствующая известным экспериментальным данным,
модель
атома создана Резерфордом.
Положительный заряд сконцентрирован
в центре атома -
в ядре, отрицательно заряженные электроны вращаются вокруг ядра.
В целом атом электронейтрален.
Проблемы модели Резерфорда:
1.Модель не объясняет долговечности атома
(атом должен излучать энергию)
2. Модель не объясняет причину возникновения линейчатых
спектров испускания (поглощения)
Слайд 3Квантовая теория атома Бора.
Основана на двух постулатах (Бора):
Первый
постулат Бора:
Электрон движется по стационарным орбитам и не излучает энергию.
Критерием стационарности является условие:
где: m- масса электрона, -скорость, r-радиус орбиты,
n-целое число, mvr- момент импульса электрона.
h – постоянная Планка 6.626 *10-34 Дж с
Если принять
, то
Стационарные орбиты дискретны, меняются со значением n=1,2,3,… .
Слайд 4Расчет радиуса электронной орбиты для атома водорода.
Электростатическая сила притяжения
электрона к ядру в атоме водорода
где r - расстояние от
электрона до ядра.Центробежная сила, действующая на электрон при движении по
круговой орбите радиусом r равна:
,
Fц=Fэ
Так как
Слайд 5Найдем r из этого равенства:
Так как
Тогда подставляем и
получаем :
. (3)
При п =1 реализуется основное состояние
5,2910-11 м (0,529Å).
Теоретический расчет в целом совпадает с экспериментальными
измерениями размера атома водорода.
Слайд 6Энергия электрона на основной орбите
Энергия электрона в атоме (Е) складывается
из его кинетической Ек
и потенциальной энергии Еп:
Е= Ек+ Еп.
При
r En0 , На расстоянии r от ядра:
Кинетическая энергия:
Мы не знаем скорость электрона, но феноменологических представлений о том,
что сила притяжения к ядру равна центростремительной силе, можно записать:
, отсюда
Слайд 7Полная энергия :
Подставим выражение для r :
,
Или
где
Или
(1312 кДж/моль).
Энергия электрона является дискретной величиной и
зависит от целого числа n.
Число п – номер стационарной орбиты для движения электрона.
С увеличением n энергия стремиться к 0.
Слайд 8Второй постулат Бора.
Если газ нагреть до температуры 5000-7000 К, то
газ начинает светиться.
Процессы свечения газа происходят на звездах, в
плазме.Излучаемый свет можно разложить по длине волны. Обнаружено, что
в спектре наблюдаются отдельные полосы повышенной интенсивности.
Это находилось в противоречии с излучением так называемого
«черного тела» нагретого до высоких температур. Например, металл
при температуре плавления).
Для объяснения излучения атомом Бор предположил (постулировал), что
электрон переходит с одной орбиты на другую, то есть из одного
состояния в другое, при этом излучается квант энергии hv.
Слайд 9На основе второго постулата Бора можно объяснить природу
линейчатых спектров
испускания.
Диаграмма энергетических уровней, объясняющая наблюдаемый
спектр атомарного водорода, может рассматриваться
как графическое представление уравнения Ридберга, описывающего частоты излучения:Слайд 10Развитие теории Бора
С развитием экспериментальной техники выяснилось, что в
спектре
испускания водорода и других атомов каждая линия не является
сплошной, а состоит из нескольких близко расположенных линий.
Это означало, что определенному значению главного квантового
числа n соответствует не одна орбита, а несколько.
На основе этих фактов теория Бора была усовершенствована Зоммерфельдом,
который предположил что орбиты бывают не только круговыми, но более сложной
Формы. Для обозначения формы было введено побочное квантовое число
L – орбитальное квантовое число, принимающее значение: L = 0,1,2,…(n-1) .
Позднее выяснилось, что при наложении магнитного поля линии в спектрах
испускания расщепляются еще больше. Этот эффект называется эффектом
Зеемана. Он означает, что при одинаковой Форме орбиты могут иметь
различную ориентацию. Число ориентаций m = -L, (-L+1),...,0,1,.., L.
Наконец, было открыто, что электрон вращается вокруг своей оси.
Это свойство называется спином.
Спин характеризуется спиновым квантовым числом: s =±1/2.
Слайд 112 ОСНОВНЫЕ ПРИНЦИПЫ КВАНТОВОЙ МЕХАНИКИ
Корпускулярные и волновые явления
К началу
20 века у ученых было твердое убеждение, что все физические
явления можно подразделить типа на материальные (классические) и волновые:Дискретное устройство материи.
Волновая природа света.
Есть связь между этими явлениями?
Планк, Эйнштейн и Бop показали, что свет при наблюдении в определенных условиях способен проявлять корпускулярные свойства.
(фотоэффект).
В 1924 г. Луи де Бройль выдвинул гипотезу, что и, наоборот, все материальные объекты обладают волновыми свойствами.
Возникал вопрос, нельзя ли перенести представления о волнах в теорию строения атома, предложенную Бором?
Если электрон волна, то на атомной орбите он может существовать как стоячая волна.
Стоячие волны на круговой орбите могут существовать только при условии, если длина орбиты равна целому числу длин волн.
Если это условие не выполняется, волны погашают друг друга.
Слайд 12Для установившихся стоячих волн на круговой орбите длина последней должна
быть равна целочисленному кратному от длины волны:
Но из исходного
предположения Бора о квантовании момента импульса электрона следует, что
Представление об установившихся стоячих волнах на орбите приводит к
соотношению:
:
.
Де Бройль выдвинул предположение, что это соотношение имеет
универсальный характер. Он предложил считать, что с каждой
частицей связана волна. Длина волны зависит от массы частицы
и скорости ее движения. .
Формула Де Бройля
Слайд 13Если это предположение оправданное, то электроны должны давать
при прохождении
сквозь кристаллы дифракционную картину, подобную той,
которую наблюдал фон Лауэ
с рентгеновскими лучами В 1927 г. Дэвидсон и Джермер продемонстрировали, что при прохождении
металлической фольги электроны дают точно такую же дифракционную
картину, как и рентгеновские лучи, и что соотношение де Бройля правильно
определяет длину волны пучка электронов.
Дифракция рентгеновских лучей и электронных волн (б)
алюминиевой фольгой
Сходство между двумя картинами является подтверждением
волновых свойств частиц.
Слайд 142.2 ПРИНЦИП НЕОПРЕДЕЛЕННОСТИ
Одним из важнейших следствий корпускулярно-волнового дуализма
(двойственности) материи
является принцип неопределенности,
установленный в 1927 г. Вернером Гейзенбергом (1901-1976).
Гейзенберг высказал гипотезу о невозможности одновременного
определения положения и импульса частицы с абсолютной точностью.
Это положение выражается соотношению неопределенности Гейзенберга
Положение электрона е в фиксированный момент времени может быть определено с помощью «супермикроскопа», в котором используется свет малой длины волны. Однако фотоны света с малой длиной волны обладают большой энергией и, следовательно, имеют большой импульс. Столкновение одного из таких фотонов с электроном мгновенно изменяет импульс электрона. Следовательно, чем точнее определяется положение электрона, тем менее определенным становится его импульс