Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ГЕННАЯ ИНЖЕНЕРИЯ
Содержание
- 1. ГЕННАЯ ИНЖЕНЕРИЯ
- 2. Генная инженерия – это больше, чем наука.
- 3. Генная инженерия полноценно зародилась в 70-х годы
- 4. Сегодня генная инженерия используется во многих сферах.
- 5. Слайд 5
- 6. Объекты генной инженерииНаиболее часто объектами для исследования
- 7. Для чего нужна генная инженерия?К середине ХХ
- 8. Этапы создания трансгенного организмаВыделение изолированного гена с
- 9. Безопасна ли генная инженерия?Во-первых, генная инженерия остаётся
- 10. Генная инженерия в медицине — уникальные технологии
- 11. Первый успех ГМОПоследствия такого тяжелого заболевания, как
- 12. В 1978 году Артур Риггс и Кэйити
- 13. Генные вакциныВ последние десятилетия правительства многих стран
- 14. Исцеление на генетическом уровнеСледующей ступенью эволюции биотехнологий
- 15. 30 августа 2017 года свершилось историческое событие,
- 16. Некоторым гематологическим, кардиологическим, эндокринологическим и противовирусным лекарствам
- 17. Когда вопрос встает таким «ребром», тысячи подопытных
- 18. Невероятные примеры генной инженерииЭко-свиньяЭко-свинья, или как критики
- 19. Светящиеся в темноте котыВ 2007 году южнокорейский
- 20. Борющиеся с загрязнениями растенияУченые Вашингтонского университета работают
- 21. Ядовитая капустаУченые недавно выделили ген, отвечающий за
- 22. Скачать презентанцию
Слайды и текст этой презентации
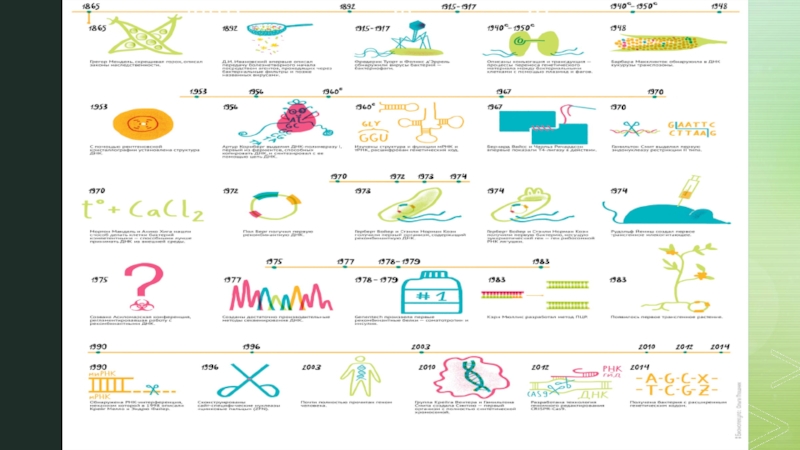
Слайд 3Генная инженерия полноценно зародилась в 70-х годы XX века в
США
Именно в этот период сложились удачные экономические, политические и научные
условия. Предпосылки для формирования генной инженерии начали закладываться еще в 19 веке. На тот момент миру уже были известны законы наследственности Менделя. В 1869 г. И. Мишер открыл факт существования ДНК, в 1910 г. профессор Т. Морган обнаружил, что гены расположены линейно на хромосомах и образуют группы сцепления. А уже в 1953 г. было сделано важнейшее открытие - Дж. Уотсон и Ф. Крик установили молекулярную структуру ДНКК началу 60-х учеными были изучены свойства генетического кода, а к концу 60-х годов его универсальность была подтверждена опытным путем. Именно в тот период установилось активное развитие генетики, объектами которой были вирусы и плазмиды. Были разработаны методы выделения высокоочищенных препаратов неповрежденных молекул ДНК, плазмид и вирусов. Их ДНК вводили в клетки в биологически активной форме, обеспечивая ее репликацию и экспрессию соответствующих генов. В 70-х годах был открыт ряд ферментов, катализирующих реакции превращения ДНК. И, все-таки, датой рождения генетической инженерии считается 1972 год, когда в Стенфордском университете П. Берг, С. Коэн, Х. Бойер и их научная группа создали первую рекомбинантную ДНК, содержавшую фрагменты ДНК вируса и бактериофага.
Слайд 4Сегодня генная инженерия используется во многих сферах. Например, на основе
генной инженерии сформировалась отрасль фармацевтической промышленности, называемая “индустрия ДНК” и
представляющая собой одну из современных ветвей биотехнологии. В медицине применяется инсулин человека (хумулин), полученный посредством рекомбинантных ДНК. Генная инженерия за короткий срок оказала огромное влияние на развитие различных молекулярно-генетических методов и позволила существенно продвинуться на пути познания генетического аппарата.Слайд 6Объекты генной инженерии
Наиболее часто объектами для исследования генной инженерии становятся
микроорганизмы, клетки растений и низших животных, однако ведутся исследования и
на клетках млекопитающих, и даже на клетках человеческого организма. Как правило, непосредственным объектом исследования является молекула ДНК, очищенная от прочих клеточных веществ. При помощи энзимов ДНК расщепляется на отдельные отрезки, причём важно уметь распознавать и выделять нужный отрезок, переносить его при помощи энзимов и встраивать в структуру другой ДНК. Современные методики уже позволяют достаточно свободно манипулировать отрезками генома, размножать нужный участок наследственной цепи и вставлять его на место другого нуклеотида в ДНК реципиента. Накоплен достаточно большой опыт и собрана немалая информация по закономерностям строения наследственных механизмов. Как правило, преобразованиям подвергаются сельскохозяйственные растения, что уже позволило существенно повысить результативность основных продовольственных культур.Слайд 7Для чего нужна генная инженерия?
К середине ХХ века традиционные методы
селекции перестали устраивать учёных, так как это направление обладает рядом
серьёзных ограничений:невозможно скрещивать неродственные виды живых существ;
процесс рекомбинации генетических признаков остаётся неуправляемым, и необходимые качества у потомства появляются в результате случайных комбинаций, при этом очень большой процент потомства признаётся неудачным и отбрасывается в ходе селекции;
точно задать нужные качества при скрещивании невозможно;
селекционный процесс занимает годы и даже десятилетия
Естественный механизм сохранения наследственных признаков является чрезвычайно стойким, и даже появление потомства с нужными качествами не даёт гарантии сохранения этих признаков в последующих поколениях. Генная инженерия позволяет преодолеть все вышеперечисленные затруднения. С помощью трансгенных технологий можно создавать организмы с заданными свойствами, заменяя отдельные участки генома другими, взятыми у живых существ, принадлежащих к другим видам. При этом сроки создания новых организмов существенно сокращаются. Необязательно закреплять нужные признаки, делая их наследуемыми, так как всегда есть возможность генетически модифицировать следующие партии, поставив процесс буквально на поток.
Слайд 8Этапы создания трансгенного организма
Выделение изолированного гена с нужными свойствами. Сегодня
для этого существуют достаточно надёжные технологии, есть даже специально подготовленные
библиотеки генов.Ввод гена в вектор для переноса. Для этого создаётся специальная конструкция – трансген, с одним или несколькими отрезками ДНК и регуляторными элементами, который встраивается в геном вектора и подвергается клонированию при помощи лигаз и рестриктаз. В качестве вектора обычно используются кольцеобразные бактериальные ДНК – плазмиды.
Встраивание вектора в организм реципиента. Этот процесс скопирован с аналогичного природного процесса встраивания ДНК вируса или бактерии в клетки носителя и действует таким же образом.
Молекулярное клонирование. При этом клетка, подвергшаяся модификации, успешно делится, производя множество новых дочерних клеток, которые содержат изменённый геном и синтезируют белковые молекулы с заданными свойствами.
Отбор ГМО. Последний этап ничем не отличается от обычной селекционной работы.
Слайд 9Безопасна ли генная инженерия?
Во-первых, генная инженерия остаётся ещё достаточно новым
направлением биотехнологий, и статистика, позволяющая делать объективные выводы об этой
проблеме, пока что не успела накопиться.Во-вторых, огромные вложения в генную инженерию со стороны транснациональных корпораций, занимающихся производством продуктов питания, могут служить дополнительной причиной отсутствия серьёзных исследований.
Впрочем, в законодательствах многих стран появились нормы, обязывающие производителей указывать наличие продуктов из ГМО на упаковке товаров пищевой группы. В любом случае, генная инженерия уже продемонстрировала высокую результативность своих технологий, а её дальнейшее развитие обещает людям ещё больше успехов и достижений.
Вопрос, насколько безопасны трансгенные технологии, периодически поднимается как в научной среде, так и в СМИ, далёких от науки. Однозначного ответа на него нет до сих пор.
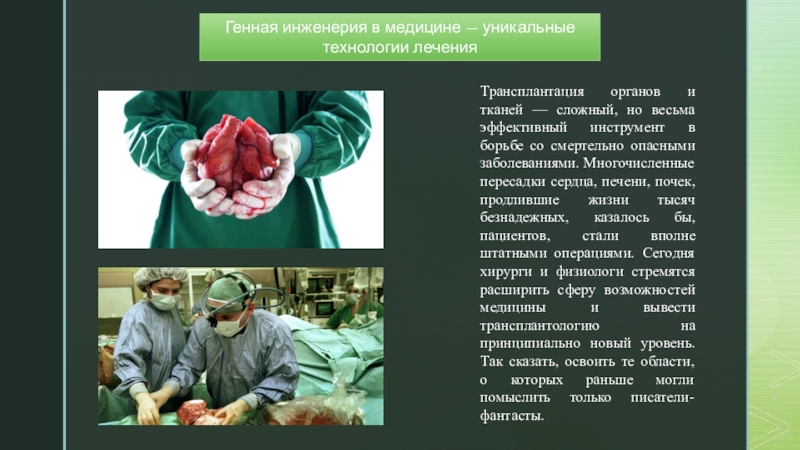
Слайд 10Генная инженерия в медицине — уникальные технологии лечения
Трансплантация органов и
тканей — сложный, но весьма эффективный инструмент в борьбе со
смертельно опасными заболеваниями. Многочисленные пересадки сердца, печени, почек, продлившие жизни тысяч безнадежных, казалось бы, пациентов, стали вполне штатными операциями. Сегодня хирурги и физиологи стремятся расширить сферу возможностей медицины и вывести трансплантологию на принципиально новый уровень. Так сказать, освоить те области, о которых раньше могли помыслить только писатели-фантасты.Слайд 11Первый успех ГМО
Последствия такого тяжелого заболевания, как диабет, известны во
всем мире. В первую очередь оно поражает сердечно-сосудистую и нервную
системы, что влечет за собой угнетение всех функций организма. Ежегодно миллионы людей пополняют печальную статистику заболевших, и единственное, по сути, на что могут положиться диабетики, — это инсулин.Вплоть до 80-х годов прошлого века препарат производился по технологии 1925 года — путем извлечения гормона из коровьей или свиной поджелудочной железы. Такой способ производства едва покрывал 10% потребностей. Учитывая же современные темпы распространения болезни, он не справился бы со столь массовым спросом на инсулин даже с применением полусинтетических методик. Широкодоступный сейчас препарат стал бы критически дефицитным, если бы не прорыв, совершенный совместными усилиями ученых из НИИ Бекмана и биотехнологической корпорации Genentech.
Слайд 12В 1978 году Артур Риггс и Кэйити Итакура при участии
Герберта Бойера успешно использовали технологию рекомбинантной ДНК для внедрения гена
синтеза человеческого инсулина в геном бактерий — пекарских дрожжей и кишечной палочки. Клетки полученных в результате эксперимента генетически модифицированных бактерий успешно росли, делились и в результате своей незатейливой жизнедеятельности вырабатывали инсулин, идентичный человеческому.Синтетический человеческий инсулин стал первым одобренным для использования лекарством, полученным путем генной инженерии. По сей день он считается одним из лучших препаратов, поддерживающих жизнь диабетиков по всему миру, а испытанная при его создании технология прочно вошла в обиход фармацевтических предприятий. Уже в 2000 году количество лекарств, полученных аналогичным путем, перевалило за сотню и продолжает расти
Слайд 13Генные вакцины
В последние десятилетия правительства многих стран дали добро на
разработку инновационных вакцин. Причины развязывания рук исследователей на государственном уровне
вполне понятны: катастрофическое распространение устойчивых к антибиотикам микроорганизмов, рост числа заболевших теми инфекциями, с которыми раньше удавалось успешно справляться, банальное отсутствие эффективных вакцин против туберкулеза, СПИДа и малярии…Для создания прививок методами генной инженерии из ДНК патогенного организма выделяется ген, кодирующий продукцию вызывающего иммунную реакцию белка, после чего ген встраивается в плазмиду, стабильную молекулу ДНК нейтрального микроорганизма, например дрожжевой бактерии.
К сожалению, большинство подобных препаратов пока еще обладают недостаточной иммуногенностью, но работы по исправлению этого недостатка ведутся неустанно.
Готовый антиген вводят в культуру для последующего самокопирования путем клеточного деления, после чего молекулу вновь выделяют, очищают и используют в качестве вакцины.
Слайд 14Исцеление на генетическом уровне
Следующей ступенью эволюции биотехнологий в медицине стала
генотерапия, хоть ее методы пока находятся на стадии экспериментальных разработок.
В ее основе лежит будоражащая воображение идея о коррекции наследственных и приобретенных генетических недостатков живого организма.Важнейшая проблема, препятствующая внедрению генной терапии в медицинскую практику уже сейчас, — обеспечение эффективной трансфекции, доставки генов к клеткам-«мишеням». Наиболее перспективными считаются методики транспортировки встроенной в плазмиду модифицированной ДНК или молекулы в составе неонкогенных вирусных частиц.
Согласитесь, подобные замыслы привычнее видеть на страницах научно-фантастических романов. Тем не менее будущее планирует наступить раньше, чем может показаться.
Слайд 1530 августа 2017 года свершилось историческое событие, которое в ближайшие
годы полностью изменит процесс лечения онкологии. Экспертный совет американского Управления
по контролю продуктов питания и лекарств (FDA) единогласно одобрил генную терапию острого лимфобластного лейкоза детей и взрослых до 25 лет, разработанную группой ученых из Университета Пенсильвании и компании Novartis. С помощью модифицированного вируса иммунодефицита в собственные Т-лимфоциты пациента внедряется ген, помогающий распознавать и уничтожать злокачественные клетки. Звучит невероятно, но ВИЧ в буквальном смысле «учит» клетки организма бороться с раком!Правда, успевший снискать славу революционного препарат, выпущенный на рынок под названием Kymriah, еще далеко не совершенен. Из-за ряда опасных побочных действий его можно применять только в клиниках под надзором прошедших специальную подготовку докторов. Хотя тот факт, что во время испытаний у 83% пациентов с острым лейкозом наступила ремиссия, позволяет решиться на этот рискованный шаг с оптимизмом.
В дальнейшем генная терапия сможет применяться для исправления дефектов центральной нервной системы, заболеваний сердца и сосудов, гемофилии, коррекции иммунного ответа (в т. ч. ВИЧ) и даже мутаций генома.
Слайд 16Некоторым гематологическим, кардиологическим, эндокринологическим и противовирусным лекарствам жизненно необходимо максимально
соответствовать естественным аналогам в человеческом организме. В этом плане синтетические
препараты имеют ряд неоспоримых преимуществ. Во-первых, в отличие от лекарств, получаемых из секреции животных, они аналогичны человеческим по структуре. Во-вторых, генная модификация в фармацевтике позволила отказаться от неподдающегося полной очистке специфического сырья, как, например, гипофизы трупов или моча женщин в менопаузе. И в-третьих, решающим фактором нередко оказывается дешевизна и рациональность производства. Для производства 200 граммов очищенного порошка инсулина необходима 1000 литров питательной среды, населенной генетически модифицированными бактериями, или 6000 коров, из чьих поджелудочных желез посмертно будет извлечен ценный гормон.Значение ГИ для медицины
Слайд 17Когда вопрос встает таким «ребром», тысячи подопытных животных, принесенных в
жертву прогрессу, кажутся меньшим из зол.
Несмотря на заметные, почти что
футуристические успехи, медицинская генная инженерия остается областью, которую ученые только начинают осваивать.По-прежнему остается масса чисто технологических трудностей, не говоря уже о несовершенстве способов преодоления иммунной реакции организма и риска заражения при использовании модифицированных вирусов. Тем не менее маячащие на горизонте светлого будущего перспективы заставляют упорных исследователей без сожаления поступаться принципами и страхами.
Слайд 18Невероятные примеры генной инженерии
Эко-свинья
Эко-свинья, или как критики ее еще называют
Франкенсвин - это свинья, которая была генетически изменена для лучшего
переваривания и переработки фосфора. Свиной навоз богат формой фосфора фитатом, а потому, когда фермеры используют его как удобрение, это химическое вещество попадает в водосборы и становится причиной цветения водорослей, которые, в свою очередь, уничтожают кислород в воде и убивают водную жизнь.Ученые добавили бактерию E. Coli и ДНК мыши в эмбрион свиньи. Это изменение уменьшило производство фосфора свиньей ни много, ни мало на 70%, что сделало ее более экологически чистой.
Слайд 19Светящиеся в темноте коты
В 2007 году южнокорейский ученый изменил ДНК
кота, чтобы заставить его светиться в темноте, а затем взял
эту ДНК и клонировал из нее других котов, создав целую группу пушистых флуоресцирующих кошачьих. И вот, как он это сделал: исследователь взял кожные клетки мужских особей турецкой ангоры и, используя вирус, ввел генетические инструкции по производству красного флуоресцентного белка. Затем он поместил генетически измененные ядра в яйцеклетки для клонирования, и эмбрионы были имплантированы назад донорским котам, что сделало их суррогатными матерями для собственных клонов.Так для чего же нужно домашнее животное, работающее по совместительству ночником? Ученые говорят, что животные с флуоресцентными протеинами дадут возможность искусственно изучать на них человеческие генетические болезни.
Слайд 20Борющиеся с загрязнениями растения
Ученые Вашингтонского университета работают над созданием тополей,
которые могут очищать загрязненные места при помощи впитывания через корневую
систему загрязняющих веществ, содержащихся в подземных водах. После этого растения разлагают загрязнители на безвредные побочные продукты, которые впитываются корнями, стволом и листьями или высвобождаются в воздух.В лабораторных испытаниях трансгенные растения удаляют ни много, ни мало 91% трихлорэтилена из жидкого раствора, химического вещества, являющегося самым распространенным загрязнителем подземных вод.
Слайд 21Ядовитая капуста
Ученые недавно выделили ген, отвечающий за яд в хвосте
скорпиона, и начали искать способы введения его в капусту. Зачем
нужна ядовитая капуста? Чтобы уменьшить использование пестицидов и при этом не давать гусеницам портить урожай. Это генетически модифицированное растение будет производить яд, убивающий гусениц после укуса листьев, но токсин изменен так, чтобы быть безвредным для людей.Плетущие паутину козы
Крепкий и гибкий паутиний шелк является одним из самых ценных материалов в природе, его можно было бы использовать для производства целого ряда изделий от искусственных волокон до парашютных строп, если бы была возможность производства в коммерческих объемах. В 2000 году компания «Nexia Biotechnologies» заявила, что имеет решение: коза, производящая в своем молоке паутинный белок паука.
Исследователи вложили ген каркасной нити паутины в ДНК козы таким образом, чтобы животное стало производить паутинный белок только в своем молоке. Это «шелковое молоко» затем можно использовать для производства паутинного материала под названием «Биосталь».