Слайд 1ГЕННАЯ ТЕРАПИЯ БОКОВОГО АМИОТРОФИЧЕСКОГО СКЛЕРОЗА:
З. А. Суслина, Б. С. Народицкий,
В. З. Тарантул, С. Н. Иллариошкин,
М. Н. Захарова, И. А.
Завалишин, М. М. Шмаров, А. Л. Гинцбург,
Н. П. Бочков
ФГБУ «Научный центр неврологии» РАМН,
Институт молекулярной генетики РАН,
НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи МЗ РФ
ФГБУ «НАУЧНЫЙ ЦЕНТР НЕВРОЛОГИИ»
РОССИЙСКОЙ АКАДЕМИИ МЕДИЦИНСКИХ НАУК
Москва, 2013
Слайд 2БАС – прогрессирующее нейродегенеративное заболевание, обусловленное избирательным поражением периферических мотонейронов
передних рогов спинного мозга и двигательных ядер мозгового ствола, а
также центральных мотонейронов. Заболевание проявляется неуклонно нарастающими парезами, мышечными атрофиями, фасцикулляциями и пирамидным синдромом
Стивен Хокинг
астрофизик
Слайд 3Спорадическая форма – 90-95% больных
Частота - 3-5 на 100000 населения
Возраст
55-60 лет
Соотношение мужчин и женщин 1,6:1
Семейная форма – 5-10% больных
Ювенильная
форма – 10%
Западно-Тихоокеанская форма
(БАС + паркинсонизм + деменция)
Частота - в 100 раз чаще, чем спорадическая
Слайд 4Индукторы запрограммированной клеточной гибели при БАС
Экзогенные
Вирусы
Токсины
Эндогенные
Мутации (Cu/Zn-СОД1, алсин)
Экзайтотоксичность
Окислительный стресс
Нарушение
Са 2+ гомеостаза
Митохондриальная дисфункция
Конформационные изменения белков и нарушения их деградации
Дефицит
нейротрофических факторов
Нарушение структуры и функции цитоскелетных белков и аксонального транспорта
Слайд 5Описанные генетические локусы при БАС
Слайд 6Подходы к разработке новых методов терапии БАС
основываются на современных представлениях
о механизмах гибели мотонейрона
используются препараты, доказавшие свою эффективность на различных
природных и трансгенных моделях болезни двигательного нейрона у животных
при БАС могут быть эффективны и препараты, которые с успехом уже применяются при других нейродегенеративных заболеваниях (болезнь Паркинсона, болезнь Альцгеймера, хорея Гентингтона, прионные болезни)
Слайд 7Нейротрофические факторы, регулирующие выживание мотонейронов
Нейротрофины (BDNF, NT-3, NT 4/5)
Цитокины (CNTF,
LIF, CT-1 (кардиотрофин-1))
Трансформирующие ростковые факторы (GDNF, neuroturin, persephin)
Инсулиноподобные ростковые факторы
(IGF-1, IGF-2)
Гипоксия индуцибельные факторы (VEGF, эритропоэтин, ангиогенин)
Слайд 8Особенности регуляции выживания мотонейронов
Синергизм действия НТФ (CNTF и IGF-1; CNTF
и BDNF; CNTF и LIF; GDNF и NT3, 4/5)
Способность замещать
друг друга
Гетерогенность действия на различные субпопуляции мотонейронов спинного мозга, ядер черепно-мозговых нервов, двигательной коры
Слайд 9VEGF (vascular endothelial growth factor) - фактор роста эндотелия кровеносных
сосудов, относящийся к новому классу соединений - гипоксия индуцибельных нейротрофических
факторов.
В экспериментах на животных показано, что уменьшение уровня VEGF приводит не только к снижению нейрональной перфузии, но и к недостаточности VEGF опосредованной нейропротекции
Делеция промоторного элемента, в гене VEGF, определяющего реакцию на гипоксию (HRE) вызывает БДН у мышей
Данная мутация приводит к избирательному снижению VEGF в МН на 40%, при гипоксии - на 75%
Полиморфизмы в гене VEGF, приводящие к снижению его экспрессии, повышают риск заболевания БАС в 1,8 раза
Снижение уровня VEGF в биологических жидкостях больных БАС и корреляция с тяжестью заболевания
Слайд 10Ангиогенин (ANG)
является ключевым фактором регулирования ростковых факторов ангиогенеза
функции ANG разнообразны
и включают стимуляцию процессов транскрипции и трансляции белков, регуляцию биогенеза
рибосом, пролиферацию и рост эндотелиальных клеток
частота встречаемости мутаций в гене ANG у больных БАС 1,5%
Слайд 11Клинические испытания НТФ при БАС (подкожное, внутримышечное, интратекальное введение)
Положительные эффекты
Замедление
прогрессирования при в/м введении IGF-1
Улучшение ЖЕЛ после в/м введения BDNF
Отрицательные
эффекты
Быстрая деградация пептидных молекул и, соответственно, кратковременный эффект
Низкая проницаемость через ГЭБ
Выраженность периферических побочных эффектов
Токсичность при введении больших доз
Образование аутоантител к нейротрофическим факторам
Слайд 12Свойства рекомбинантных
аденовирусов
не вызывают вирусной инфекции;
не встраиваются в геном клеток-мишеней;
выводятся
из организма в течение 4- 5 недель
способны проникать в широкий
спектр как делящихся, так и неделящихся клеток;
осуществляют высокоэффективную экспрессию генов терапевтического вмешательства
Безопасность
Эффективность
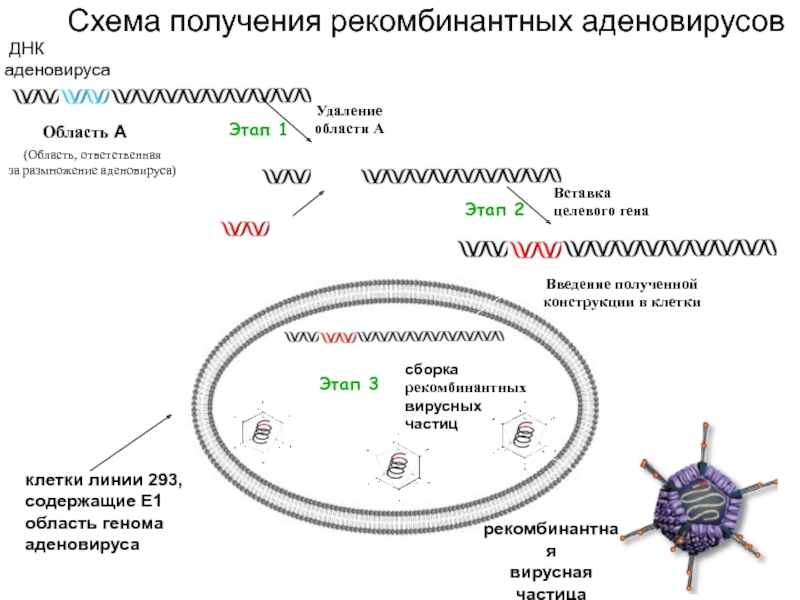
Слайд 13 ДНК
аденовируса
(Область, ответственная
за размножение аденовируса)
Схема получения рекомбинантных аденовирусов
сборка
рекомбинантных
вирусных
частиц
клетки линии 293,
содержащие E1
область генома
аденовируса
рекомбинантная
вирусная
частица
Введение полученной
конструкции
в клетки
Этап 3
Область А
Этап 1
Удаление
области А
VEGF
Вставка
целевого гена
Этап 2
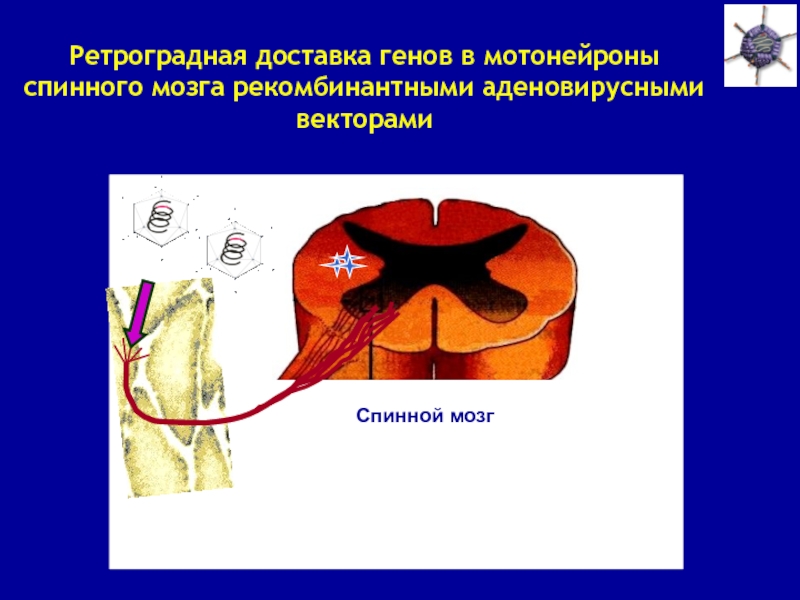
Слайд 14Ретроградная доставка генов в мотонейроны спинного мозга рекомбинантными аденовирусными векторами
Спинной мозг
Слайд 15Характеристика препарата АдеВаск™
Торговое название препарата:
АдеВаск™
Международное непатентованное название:
нет
Лекарственная форма:
раствор для внутримышечного
введения, доза/3 мл.
Состав:
смесь (1:1) рекомбинантных псевдоаденовирусных частиц, экспрессирующих гены фактора
роста эндотелия сосудов человека и ангиогенина человека, в суммарной концентрации (7,0±1,4)х1011 частиц в 3 мл буферного раствора.
Слайд 16Экспериментальная модель БАС
трансгенные мыши линии B6SJL-Tg(SOD1*G93A)dl1Gur/J (мыши линии SOD1*G93A).
экспрессируют мутантный ген Cu/Zn-супероксиддисмутазы SOD1
характеризуются прогрессирующей дегенерацией мотонейронов,
в
возрасте 6–7 месяцев появляются первые клинические признаки заболевания: парез и последующий паралич одной или двух конечностей, с последующей генерализацией
умирают через 4–6 недель после клинической манифестации заболевания в возрасте около 8 месяцев
Слайд 17Дизайн исследования на
трансгенных животных
Начало инъекций с 5-месячного возраста до конца
жизни
Курс инъекций через каждые 2 недели
Раствор вводился билатерально в
разные группы мышц передних, задних конечностей и спины (всего 6 групп); в каждой из указанных мышечных зон было по 5 точек введения, каждое введение – по 30 мкл препарата или сравниваемого контрольного раствора (в каждую группу мышц по 150 мкл, соответственно)
общее количество вводимого препарата 0,9 мл
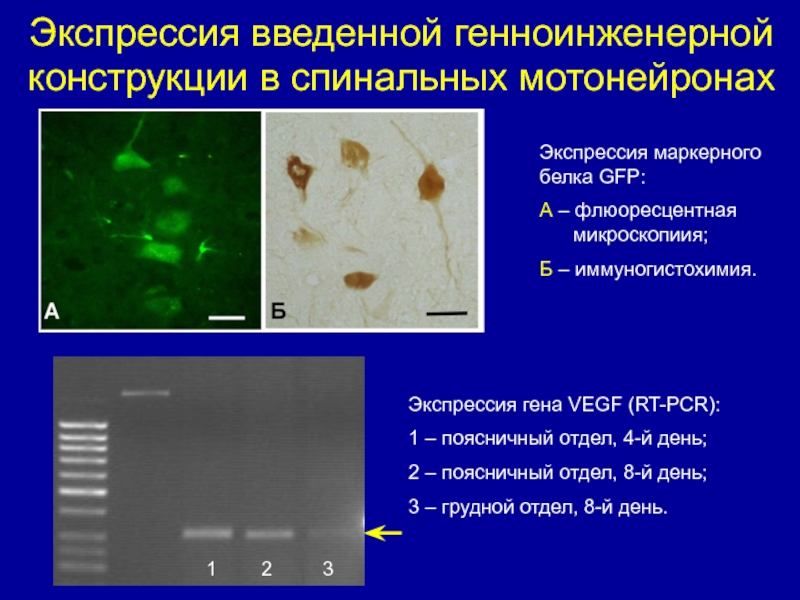
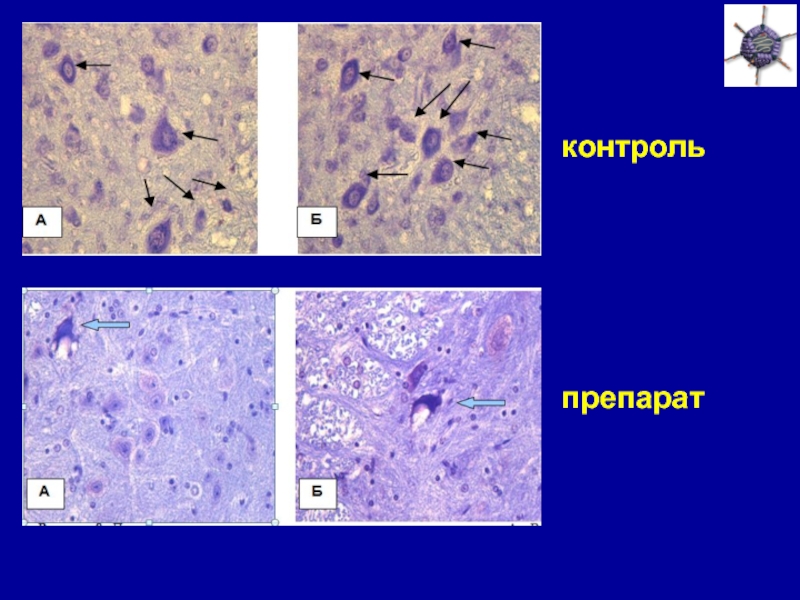
Слайд 18Экспрессия введенной генноинженерной конструкции в спинальных мотонейронах
1
2 3
Экспрессия гена VEGF (RT-PCR):
1 –
поясничный отдел, 4-й день;
2 – поясничный отдел, 8-й день;
3 – грудной отдел, 8-й день.
Экспрессия маркерного белка GFP:
A – флюоресцентная
микроскопиия;
Б – иммуногистохимия.
Слайд 19Безопасность
повторные инъекции не приводили к летальным исходам и выбраковке экспериментальных
животных
после введения препарата (сравниваемого раствора) у животных не наблюдалось явных
признаков воспалительных, аллергических реакций или проявлений системной интоксикации
в экспериментальных группах не зафиксировано каких-либо ассоциированных патологических состояний, которые могли бы быть прямо или косвенно связаны с введением рекомбинантного препарата
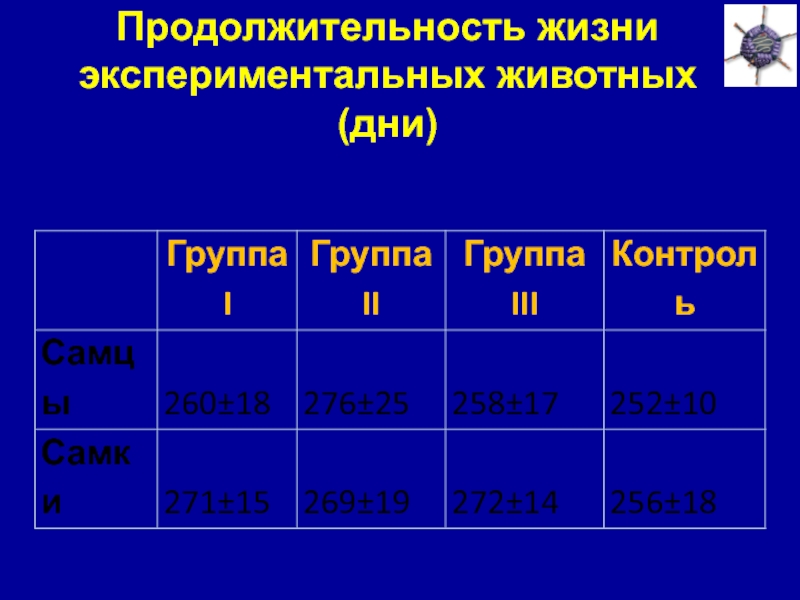
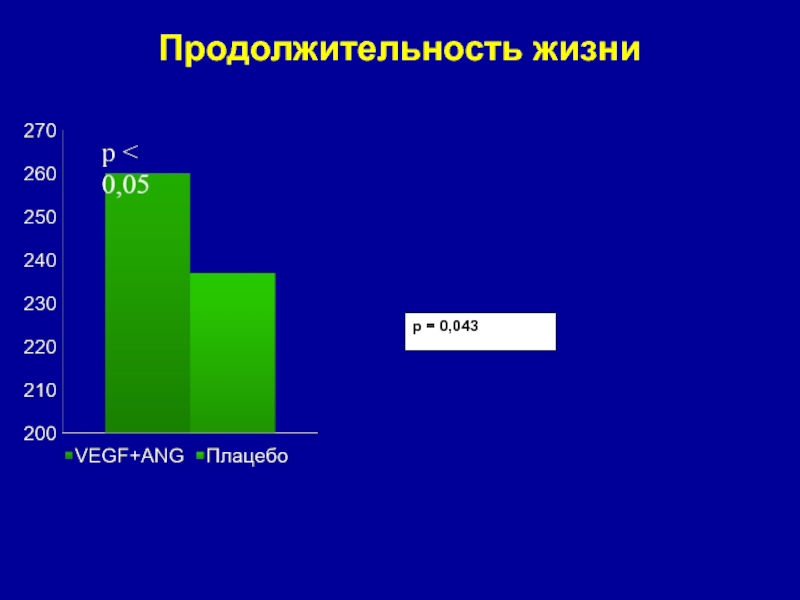
Слайд 20Продолжительность жизни экспериментальных животных
(дни)
Слайд 23p = 0,043
Продолжительность жизни
Слайд 24Оценка показателей двигательной активности и неврологического статуса
Оценка неврологического статуса: паралич
задних конечностей
Установка Opto-Varimex-3 ("Columbus instruments", США)
Слайд 25Двигательная активность
*
* - статистически значимые различия между группами, p
0,05
*
Слайд 27Цель исследования
Оценить безопасность и переносимость AdV терапии с введением генов
VEGF 121 и ANG у больных со спорадической формой БАС
Слайд 28Критерии включения больных
в исследование:
Письменное информированное согласие
Мужчины и женщины в
возрасте от 18 до 69 лет
Достоверный диагноз БАС, согласно международным
критериям El Escorial (1998)
Длительность заболевания не более 3-х лет
Значение по шкале ALSFRS не менее 30 баллов
ЖЕЛ не менее 70%
Женщины могут включаться в исследование при следующих условиях:
- не обладающие репродуктивным потенциалом
- обладающие репродуктивным потенциалом с отрицательным результатом теста мочи на беременность во время скрининга при условии согласия постоянно использовать один из указанных методов контрацепции (ВМС, барьерные методы контрацепции)
Слайд 29Критерии исключения
Пациенты, получавшие или получающие рилузол
Пациенты с клинически значимыми изменениями
лабораторных показателей функции почек и печени
Наличие онкологических заболеваний у пациентов
Любое
клинически значимое отклонение от нормы на ЭКГ, зарегистрированное в любом из 12 отведениях
Кормление грудью, беременные женщины или пациентки, планирующие беременность
Наличие сахарного диабета I-II типов
Наркотическая и лекарственная зависимость, алкогольная зависимость в течение последних 6 месяцев
Пациенты, позитивные по гепатитам В, С или ВИЧ
Участие в других клинических испытаниях
Наличие у больных трахеостомы или гастростомы
Высокий исходный уровень вируснейтрализующих антител (>1:80)
Слайд 30Дизайн исследования
Рандомизированное плацебо-контролируемое исследование
50 больных спорадическим БАС (25 пациентов получающих
AdV VEGF+ANG, 25 получающих плацебо)
Введение препарата (или плацебо) внутримышечное в
3 мышцы (m.trapezius, m.deltoideus, m.quadriceps) с каждой стороны каждые 3 недели
Общая однократно вводимая доза препарата 1,2 мл, содержащие 3х109БОЕ (бляшкообразующих единиц) (в каждую мышцу по 0,2 мл)
Количество визитов – 26 (в течение 18 месяцев)
Слайд 31Безопасность и переносимость
Контроль за физиологическими показателями (АД, ЧСС, t тела,
масса тела, ЭКГ)
Контроль лабораторных данных (клинический и биохимический анализы крови,
мочи, исследование онкомаркёров)
Оценка нежелательных явлений (местных, системных, лабораторных отклонений)
Слайд 32Оценка прогрессирования заболевания
Исследование жизненной ёмкости лёгких (ЖЕЛ/ДЖЕЛ)
Оценка по функциональной шкале
ALSFRSR
Исследование мышечной силы с оценкой по шкале ММТ (manual muscle
test)
Выживаемость больных БАС
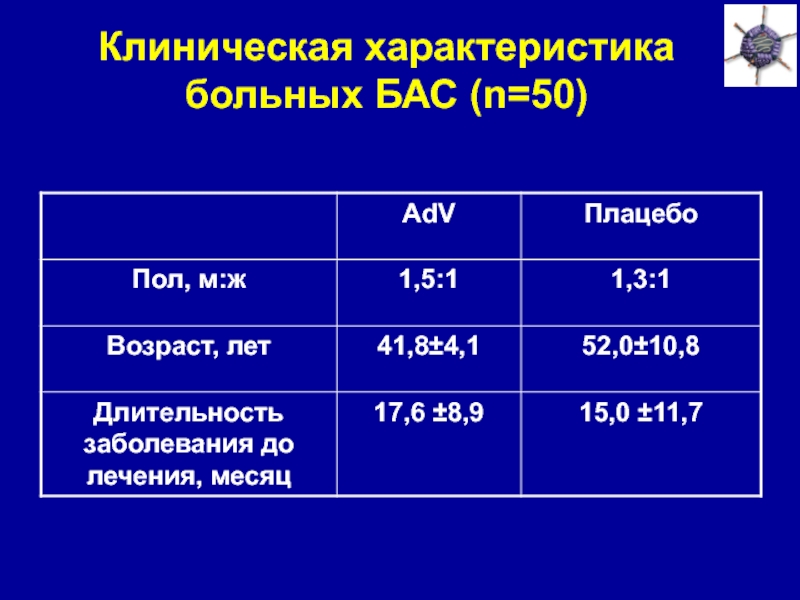
Слайд 33Клиническая характеристика больных БАС (n=50)
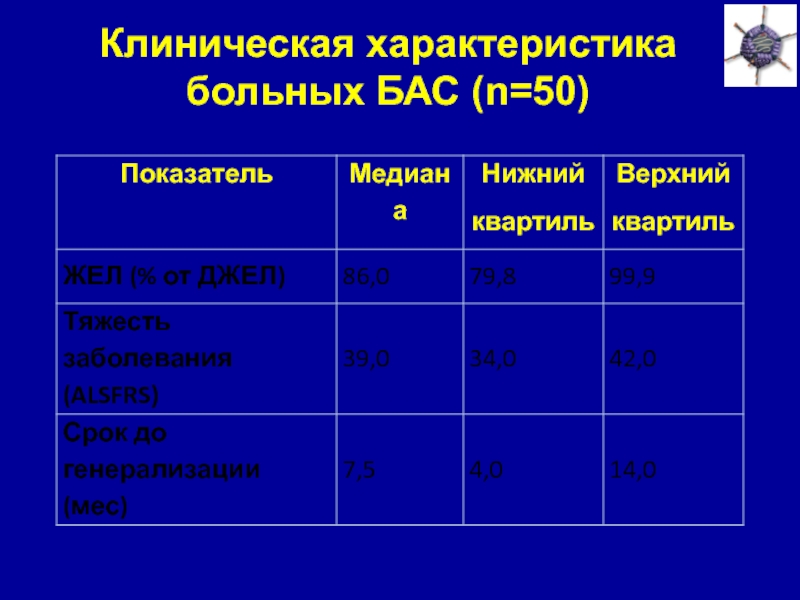
Слайд 34Клиническая характеристика больных БАС (n=50)
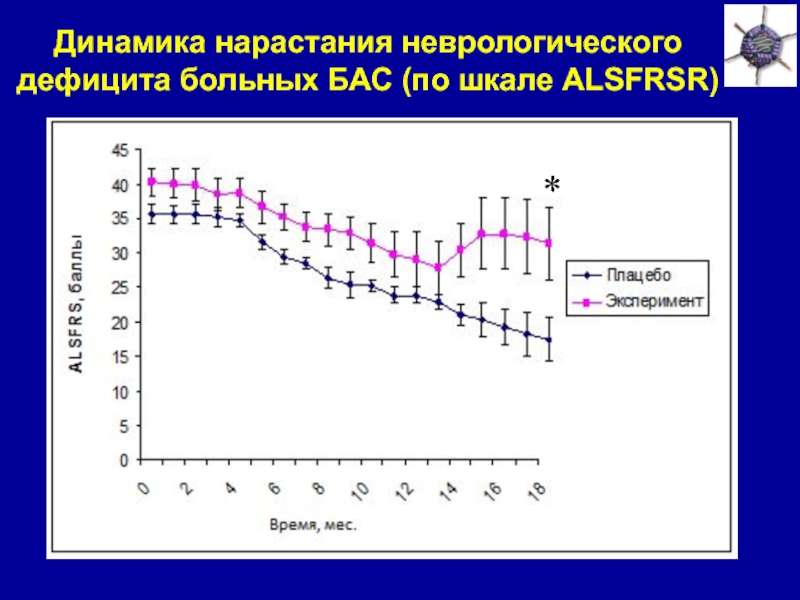
Слайд 35Динамика нарастания неврологического дефицита больных БАС (по шкале ALSFRSR)
*
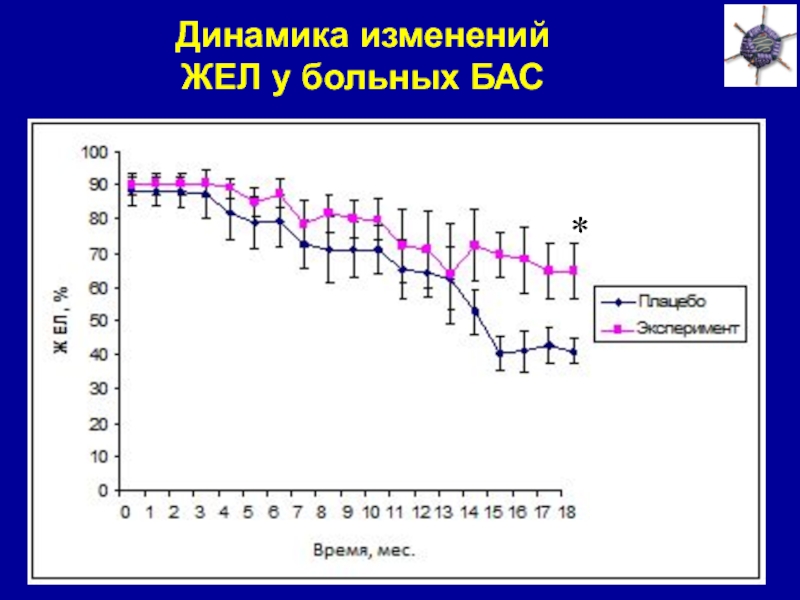
Слайд 36Динамика изменений
ЖЕЛ у больных БАС
*
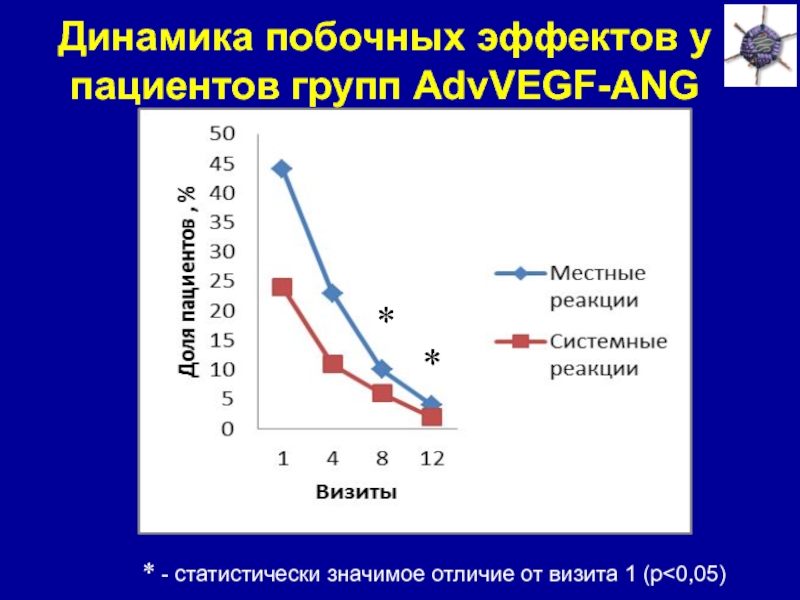
Слайд 37Динамика побочных эффектов у пациентов групп AdvVEGF-ANG
*
*
* - статистически значимое
отличие от визита 1 (p
Слайд 38Заключение
Лечение препаратом AdvVEGF+ANG замедляет нарастание неврологического дефицита у больных БАС
Лечение
препаратом AdvVEGF+ANG замедляет снижение жизненной емкости легких у больных БАС.
Во
время исследования серьезных нежелательных явлений не было