Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Геохимические процессы в системе природная вода – горная порода 1
Содержание
- 1. Геохимические процессы в системе природная вода – горная порода 1
- 2. При изучении формирования химического состава природных вод
- 3. 2) факторы формирования химического состава природных вод
- 4. Особенности взаимодействия в системе вода –породаВзаимодействие подземных
- 5. физические процессы, происходящие на границе раздела твердой
- 6. Растворение – кристаллизацияПри взаимодействии твердого вещества с
- 7. Конгруэнтное растворение Важнейший тип химического взаимодействия воды
- 8. Д. И. Менделеев (1887) показал, что при
- 9. В основе равновесия между твердым веществом и
- 10. В неравновесной системе компонент из фазы, в
- 11. Некоторые минералы медленно растворяются в воде в
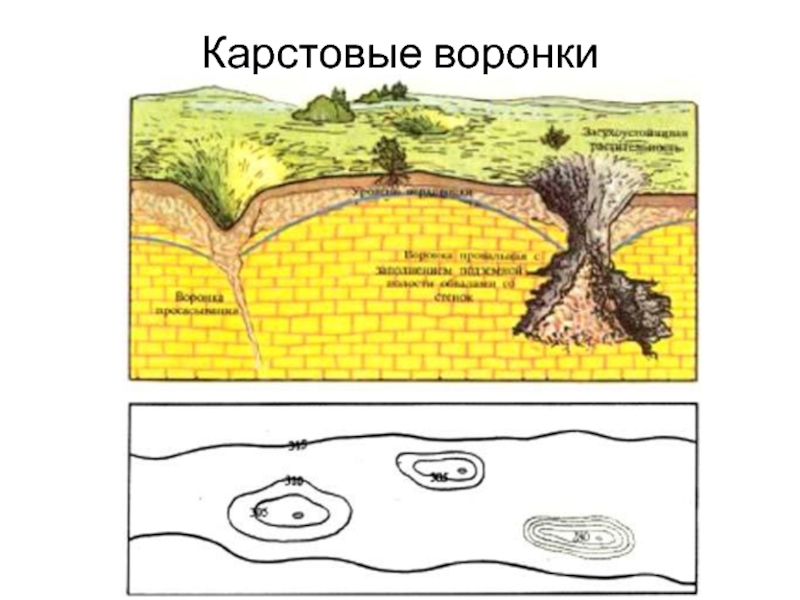
- 12. Карстовые воронки
- 13. Карстовая воронка Балаа (Ливан)
- 14. Глубина 250 м. Возраст 150000 лет.
- 15. выщелачиваниеХимическое растворение отличается от выщелачивания кинетически. При
- 16. фториды виллиомит NaF и криолит Na3AlF6 довольно
- 17. Отпечатки полностью растворённого пластинчатого кальцита ("папир-шпата") на
- 18. Кристаллизация Процесс, в результате которого растворенное вещество
- 19. В насыщенном равновесном растворе кристаллизация прекращается.
- 20. Многие водорастворимые минералы (в основном хлориды, сульфаты, карбонаты), осаждаются из воды соляных озер и лагун
- 21. Мертвое море
- 22. Эти же минералы, а также нитраты образуют
- 23. Влияние других солей: а) одноименные ионы снижают
- 24. Влияние газового состава: Это уже не простое
- 25. Гидролиз (инконгруэнтное растворение)более сложно, чем конгруэнтное
- 26. Обладая электростатическим зарядом, ионы гидроксила, и, особенно
- 27. Атомы металлов, вследствие разности химических потенциалов в
- 28. Образуются обогащенные Al вторичные минералы. 4Na AlSi3O8
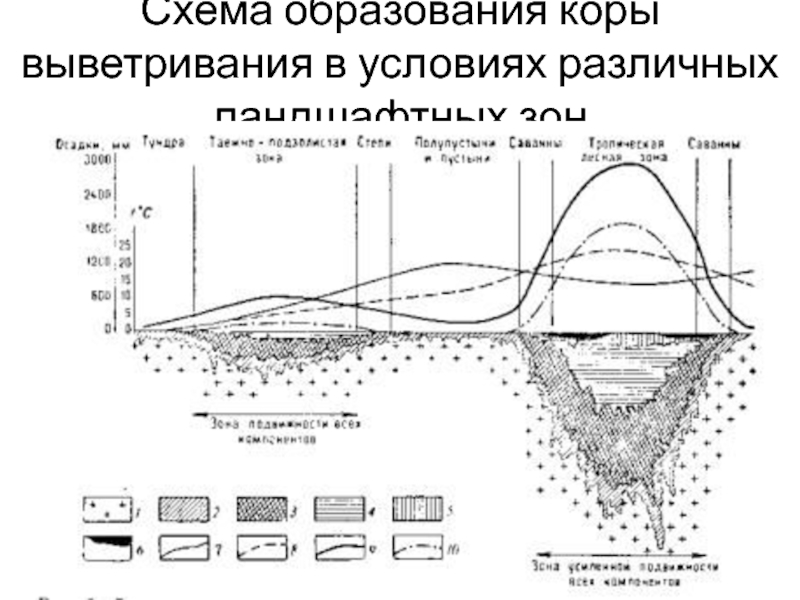
- 29. Схема образования коры выветривания в условиях различных ландшафтных зон
- 30. Условные обозначения1 — материнская порода; 2 —
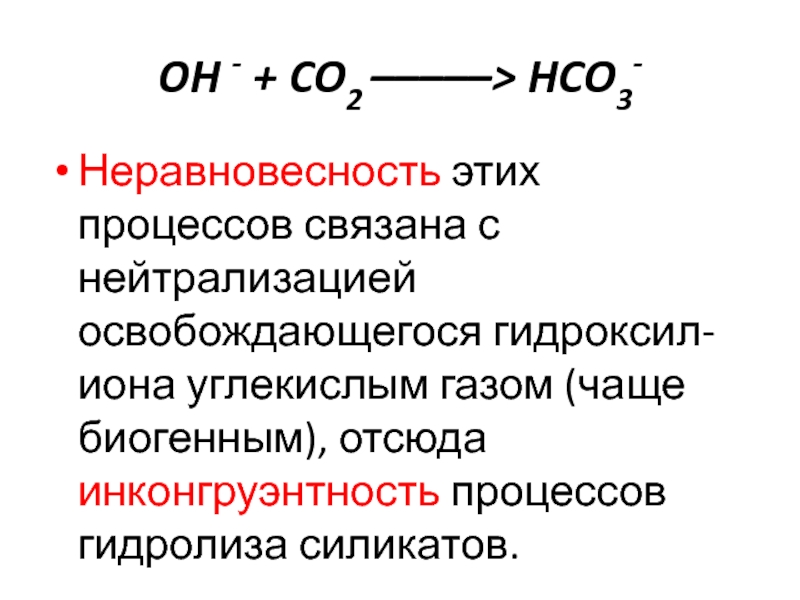
- 31. OH - + CO2 –––––> HCO3-Неравновесность этих
- 32. В планетарном масштабе значение этих процессов огромно.
- 33. Скачать презентанцию
При изучении формирования химического состава природных вод необходимо рассматривать три составные части этого глобального явления:1) процессы формирования химического состава природных вод – физико-химические механизмы, посредством которых осуществляется перевод вещества в раствор,
Слайды и текст этой презентации
Слайд 1Геохимические процессы в системе природная вода – горная порода
(1)
Три источника,
три составные части теории формирования химического состава природных вод
Слайд 2При изучении формирования химического состава природных вод необходимо рассматривать три
составные части этого глобального явления:
1) процессы формирования химического состава природных
вод – физико-химические механизмы, посредством которых осуществляется перевод вещества в раствор, вывод из раствора (т. е. воспроизводство и поглощение растворенного вещества), добавление и поглощение молекул растворителя; Слайд 32) факторы формирования химического состава природных вод – условия, способствующие
или противостоящие протеканию процессов и водной миграции элементов.
3) миграция
элементов (перенос вещества и энергии); Слайд 4Особенности взаимодействия в системе вода –порода
Взаимодействие подземных вод с горными
породами имеет весьма сложный многоступенчатый характер. Менялось оно и в
ходе эволюции земной коры. На ранних этапах горные породы были магматическими, подземные воды имели специфический характер, присущий, по-видимому, современным вулканическим областям.По мере накопления осадочных толщ и формирования метаморфических горных пород, процессы взаимодействия жидкой и твердой фаз становились более многообразными и примерно в начале фанерозоя приобрели современный характер.
Слайд 5физические процессы, происходящие на границе раздела твердой и жидкой фаз
Интенсивность
определяется гл. образом величиной поверхностной энергии минералов и горных пород,
которая является функцией удельной поверхности. Эта величина тем больше, чем дисперсность частиц породы выше.Этим объясняется то, что наиболее интенсивно подвержены химическому выветриванию средне- и тонкодисперсные породы, а обломочные и грубодисперсные более устойчивы.
Слайд 6Растворение – кристаллизация
При взаимодействии твердого вещества с водой наблюдаются два
одновременно протекающих процесса: переход ионов из твердого состояния в раствор
и обратно. В зависимости от преобладания того или иного процесса происходит растворение или кристаллизация. Когда скорости обоих процессов выравниваются, наступает равновесие и растворение, и кристаллизация практически прекращаются.Слайд 7Конгруэнтное растворение
Важнейший тип химического взаимодействия воды н горной породы
— процесс конгруэнтного (согласованного, гармоничного) растворения, при котором вещество пород
полностью переходит в растворенное состояние.Растворимость большого числа природных минералов в воде связана с аномальными особенностями воды, полярной природой ее молекул, способностью воды к образованию тетраэдрической координированной структуры, от чего зависит ее высокая диэлектрическая постоянная.
Слайд 8Д. И. Менделеев (1887) показал, что при растворении получаются близкие
к химическим соединениям системы, состоящие из молекул растворителя и растворённого
вещества, с определенной теплотой образования (теплотой растворения).Эта теория получила развитие в работах И. А. Каблукова (1891) применительно к водным растворам электролитов, например при растворении минералов с ионной кристаллической решёткой (KCl, CaCl2, NaCl и т.п.).
Слайд 9В основе равновесия между твердым веществом и раствором лежит закон
равновесия Гиббса, согласно которому равновесие наступает, когда химический потенциал вещества
в растворе µАж становится равным химическому потенциалу вещества в твердой фазе µАтв , т.е.µАтв = µАж = µАо + RTlnXA
где µАо — стандартный химический потенциал вещества в растворе; R — газовая постоянная; Т—температура, К; XA — мольная доля вещества А в растворе.
Слайд 10В неравновесной системе компонент из фазы, в которой его химический
потенциал больше, будет самопроизвольно переходить в фазу, в которой последний
меньше, т.е. с термодинамической точки зрения процесс растворения возможен тогда, когда µАтв > µАж .Основными хорошо растворимыми породообразующими минералами являются кальцит, доломит, гипс, ангидрит и галит.
Слайд 11Некоторые минералы медленно растворяются в воде в естественных условиях;
к
их числу относятся прежде всего кальцит и гипс, растворение которых
дождевыми и текучими водами приводит к развитию карста (образованию карстовых воронок, провалов, пещер и т.п.),Слайд 15выщелачивание
Химическое растворение отличается от выщелачивания кинетически. При растворении взаимодействие с
растворяемым веществом, например в забоях соляных камер при скважинном подземном
выщелачивании, происходит на границе раздела твёрдой и жидкой фаз по законам внешних диффузий. Скорость растворения мало изменяется во времени, т.к. определяется практически неизменной величиной поверхности контакта растворяемого вещества с растворителем (водой).При выщелачивании происходит химическое растворение минералов, рассеянных в массе породы.
Слайд 16фториды виллиомит NaF и криолит Na3AlF6 довольно быстро полностью или
частично выщелачиваются дождями и талыми водами из поверхностного слоя содержащих
их горных пород.На месте этих минералов остаются лишь пустоты характерной формы.
Слайд 17Отпечатки полностью растворённого пластинчатого кальцита ("папир-шпата") на находившихся с ним
в срастании кристаллах кварца и датолита.
Слайд 18Кристаллизация
Процесс, в результате которого растворенное вещество переходит из жидкой
фазы в структуру минерала.
Состоит из ряда последовательных стадий, включающих
разрыв и перестройку связей. Скорость перехода является функцией степени перенасыщения в растворе и концентрации насыщения в первом слое на границе с кристаллом.
Слайд 19В насыщенном равновесном растворе кристаллизация прекращается.
Кристаллизация минеральных веществ из
подземных вод имеет огромное геологическое значение, так как с ней
связано образование очень многих месторождений полезных ископаемых, кольматация тектонической трещиноватости и другие процессы.Слайд 20Многие водорастворимые минералы (в основном хлориды, сульфаты, карбонаты), осаждаются из
воды соляных озер и лагун
Слайд 22Эти же минералы, а также нитраты образуют на суше, в
районах с аридным климатом, различные эфемерные выделения — выцветы, налеты
и т.п., исчезающие в периоды дождей.Слайд 23Влияние других солей:
а) одноименные ионы снижают растворимость;
б) изменение растворимости
в растворах:
Повышается растворимость гипса в растворе каменной соли
Снижается растворимость соды
в растворе каменной солиСлайд 24Влияние газового состава:
Это уже не простое растворение, а реакции: с
СО2 – переход в р-р карбонатных солей, гидролиз силикатов.
с
О2 – все окислительные процессыСлайд 25 Гидролиз (инконгруэнтное растворение)
более сложно, чем конгруэнтное растворение, протекает процесс
инконгруэнтного растворения широко распространенных в природе силикатов и алюмосиликатов.
Природные
воды содержат ионы Н+ и ОН-, образующиеся в результате диссоциации воды. Слайд 26Обладая электростатическим зарядом, ионы гидроксила, и, особенно водорода, активно взаимодействуют
с поверхностными зонами частиц горных пород.
Первый этап реакций взаимодействия
природных вод с алюмосиликатами (прежде всего с полевыми шпатами и плагиоклазами), заключается в вытеснении ионом Н+ водного раствора катионов металла (K+, Na+, Ca2+, Mg2+) из кристаллической решетки минералов. Слайд 27Атомы металлов, вследствие разности химических потенциалов в жидкой и твердой
фазах переходят с поверхности кристаллической решетки в раствор.
Образующнеся пустоты
в кристаллической решетке минерала занимают ионы водорода, сохраняя электронейтральность кристаллической структуры. Размеры ионов Н2 ничтожно малы, в кристаллической решетке образуются «дыры» которые служат путями выноса из глубоких слоев ионов металла. Они диффундируют в эти пустоты и переходят в жидкую фазу.
Слайд 28Образуются обогащенные Al вторичные минералы.
4Na AlSi3O8 (альбит) + 22H2O
––––> Al4Si4O10(OH)8 (каолинит)+4Na+ + 4OH - +8H4SiO4
2СaAl2Si2O8 (анортит)+ 6H2O ––––>
Al4Si4O10(OH)8 + 2Ca2+ + 4OH-или: 2СaAl2Si2O8 + H2O + H+ –––––> Al4Si4 O10OH8 + 2Ca2+
4NaAlSiO4 (нефелин)+ 6H2O –––––> Al4Si4O10OH8 + 4Na+ + 4OH- или:
NaAlSiO4 + 3H2O –––––> Al(OH)3 (гиббсит)+ Na+ + OH- + H2SiO3
Слайд 30Условные обозначения
1 — материнская порода; 2 — зона дресвы химически
малоизмененной; 3 — гидрослюдисто-монтмориллонитово-бейделлитовая зона; 4 — каолинитовая зона; 5
— охры А12О4; 6 — панцирь Fе2О8 + А12О4; 7— годовое испарение; 8 — средняя годовая температура; 9 — средняя годовая сумма атмосферных осадков; 10 — годовой отпад органического (растительного) веществаСлайд 31OH - + CO2 –––––> HCO3-
Неравновесность этих процессов связана с
нейтрализацией освобождающегося гидроксил-иона углекислым газом (чаще биогенным), отсюда инконгруэнтность процессов
гидролиза силикатов.Слайд 32В планетарном масштабе значение этих процессов огромно.
С ними связана
нейтрализация воды первичного кислого океана.
Ими объясняется существование гидрокарбонатных вод
на площадях развития силикатных пород; углерод гидрокарбонат-иона чаще всего биогенный. Существование воды и жизни на Земле поддерживает и регулирует мощные процессы разрушения силикатных пород.