Слайд 1Гетерогенное равновесие в организме:
H2PO4-
HPO4 2-
CO3 2-
Ca3(PO4)2 ↔ 3
Ca 2+ + 2 PO4 3 –
Кs= [Ca 2+
] 3x[PO4 3 – ] 2 =10-29
Реакции, лежащие в основе образования костной ткани: при рН6
5 Ca 2+ + 3 HPO4 2 - +4OH- = Ca5(PO4)3OH + H2O
Кs=10-58
Гидроксоаппатит образуется раньше, чем Ca3(PO4)2 - покрывает сверху гидроксоапатит
Условия образование костной ткани:
- рН6
- перенасыщенность гидроксоапатитом
кровь -в 2,5 раза
слюна – в 4 раза
- соотношение Са:Р1.67
Слайд 2
Камнеобразование в почках и желчном протоке.
Причина – перенасыщенность биологических
растворов .
ураты- Са соли мочевой кислоты
оксалаты- Са С204
карбонаты -
СаСОз
От рН:
рН5 в моче обр-ся оксалаты и ураты
рН8 - фосфаты
Слайд 3КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
Коллигативными свойствами называются свойства растворов, не зависящие от
природы частиц растворенного вещества, а зависящие только от концентрации частиц
в растворе.
Коллигативными свойствами разбавленных растворов являются:
- 1. скорость диффузии;
- 2. осмотическое давление;
- 3. давление насыщенного пара растворителя над раствором;
- 4 повыщение температуры кипения и понижение температуры замерзания растворов по сравнению с растворителем
.
Слайд 4Диффузией в растворе называется самопроизвольный направленный процесс переноса частиц растворенного
вещества и растворителя, который приводит к выравниванию концентрации
В 1855
г. Фик вывел 1 закон:
V= -DS ∆C/∆x
, где
V скорость диффузии;
D — коэффициент диффузии;
S — площадь сечения;
∆C/∆x- градиент концентрации.
Скорость диффузии
возрастает
- при повышении температуры и градиента концентрации
уменьшается
- при увеличении вязкости растворителя и размера диффундирующих частиц.
- с увеличением молекулярной массы
Слайд 52. Осмос-
односторонняя диффузия через полупроницаемую мембрану молекул растворителя под
действием разности концентраций.
Осмотическое давление - равно тому давлению, которое нужно
приложить к раствору, чтобы прекратить осмос
Осмотическое давление растворов неэлектролитов можно рассчитать, пользуясь уравнением Вант-Гоффа:
Р = CRT, где
Р — осмотическое давление раствора [кПа];
С — молярность раствора [моль/л];
R — универсальная газовая постоянная [8,314 Дж/мольК];
Т — абсолютная температура раствора;
Слайд 63 типа растворов по отношению к данному раствору:
с меньшим осмотическим
давлением — гипотонический,
с бóльшим — гипертонический
с одинаковым осмотическим
давлением- изотонический
В медицинской практике изотоническими растворами называются растворы, осмотическое давление которых равно
- осмотическому давлению крови = 7,7 атм.
0,9% раствор хлорида натрия и
4,5-5,0% раствор глюкозы называемые физиологическими р-ми
- Р онкотич=0.03-0,04атм
создается белками крови (7-8 %)
- Р осм. мочи = 8-25 атм
Слайд 7Осмотическая ячейка - это система, отделенная от окружающей среды мембраной
с избирательной проницаемостью
Эндоосмос происходит, если клетка оказывается в гипотоническом растворе.
Эндоосмос
- движение растворителя в осмотическую ячейку из окружающей среды.
В результате эндоосмоса вода диффундирует в клетку, происходит набухание клетки с появлением напряженного состояния клетки, называемого тургор.
-эндоосмос приводит к разрушению клеточной мембраны и лизису клетки ( гемолиз эритроцитов крови с выделением гемоглобина в плазму)
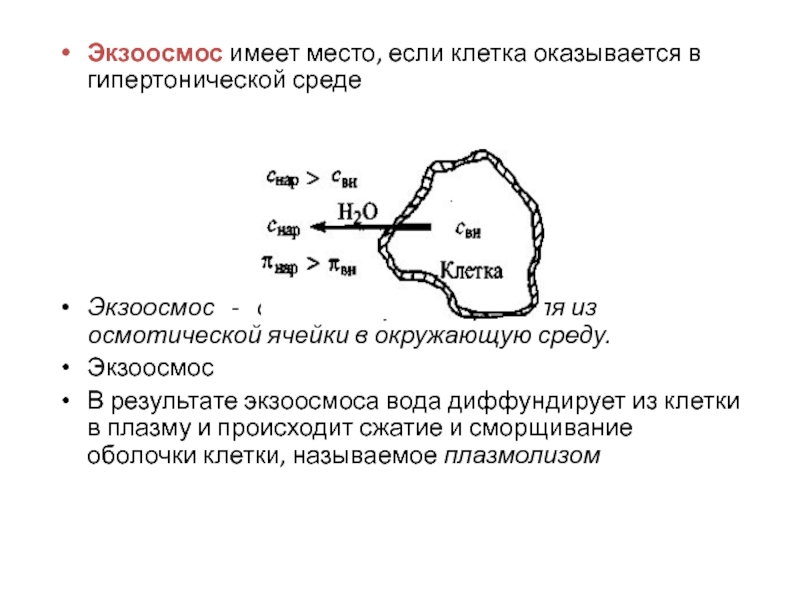
Слайд 8Экзоосмос имеет место, если клетка оказывается в гипертонической среде
Экзоосмос
- движение растворителя из осмотической ячейки в окружающую среду.
Экзоосмос
В результате экзоосмоса вода диффундирует из клетки в плазму и происходит сжатие и сморщивание оболочки клетки, называемое плазмолизом
Слайд 9При приготовлении физиологических растворов необходимо учитывать их осмотические свойства, поэтому
их концентрацию выражают через осмолярную концентрацию (осмолярностъ)
Осмолярная концентрация -
суммарное молярное количество всех кинетически активных, т. е. способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы.
Осмотическому давлению крови человека соответствует осмолярная концентрация частиц от 275 до 300 мОсм/л.
Осмолярность считается так:
0,1 М NaCl 0.1х 1 + 0.1х1= 0.2 Осм/л= 200 мОсм/л.
или:
0,2М СaCl2 0,2х 1+ 0.2х2= 0.6 Осм/л
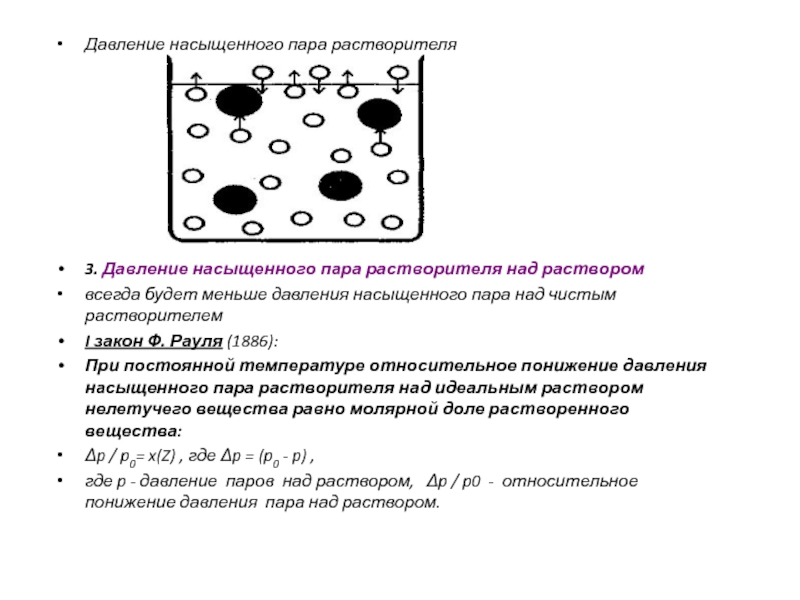
Слайд 10Давление насыщенного пара растворителя
3. Давление насыщенного пара растворителя над раствором
всегда будет меньше давления насыщенного пара над чистым растворителем
I
закон Ф. Рауля (1886):
При постоянной температуре относительное понижение давления насыщенного пара растворителя над идеальным раствором нелетучего вещества равно молярной доле растворенного вещества:
p / p0= x(Z) , где p = (p0 - p) ,
где p - давление паров над раствором, p / p0 - относительное понижение давления пара над раствором.
Слайд 114. Температура кипения жидкости - при которой давление насыщенного пара
над жидкостью равно внешнему давлению.
Температура замерзания жидкости - давление
насыщенного пара над жидкостью равно давлению насыщенного пара над кристаллами этой жидкости.
II закон Рауля:
Повышение температуры кипения или понижение температуры, замерзания идеальных растворов нелетучих веществ прямо пропорционально моляльной концентрации раствора:
Tк = Kэb(Х) , и
Tз = Kкb(Х) соответственно,
где Kэ и Kк – эбуллиоскопическая и криоскопическая константа, соответственно.
КЭ для воды равна 0,52С
КК[вода] = 1,86С.
.
Слайд 12Методы криоскопии и эбулиоскопии используются для определения молекулярной массы веществ:
,
где
М — молекулярная масса растворённого вещества;
К — эбулиоскопическая или криоскопическая
константа;
m — масса растворённого вещества в г [или кг];
G — масса растворителя в г [или кг];
Осмолярность плазмы крови взрослого человека в норме 275-300 мосм/кг воды.
Можно определить осмолярную концентрацию любой биологическлой жидкости, если известна точка её замерзания:
.
Слайд 13Водно-электролитный баланс
В зависимости от содержания внеклеточной жидкости
различают 6 состояний,
приводящих к или
Внеклеточной жидкости:
содержание увеличено в 2 и
более раза- гипергидратация
уменьшено в 2 раза- дегидратация
1. Гипертоническая дегидратация :
Р осм жидкость
при диабете, почечной недостаточности : клетка теряет воду.
2.Изотоническая дегидратация –
Р =N жидкость
страдает внеклеточное пространство- при потере крови.
3.Гипотоническая дегидратация
Р осм жидкость
клетка пересыщается водой – при потери натрия, который удерживает воду.
Слайд 14
4. Гипертоническая гипергидратация
Р осм жидкость
клетка обезвоживается- если нет
пресной воды
5. Изотоническая гипергидратация
Р =N жидкость
отеки при
циррозе печени, ССЗ
6. Гипотоническая гипергидратация
Р осм жидкость
чрезмерное потребление воды, поражаются клетки
Слайд 15. Равновесие между раствором и осадком малорастворимого сильного электролита.
Са3(РО4)2 ↓↔
3Са 2+ + 2PO4 3-.
Применяя закон действующих масс для
данного равновесного состояния, выразим константу растворимости КS (произведение растворимости (ПР)):
ПР = [Са 2+ ] 3[PO4 3- ]2 / [Са3(РО4)2 ] .
[Са3(РО4)2 ] = const, и ПР(Са3(РО4)2)= [Са 2+ ] 3[PO4 3- ]2 .
Чем меньше ПР, тем ниже растворимость электролита.
Условия образования осадка: стехиометрическое произведение концентраций ионов сильного электролита должно быть больше ПР:
[Са 2+ ] 3[PO4 3- ]2 > ПР.
Условия растворения осадка: осадок малорастворимого сильного электролита растворится, когда стехиометрическое произведение концентраций ионов сильного электролита меньше ПР:
[Са 2+ ] 3[PO4 3- ]2 < ПР.
Последовательность осаждения ионов: если к раствору, содержащему смесь ионов, осаждаемых одним и тем же реагентом, добавить этот реагент, то образование осадков идет поочередно, начиная с электролита, имеющего наименьшее ПР.