Слайд 1GLP – Тиісті зертханалық тәжірибе
“Астана Медициналық университеті” КеАҚ
Слайд 2Жоспар
Кіріспе
Негізгі бөлім
ДЗ сапасын бақылау
GLP
Даму тарихы
GLP негізгі міндеті
Қолдану аймағы
GLP талаптары
Қорытынды
Пайдаланылған әдебиеттер
Слайд 3Кіріспе
Дәрі-дәрмек сапасы ауруларды емдеу және алдын алу, зор
денсаулық және өмір сүру жағдайының жоғары сапасы болып табылады. Медициналық
көмектің сапасын жақсарту мақсатында GXP тиісті тәжірибелер GXP сериясы әзірленді.
GXP - дәрілік заттардың сапасын қамтамасыз ету жүйесі халықаралық танылған. GXP жүйесі тұтынушыға фармацевтикалық дамуынан бастап препараттың өмірлік циклінің барлық кезеңдерін қамтиды.
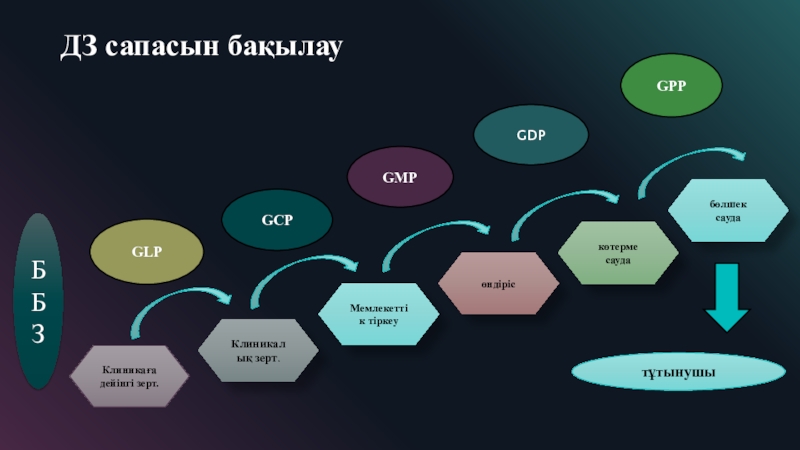
Слайд 4ДЗ сапасын бақылау
ББЗ
Клиникаға дейінгі зерт.
Клиникалық зерт.
Мемлекеттік тіркеу
өндіріс
көтерме сауда
бөлшек сауда
GLP
GCP
GMP
GDP
GPP
тұтынушы
Слайд 5GLP
GLP стандарты (ағылшын Good Laboratory Practice -Тиісті лабораториялық
практика) - зертханалық нәтижелерінің дәйектілігі мен сенімділігін қамтамасыз ету нормалардың,
ережелер мен нұсқаулардың жүйесі.
Осы стандарт жоспарлау, клиникалық зерттеулер жүргізу, есептерді дайындау және зерттеу есептерін қалыптастыру негізінде жүзеге асырылады. GLP ережелерді сақтау, зерттеу нәтижелерін және олардың жинақталу дәлдігін қамтамасыз етуге мүмкіндік береді. GLP ережелері заттың қауіпсіздігі анықтауына байланысты, клиникалық сынақтар жүргізу үшін технологиясын анықтайды.
Слайд 6
МЕЖДУНАРОДНЫЙ СТАНДАРТ
«OECD Principles on Good Laboratory Practice» (OECD, ENV/MC/CHEM(98)17,
1997 г.)
НАЦИОНАЛЬНЫЕ СТАНДАРТЫ
«Принципы надлежащей лабораторной практики» (ГОСТ Р 53434-2009)
США.
Good Laboratory Practice for Nonclinical Laboratory Studies (FDA, 21 CFR Part 58, 22 декабря 1978 г.)
GLP – СТАНДАРТ ДЛЯ ДОКЛИНИЧЕСКИХ ИСПЫТАНИЙ
данные
мониторинг
Слайд 7Даму тарихы
GLP жүйесі 20 жылдан астам уақыт бойы
жұмыс істеп келеді. Бастапқыда GLP стандарттары жүйесінің қолда бар нормативтік
құжаттамада сәйкессіздіктерді жою үшін улы заттарды пайдалана отырып, өндіріске қатысты азық-түлік және медициналық салалардың АҚШ басқармасымен (FDA) әзірленді және іске қосылды. GMP стандарттары АҚШ-та барлық компаниялар үшін міндетті болды, ал кейіннен - Америка Құрама Штаттары өз өнімдерін экспорттаушы елдерде міндетті болды. Содан кейін Экономикалық ынтымақтастық даму ұйымының (ЭЫДҰ) күшімен осы ережелер дүние жүзіне тарала бастады.
Слайд 8Даму тарихы
GLP ережесін құру кезінде бұрын GMP талаптарына
бекітілген сапаны бақылау принциптері қолданылды. Сонымен қатар, олар зертханалық жануарлар
iзгiлiкпен қарау қажеттігі туралы ереженi енгізілген. 1824 жылы компания Ұлыбританияда жануарлар қорғауға құрылған. АҚШ-та, ұқсас акт 1960-70 жылы 1966 жылы қабылданды. Еуропа Кеңесі шеңберінде жануарларды қорғау жөніндегі халықаралық конвенцияларға бірқатар қол қойылды.
2016 Жылдың 1-ші қаңтарынан бастап бастап Еуразиялық экономикалық одақ дәрілік заттарды өндіру үшін Тиісті зертханалық практикаға (GLP) бірыңғай ережелер енгізілуде.
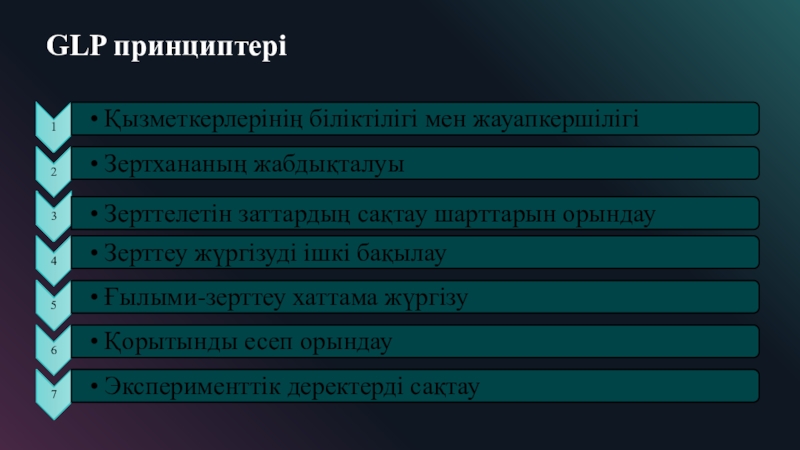
Слайд 9GLP негізгі міндеті
GLP негізгі міндеті - толық қадағалау
және зерттеу барысында қалпына келтіруге мүмкіндік береді. Сапаны бақылауды кезеңді
түрде GLP ережелерге сәйкес нақты органдарға жүзеге асыруға арналған. GLP құжаттаманы жүргiзу және сақтау үшін өте қатаң талаптар қояды. GLP қолдану саласы заңмен белгіленеді. Бұл, ең алдымен жаңа химиялық заттар дайындау, алу, улы заттар қолдану және денсаулық сақтау болып табылады.
Слайд 10Клиникаға дейінгі зерттеулер
ДД.ММ.20ГГ
Жаңа ДЗ клиникаға дейінгі этапта зерттеудің мақсаты
– олардың фармакологиялық қасиеттері мен тиімділігін, сонымен қоса, токсикалық қасиеттерін
анықтау болып табылады.
Жаңа дәрілік заттарды адамдарға тағайындамас бұрын, олардың тиімділігі мен қауіпсіздігі, экспериментальды моделдер мен жануарларда жүргізілген клиникаға дейінгі зерттеулерде анықталуы қажет. Мұндай зерттеулерге келесі аталғандар жатады:
· фармакологиялық;
· фармакокинетикалық;
· токсикологиялық.
Слайд 11ДД.ММ.20ГГ
ДОБАВИТЬ НИЖНИЙ КОЛОНТИТУЛ
► Фармакологиялық зерттеулер
Фармакологиялық зерттеулер жаңа ДЗ негізгі
әсерін, оның ағзадағы маңызды анатомиялық және физиологиялық жүйелерге әсерін және
де әсер ету ұзақтығын анықтауға мүмкіндік береді.
► Фармакокинетикалық зерттеулер
Фармакокинетикалық зерттеулер кезінде жаңа ДЗ сіңірілуі, ағзада таралуы, түрленуі және шығарылуы, сонымен қоса, олардың түрленуі салдарынан пайда болған метаболиттер туралы мәліметтер алынып, ДЗ уақыт аралығындағы фармакокинетикалық профилі анықталып, олардың мөлшерлеу тәртібін жасауға мүмкіндік береді.
►Токсикологиялық зерттеулер
Токсикалық зерттеулер кезінде экспериментальды жануарлардың ағзасына препараттың зақымдаушы әсерінің сипаты мен қарқындылығы анықталады.
Токсикологиялық зерттеулер үш этаптан тұрады:
- бірінші этапта ағзаға ДЗ бір рет енгізгеннен соң дамыған жедел токсикалық қасиеті зерттеледі;
- екінші этапта ДЗ екінші рет немесе бір жыл бойы бірнеше рет қайталап енгізген соң дамыған созылмалы токсикалық қасиеті зерттеледі;
- үшінші этапта препараттың арнайы токсикалық қасиеттері - канцерогенділігі, мутагенділігі, эмбриотоксикалық және тератогендік қасиеттері, аллергенділігі, сонымен қоса, дәрілік затқа тәуелділік тудыру қасиеті зерттеледі.

Слайд 12ДД.ММ.20XX
Бұл стандарт клиникалық емес фармацевтикалық өнімдер, пестицидтер, косметикалық
өнімдер, ветеринариялық препараттар, тамақ және азық қоспалары қамтылған объектілерді сынау,
және өнеркәсіптік пайдалануға арналған химикаттар кезінде пайдалануға арналған зертханалық практика, принциптерін белгілейді. Сынау препараттар синтетикалық сипатты мен биогенді, сондай-ақ тірі организм болуы мүмкін.
Қолдану аймағы
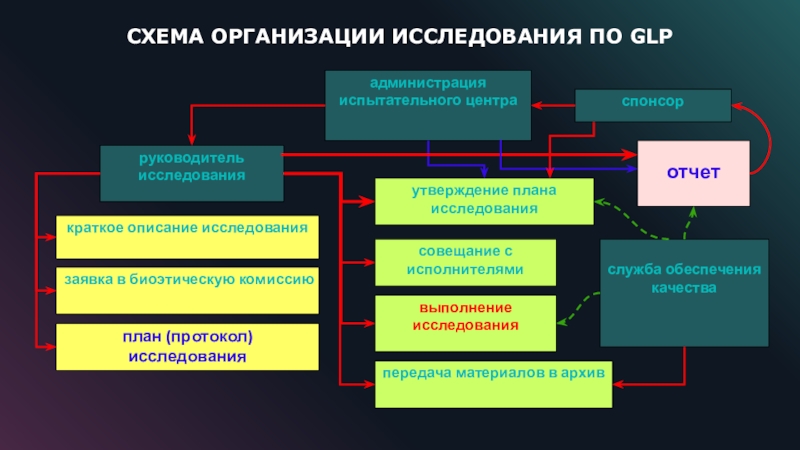
Слайд 15СХЕМА ОРГАНИЗАЦИИ ИССЛЕДОВАНИЯ ПО GLP
руководитель исследования
краткое описание исследования
заявка в биоэтическую
комиссию
план (протокол) исследования
выполнение исследования
отчет
передача материалов в архив
совещание с исполнителями
администрация испытательного
центра
спонсор
утверждение плана исследования
служба обеспечения качества
Слайд 18Бөлмелерге талаптар
Бөлмелер арнайы талаптарға сай болу керек
Зерттелінетін жануарлардың, ауру
жануарлардың бөлмелері және тамақ сақтайтын бөлмелері бөлек болу қажет
Барлық өндірістік
нысандар мерзімді санитарлық өңделуі тиіс
Клиникаға дейінгі зерттеулер жүргізілетін бөлме санитарлы- гигиеналық нормаға сай болу керек
Слайд 19Лаборатория размещена в корпусе биомедицинских исследований (2450 кв.м) Филиала ИБХ
РАН (Институт биоорганической химии Российской академии наук)
13 комнат для животных
17 лабораторных
комнат
Одновременное выполнение испытаний на грызунах 20-30 фармакологических веществ
корпус биомедицинских исследований
Слайд 20Лаборатория имеет необходимое оборудование и укомплектована персоналом, имеющим соответствующее образование,
квалификацию и опыт работы для выполнения доклинических испытаний по правилам
GLP
Слайд 21Қорытынды
Қорыта келгенде, GLP қағидаларын қамтитын медициналық
және экологиялық қауіпсіздік саласындағы клиникалық емес сынақтарға зертханалық, жылыжайлық және
далалық жағдайларды жүргізілген зерттеулер жатады. GLP қағидалары дәрілік заттарды, пестицидтерді, азықтық және жемдік қоспаларды, косметикалық өнімдерді, ветеринарлық препараттар, сондай-ақ өнеркәсіптік мақсаттағы химиялық заттарды тіркеу мен лицензиялау мақсатында жүргізілген медициналық және экологиялық қауіпсіздік саласында барлық сынақтары үшін қолданылады.
Ғылыми орталықпен GLP қағидаларын енгізу жөніндегі жоспарлы қызмет нәтижесінде 2014 жылы 31 наурызда Германия Федеративтік Республикасы Федералды GLP – бюросы мамандарының инспекция жүргізгеннен кейін Орталықтың зерттеу базасымен орындалған in vitro мутагендігін зерттеуі мен физикалық - химиялық сынақтарды дәлелдейтін сертификат алынып, Орталықтағы зерттеу базасымен орындалғандар GLP қағидаларына сай жүргізіледі.