Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Государственный университет Дубна Факультет естественных и инженерных наук
Содержание
- 1. Государственный университет Дубна Факультет естественных и инженерных наук
- 2. Руководство кафедрыЗаведующий кафедрой: Моржухина Светлана Владимировна,кандидат химических
- 3. Ежегодные профориентационные мероприятияна базе кафедры химии, новых
- 4. ЛЕТНЯЯ ХИМИЧЕСКАЯ ШКОЛАКонтингент – учащиеся 7 –
- 5. Основные задачи ЛХШ Привлечение ребят, интересующихся химией
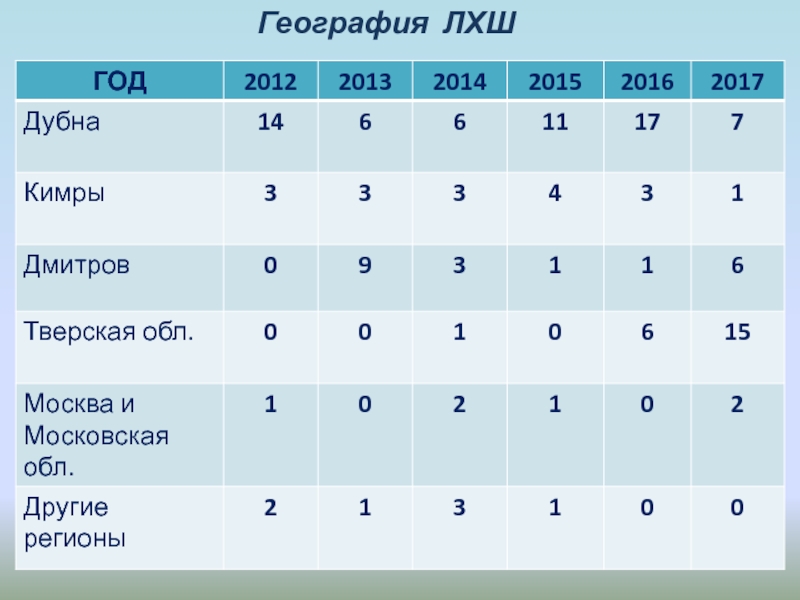
- 6. География ЛХШ До 2018 года приняли участие ученики 7–10 классов из городов:ДубнаЛобняКимрыДмитровТоржокКашинТалдомПушкиноВоронежЕльняИжевскСмоленск…
- 7. География ЛХШ
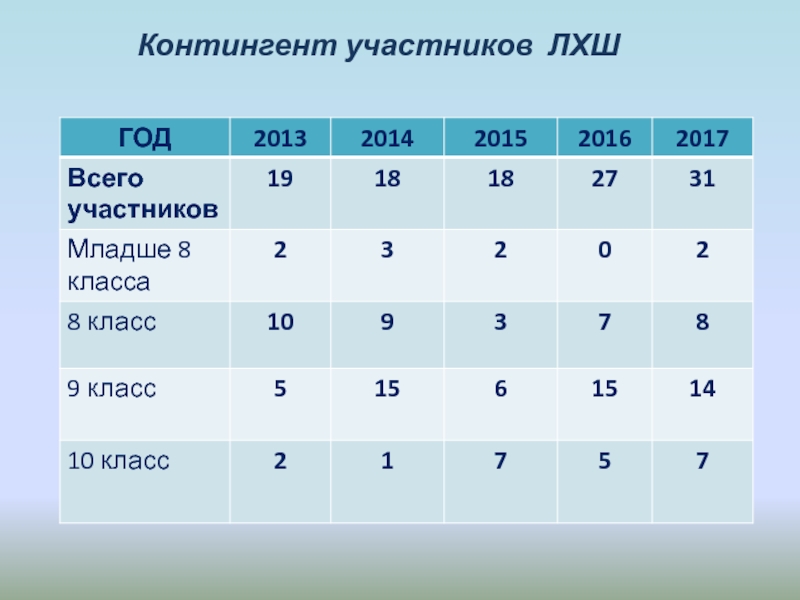
- 8. Контингент участников ЛХШ
- 9. В программе ЛХШРешение теоретических и экспериментальных задач
- 10. В программе ЛХШ 2. Работа в лабораториях Университета «Дубна» на современном оборудовании
- 11. Материально-техническое оснащение для совместной научно-практической работы старшеклассников
- 12. В программе ЛХШ3. Научно - популярные лекции ведущих преподавателей
- 13. Примеры тематик научно – популярных лекцийПроф. П.П.
- 14. В программе ЛХШ4. Культурно-экскурсионная программа на территории Университета и города Дубна
- 15. Экскурсионная программаОбзорная экскурсия по городуВодоканал Музей археологии
- 16. В программе ЛХШ5. Занимательные опыты по химии
- 17. В программе ЛХШ6. Отчетная конференция и награждение
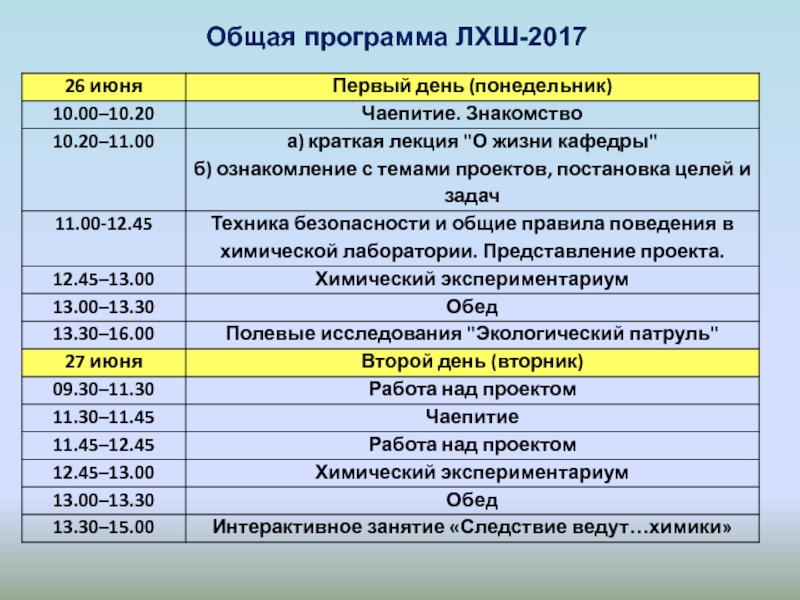
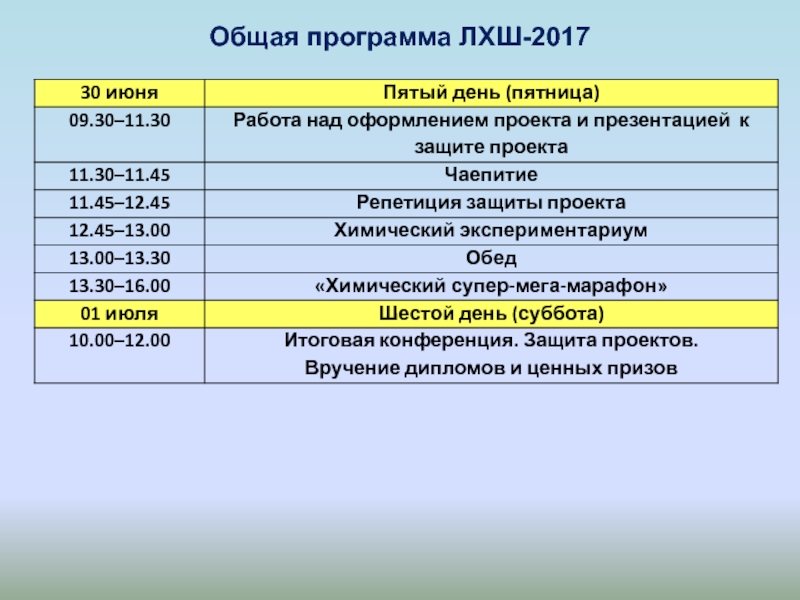
- 18. Общая программа ЛХШ-2017
- 19. Общая программа ЛХШ-2017
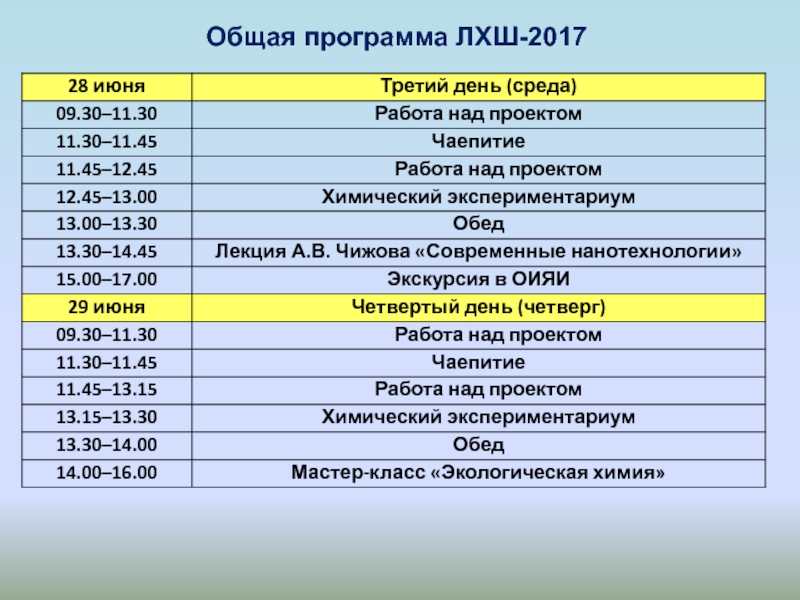
- 20. Общая программа ЛХШ-2017
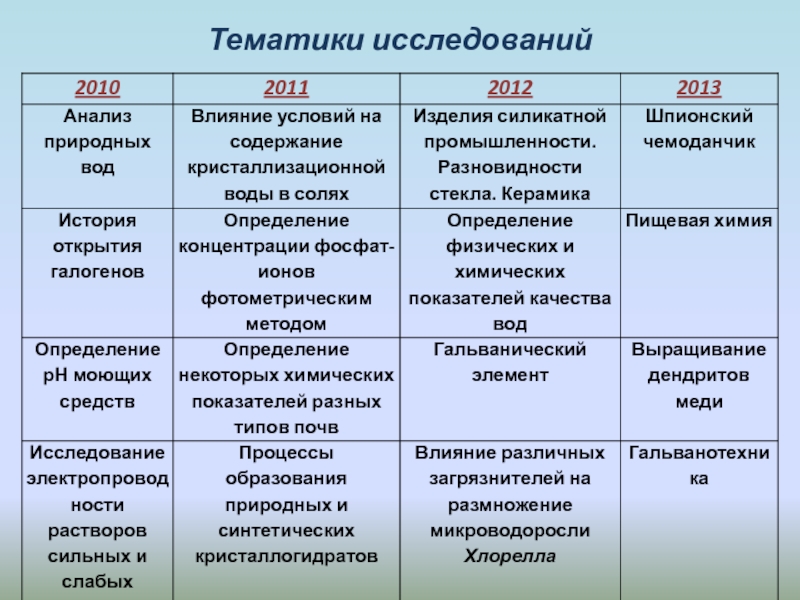
- 21. Тематики исследований
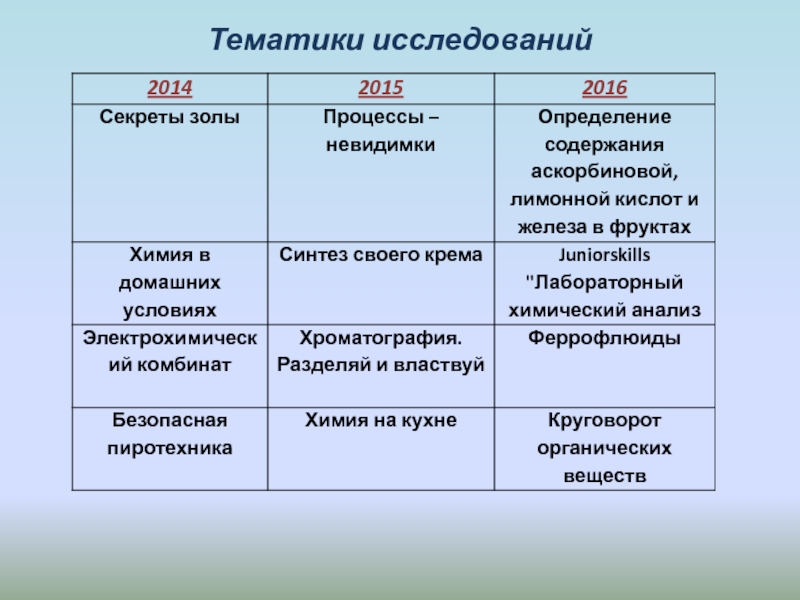
- 22. Тематики исследований
- 23. Проекты ЛХШ-2017«Химия на кухне» (рук. – ст.
- 24. Проекты ЛХШ-2017«Определение рН растений» (рук. – ст.преп.
- 25. Проекты ЛХШ-2017«Электрохимический комбинат» (рук. – магистр Ушакова
- 26. Государственный университет «Дубна» Кафедра химии, новых технологий
- 27. Целеполагание Сделать гальваническое покрытие своими руками, вооружившись
- 28. Слайд 28
- 29. План действий День первый: Начало.Техника безопасности по
- 30. День второй: Подбираем условия.Экспериментируем с медным покрытием!
- 31. День третий: продолжаем эксперименты!Никелирование и серебрение.Индивидуальные задания. Рисуем эскизы, подбираем материалы, готовим реагенты.
- 32. День четвертый: Самое главное! Пока идет процесс, учимся
- 33. День пятый: ИтогПодготовка изделий к демонстрации. Дополнительные покрытия, затирка и другие украшательства.Подготовка к отчетной конференции.
- 34. «Электрохимический комбинат» Руководители проета: Ушакова Е.Е., Волкова
- 35. Цель: Освоить метод электролиза, собрать гальванический элемент
- 36. Теоретическая основа электролизаБорис ЯкобиМайкл ФарадейАлессандро ВольтаЛуиджи ГальваниZn +
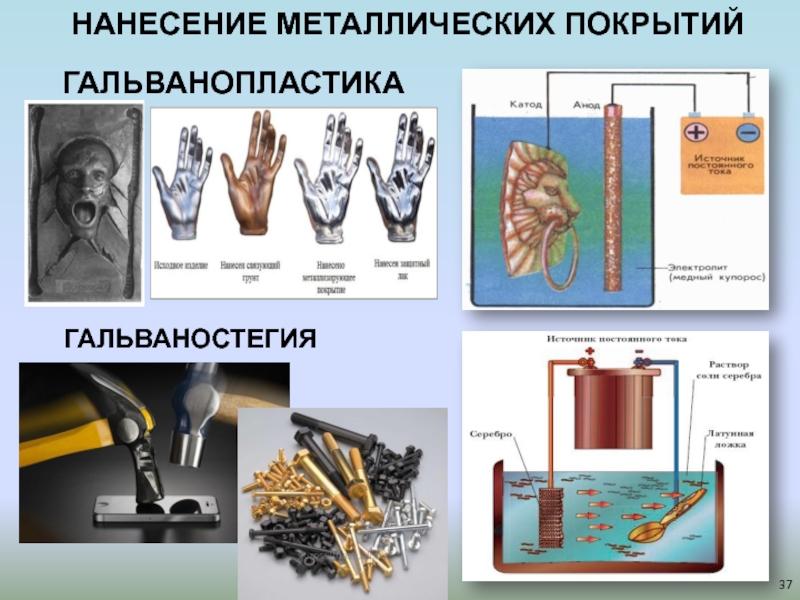
- 37. ГАЛЬВАНОПЛАСТИКАГАЛЬВАНОСТЕГИЯНАНЕСЕНИЕ МЕТАЛЛИЧЕСКИХ ПОКРЫТИЙ
- 38. Сборка и тестирование гальванического элементаРеакции на электродах:
- 39. «Съедобная» батарейка
- 40. Электролиз. Получение металлических покрытий под действием тока
- 41. Используемые реактивы: 450 мл воды, 25 г
- 42. Получение сульфата меди(II), CuSO4*nH2O Медный катод и
- 43. Выводы: В ходе работы были изучены теоретические
- 44. Литература:Кистяковский В. А.,. Электрохимия // Энциклопедический словарь Брокгауза и Ефрона :
- 45. СПАСИБО ЗА ВНИМАНИЕ !
- 46. Приглашаем вас на кафедру химии, новых технологий
- 47. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1 Государственный университет «Дубна» Факультет естественных и инженерных наук Кафедра химии, новых технологий и
материалов
ЛЕТНЯЯ ХИМИЧЕСКАЯ ШКОЛА
Слайд 2Руководство кафедры
Заведующий кафедрой:
Моржухина Светлана Владимировна,
кандидат химических наук, доцент
Заместитель заведующего
по
научной работе:
Гладышев Павел Павлович,
доктор химических наук, профессор
Слайд 3Ежегодные профориентационные мероприятия
на базе кафедры химии, новых технологий и материалов:
Выполнение
совместных экспериментальных проектов по химии
Дни науки
Научный лекторий по современным
проблемам химииРегиональная олимпиада по естественным наукам для учащихся 8 – 11 классов (химия, география, физика)
Региональная конференция по естественным наукам для учащихся 7 – 11 классов (химия, науки о Земле, физика)
Летняя Химическая Школа
Встречи студентов и преподавателей со школьниками на кафедре и в СОШ
Для преподавателей: курсы повышения квалификации
Подготовительные курсы по химии
Слайд 4ЛЕТНЯЯ ХИМИЧЕСКАЯ ШКОЛА
Контингент – учащиеся 7 – 10 классов
Дата проведения
– последняя неделя июня.
Участие – бесплатное.
Сроки проведения – 1
неделя.Количество участников в 1 проекте – не более 5.
Руководители проектов – преподаватели, аспиранты, магистры.
Помощники руководителей – студенты кафедры 1 и 3 курса.
Для иногородних – возможность проживания с сопровождающим.
Слайд 5Основные задачи ЛХШ
Привлечение ребят, интересующихся химией
Обучение работать в
команде
Обучение методам поиска научной информации и обработки литературы по
заданной темеПриобретение навыков проведения экспериментов, работы с реактивами, современным оборудованием
Анализ и обработка полученных данных, выводы
Составление научной презентации по теме
Опыт выступлений на научной конференции
Слайд 6География ЛХШ
До 2018 года приняли участие ученики 7–10 классов из
городов:
Дубна
Лобня
Кимры
Дмитров
Торжок
Кашин
Талдом
Пушкино
Воронеж
Ельня
Ижевск
Смоленск…
Слайд 11Материально-техническое оснащение для совместной научно-практической работы старшеклассников и студентов
Хроматограф «Аквилон»
Система капиллярного электрофореза «Капель»
Спектрофотометр UNICO 2100
Оптический эмиссионный спектрометр Shimadzu
ИК-Фурье спектрометр
ShimadzuГазовый хроматограф Shimadzu
Слайд 13Примеры тематик научно – популярных лекций
Проф. П.П. Гладышев «Роль химии
в развитии и реализации нанотехнологий»
Доц. Л.П. Чермных «Челюсти»
«Симметрия в природе»
«Слово
о камне»проф. А.В. Чижов «Современные нанотехнологии»
Доц. И.Н. Фадейкина «Что могут полимеры»
Слайд 14В программе ЛХШ
4. Культурно-экскурсионная программа на территории Университета и города
Дубна
Слайд 15Экскурсионная программа
Обзорная экскурсия по городу
Водоканал
Музей археологии и краеведения
Музей естественной
истории
Музей истории науки и техники ОИЯИ
Центр Просвещения им. академика А.Н.
СисакянаООО «Шоколадная фабрика Александра»
Слайд 17В программе ЛХШ
6. Отчетная конференция и награждение участников
спонсор - Фонд
развития культуры и образования «Московское время»
Слайд 23Проекты ЛХШ-2017
«Химия на кухне» (рук. – ст. преп. Плешкова Н.А.).
Самые младшие участники и ребята постарше исследовали химические процессы с
продуктами питания, моющими средствами, протекающие в быту. Также ребята изучили используемые на кухне источники энергии и химические способы подготовки продуктов к употреблению в пищу.«Легкоплавкие стекла» (рук. – ст.преп. Мухина И.В.). Команда проекта из учащихся 8-9 классов экспериментально исследовала методы получения цветных стекол в химической лаборатории. Ребята познакомились с историей развития стеклоделия, основными способами получения легкоплавких цветных стекол, а также определили влияние различных добавок на цвет стекла.
Слайд 24Проекты ЛХШ-2017
«Определение рН растений» (рук. – ст.преп. Попова Е.С.). Учащиеся
9 класса осуществили пробоотбор и пробоподготовку более 10 видов растений,
научились определять рН растворов и на основании полученных результатов смогли рекомендовать те растения, которые лучше всего подходят в качестве индикаторов для определения различных сред.«Бензиновая корпорация» (рук. – доц. Фадейкина И.Н., студ. Глазунов И., Огурцова А.). Ребята, окончившие 9-10 класс, изучали состав, октановое число и плотность бензинов, по полученным характеристикам смогли сделать вывод о качестве исследуемых бензинов. Также участники проекта отбирали пробы воды с открытых водоемов г. Дубна и г. Дмитров и определяли в них содержание нефтепродуктов методом ИК-спектроскопии.
Слайд 25Проекты ЛХШ-2017
«Электрохимический комбинат» (рук. – магистр Ушакова Е.Е.) для ребят
9-10 класса. Данный проект был посвящен экспериментальному изучению электрохимических свойств
металлов, процессов электролиза, гальваностерии и гальванопластики. Опытным путём доказана возможность перехода химической энергии в электрическую путем конструирования гальванического элемента. Участниками освоен процесс создания различных металлических покрытий на примере меди и никеля в процессе проведения электролиза в водных растворах солей.Слайд 26Государственный университет «Дубна» Кафедра химии, новых технологий и материалов Проект Летней Химической
Школы
«Электрохимический комбинат»
Для учащихся 9-10 класса
Слайд 27Целеполагание
Сделать гальваническое покрытие своими руками, вооружившись лишь минимум необходимых
знаний и толикой терпения, по силам каждому. А красивая вещица
- украшение, копия старинной монеты, статуэтка или что-то другое - будет тому подтверждением. Возможно, это станет первым шагом к новому хобби или серьезному увлечению.Слайд 29План действий
День первый: Начало.
Техника безопасности по работе с электрооборудованием, химической
посудой, реактивами. Общие правила поведения в химической лаборатории
Гальванические процессы –
это просто! (немного теории)Пробные запуски гальванических ванн.
Слайд 30День второй: Подбираем условия.
Экспериментируем с медным покрытием! Меняем силу тока
и напряжение, пробуем разные электролиты, разные материалы для формы, наблюдаем
и делаем выводы.Слайд 31День третий: продолжаем эксперименты!
Никелирование и серебрение.
Индивидуальные задания. Рисуем эскизы, подбираем
материалы, готовим реагенты.
Слайд 32День четвертый: Самое главное!
Пока идет процесс, учимся рассчитывать расход металла
в гальванических процессах и его потери.
Запускаем и наблюдаем за гальваническими
процессами на своих изделиях.Слайд 33День пятый: Итог
Подготовка изделий к демонстрации. Дополнительные покрытия, затирка и
другие украшательства.
Подготовка к отчетной конференции.
Слайд 34«Электрохимический комбинат»
Руководители проета:
Ушакова Е.Е., Волкова В.А., Щекодина В.С., Фокина
С.И., Хрущев А.Г., Саргсян П.В.
Выполнили:
Федорова Д.А., Новикова Д.В.,
Кириченко Е.В.,
Яковлева Е.С., Сергеева Е.С., Берешполова Ю.Д., Качанов Ф.С., Козин А.А.Слайд 35Цель: Освоить метод электролиза, собрать гальванический элемент и проверить его в
работе. Задачи: - Изучить теоретический материал об электрохимических свойствах металлов, электролизе, гальваностерии
и гальванопластике; - исследовать электрохимические свойства металлов в воде в отсутствии тока; - собрать и испытать гальванический элемент из собранных материалов; - исследовать электрохимические свойства меди и никеля.Слайд 36Теоретическая основа электролиза
Борис Якоби
Майкл Фарадей
Алессандро Вольта
Луиджи Гальвани
Zn + CuSO4 → ZnSO4 + Cu
Zn – 2e → Zn2+
(-),
Cu2+ + 2e → Cu
(+)Слайд 38Сборка и тестирование гальванического элемента
Реакции на электродах:
(-)Fe = Fe2+ +
2е--;
(+) 2Н++ 2е-- =Н2
Ток в цепи после добавления деполяризатора
K2Cr2O7 После добавления ФФ
Теоретическая
ΔE =|E1-E2|=|Е°(2H+/H2)-
-Е°(Zn2+/Zn°)|= 0 + 0.44= =0.44B
2. До добавления K2Cr2O7
ΔE =0.43B
3. После добавления K2Cr2O7
ΔE = 0.51В
(-)Fe|Н₂SO₄|Cu(+)
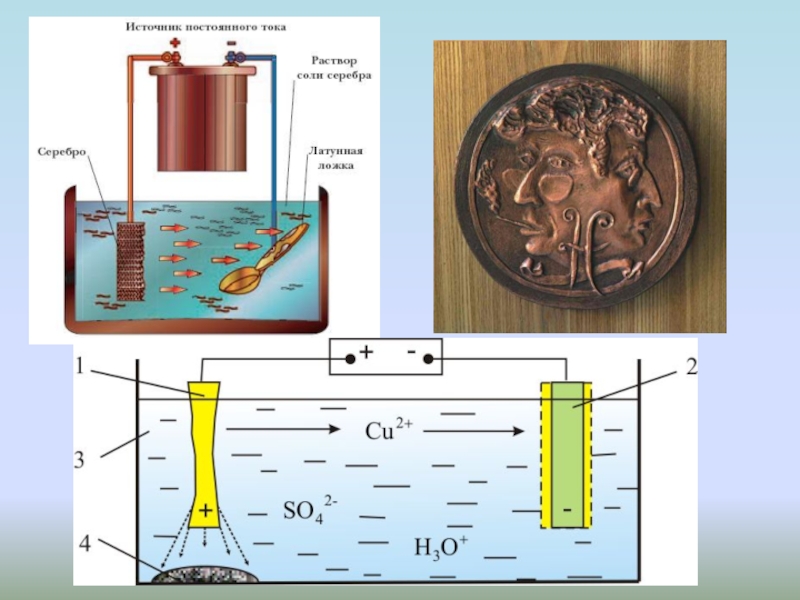
Слайд 40Электролиз. Получение металлических покрытий под действием тока
Используемые реактивы: 1
л воды, 250 г сульфата меди CuSO4 и 80-100г концентрированной
серной кислоты 10-15% H2SO4, медная пластинка, железная пластинкаВосстановление меди: Cu2+ + 2е-=Cu○
Покрытие железа слоем меди
Слайд 41Используемые реактивы: 450 мл воды, 25 г кристаллического сульфата никеля
NiSO4, 10г цитрата натрия Na3C6H5O7. пластина никеля, пластина железа.
Рис.8. Электролитическая
ячейка для никелирования. (-) железный электрод; (+) никелевый электродРис.9. Никелевое покрытие на железе (справа); медное покрытие на железе (слева снизу)
Никелирование железа:
Слайд 42Получение сульфата меди(II), CuSO4*nH2O
Медный катод и анод, электролит –
водный раствор серной кислоты H2SO4 10%.
Образование голубого сульфата меди
Слайд 43Выводы:
В ходе работы были изучены теоретические основы электролиза; собраны
источники тока и проверены в работе;
Экспериментальным путём была доказана
возможность перехода химической энергии в электрическую путем конструирования гальванического элемента;Был изучен и освоен процесс создания различных металлических покрытий в процессе проведения электролиза в водных растворах их солей.
Слайд 44Литература:
Кистяковский В. А.,. Электрохимия // Энциклопедический словарь Брокгауза и Ефрона : в 86 т.
(82 т. и 4 доп.), СПб., 1890—1907;
Багоцкий В.С. Основы электрохимии. М.,
1988;Энергетика. История, настоящее и будущее // [открытый электронный ресурс] http://energetika.in.ua/ru/books/book-2/part-3/section-10/10-1 (Дата обращения 29.06.2017);
Электрохимический ряд напряжений // [открытый электронный ресурс] http://chemistry48.ru/chemistry/practice/page/8/ (Дата обращения 09.02.2017);
Химия и Химики. Журнал Химиков-Энтузиастов // № 2, 2012;
Методы измерения в электрохимии, тт. 1-2. М., 1977.
Слайд 46Приглашаем вас на кафедру
химии, новых технологий и материалов!
Адрес: 141980,
г. Дубна, ул. Университетская, д. 19, корп. 2, ауд. 403
Телефон: (49621) 6-60-72
Сайты: http:// uni-dubna.ru
http://chem.uni-dubna.ru
E-mail: polot.nat@gmail.com
i.fadeikina@yandex.ru
kafchem@uni-dubna.ru