Слайд 2Каталог растений
Каталог растений России
Слайд 3Периодическая система химических
элементов Д.И. Менделеева
Слайд 4План описания химического элемента
Находим химический элемент в таблице и по
его положению описываем строение его атомов.
Все химические элементы в таблице
делятся на металлы и неметаллы. Отмечаем металл или неметалл, описываемый нами элемент.
Сравнение свойств нашего простого вещества металла или неметалла с соседними по подгруппе элементами.
Сравнение свойств нашего простого вещества металла или неметалла с соседними по периоду элементами.
Состав и характеристика высшего оксида описываемого элемента (то есть относится к основным, кислотным или амфотерным).
Состав и характеристика высшего гидроксида (то есть он является основанием, амфотерным гидроксидом, кислородосодержащей кислотой).
Если элемент неметалл, то состав летучего водородного соединения.
Слайд 6Находим химический элемент в таблице и по его положению описываем
строение его атомов.
Слайд 7Находим химический элемент в таблице и по его положению описываем
строение его атомов.
Z (число протонов) = 20
N (число нейтронов)
= A - Z = 40 - 20 = 20
Слайд 8Находим химический элемент в таблице и по его положению описываем
строение его атомов.
Электроны расположены
на четырёх энергетических
уровнях.
Слайд 9Находим химический элемент в таблице и по его положению описываем
строение его атомов.
20Ca
2e
8e
8e
2e
–
–
–
–
Cтепень окисления +2
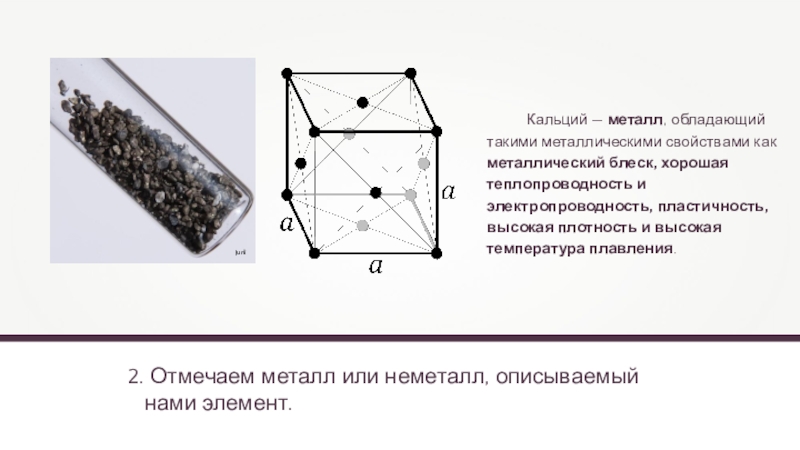
Слайд 102. Отмечаем металл или неметалл, описываемый
нами элемент.
Jurii
Кальций
— металл, обладающий такими металлическими свойствами как металлический блеск, хорошая
теплопроводность и электропроводность, пластичность, высокая плотность и высокая температура плавления.
Слайд 113. Сравнение свойств простого вещества металла или неметалла с соседними
по подгруппе элементами.
Бериллий
Кальций
Магний
Cтронций
Слайд 124. Сравнение свойств нашего простого вещества металла или неметалла с
соседними по периоду элементами.
Калий
Кальций
19K
20Сa
1S2/2S22p6/3S23p6/4S1
1S2/2S22p6/3S23p6/4S2
Слайд 135. Состав и характеристика высшего оксида описываемого элемента.
Оксид кальция
(СaO)
Оксид кальция
СаО является основным оксидом и проявляет такие свойства основного оксида
как взаимодействие с водой с образованием щёлочи, взаимодействие с кислотным оксидом с образованием соли, взаимодействие с кислотой с образованием соли и воды.
Слайд 146. Состав и характеристика высшего гидроксида.
Гидроксид кальция
(Ca(OH)2)
Гидроксид кальция проявляет типичные
свойства оснований: мылкость на ощупь, изменение окраски индикаторов, взаимодействие с
кислотами с образованием соли и воды, взаимодействие с оксидом неметалла с образованием соли и воды, взаимодействие с солью с образованием новой соли и нового основания.
Слайд 157. Состав летучего водородного соединения.
Металл кальций (Ca) летучего водородного
соединения не образует.
Слайд 16Находим химический элемент в таблице и по его положению описываем
строение его атомов.
Слайд 17Находим химический элемент в таблице и по его положению описываем
строение его атомов.
Z (число протонов) = 15
N (число нейтронов)
= A – Z = 31 - 15 = 16
Слайд 18Находим химический элемент в таблице и по его положению описываем
строение его атомов.
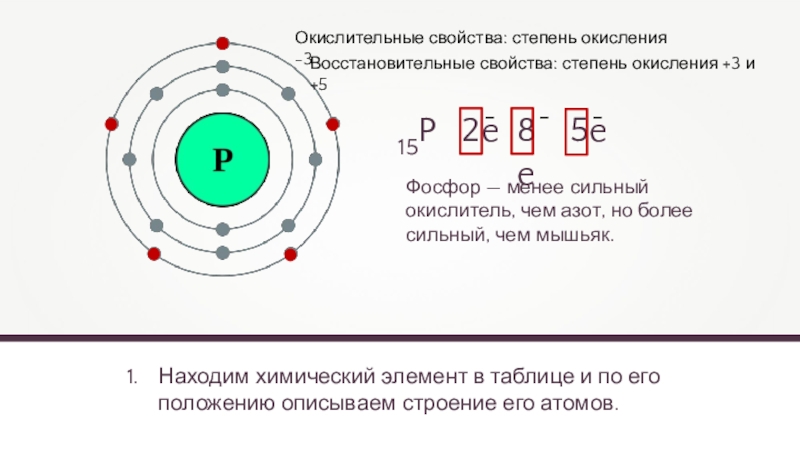
15P
2e
8e
5e
–
–
–
Окислительные свойства: степень окисления -3
Фосфор — менее
сильный окислитель, чем азот, но более сильный, чем мышьяк.
Восстановительные свойства: степень окисления +3 и +5
Слайд 192. Отмечаем металл или неметалл, описываемый
нами элемент.
Materialscientist
Фосфор
относится
к типичным неметаллам.
Кристаллическая структура
чёрного фосфора
Кристаллическая структура
красного фосфора
Слайд 203. Сравнение свойств простого вещества металла или неметалла с соседними
по подгруппе элементами.
Азот
Фосфор
Мышьяк
Слайд 214. Сравнение свойств нашего простого вещества металла или неметалла с
соседними по периоду элементами.
Кремний
Фосфор
Сера
Слайд 225. Состав и характеристика высшего оксида описываемого элемента.
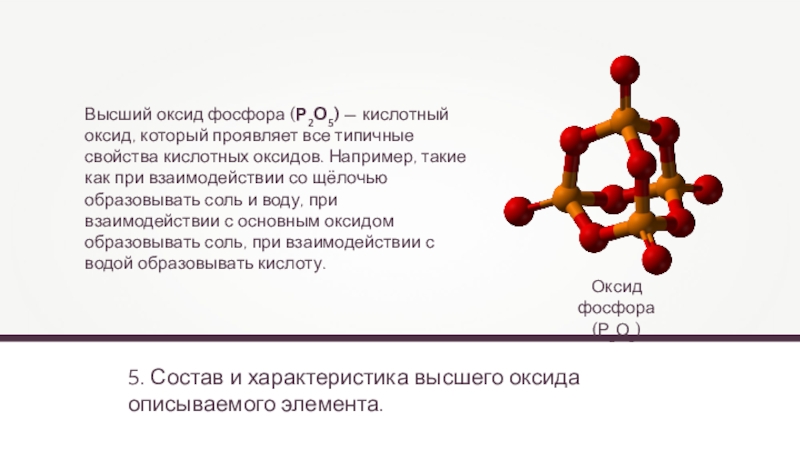
Оксид фосфора
(Р2О5)
Высший оксид
фосфора (Р2О5) — кислотный оксид, который проявляет все типичные свойства
кислотных оксидов. Например, такие как при взаимодействии со щёлочью образовывать соль и воду, при взаимодействии с основным оксидом образовывать соль, при взаимодействии с водой образовывать кислоту.
Слайд 236. Состав и характеристика высшего гидроксида.
Фосфорная кислота
(Н3РО4)
Высший гидроксид фосфора —
фосфорная кислота Н3РО4, раствор которой проявляет все типичные свойства кислот.
Например, такие как кислый вкус, изменение окраски индикаторов, взаимодействие с основаниями и оксидами металлов с образованием соли и воды.
Слайд 247. Состав летучего водородного соединения.
С водородом фосфор образует летучее
соединение фосфин РН3.
Слайд 25Периодическая система химических
элементов Д.И. Менделеева