Слайд 1ХИМИЧЕСКАЯ КИНЕТИКА
ФИЗИЧЕСКАЯ ХИМИЯ. ЛЕКЦИЯ 14.
Слайд 2Что изучает химическая кинетика?
Химическая кинетика изучает скорости протекания химических процессов
и их механизм
Основные задачи химической кинетики:
расчёт скоростей реакций и определение
кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача)
определение механизмов реакций по кинетическим кривым (обратная задача)
Знание механизма реакции, факторов, влияющих на скорость реакции позволяет управлять скоростью химической реакции
Слайд 3Скорость химической реакции
Скорость гомогенной химической реакции (в газовой фазе или
в растворе) – это изменение концентрации одного из реагентов или
продуктов реакции в единицу времени в единице объёма:
Знак (+) используют, если скорость определяют по продукту, а (-) – если по исходному веществу
Скорость химической реакции может быть измерена по любому компоненту, участвующему в реакции. Она всегда положительна, поэтому знак перед производной dni/dτ определяется тем, является ли вещество исходным реагентом (тогда dni/dτ отрицательна) или продуктом (тогда dni/dτ положительна)
Если реакция протекает при постоянном объёме, скорость определяют как изменение молярной концентрации ci в единицу времени:
Слайд 4Скорость химической реакции
Если химическая реакция описывается стехиометрическим уравнением
aA +
bB → rR + sS
то изменение количеств реагентов и продуктов
Δni в результате её протекания связаны между собой соотношениями:
С учётом стехиометрических коэффициентов скорость реакции равна
где i – стехиометрический коэффициент у вещества, по которому рассчитывают скорость реакции
Тогда скорость приводится к общему знаменателю и независимо от того, по изменению какого конкретного реагента или продукта она определялась, будет численно одинакова, т.е.
Слайд 5Элементарные реакции
Большинство химических реакций состоит из нескольких стадий, называемых элементарными
реакциями
Элементарная (простая) реакция – единичный акт образования или разрыва химической
связи, протекающий через образование переходного комплекса (т.е. реакция, протекающая в одну стадию)
Переходный или активированный комплекс – конфигурация ядер, соответствующих переходу от реагентов к продуктам
Обычно переходному комплексу отвечает область вблизи максимума на энергетической кривой химической реакции
Слайд 6Молекулярность реакции
Для характеристики элементарных реакций используют понятие молекулярности реакции
Молекулярностью реакции
называют число частиц, участвующих в элементарной реакции
Слайд 7Механизм реакции
Сложная реакция состоит из нескольких элементарных реакций
Совокупность элементарных реакций
называют механизмом реакции
Скорость сложной реакции определяется скоростью самой медленной её
стадии (лимитирующая стадия)
Уравнение химической реакции не отражает её механизма
По уравнению реакции нельзя сказать, является ли реакция элементарной или сложной
Слайд 8Факторы, влияющие на скорость реакции
Природа реагирующих веществ (тип химических связей
в молекулах реагентов, прочность связей, строение кристаллической решётки, строение электронной
оболочки атома, прочность связывания внешних электронов и др.
Концентрация реагентов
Температура
Давление
Катализатор
Степень перемешивания веществ
Слайд 9Постулаты химической кинетики
Законы химической кинетики основаны на двух принципах (постулатах):
скорость
химической реакции пропорциональна концентрациям реагентов
суммарная скорость нескольких последовательных превращений, широко
различающихся по скорости, определяется скоростью наиболее медленной стадии
Слайд 10Влияние концентрации реагирующих веществ на скорость реакции
Функциональная зависимость скорости химической
реакции от концентраций компонентов называется кинетическим уравнением реакции
Основной постулат химической
кинетики или закон действующих масс:
скорость химической реакции при постоянной температуре в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведённым в некоторые степени
Для необратимой элементарной химической реакции
aA + bB → rR + sS
скорость равна
где k – константа скорости химической реакции; зависит только от температуры
a и b – порядки реакции по реагентам (частные порядки) соответственно А и В, совпадают со стехиометрическим коэффициентом
Их сумма a + b = n называется общим порядком реакции
Слайд 11Порядок сложной реакции
Порядок сложной реакции по веществу в общем случае
не совпадает с коэффициентами в уравнении реакции
Общий порядок реакции равен
сумме показателей степеней в уравнении скорости реакции
Для реакции
aA + bB + dD → rR + sS + qQ
кинетическое уравнение
где частные порядки α, β и δ находят экспериментально
В общем случае α≠a, β≠b и δ≠d, т.е. молекулярность и порядок реакции не совпадают
Общий порядок реакции равен сумме показателей степеней в уравнении скорости реакции: n=α+β+δ
Порядок реакции может быть положительным и отрицательным, целым и дробным
Слайд 12Реакции нулевого порядка
Реакциями нулевого порядка по данному веществу являются реакции
в закрытой системе про постоянном подводе одного из веществ, обеспечивающем
его концентрацию постоянной, или при содержании малорастворимой твёрдой фазы при условии, что скорость растворения велика (т.е. )
Скорость этих реакций не зависит от концентрации реагирующих веществ и равна константе скорости: v=k
Кинетическое уравнение:
Разделяя переменные и интегрируя, получим: (или )
Особенности реакций нулевого порядка:
Концентрация исходного вещества линейно уменьшается во времени
Константа скорости и время, необходимое для достижения заданной концентрации
Время полупревращения (период полураспада) – время, за которое превращается половина вещества (т.е. С=1/2 С₀)
Кинетическая кривая реакции нулевого порядка
Слайд 13Примеры реакций нулевого порядка
Реакции нулевого порядка встречаются в гетерогенных процессах,
гетерогенном катализе и всегда указывают на протекание сложной реакции, состоящей
из нескольких последовательных стадий
Лимитирующей стадией является диффузия, поэтому химическое превращение не влияет на скорость
Гетерогенная реакция горения углерода
С (т) + О₂(г) = СО₂(г)
при большом парциальном давлении кислорода (например, когда применяют дутье), израсходованный кислород практически сразу восполняется; при уменьшении парциального давления кислорода до определенной величины порядок реакции становится первым
Гидрирование этилена на платине:
С₂Н₄+Н₂ => (Pt) => C₂H₆
Скорость реакции здесь определяется площадью поверхности катализатора и не зависит от концентрации реагирующих веществ
Разложение на платиновой проволоке оксида азота (I) или аммиака
2N₂O => (Pt) => 2N₂+O₂
2NH₃ => (Pt) =>N₂+3H₂
Омыление малорастворимого сложного эфира водой в разбавленном водном растворе (эфир в избытке), чтобы в системе присутствовал эфирный слой, то расход эфира будет постоянно восполняться из эфирного слоя
Фотохимические реакции (скорость процесса лимитируется подачей энергии, необходимой для активации реагирующих молекул)

Слайд 14Реакции первого порядка
Это реакции типа А => продукты
Скорость реакции прямо
пропорциональна концентрации, т.е. кинетическое уравнение:
Разделяя переменные
и интегрируя, получим
Кинетические
кривые реакций первого порядка:
Слайд 15Реакции первого порядка
Особенности реакций первого порядка:
Скорость реакции экспоненциально зависит от
концентрации
График зависимости lnC от времени выражается прямой линией
Концентрация исходного вещества
стремится к нулю при
Время полупревращения при С=С₀/2
т.е. не зависит от начальной концентрации реагирующего вещества
Кинетическая кривая инвариантна, т.е. кинетическое уравнение остаётся неизменным при умножении концентрации на какую-либо постоянную величину; поэтому для оценки скорости реакции вместо концентрации можно использовать любую другую пропорциональную её величину, например, электропроводность, спектральную оптическую плотность, объём раствора, израсходованного на титрование.
Слайд 16Примеры реакций первого порядка
Разложение оксида азота (V) в газовой фазе
Разложение
ацетона
Радиоактивный распад
Гидролиз в растворе
Инверсия тростникового сахара в кислотной среде
Реакции изомеризации
Слайд 17Реакции второго порядка
В реакции участвуют два реагента
Возможны два случая
Случай
1.
А+В→продукты, начальные концентрации веществ равны, т.е.
Кинетическое уравнение
Разделяя переменные и
интегрируя в пределах от С₀ до С, получим
Из этого уравнения следует, что концентрация исходных веществ зависит от времени следующим образом:
Слайд 18Реакции второго порядка
Особенности реакций второго порядка:
Скорость реакции гиперболически зависит от
концентрации
При равенстве начальных концентраций реагирующих веществ обратная концентрация линейно
зависит от времени
Константа скорости
Время полупревращения при С=С₀/2 обратно пропорционально начальной концентрации
Слайд 19Реакции второго порядка
Случай 2.
А+В→продукты, начальные концентрации веществ не равны, т.е.
Кинетическое
уравнение
Разделяя переменные и интегрируя, получим
Время полупревращения
Слайд 20Примеры реакций второго порядка
Газофазное разложение иодоводорода
Разложение оксида азота (IV)
Разложение гипохлорит-иона
в растворе
Газофазное образование иодоводорода
Радикальные реакции, например:
Слайд 21Реакции n-го порядка
Это реакции типа nА→продукты
Кинетическое уравнение
Решение уравнения:
Время полупревращения
Слайд 22Реакции других порядков
Необычный — дробный или отрицательный — порядок реакции
однозначно указывает на её сложный механизм
В растворах, если реакция происходит
между молекулой и ионом, возможен порядок 3/2
Реакция окисления СО кислородом на поверхности платины
2СО+О2→2СО2
имеет отрицательный (минус первый) порядок по СО:
т. е. при увеличении концентрации СО скорость реакции уменьшается
Слайд 23Определение порядка реакции
Методы определения порядка реакции базируются на методах вычислительной
математики, которые позволяют по кинетическим кривым, полученным экспериментально, найти порядки
реакции по отдельным реагентам
Слайд 24Метод Вант-Гоффа
Порядок реакции определяют по скоростям превращения
Для реакции А+В→продукты записывают
уравнение закона действующих масс:
Для определения порядка реакции по веществу А
проводят серию экспериментов при постоянной начальной концентрации вещества В ( )
В этих условиях
При различных значениях измеряют начальные скорости и строят график зависимости от , который выражается прямой линией
Тангенс угла наклона прямой равен порядку реакции по веществу А (tgα=n)
Аналогично по данным другой серии экспериментов
определяют порядок реакции по веществу В
Порядок реакции можно определить и расчётным путём:
Слайд 25Метод подстановки
Заключается в том, что экспериментальные данные последовательно подставляют в
интегральные кинетические уравнения для реакций целых порядков и рассчитывают константу
скорости k
Если для выбранного порядка значения k приблизительно постоянны, то изучаемая реакция имеет данный порядок
Если ни одно из кинетических уравнений не даёт удовлетворительного результата, то порядок реакции не является целым, т.е. реакция описывается более сложным кинетическим уравнением
Правильность выбора уравнения проверяется графически по линейности получаемого графика в соответствующих координатах
Способ трудоёмок и позволяет определить только целые порядки реакции
Слайд 26Метод Оствальда-Нойеса
Порядок реакции определяют по времени достижения определённой доли превращения
α:
Отсюда порядок реакции
Слайд 27Метод полупревращения
Частный случай метода Оствальда-Нойеса
Порядок реакции определяют по периоду полупревращения
(α=1/2)
Метод Оствальда-Нойеса и метод полупревращения позволяют определять любые значения порядка
реакции, включая дробные и отрицательные
Слайд 28Влияние температуры на скорость реакции
Скорость большинства реакций увеличивается с ростом
температуры, т.к. при этом возрастает энергия сталкивающихся частиц и повышается
вероятность того, что при столкновении произойдёт химическое превращение
Основное влияние температура оказывает на константу скорости реакции
Зависимость скорости реакции от температуры описывается правилом Вант-Гоффа и уравнением Аррениуса
Правило Вант-Гоффа: при повышении температуры на 10 градусов скорость большинства химических реакций увеличивается в 2-4 раза:
Температурный коэффициент скорости
Правило является приближённым и применимо в ограниченном интервале температур (реакции в растворах, 0-120°С, не слишком быстрые реакции)
Скорость реакции при температуре Т₂ можно определить по формуле:
Слайд 29Уравнение Аррениуса
Описывает зависимость константы скорости k от температуры (экспоненциальная):
Энергия активации
– энергетический барьер на пути реакции, избыток энергии по сравнению
со средней энергией молекул при данной температуре, необходимый для того, чтобы реакция произошла
Энергия активации определяется свойствами реагирующих частиц, их энергетическим состоянием
Слайд 30Определение энергия активации
Уравнение Аррениуса
в логарифмической форме:
и в дифференциальной форме
Энергию
активации вычисляют по значениям константы скорости, измеренным при нескольких разных
температурах
По экспериментальным данным строят график от1/Т
Тангенс угла наклона равен
Энергию активации можно вычислить по формуле:
Графическое определение энергии активации
Константа скорости, а следовательно, и скорость реакции увеличивается с увеличением температуры и уменьшением энергии активации
Слайд 31Аномальная зависимость константы скорости от температуры
Характерна для некоторых реакций третьего
порядка, ферментативных и цепных реакций
Существуют и реакции, скорость которых уменьшается
при нагревании. Так, реакция 2NO+О2=2NO2 протекает в две стадии, первая из которых обратима: 2NO(NO)2; (NO)2+O2 2NO,. Константа скорости второй реакции, как это обычно и бывает, увеличивается с ростом температуры. Но вот концентрация продукта первой реакции — димера (NO)2 — при нагревании падает. Концентрация димера уменьшается быстрее, чем константа скорости второй реакции, поэтому суммарная скорость всего процесса при нагревании уменьшается
Скорость биохимических реакций, катализируемых ферментами, зависит от температуры следующим образом. Вплоть до некоторой критической температуры скорость ферментативной реакции увеличивается в соответствии с уравнением Аррениуса, а затем происходит денатурация фермента (нарушение его природной конфигурации), он теряет каталитические свойства, и скорость реакции уменьшается.
В цепных экзотермических реакциях возможно явление «теплового взрыва», при котором константа скорости резко возрастает при температуре выше некоторого предела

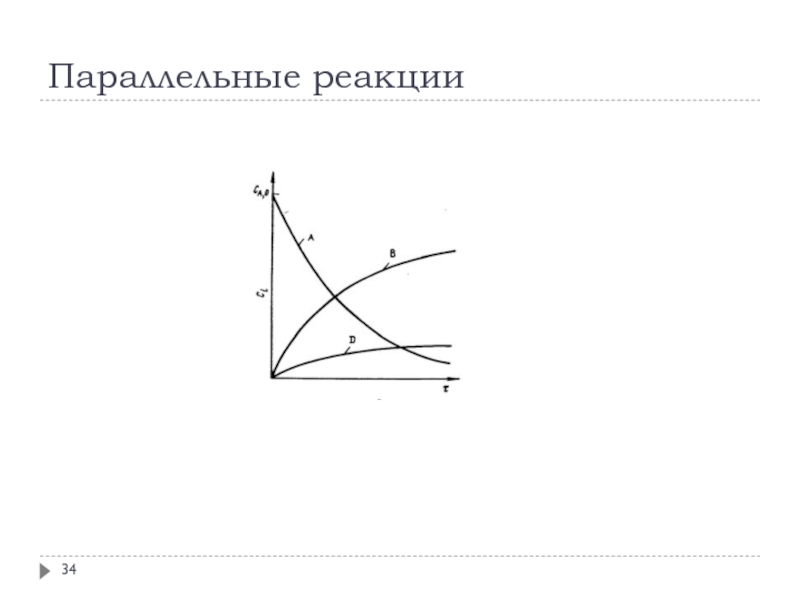
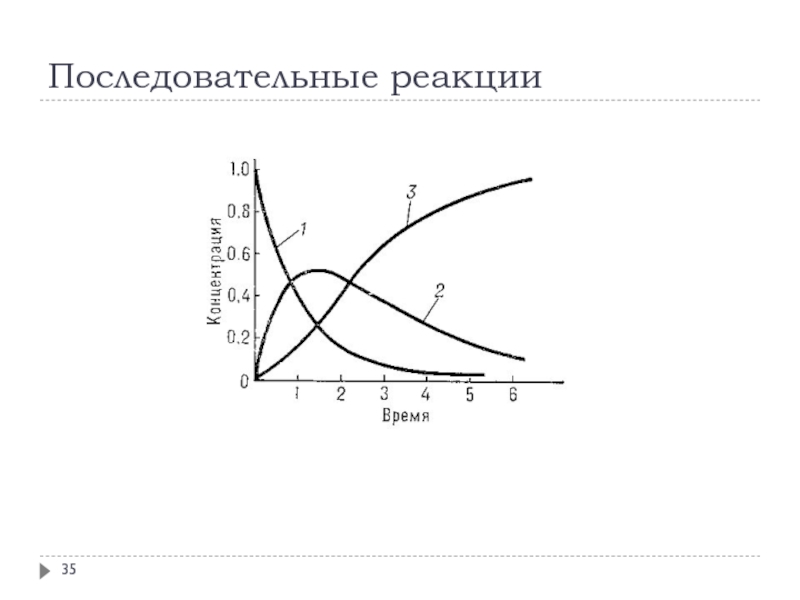
Слайд 32Кинетика сложных реакций
При изучении сложных реакций, включающих несколько элементарных стадий,
используют принцип независимости химических реакций:
если в системе протекает несколько простых
реакций, то каждая из них подчиняется основному постулату химической кинетики независимо от других реакций
Рассмотрим основные типы сложных реакций на примере реакций первого порядка