Слайд 1ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Шукаев И.Л.
2020
Слайд 2Химическая кинетика
Это наука о скоростях и механизмах химических реакций
Отличие от
термодинамики:
Термодинамика учит о возможности и невозможности протекания процессов, о
равновесии, но не учит, как достигнуть равновесия. Многие термодинамически возможные процессы практически не идут, ведь их скорость очень мала. Примеры - окисление органики (в том числе нас с вами) кислородом воздуха или кристаллизация стекла при обычных температурах.
Механизмы реакций – это путь, по которому исходные вещества (реагенты) переходят в конечные вещества (продукты). Реакции бывают простые или элементарные (идут в одну стадию) и сложные (включают несколько стадий, идущих последовательно или параллельно). При изучении механизма реакций стараются выделить эти элементарные реакции, определить их реагенты и продукты (в частности, промежуточные вещества), определить скорость каждой из составляющих простых реакций.
Механизмы реакций очень трудны для изучения, так как элементарный акт взаимодействия происходит за время порядка 10-13 с. Для их изучения применяют метод меченых атомов (то есть, необычных радиоактивных изотопов элементов), анализ скоростей реакций, спектроскопию и другие экспериментальные методы, а также компьютерное моделирование методами квантовой химии.
Все реакции делят на гомогенные (все реагенты и продукты находятся в одной фазе) и гетерогенные (когда есть граница раздела фаз).

Слайд 3Скорость реакции
На микроскопическом уровне - это число элементарных актов химического
взаимодействия в единицу времени в единице объёма (для гомогенных реакций)
или на единице площади контакта фаз (для гетерогенных).
Но этим определением очень трудно пользоваться: во-первых, очень трудно считать элементарные акты, во-вторых, почти невозможно правильно определить площадь контакта, особенно в твердофазных реакциях. Поэтому чаще скорость определяют через макроскопические параметры - измеримые на опыте концентрации или количества вещества.
Макроскопическая скорость гомогенной реакции - это количество вещества, расходующееся или образующееся в единицу времени в единице объёма. Обычно в элементарном акте рождается или гибнет одна или две частицы, поэтому макроскопическая скорость отличается от микроскопической в NA или в NA/2 раз.
Если объем системы постоянен, и никакие вещества в систему не добавляются и не выводятся из нее, то можно пользоваться более традиционным определением: макроскопическая скорость гомогенной реакции w - это изменение концентрации какого-то из реагентов или продуктов в единицу времени . Изменение концентрации исходного вещества отрицательно, поэтому, чтобы получить положительную скорость, перед ним нужно поставить минус, а если измерять по продуктам - то плюс.
wгом. = С/.
Но так определяется средняя скорость (когда интервал большой), а реально она все время изменяется. Поэтому для определения мгновенной скорости, как и в механике, нужно взять производную концентрации по времени:
wгом. = dC/d.

Слайд 4Скорость гетерогенной реакции
Слайд 5ЧТО ВЛИЯЕТ НА СКОРОСТЬ РЕАКЦИИ?
Природа веществ (что конкретно реагирует, агрегатное
состояние, чистые вещества или в растворе так далее)
Концентрации реагентов (для
газов – давления)
Температура системы
Присутствие нерасходуемых веществ, ускоряющих реакцию (катализаторов)
Присутствие немного расходуемых веществ, замедляющих реакцию (ингибиторов)
Наличие высокоэнергетических излучений (например, ультрафиолетового излучения)
Природа растворителя (для реакций в растворе)
Площадь поверхности раздела фаз (для гетерогенных реакций)
Скорость подвода реагентов и отвода продуктов от границы раздела фаз (для гетерогенных реакций)
Слайд 6Зависимость скорости реакции от концентрации
Её описывает закон действия масс: скорость
гомогенной реакции, протекающей в одну стадию, пропорциональна концентрациям реагентов, взятым
в степенях с показателями, равными коэффициентам в уравнении реакции.
Если уравнение реакции aA + bB = хХ (большие буквы - вещества, маленькие - коэффициенты), то скорость
w = k СAa CBb, где С - молярные концентрации.
Эту формулу называют кинетическим уравнением. Обоснование: скорость пропорциональна частоте столкновений частиц, а она пропорциональна концентрации каждой из сталкивающихся частиц. Это уравнение имеет смысл только если a + b 3, потому что столкновение более трех частиц в одной точке практически невероятно.
Другой способ обозначения концентрации - формула в квадратных скобках. Принято в этих скобках писать концентрацию частиц, реально существующих в растворе. Например, Na2S2O3 - сильный электролит, в растворе существует в виде ионов, поэтому пишут не [Na2S2O3], a [S2O32-].
Если в реакции участвует газ, то принято вместо концентрации писать в кинетическом уравнении его парциальное давление. Согласно уравнению Менделеева-Клапейрона, оно пропорционально концентрации:
p = nRT/V = СRT, т.к. n/V = C.
Смысл константы скорости k - это величина скорости реакции при единичных концентрациях или единичных парциальных давлениях реагентов. Разумеется, и численное значение, и размерность k зависят от того, подставляются концентрации или давления, поэтому нужно различать kc и kp.

Слайд 7Молекулярность и порядок реакции
Молекулярность - число частиц (молекул, атомов, ионов,
радикалов), участвующих в элементарном акте химического взаимодействия. Это микроскопическая характеристика,
целое число от 1 до 3; различают мономолекулярные, бимолекулярные и тримолекулярные реакции. Тримолекулярные реакции редки, а больше трех частицне сталкиваются. Поэтому, если в уравнении реакции участвуют более трех частиц - эта реакция идет не в одну стадию. Если три, две или одна - то, может быть, в одну стадию, а может быть, и нет.
Порядок реакции - это макроскопическая характеристика, показатель степени или сумма показателей в кинетическом уравнении, которое правильно описывает наблюдаемую на опыте макроскопическую скорость реакции. В простейших случаях порядок и молекулярность совпадают. Но так бывает не всегда.
Иногда на опыте наблюдается дробный, нулевой или даже отрицательный порядок. Почему ?
1) Вещество, которое всегда присутствует в большой концентрации (например, растворитель), не входит в кинетическое уравнение, потому что мы на опыте не меняем его концентрацию. Но оно может участвовать в реакции.
2) Многие реакции являются сложными, и тогда наблюдаемое изменение концентрации определяется наложением нескольких разных процессов.

Слайд 8Виды сложных реакций
а) Параллельные - когда одно и то же
вещество расходуется (или образуется) в двух или нескольких независимых реакциях.
Например, нитрат аммония может разлагаться по трем уравнениям (термодинамически наиболее выгодно последнее, но реально возможны все три варианта):
NH4NO3 NH3 + HNO3
NH4NO3 N2O +2H2O
NH4NO3 N2 + 0.5O2 +2H2O.
Скорость расхода нитрата аммония - это сумма скоростей всех реакций.
б) Последовательные - когда продукт одной реакции является исходным веществом для другой. Если они резко отличаются по скорости, то скорость получения конечного продукта определяется скоростью самой медленной стадии. Если же скорости реакций сравнимы, то влияют они все. В результате может получиться дробный порядок.
в) Цепные – в которых один первичный акт вызывает длинную последовательность актов и образование больших количеств продукта. Они обычно идут по радикальному механизму. Радикал – группа атомов (или атом) с ненасыщенными валентностями, способная образовывать дополнительную связь и потому обычно недолгоживущая. Рассмотрим на примере неразветвленной реакции.
В смеси водорода с хлором при обычных условиях взаимодействие практически не идет. Но если разрушить одну молекулу (квантом ультрафиолетового излучения, электрическим разрядом, местным нагревом): Cl2 2Cl*, то образуются две неустойчивые активные частицы – радикалы. Далеев озможны два варианта: Cl* + Cl2 Cl2 + Cl* и Cl* + Н2 HCl + H*. Первый вариант не дает ничего нового, интереснее второй. Образовавшийся радикал Н* тоже реагирует с молекулой хлора или водорода и порождает новый радикал, и процесс продолжается, давая все больше молекул HCl. Иногда все же радикалы гибнут. Но для этого мало, чтобы столкнулись два радикала. Надо еще, чтобы они отдали выделяющуюся энергию третьей частице (или стенке сосуда), иначе образовавшаяся молекула опять распадется. Поэтому обрыв цепи происходит редко, и один исходный квант порождает десятки и сотни тысяч молекул продукта Разумеется, к таким процессам закон действия масс плохо применим.
Начало цепи могут положить и посторонние молекулы – инициаторы, которые легче распадаются на радикалы, чем сами реагенты. Как инициаторы полимеризации часто используют органические пероксиды R-O-O-R. Они легко распадаются на 2R-O* и начинают полимеризацию. Одна молекула инициатора вызывает соединение десятков тысяч молекул мономера. По внешним признакам инициатор похож на катализатор: без него реакция не шла, а после малой добавки резко ускорилась. Но инициатор расходуется при реакции и этим отличается от катализатора.

Слайд 9Зависимость скорости реакции от температуры
Нагревание резко ускоряет реакции. Это описывает
эмпирическое правило Вант-Гоффа:
при нагревании на каждые 10 скорость реакции
(при прочих равных условиях) возрастает в некоторое постоянное для данной реакции число раз , обычно – в 2 – 4 раза.
К2 = К1* T/10 (где Т=Т2-Т1).
Этого нельзя объяснить простым увеличением частоты столкновений. При нагревании на 10, например с 300 до 310 К, средняя кинетическая энергия частиц возрастает в 310/300 1,03 раза, а средняя скорость – в квадратный корень из этой величины, то есть в 1,015 раза, то есть на 1,5%. Это ничтожное увеличение не может объяснить роста скорости в 2-4 раза, то есть на 100-300%.
Причина в другом – в увеличении доли активных частиц. Чтобы произошла реакция, недостаточно столкновения молекул. Нужно еще, чтобы они обладали достаточной энергией для разрыва или ослабления связей. Эта пороговая энергия называется энергией активации ЕА.
Опыт показывает, что энергия активации обычно меньше энергии связей, то есть образование новых связей начинается, когда старые связи еще не полностью разорваны. Это переходное состояние называется активированным комплексом.
Тепловой эффект реакции равен разности энергий активации прямой и обратной реакций.

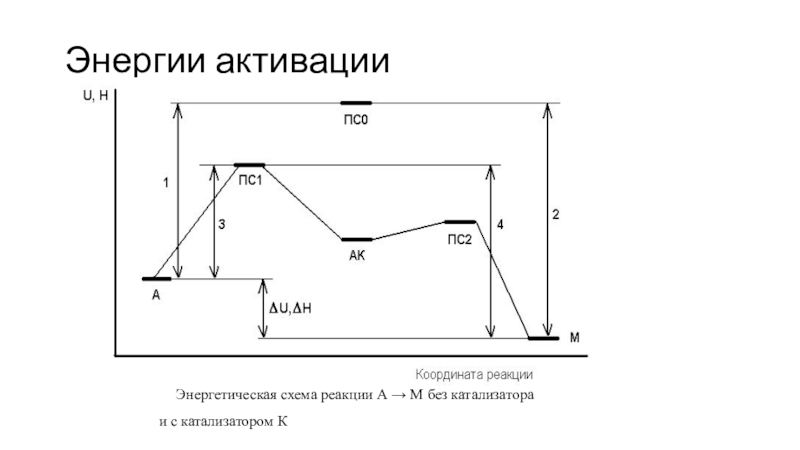
Слайд 10Энергии активации
Энергетическая схема реакции А → М без катализатора
и
с катализатором К
Слайд 11Уравнение Аррениуса
Оно также описывает зависимость константы скорости реакции от температуры:
К
= Ае-ЕА/RT.
Первый сомножитель А (предэкспоненциальный), пропорционален частоте столкновений частиц
реагентов в нужном соотношении и в нужной ориентации в единице объема при единичных концентрациях (или единичных парциальных давлениях). Второй сомножитель показывает вероятность того, что сталкивающиеся частицы будут иметь достаточную для реакции энергию. Для осуществления реакции нужны оба условия, поэтому скорость пропорциональна обоим сомножителям.
С математической точки зрения не могут быть одновременно верны и уравнение Вант-Гоффа, и уравнение Аррениуса. Но если эксперимент проводится в не очень широком интервале температур, то оба они удовлетворительно описывают экспериментальные данные. Первое не имеет теоретического обоснования и используется лишь потому, что удобнее для устного счета. Но из уравнения Аррениуса следует, что коэффициент Вант-Гоффа - не константа, а зависит от температуры.
При комнатной температуре (300 К) средняя кинетическая энергия молекул воздуха 2,5RT 6 кДж/моль, или 0,06 эВ/частицу. Может ли быть ЕА для какой-то реакции 1 кДж/моль? 104 кДж/моль? В принципе да, это не запрещено законами природы. Но ни ту, ни другую реакцию не удастся наблюдать на опыте – первая давно закончилась (почти все молекулы имели достаточную энергию), а вторая практически не идет, настолько велик активационный барьер. Реально можно изучать на опыте кинетику тех реакций, у которых ЕА составляет десятки или сотни кДж/моль.

Слайд 12Логарифмическая форма уравнения Аррениуса
Как проверить, подчиняются ли экспериментальные данные уравнению
Аррениуса?
Для этого удобно привести его к линейному виду, логарифмируя:
ln K = lnA - ЕА/RT.
Если рассматривать в качестве аргумента не Т, а 1/T, а в качестве функции не К, а lnK, то получается линейное уравнение. Строим график, откладывая по осям 1/T и ln K. Если точки ложатся на прямую, значит, уравнение выполняется, и можно рассчитать энергию активации
lnK1 = lnA - ЕА/RT1
lnKn = lnA - ЕА/RTn
Слайд 13ВЛИЯНИЕ КАТАЛИЗАТОРОВ
Катализатор – это вещество, которое увеличивает скорость реакции, но
само при этом не расходуется. (“не участвует”, “не изменяется” -
неверно). Само явление ускорения называется катализ.
Если катализатор не расходуется, это не значит, что он не вступает в реакции. Он участвует в промежуточных стадиях взаимодействия, а в конце выделяется в неизменном виде. Во многих случаях это доказано методом меченых атомов: использовали катализатор, содержащий необычный изотоп какого-то элемента, например, 18О, а после реакции оказывалось, что меченые атомы перешли в продукт и заменились в катализаторе атомами обычного изотопа из реагентов. Исследование твердых катализаторов в электронном микроскопе показывает, что во многих случаях меняется рельеф поверхности: хоть количество вещества не изменилось, но оно переместилось, значит, рвались связи…
Простейший пример гомогенного катализа.
2SO2 + O2 = 2SO3 – медленный процесс;
SO2 + NO2 = SO3 + NO – быстрый процесс;
2NO + O2 = 2 NO2 – быстрый процесс;
Суммарно: 2SO2 + O2 = 2SO3 – быстрый процесс в присутствии оксида азота.
Роль катализатора в том, что он направляет реакцию по новому пути с более низким энергетическим барьером (см. энергетическую диаграмму).

Слайд 14Скорость химической реакции
Химическая кинетика – наука о скоростях и механизмах
химических реакций. Термодинамика учит о возможности и невозможности протекания процессов,
о равновесии, но не учит, как достигнуть равновесия. Многие термодинамически возможные процессы практически не идут, т.е. их скорость очень мала.
Химические реакции – это превращения одних веществ в другие в результате столкновений молекул, ионов или радикалов друг с другом или с твёрдым телом в процессе теплового движения (радикал – обломок молекулы с ненасыщенной валентностью и потому неустойчивый, быстро соединяющийся с чем-нибудь).
Гомогенные реакции происходят в однородной среде – газовом, жидком или твёрдом растворе, а гетерогенные – на границе раздела фаз (газ–жидкость, газ–твёрдое, жидкость–жидкость, жидкость–твёрдое, твёрдое–твёрдое). Не путайте агрегатное состояние и фазу. Если все реагенты и продукты жидкие, сколько здесь фаз? Не всегда одна! Ведь бывают несмешивающиеся жидкости, например, вода и масло.