Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь – это совокупность взаимодействий между электронами и ядрами,
Содержание
- 1. Химическая связь – это совокупность взаимодействий между электронами и ядрами,
- 2. Характеристики связиДлиной химической связи (rc) называют величину,
- 3. Ориентация химической связи (с) – величина, измеряемая
- 4. Типы химической связи: КПС, КНС, ИС, МС
- 5. Механизмы обр. связиПри обменном механизме образования химической
- 6. Обменный механизм
- 7. Слайд 7
- 8. Донорно-акцепторный механизм
- 9. Основные характеристики ковалентной связи: насыщаемость направленность. Насыщаемость-
- 10. Направленность ковалентной связи1. Направленность ковалентной связи определяет
- 11. Полярность молекулы Полярность молекулы – и полярность
- 12. Дипольный момент Мерой полярности связи служит электрический
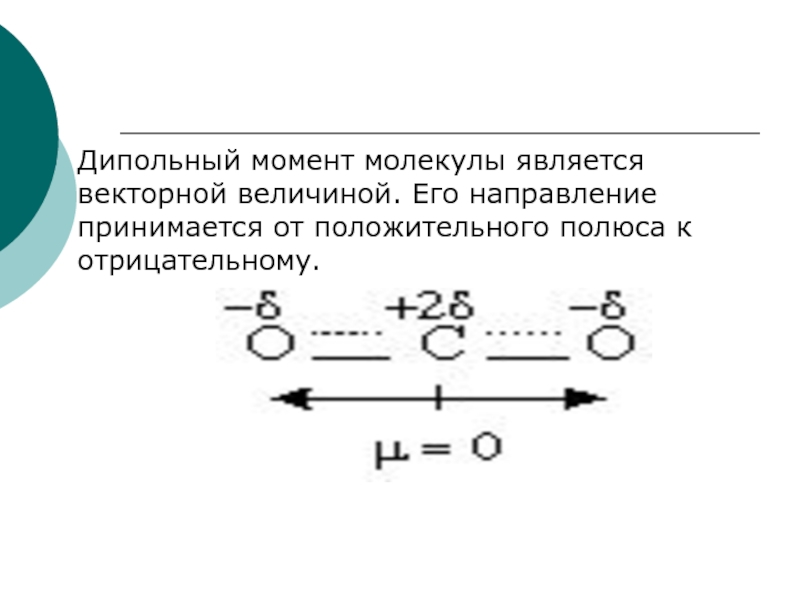
- 13. Дипольный момент молекулы является векторной величиной. Его направление принимается от положительного полюса к отрицательному.
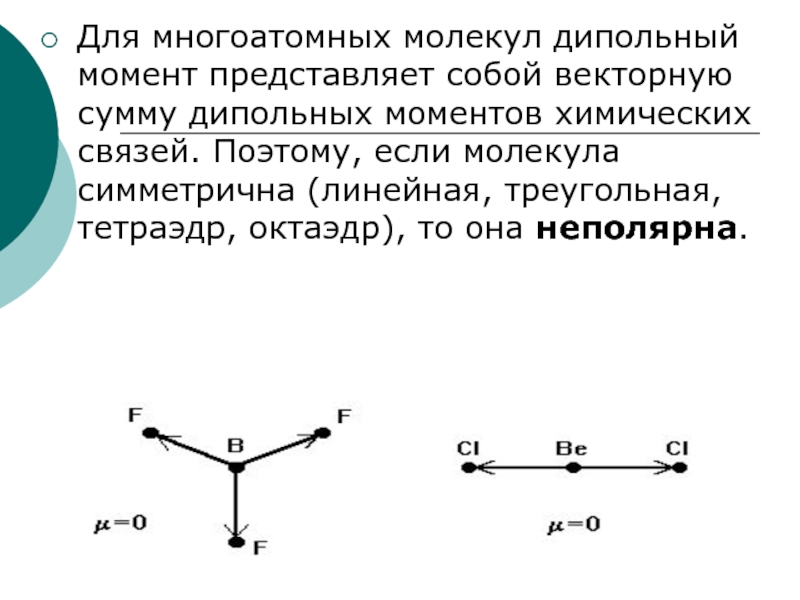
- 14. Для многоатомных молекул дипольный момент представляет собой
- 15. Ионная связьИонной называют связь, при которой осуществляется
- 16. Ионная связь, в отличие от ковалентной, характеризуется:
- 17. Металлическая связьМеталлическая связь проявляется при взаимодействии атомов
- 18. ВИДЫ межмолекулярных взаимодействийОсновные виды взаимодействия молекул: Вандерваальсовы
- 19. Слайд 19
- 20. Водородная связьЭто физико-химическая связь между водородом одной молекулы и ЭО элементом другой молекулы.
- 21. Есвязи, кДж/мольковалентная100-400водородная4-50межмолекулярная0,1 -5 Энергия Н-связи
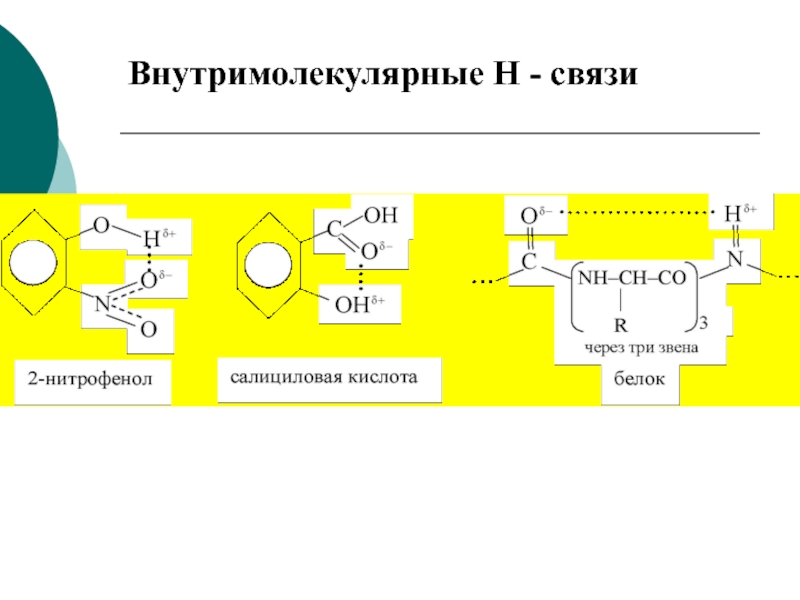
- 22. Внутримолекулярные Н - связи
- 23. Пространственная структура молекул Пространственная структура молекул зависит
- 24. Понятие σ, π, δ
- 25. НАПРАВЛЕННОСТЬ СВЯЗЕЙ. СОСОБЫ ПЕРЕКРЫВАНИЯ АОσ-связьπ-связьδ-связьs-s s-p p-p
- 26. Число σ-связей, которые образует центральный атом в
- 27. Гибридизации атомных орбиталей. Связи, образованные атомом за
- 28. sp2 – гибридизацияТИПЫ ГИБРИДИЗАЦИИ АОsp – гибридизация120º
- 29. sp3 – гибридизацияCН4Н2ОNН3ОNC104,50107,30Н-C-Н = 109,50Н-О-Н = 104,50Н-N-Н = 107,30····••••••··ТИПЫ ГИБРИДИЗАЦИИ АО
- 30. МВС, ММООбычно используют приближенные методы расчета двух-
- 31. Метод валентных связей Метод валентных связей (МВС)
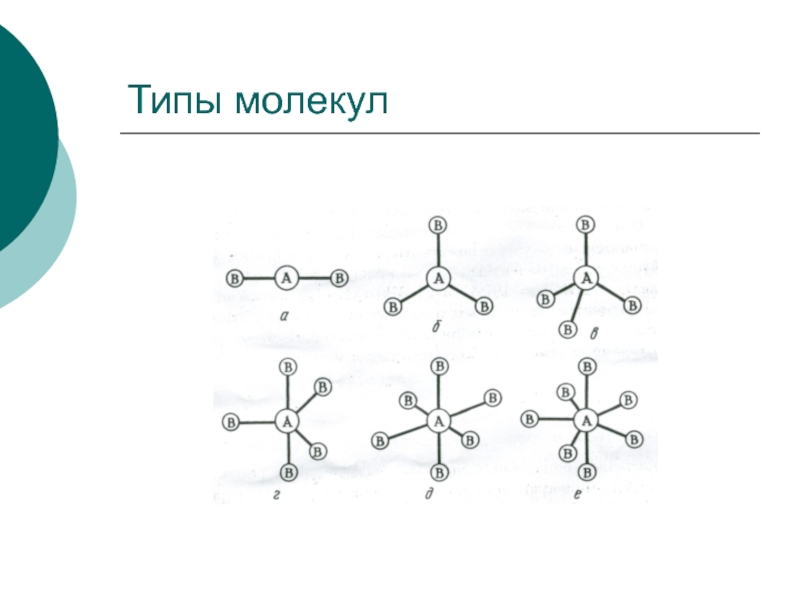
- 32. Типы молекул
- 33. Метод молекулярных орбиталей ММО (Метод линейной комбинации
- 34. Наиболее сильно взаимодействуют АО, которые:а) близки по
- 35. МО, которые имеют энергию ниже, чем исходные
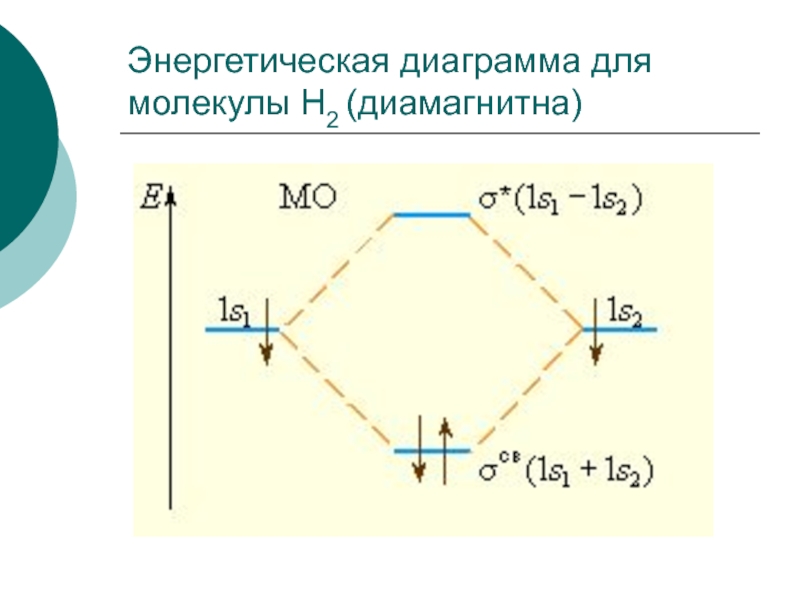
- 36. Энергетическая диаграмма для молекулы H2 (диамагнитна)
- 37. В ММО невозможно определить число связей между
- 38. Например: ПС (H2) = (2-0)/2 = 1
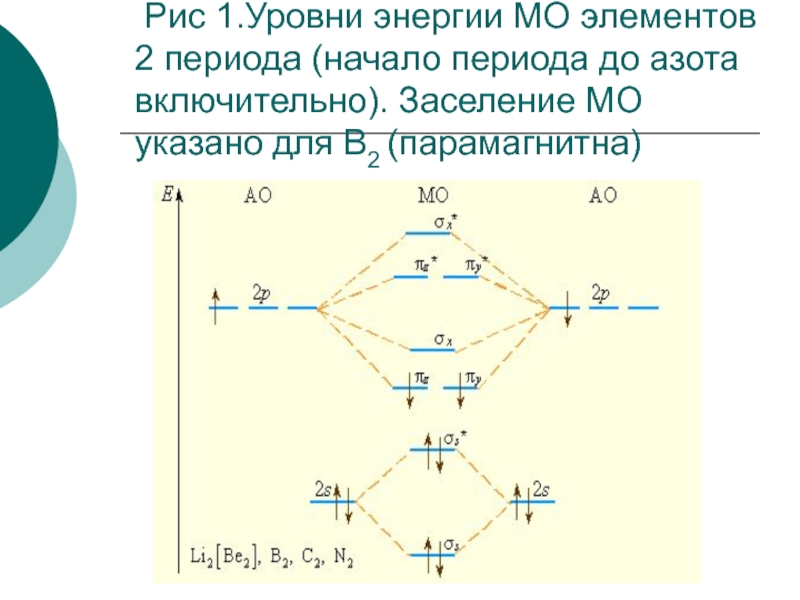
- 39. В начале периода s- и p-подуровни близки
- 40. Рис 1.Уровни энергии МО элементов 2
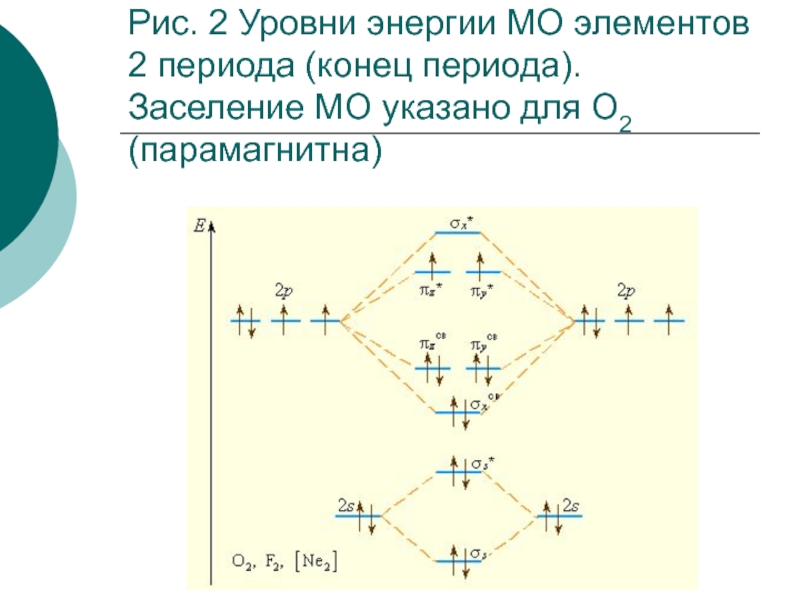
- 41. Рис. 2 Уровни энергии МО элементов 2 периода (конец периода). Заселение МО указано для О2 (парамагнитна)
- 42. Скачать презентанцию
Характеристики связиДлиной химической связи (rc) называют величину, измеряемую расстоянием между ядрами связываемых атомов. Измеряется в пикометрах (пм)(нм): 1 пм = 10-12 м. Характерное значение для одинарной связи rc = 100 пм.
Слайды и текст этой презентации
Слайд 1Химическая связь – это совокупность взаимодействий между электронами и ядрами,
приводящих к соединению атомов в молекулы, ионы и др. частицы.
Слайд 2Характеристики связи
Длиной химической связи (rc) называют величину, измеряемую расстоянием между
ядрами связываемых атомов.
Измеряется в пикометрах (пм)(нм): 1 пм =
10-12 м. Характерное значение для одинарной связи rc = 100 пм. Для молекулы воды rон = 97 пм. Длина связи определяется рентгеноструктурным анализом и другими физическими методами.Прочность химической связи (Ес) – величина, измеряемая энтальпией ∆Нс образования связи.
Единица измерения прочности химической связи используют кДж/моль.
Характерное значение для одинарной связи ∆Нс = 400 кДж/моль. Для водорода
∆Н Н-Н = 430 кДж/моль,
для воды ∆Н-О-Н = 456 кДж/моль.
Слайд 3Ориентация химической связи (с) – величина, измеряемая углом между направлениями
связей данного атома с соседними атомами молекулы. Угол с называют
валентным. Единица измерения валентного угла с – градус, значение которого может меняться от 90 до 180 0. Для воды НОН = 104 0. Для оксида углерода (+4) ОСО = 180 0.Полярность химической связи (с) – величина, измеряемая электрическим моментом данной связи. Химическая связь поляризуется, когда связываются два атома с разной ЭО. В результате на атоме с большим значением ЭО возникает избыточный отрицательный заряд -, а на другом атоме с меньшим значением ЭО – избыточный положительный заряд +.
Слайд 4Типы химической связи: КПС, КНС, ИС, МС
Ковалентной связью называют
химическую связь, образованную путем обобществления пары электронов двумя атомами неметаллов.
Если связь образована между двумя одинаковыми атомами, то образуется ковалентная неполярная связь. В этом случае электронная плотность общей пары равномерно распределена между атомами (например, H - H; O = O; N N).
Если связь образована между двумя разными атомами, то образуется ковалентная полярная связь и более электроотрицательный атом сильнее притягивает общую пару электронов (например, Н2О).
Слайд 5Механизмы обр. связи
При обменном механизме образования химической связи неспаренные электроны
одного атома взаимодействуют с неспаренными электронами другого атома.
H• +
•H H : HПри донорно-акцепторном механизме общая электронная пара образуется за счет неподеленной пары электронов одного атома (донора) и вакантной орбитали другого атома или иона (акцептора). Например, образование иона аммония из растворенного в воде газообразного аммиака:
Слайд 9Основные характеристики ковалентной связи: насыщаемость направленность.
Насыщаемость- способность атомов образовывать
ограниченное число ковалентных связей.
Благодаря насыщаемости связей молекулы имеют определенный
состав: H2, а не H3; HCl, а не H2Cl и т.д. Слайд 10Направленность ковалентной связи
1. Направленность ковалентной связи определяет пространственную структуру молекул.
Количественно направленность выражается в виде валентных углов между направлениями химической
связи в молекулах.Слайд 11Полярность молекулы
Полярность молекулы – и полярность связи понятия разные.
Полярные бинарные молекулы называют диполями. Т.е. полярнорсть связи и полярность
молекулы совпадаютСлайд 12Дипольный момент
Мерой полярности связи служит электрический момент диполя μ,
равный произведению эффективного заряда на длину диполя:
μ = q
∙ l, где q=1.6 ∙10-19КлСлайд 13Дипольный момент молекулы является векторной величиной. Его направление принимается от
положительного полюса к отрицательному.
Слайд 14Для многоатомных молекул дипольный момент представляет собой векторную сумму дипольных
моментов химических связей. Поэтому, если молекула симметрична (линейная, треугольная, тетраэдр,
октаэдр), то она неполярна.Слайд 15Ионная связь
Ионной называют связь, при которой осуществляется значительное смещение межъядерной
электронной плотности к атому с большей ЭО и атомы могут
считаться положительно и отрицательно заряженными ионами, между которыми действуют силы электростатического притяжения. (например, NaF, NaСl, КСl).Принято считать крайний случай ковалентной полярной связи - ионной, если изменение ЭО > 1,9. Ионная связь образуется между катионами s-металлов I и II групп периодической системы и ионами р-неметаллов VI и VII групп (NaF, КСl, Nа2O и др.).
→
Слайд 16Ионная связь, в отличие от ковалентной, характеризуется: ненаправленностью, так как
сферическое поле вокруг ионов во всех направлениях равноценно; ненасыщаемостью, поскольку
при взаимодействии ионов не происходит полной компенсации их силовых полей; координационными числами в ионных соединениях, которые определяются не электронной структурой атомов, а соотношением радиусов взаимодействующих ионов.Так, отношение радиуса иона натрия к радиусу иона хлора равно:
r(Na+)/r(Cl-) = 0,098/0,0181 = 0,54.
Это значение лежит в пределах 0,41 – 0,73, что определяет октаэдрическую координацию ионов, которая характеризует кристаллическую решетку хлорида натрия.
Таким образом, химическая связь в большинстве химических соединений сочетает свойства ковалентной и ионной связи. Поэтому ее можно считать ковалентной с определенной долей ионности.
Слайд 17Металлическая связь
Металлическая связь проявляется при взаимодействии атомов элементов, имеющих избыток
свободных валентных орбиталей по отношению к числу валентных орбиталей электронов.
К такому типу химической связи относятся металлы и их сплавы. В металлах электроны приобретают способность свободно перемещаться между ядрами в пространстве именно благодаря относительно высокой «концентрации» свободных орбиталей. В результате этого в решетке металлов возникают свободные электроны (электронный газ), которые непрерывно перемещаются между положительными заряженными ионами, электрически их притягивают и обеспечивают стабильность решетки металлов.
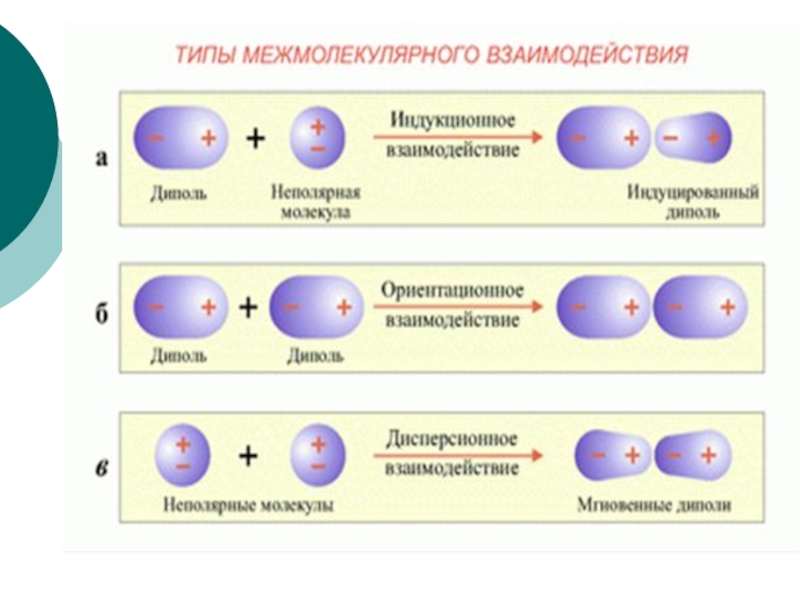
Слайд 18ВИДЫ межмолекулярных взаимодействий
Основные виды взаимодействия молекул: Вандерваальсовы силы,
водородные связи.
Силы, которые способствуют притяжению молекул, получили название вандерваальсовых. Они характеризуются
тремя видами межмолекулярного взаимодействия:а) ориентационное взаимодействие, которое проявляется между полярными молекулами, (по-другому оно называется диполь-дипольное взаимодействие);
б) индукционное, которое возникает между индуцированными диполями, причина образования которых является взаимная поляризация атомов двух сближающихся молекул;
в) дисперсионное, которое возникает в результате взаимодействия микродиполей, образующихся за счет мгновенных смещений положительных и отрицательных зарядов в молекулах при движении электронов и колебаний ядер.
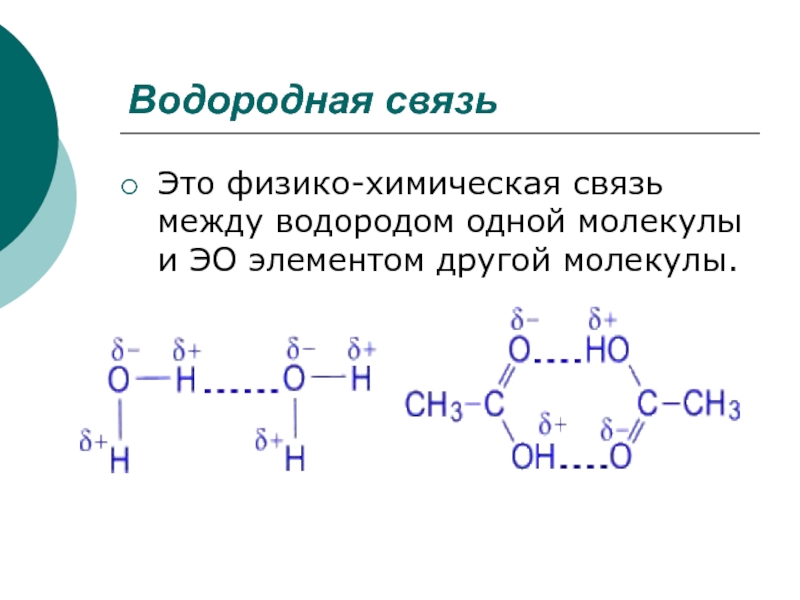
Слайд 20Водородная связь
Это физико-химическая связь между водородом одной молекулы и ЭО
элементом другой молекулы.
Слайд 23Пространственная структура молекул
Пространственная структура молекул зависит от пространственной направленности
перекрывания электронных облаков числом атомов в молекуле и числом электронных
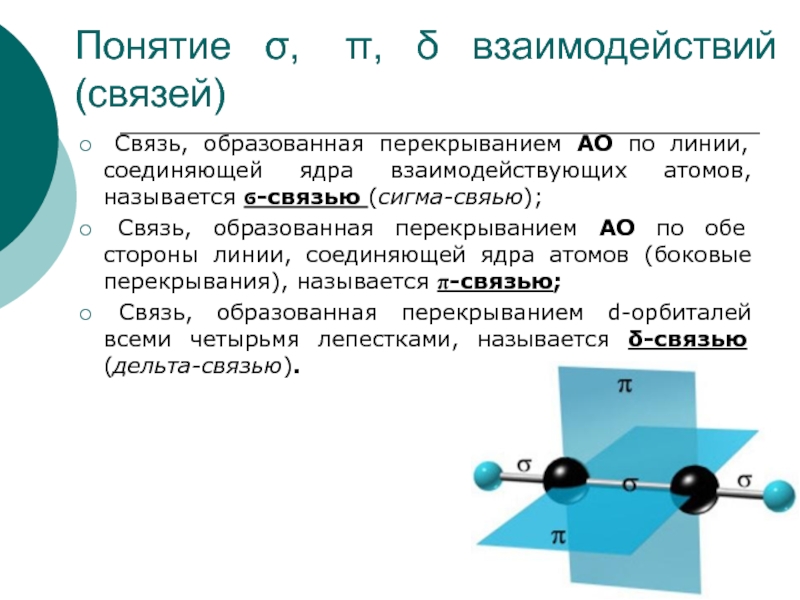
пар связей за счет неподеленных электронов.Слайд 24Понятие σ, π, δ взаимодействий (связей)
Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов,
называется ϭ-связью (сигма-свяью);Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью;
Связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками, называется δ-связью (дельта-связью).
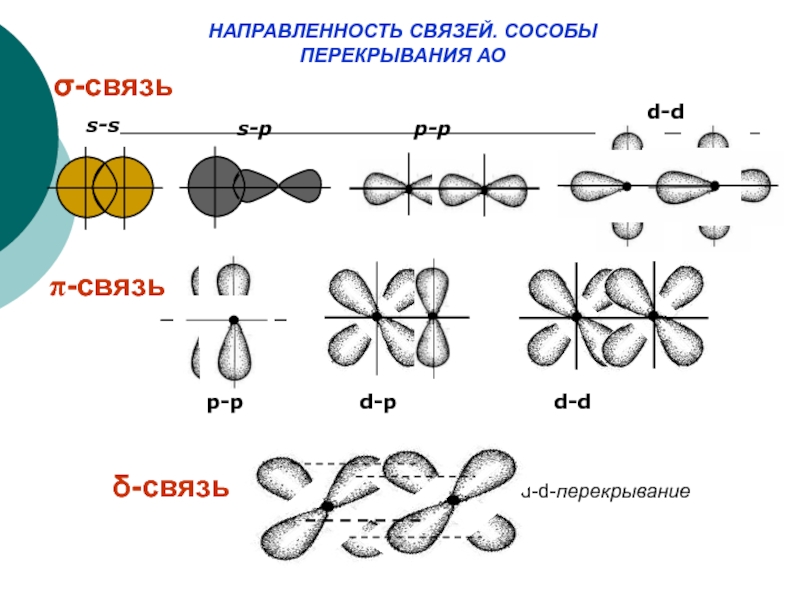
Слайд 25НАПРАВЛЕННОСТЬ СВЯЗЕЙ. СОСОБЫ
ПЕРЕКРЫВАНИЯ АО
σ-связь
π-связь
δ-связь
s-s
s-p
p-p
d-d
p-p
d-p
d-dd-d-перекрывание
Слайд 26Число σ-связей, которые образует центральный атом в сложных молекулах или
ионах, определяет для него значение координационного числа. Например, в молекуле
NH3 и ионе NH4+ для атома азота оно равно трем и четырем соответственно.π- связь, образованная более чем одной парой электронов называется кратной.
Кратность связи обусловлена наложением на σ связь π и δ связей.
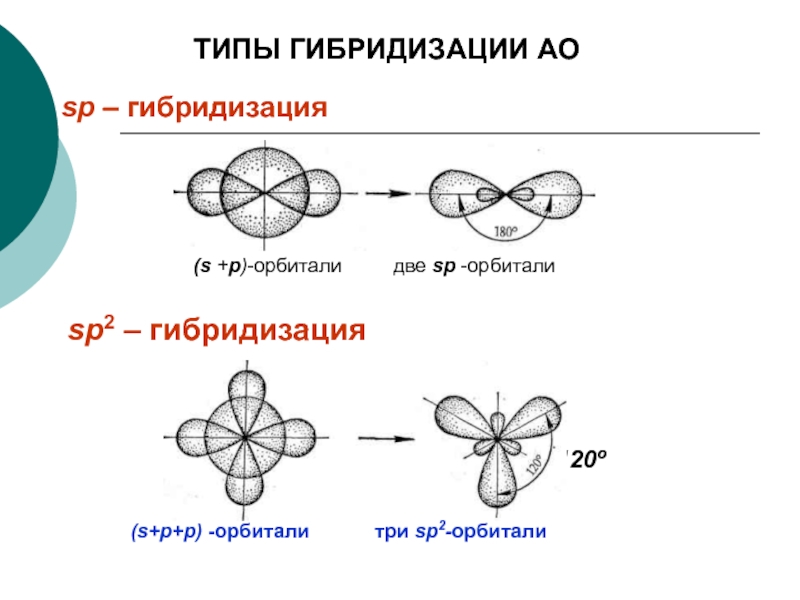
Слайд 27Гибридизации атомных орбиталей.
Связи, образованные атомом за счет орбиталей с
различным значением орбитального квантового числа, должны быть энергетически неравноценными, что,
однако, не подтверждается экспериментом. Противоречие устраняется идеей гибридизации, предложенной Л. Полингом (1901).Гибридизациией называют образование одинаковых по энергии и форме орбиталей атома в результате сложения различных по энергии и форме орбиталей при возбуждении этого атома. При этом орбитали разной симметрии смешиваются и переходят в гибридные атомные орбитали одинаковой формы и одинаковой усредненной энергии, что обеспечивает равноценность образуемых ими связей.
Слайд 28sp2 – гибридизация
ТИПЫ ГИБРИДИЗАЦИИ АО
sp – гибридизация
120º
(s +р)-орбитали
две sр -орбитали
(s+p+p) -орбитали три sp2-орбитали
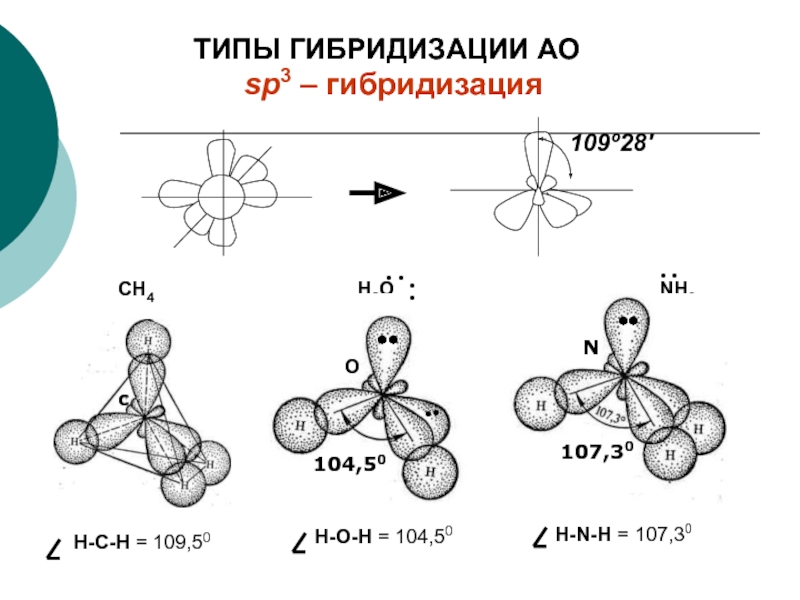
Слайд 29sp3 – гибридизация
CН4
Н2О
NН3
О
N
C
104,50
107,30
Н-C-Н = 109,50
Н-О-Н = 104,50
Н-N-Н = 107,30
··
··
••
••
••
··
ТИПЫ ГИБРИДИЗАЦИИ
АО
Слайд 30МВС, ММО
Обычно используют приближенные методы расчета двух- и многоатомных систем
с ковалентной связью: метод валентных связей (МВС) или метод молекулярных
орбиталей (ММО). Эти два метода не исключают, а взаимно дополняют друг друга. МВС позволяет объяснить химические связи и свойства многих соединений. ММО обеспечивает общий подход ко всем типам химических соединений, его используют при программированииСлайд 31Метод валентных связей
Метод валентных связей (МВС) описывает образование ковалентных
связей в молекулах с позиций квантовой механики. Он базируется на
следующих основных положениях:1.Химическая связь локализована между двумя атомами, т.е. она двуцентровая и двухэлектронная образованная по обменному и д/а механизму.
2. Модель гибридизации АО. В ходе взаимодействия АО могут подвергаться гибридизации (при этом получаются ГАО - гибридные атомные орбитали).
3. Модель локализованных электронных пар: расположение связей вокруг центрального атома определяется числом его σ- электронных пар, втом числе и несвязывающих
Слайд 33Метод молекулярных орбиталей ММО (Метод линейной комбинации атомных орбиталей МЛКАО)
Метод
валентных связей достаточно наглядно объясняет образование и строение многих молекул,
однако он не может объяснить многие факты, например, существование молекулярных ионов (Н2+, Не 2+) или радикалов (·СН3,·NH2 ), парамагнетизм молекул с четным числом электронов (О2, NO), которые находят объяснение в рамках метода молекулярных орбиталей (ММО).В ММО молекула (или любая другая частица) рассматривается как единое целое.
Существуют орбитали, которые называются молекулярными орбиталями (МО).
МО получаются при взаимодействии АО исходных атомов. МО отличаются от АО по энергии, форме и ориентации в пространстве.
Слайд 34Наиболее сильно взаимодействуют АО, которые:
а) близки по энергии
б) имеют одинаковую
форму (s+s, p+p, d+d)
в) одинаково ориентированы в пространстве (px+px, py+py
и т.д.).При образовании МО соблюдается правило сохранения количества орбиталей: количество получившихся МО = количеству исходных АО.
Слайд 35МО, которые имеют энергию ниже, чем исходные АО называются связывающими.
МО,
имеющие энергию выше, чем исходные АО называются разрыхляющими (*).
Заполнение МО
электронами МО осуществляется по тем же законам, как и в атоме:1. Принцип наименьшей энергии.
2. Принцип Паули.
3. Правило Хунда.
Слайд 37В ММО невозможно определить число связей между атомами в молекуле.
Вместо этого здесь используется понятие о порядке связи (ПС):
ПС=(Nсв-Nразр)/m ,
где: Nсв - кол-во электронов на СМО,
Nразр - кол-во электронов на РМО,
m - кол-во ядер в молекуле.
Чем больше ПС, тем крепче, прочнее частица (молекула, ион, радикал).
Если ПС ≤ 0, то связи вообще нет, т.е. данная частица существовать не может.
Наличие неспаренных электронов обусловливает парамагнитные свойства молекулы, отсутствие – диамагнитные.
Слайд 38Например: ПС (H2) = (2-0)/2 = 1
молекула H2 устойчивая частица.
ПС (H2+ ) = (1-0)/2 = 1/2
> 0 H2+ устойчивая частица ПС (H2+2) = (0-0)/2 = 0 H2+2 не существует
ПС (H2-) = (2-1)/2 = 1/2 > 0 H2- устойчивая частица
ПС (H2-2) = (2-2)/2 = 0 H2-2 не существует