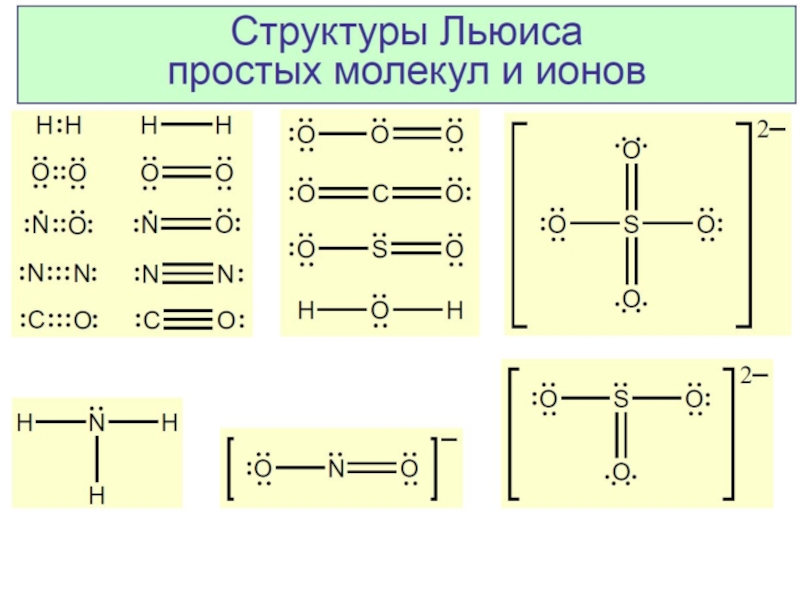
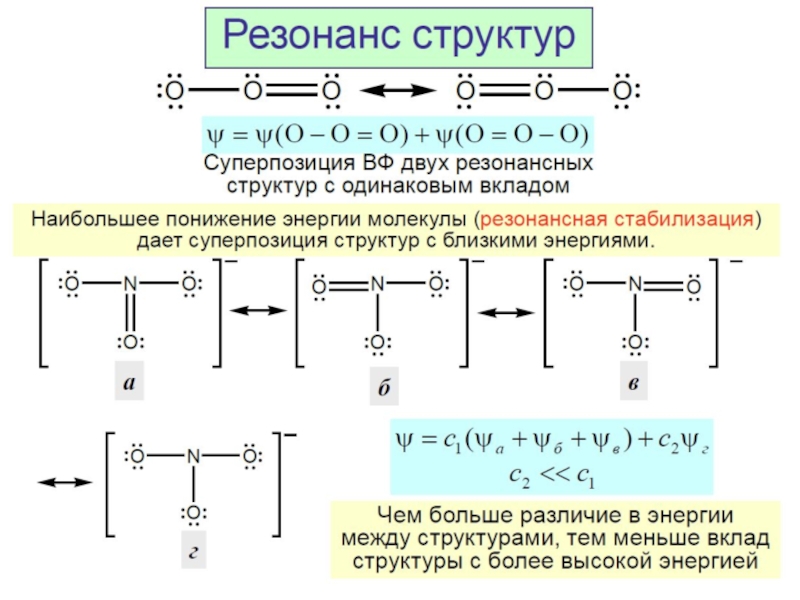
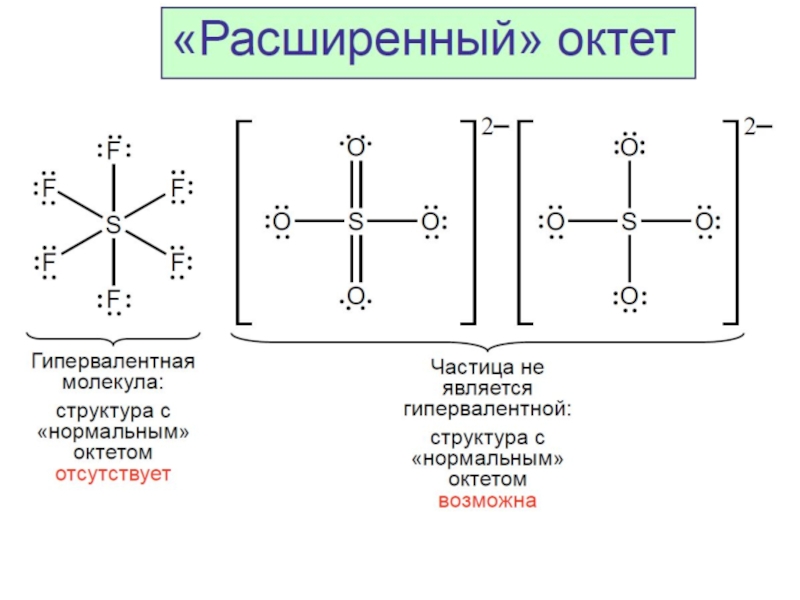
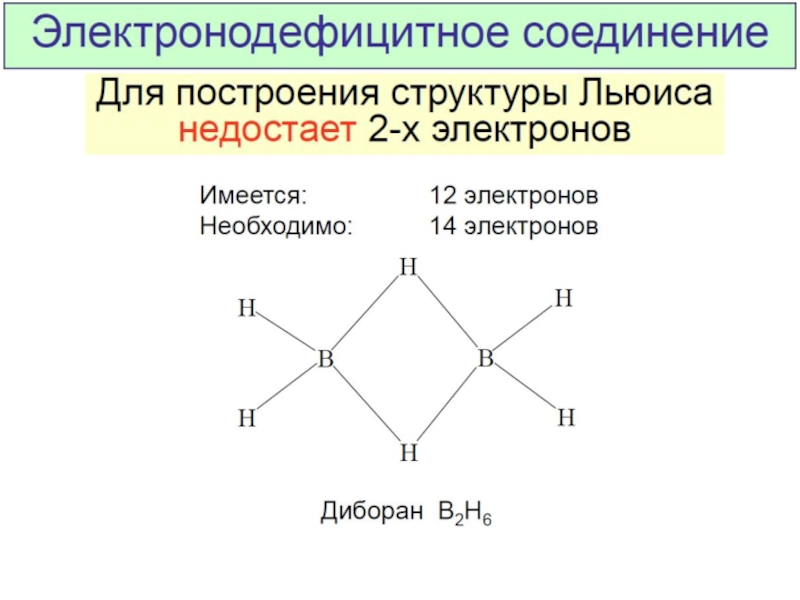
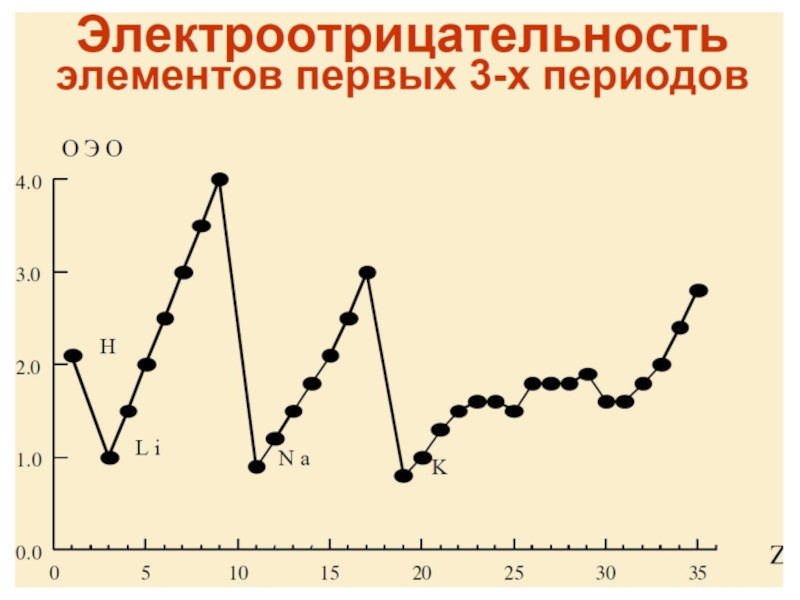
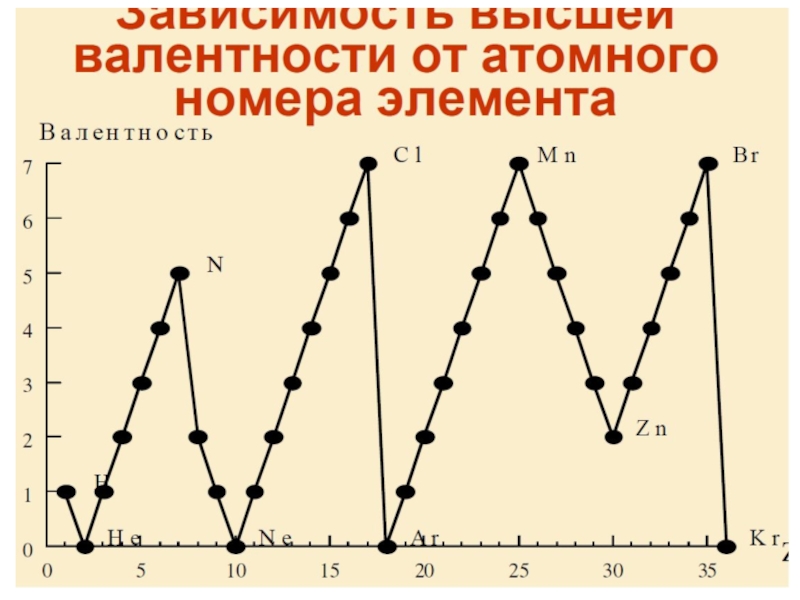
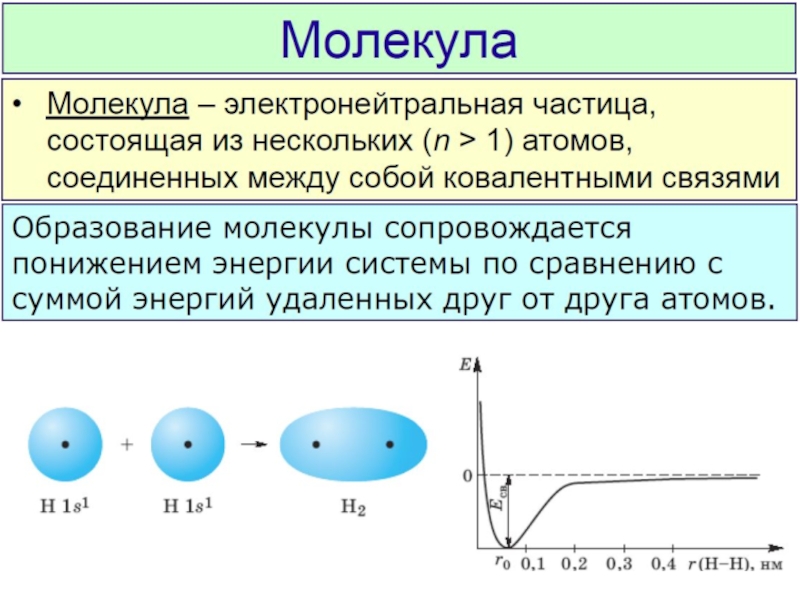
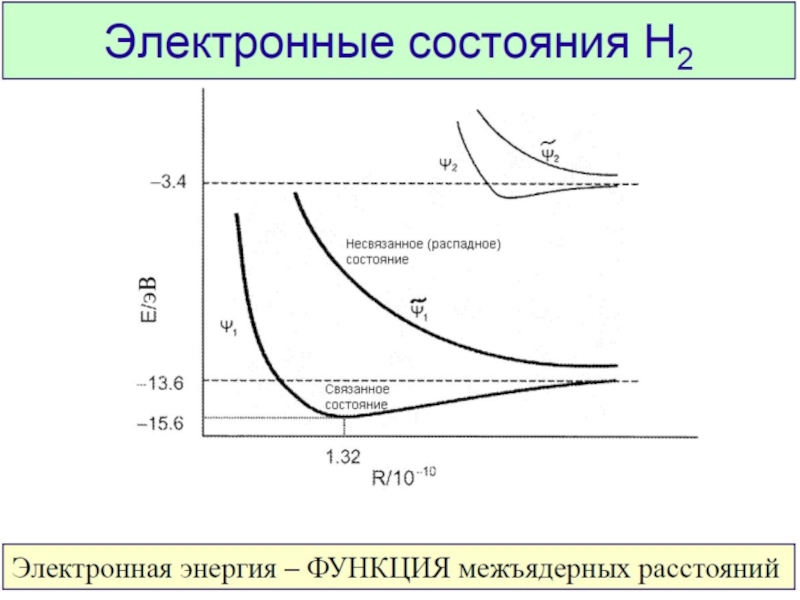
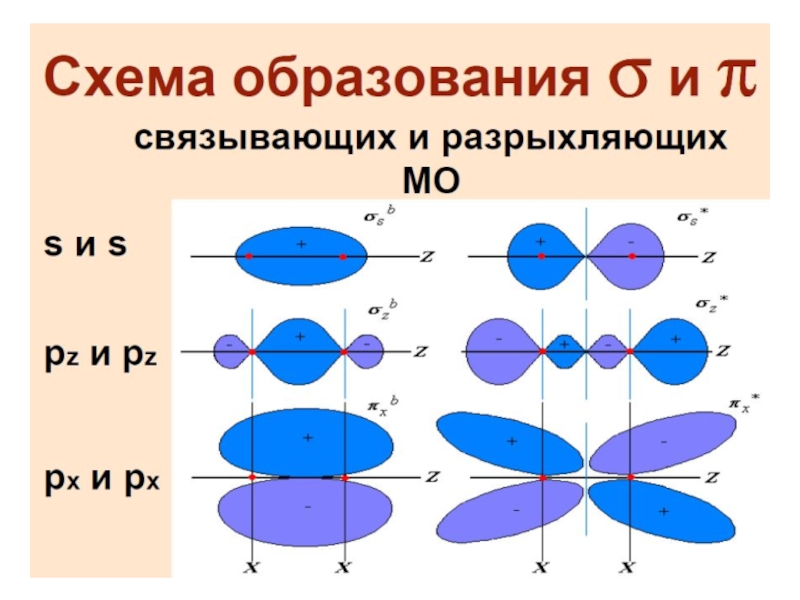
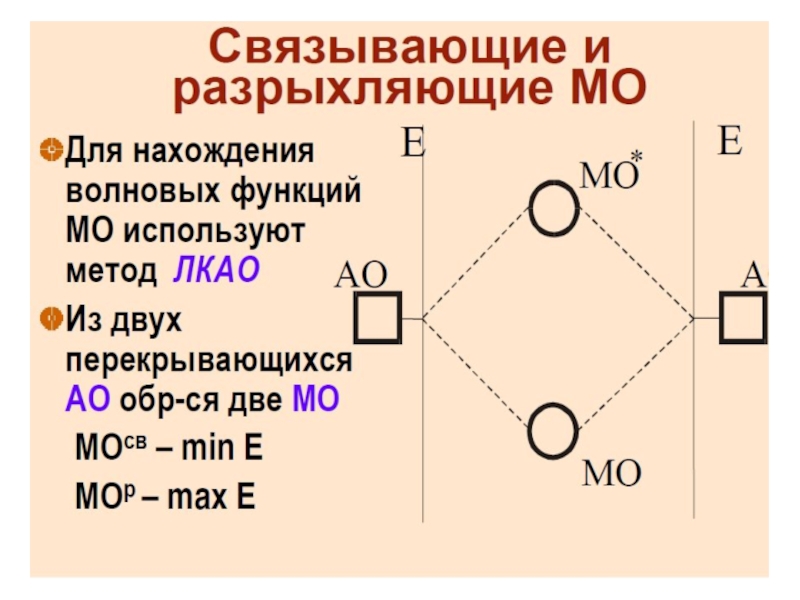
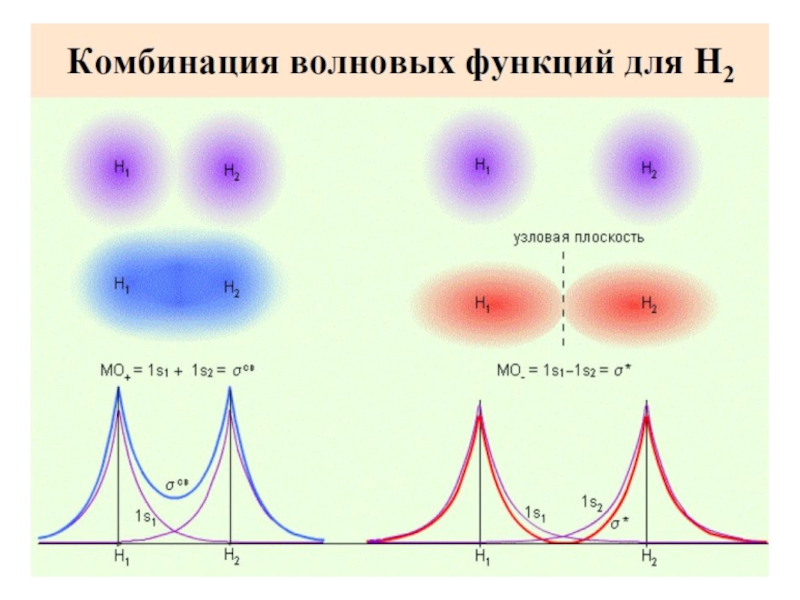
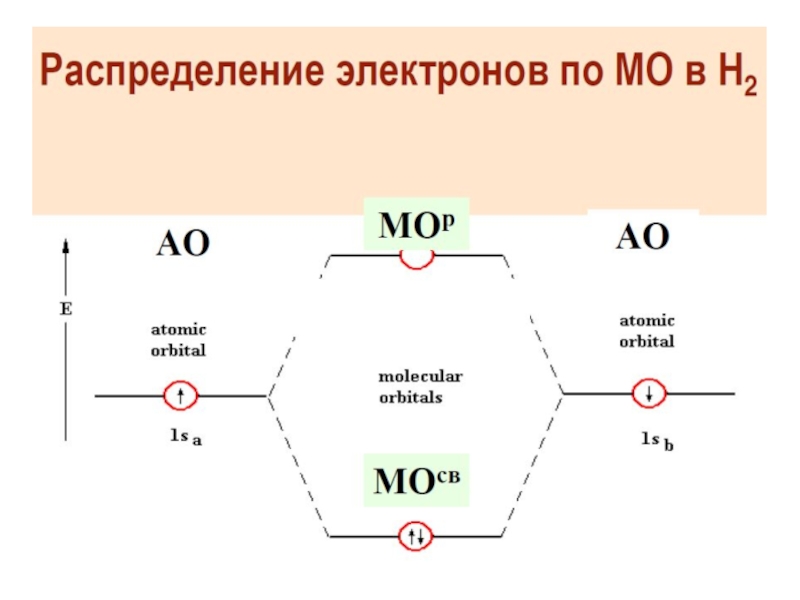
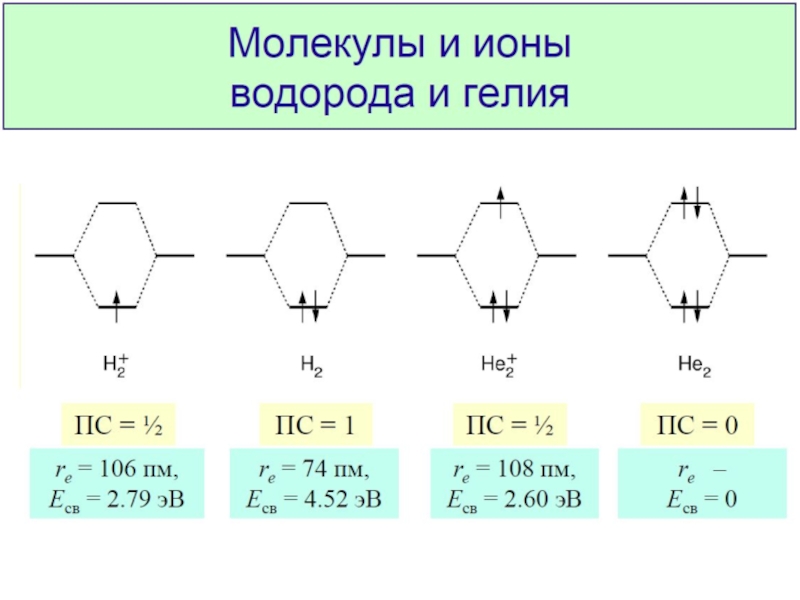
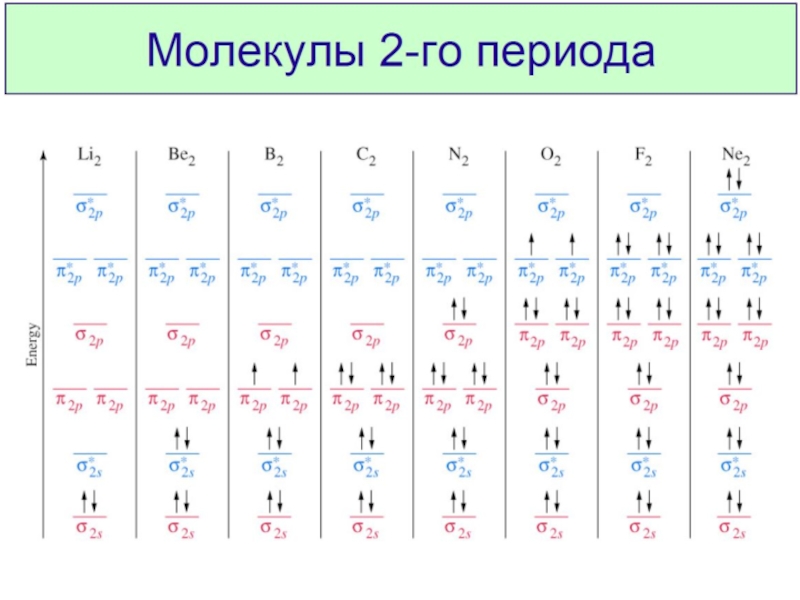
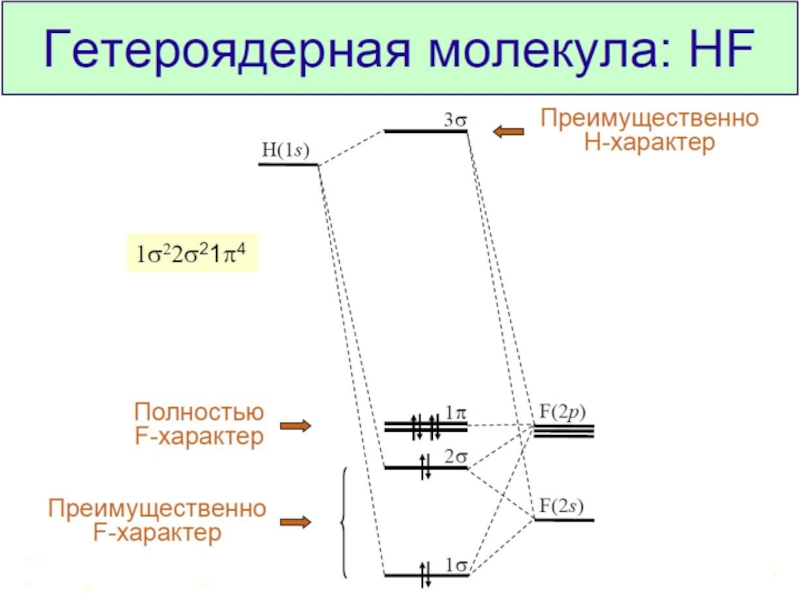
Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
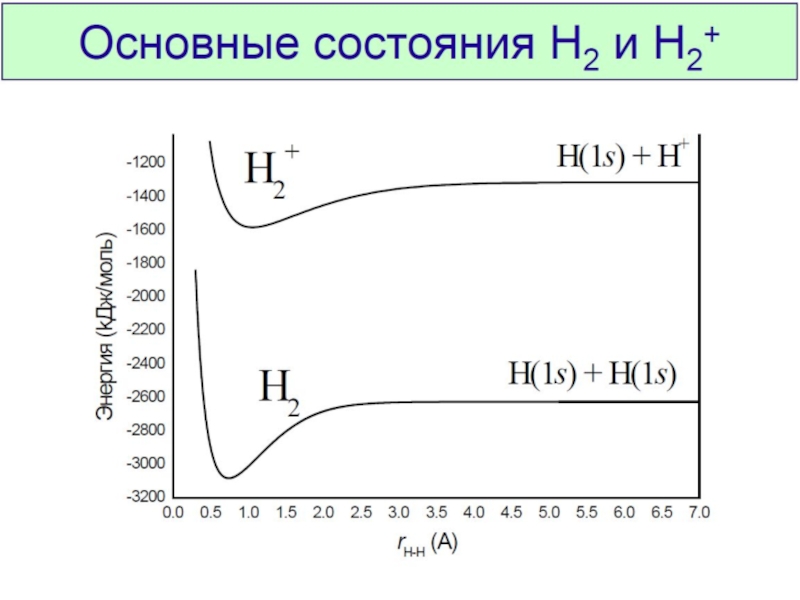
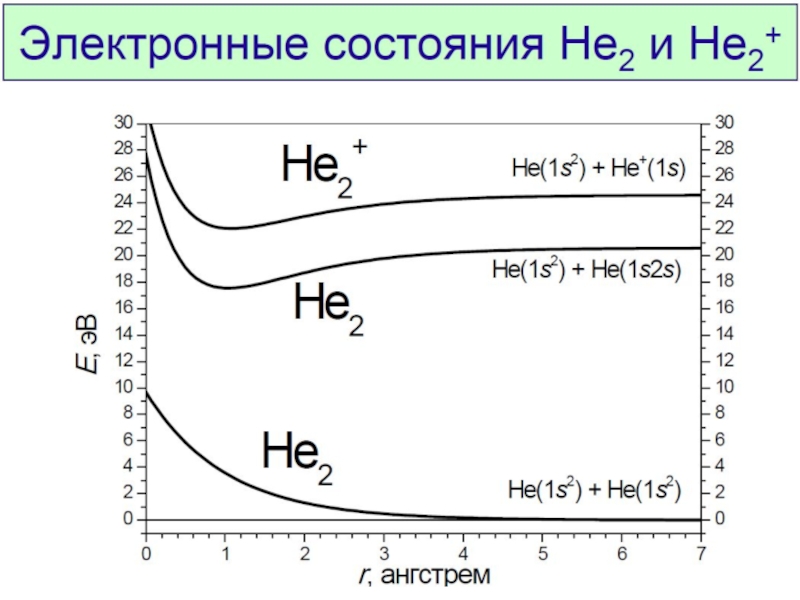
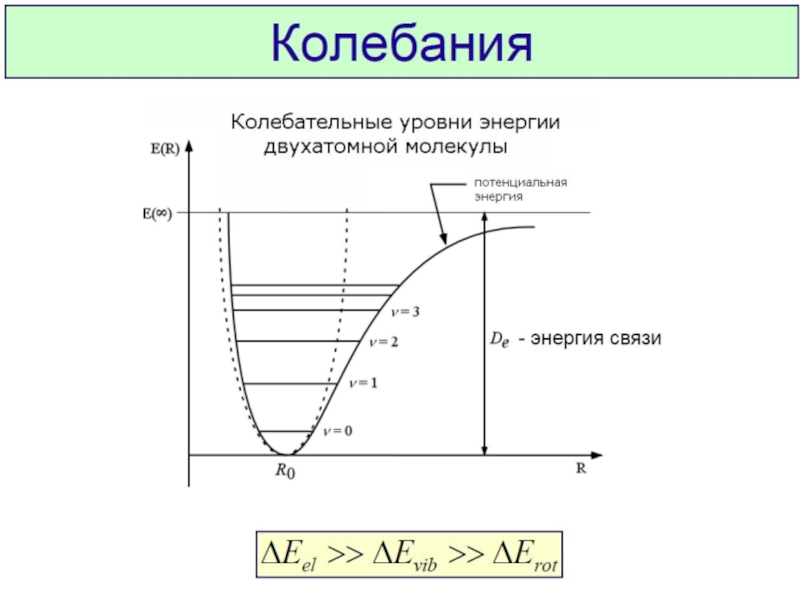
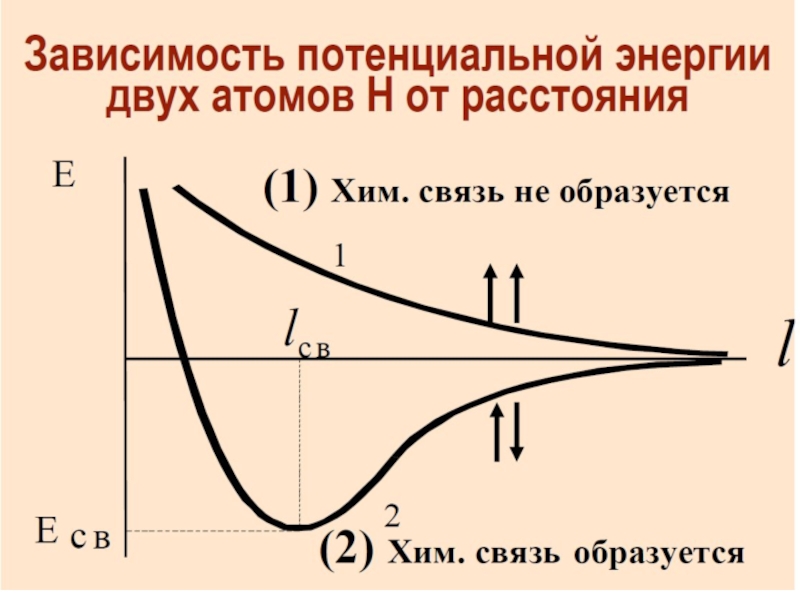
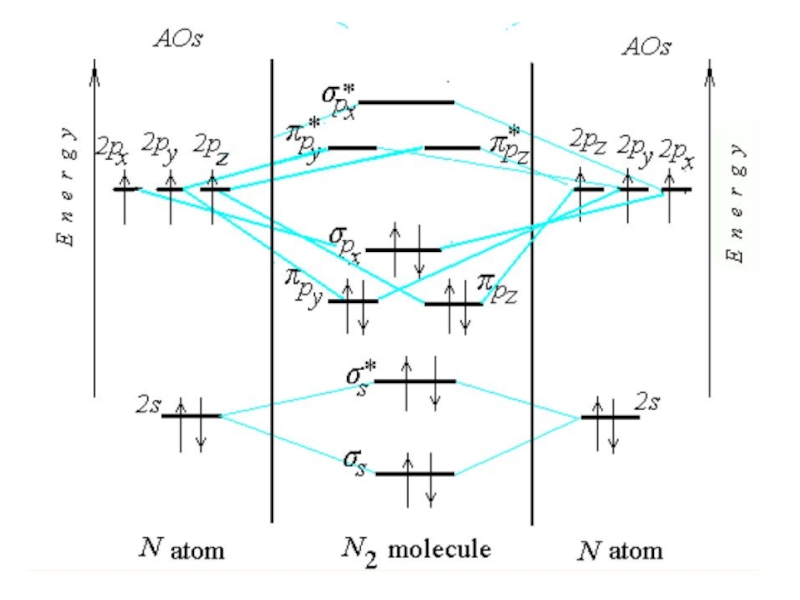
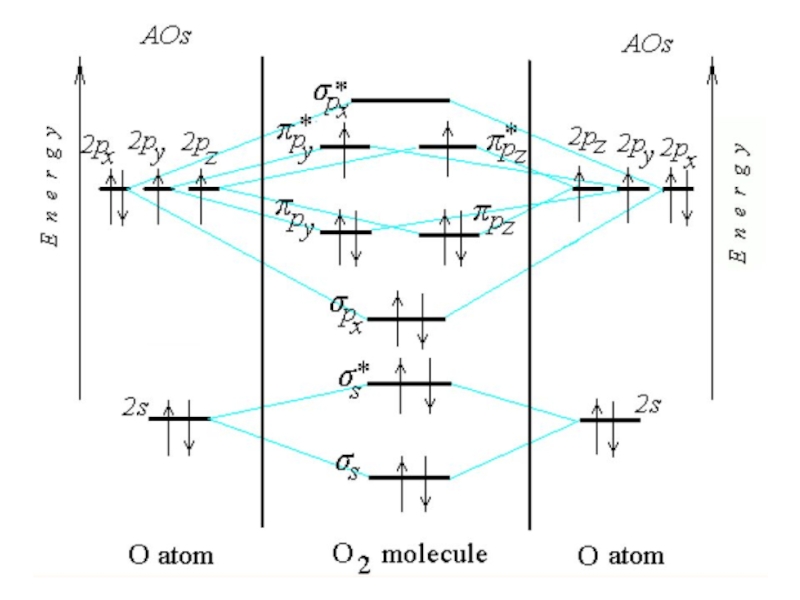
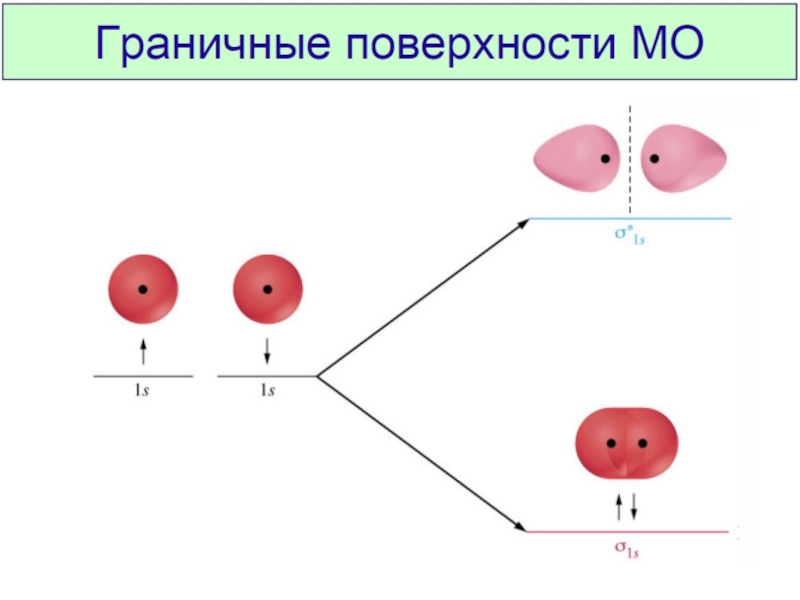
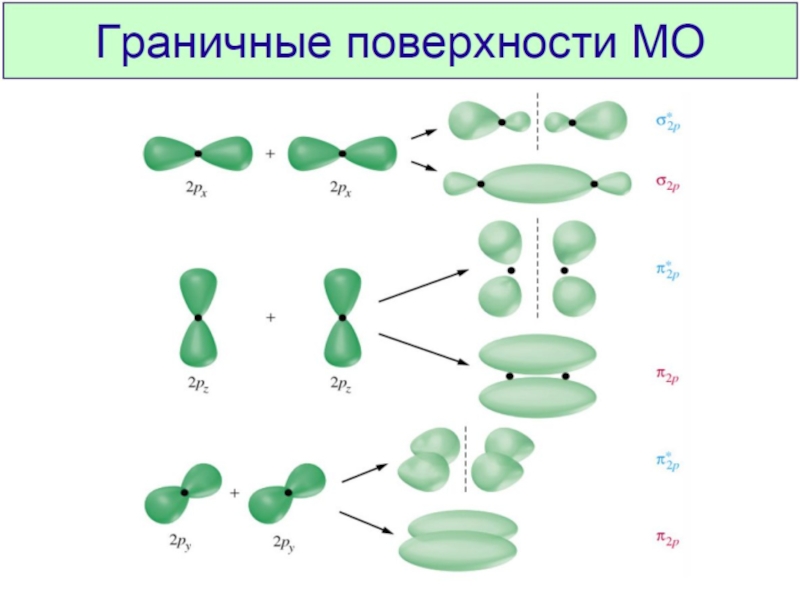
Химическая связь и строение молекул red2
Содержание
- 1. Химическая связь и строение молекул red2
- 2. Слайд 2
- 3. Слайд 3
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. Слайд 26
- 27. Слайд 27
- 28. Слайд 28
- 29. Слайд 29
- 30. Слайд 30
- 31. Слайд 31
- 32. Слайд 32
- 33. Слайд 33
- 34. Слайд 34
- 35. Слайд 35
- 36. Слайд 36
- 37. Слайд 37
- 38. Слайд 38
- 39. Модели атомаМодель ТомсонаПланетарная модель Резерфорда (1911)Квантово-механическая модель
- 40. Слайд 40
- 41. Слайд 41
- 42. Слайд 42
- 43. Слайд 43
- 44. Слайд 44
- 45. 2.Принцип дуализма(корпускулярно-волновой природы)При свободном движении электронов проявляются
- 46. Квантово-механическое введение в теорию строения молекул
- 47. Слайд 47
- 48. 3.Принцип неопределенности(В. Гейзенберг, 1925) Движение электрона в
- 49. Слайд 49
- 50. Слайд 50
- 51. Слайд 51
- 52. Слайд 52
- 53. Слайд 53
- 54. Слайд 54
- 55. Слайд 55
- 56. Слайд 56
- 57. Слайд 57
- 58. Слайд 58
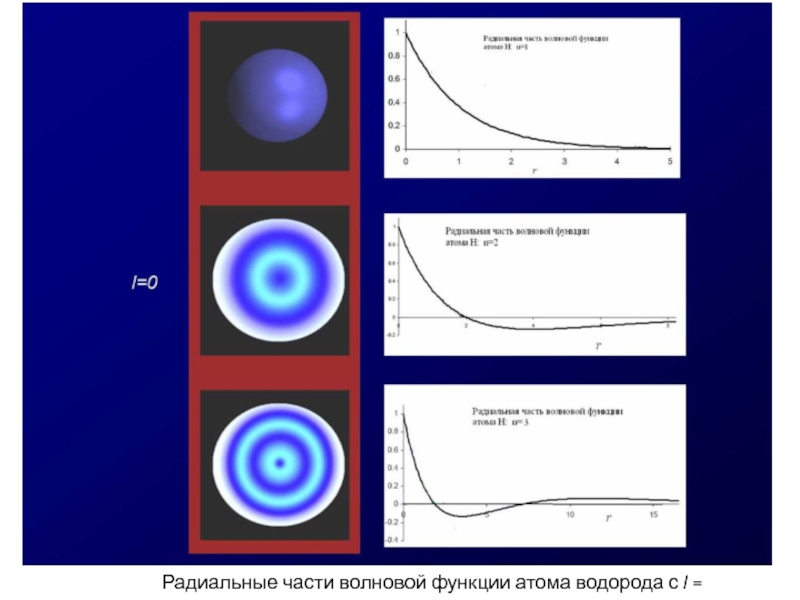
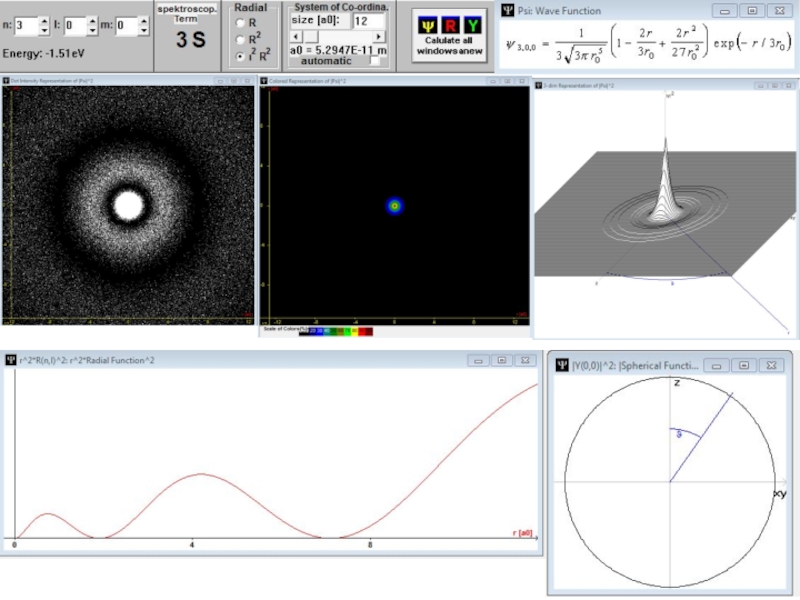
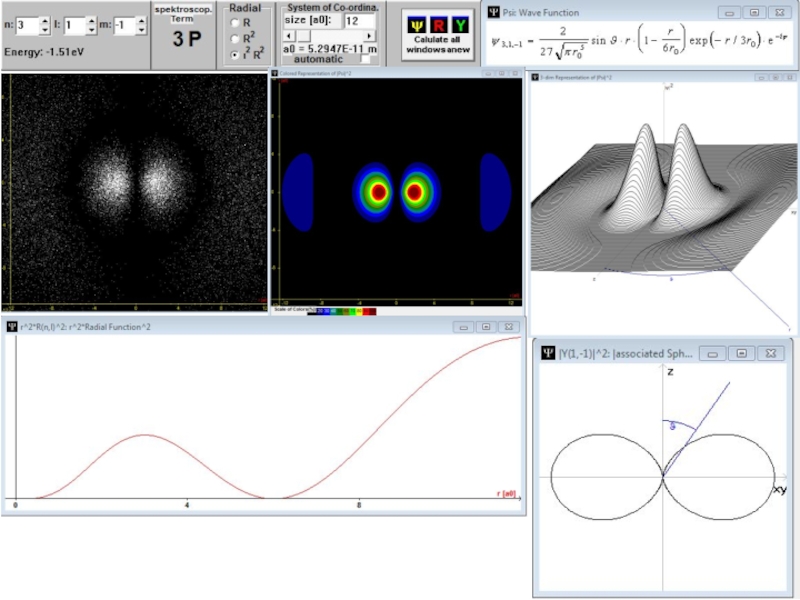
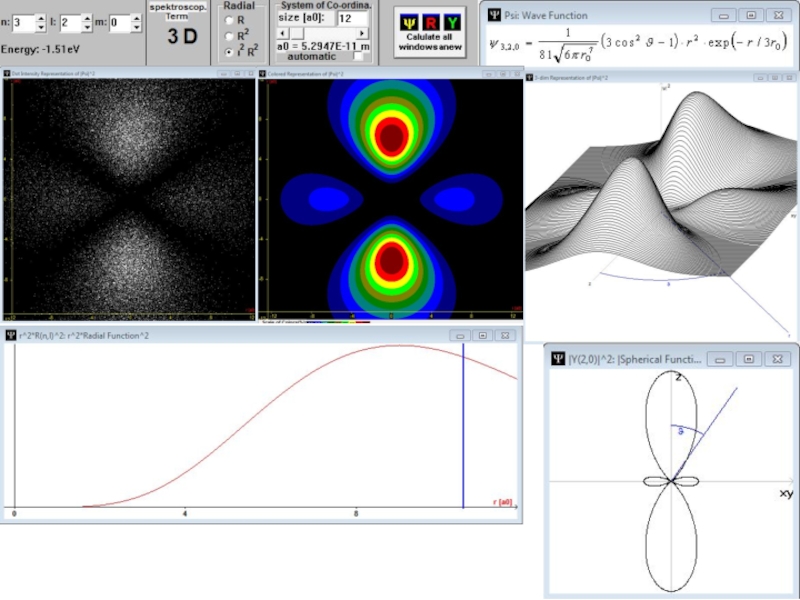
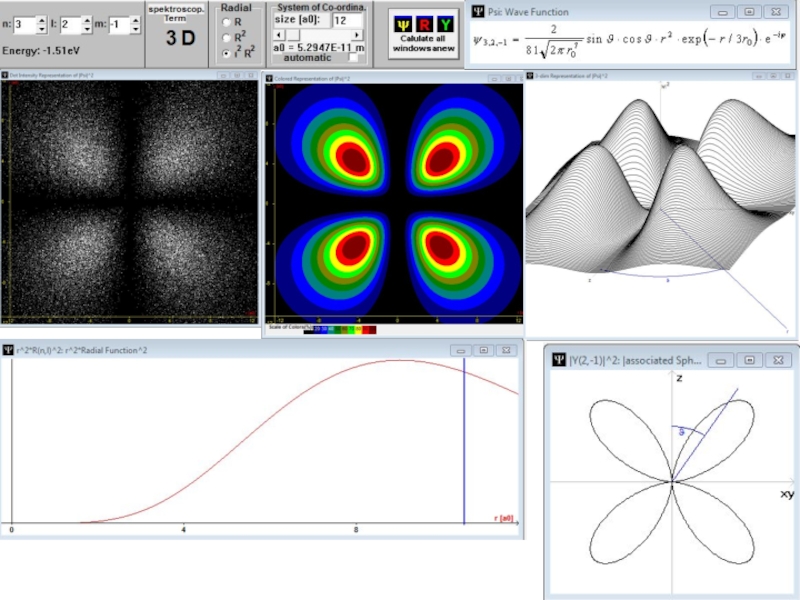
- 59. Радиальные части волновой функции атома водорода с l = 0.
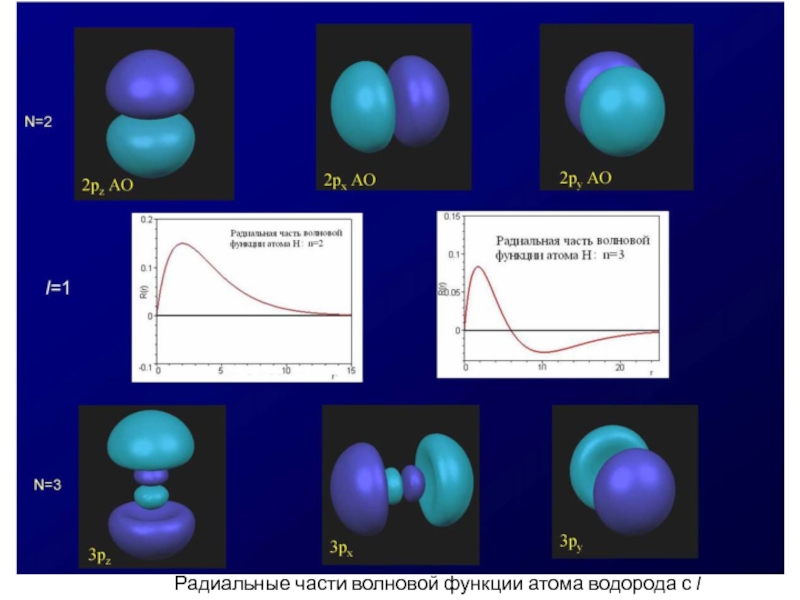
- 60. Радиальные части волновой функции атома водорода с l = 1
- 61. Слайд 61
- 62. Слайд 62
- 63. Слайд 63
- 64. Слайд 64
- 65. Атомные орбитали с n 5. Части
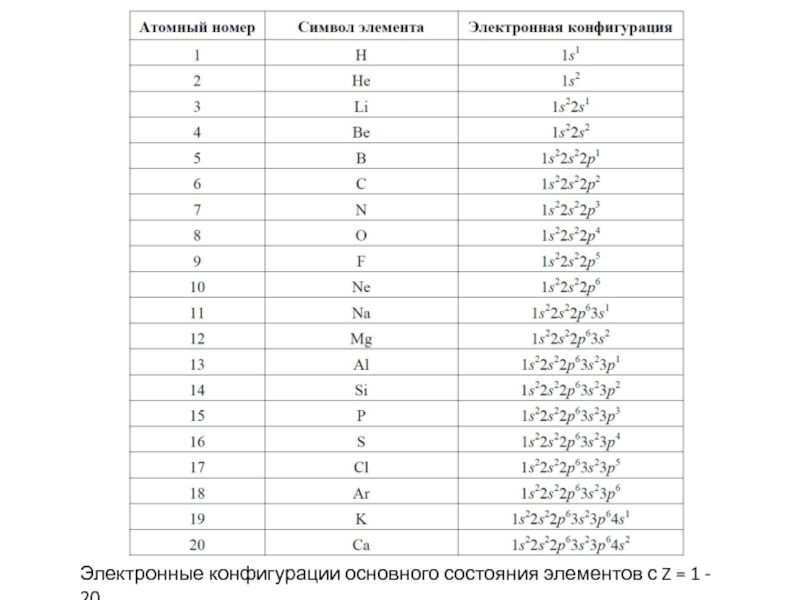
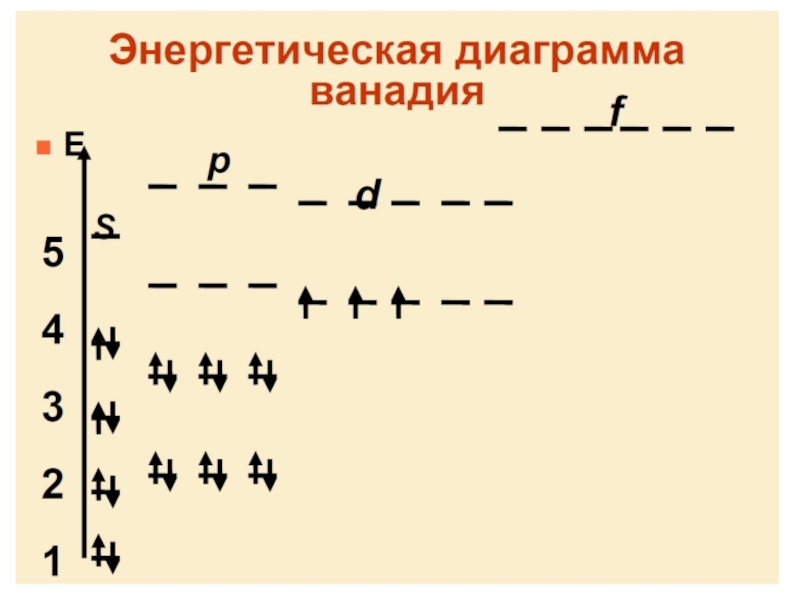
- 66. Для нейтральных атомов в основном состоянии последовательность
- 67. Электронные конфигурации основного состояния элементов с Z = 1 - 20
- 68. Слайд 68
- 69. Слайд 69
- 70. Слайд 70
- 71. Слайд 71
- 72. Слайд 72
- 73. Слайд 73
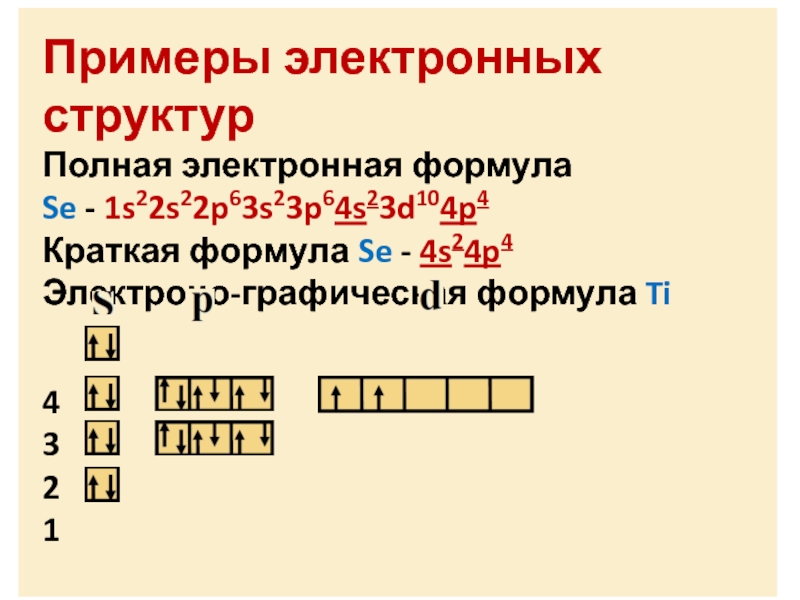
- 74. Примеры электронных структурПолная электронная формулаSe - 1s22s22p63s23p64s23d104p4Краткая формула Se - 4s24p4Электроно-графическая формула Ti4 321
- 75. Слайд 75
- 76. Слайд 76
- 77. Слайд 77
- 78. Слайд 78
- 79. Слайд 79
- 80. Слайд 80
- 81. Слайд 81
- 82. Слайд 82
- 83. Слайд 83
- 84. Слайд 84
- 85. Слайд 85
- 86. Слайд 86
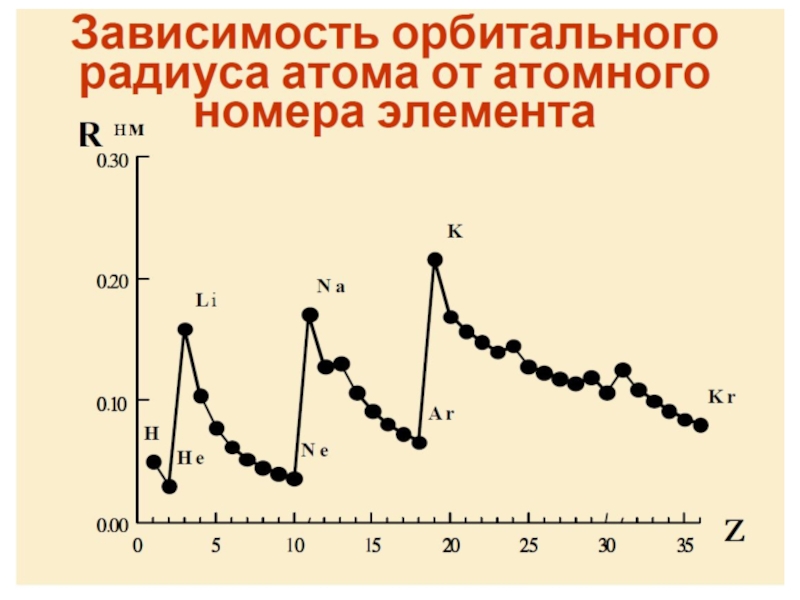
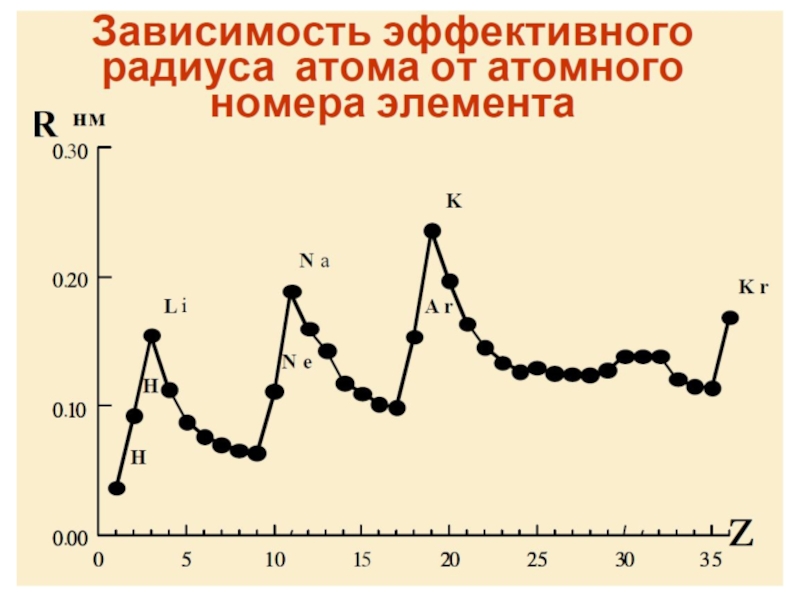
- 87. Атомные и ионные радиусы химических элементов
- 88. Слайд 88
- 89. Слайд 89
- 90. Слайд 90
- 91. Слайд 91
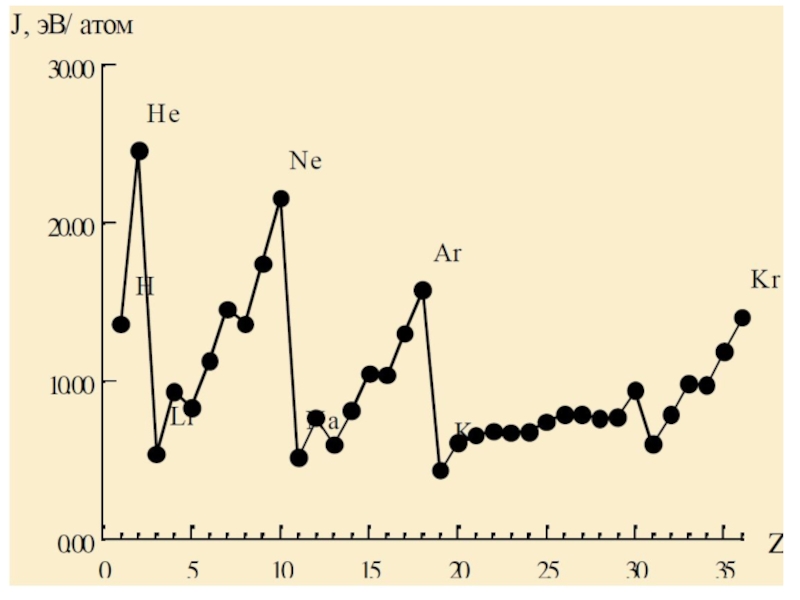
- 92. Энергия и потенциал ионизации атомовЭнергия ионизации –
- 93. Слайд 93
- 94. Слайд 94
- 95. Слайд 95
- 96. Слайд 96
- 97. Слайд 97
- 98. Слайд 98
- 99. Слайд 99
- 100. Слайд 100
- 101. Слайд 101
- 102. Слайд 102
- 103. Слайд 103
- 104. Слайд 104
- 105. Слайд 105
- 106. Слайд 106
- 107. Слайд 107
- 108. Слайд 108
- 109. Слайд 109
- 110. Слайд 110
- 111. Слайд 111
- 112. Слайд 112
- 113. Слайд 113
- 114. Слайд 114
- 115. Слайд 115
- 116. Слайд 116
- 117. Слайд 117
- 118. Слайд 118
- 119. Слайд 119
- 120. Слайд 120
- 121. Слайд 121
- 122. Слайд 122
- 123. Слайд 123
- 124. Слайд 124
- 125. Слайд 125
- 126. Слайд 126
- 127. Слайд 127
- 128. Слайд 128
- 129. Слайд 129
- 130. Слайд 130
- 131. Слайд 131
- 132. Слайд 132
- 133. Слайд 133
- 134. Слайд 134
- 135. Слайд 135
- 136. Слайд 136
- 137. Слайд 137
- 138. Слайд 138
- 139. Слайд 139
- 140. Слайд 140
- 141. Слайд 141
- 142. Слайд 142
- 143. Слайд 143
- 144. Слайд 144
- 145. Слайд 145
- 146. Слайд 146
- 147. Слайд 147
- 148. Слайд 148
- 149. Слайд 149
- 150. Слайд 150
- 151. Слайд 151
- 152. Слайд 152
- 153. Слайд 153
- 154. Слайд 154
- 155. Слайд 155
- 156. Слайд 156
- 157. Слайд 157
- 158. Слайд 158
- 159. Слайд 159
- 160. Слайд 160
- 161. Слайд 161
- 162. Слайд 162
- 163. Слайд 163
- 164. Слайд 164
- 165. Слайд 165
- 166. Слайд 166
- 167. Слайд 167
- 168. Слайд 168
- 169. Слайд 169
- 170. Слайд 170
- 171. Слайд 171
- 172. Слайд 172
- 173. Слайд 173
- 174. Слайд 174
- 175. Слайд 175
- 176. Слайд 176
- 177. Слайд 177
- 178. Слайд 178
- 179. Скачать презентанцию
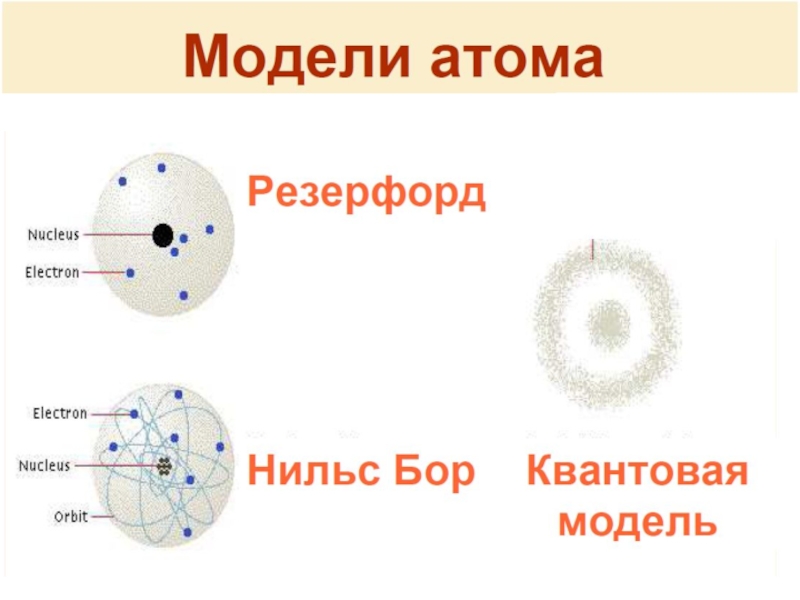
Модели атомаМодель ТомсонаПланетарная модель Резерфорда (1911)Квантово-механическая модель Бора (1913)Корпускулярно-волновая модель Н. Бор, Л. де Бройль, Ф.Хунд, Э. Шредингер, П.Дирак, В.Паули, В. Гейзенберг
Слайды и текст этой презентации
Слайд 39Модели атома
Модель Томсона
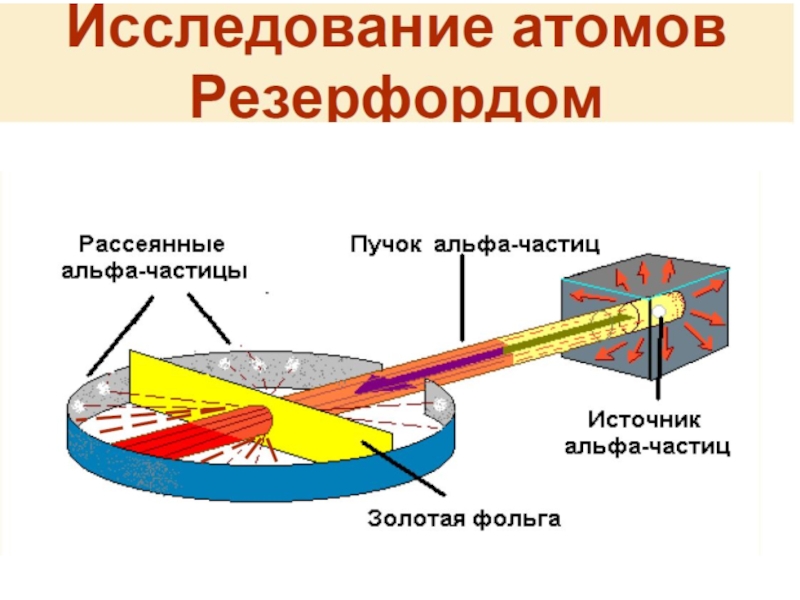
Планетарная модель Резерфорда (1911)
Квантово-механическая модель Бора (1913)
Корпускулярно-волновая модель
Слайд 452.Принцип дуализма
(корпускулярно-волновой природы)
При свободном движении электронов проявляются волновые свойства
При взаимодействии
с веществом – корпускулярные свойства
Волновые и корпускулярные свойства присущи электронам
одновременно
Слайд 483.Принцип неопределенности
(В. Гейзенберг, 1925)
Движение электрона в атоме не может
быть точно фиксировано
Координаты и скорость движения электрона в атоме
можно найти лишь с некоторой неточностью, определяемой соотношением:
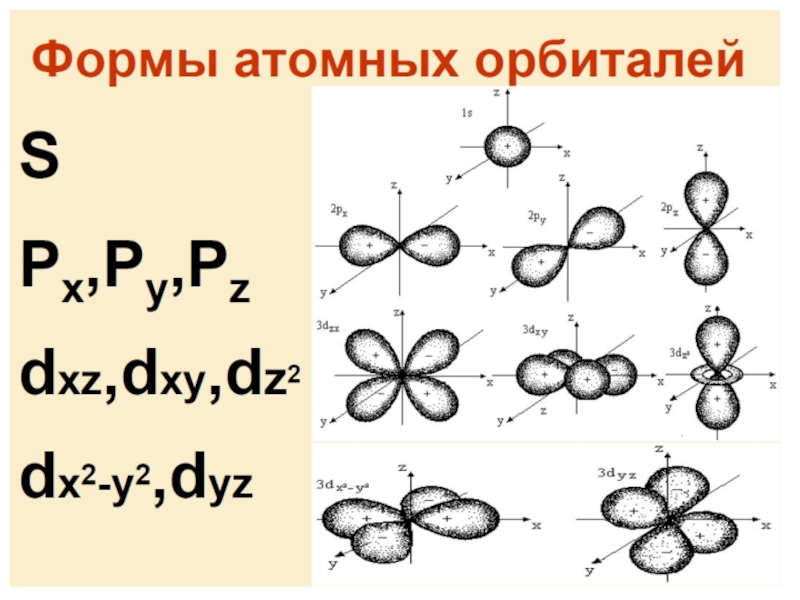
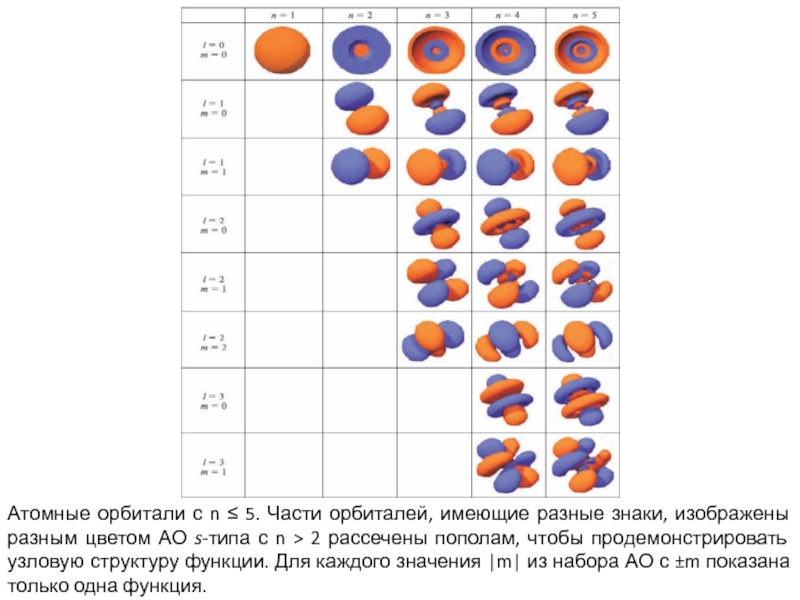
Слайд 65Атомные орбитали с n 5. Части орбиталей, имеющие разные
знаки, изображены разным цветом АО s-типа с n 2
рассечены пополам, чтобы продемонстрировать узловую структуру функции. Для каждого значения |m| из набора АО с m показана только одна функция.Слайд 66Для нейтральных атомов в основном состоянии последовательность заполнения АО следующая:
Эта
последовательность выражает так называемый aufbau-принцип, который служит обоснованием таблицы Менделеева.
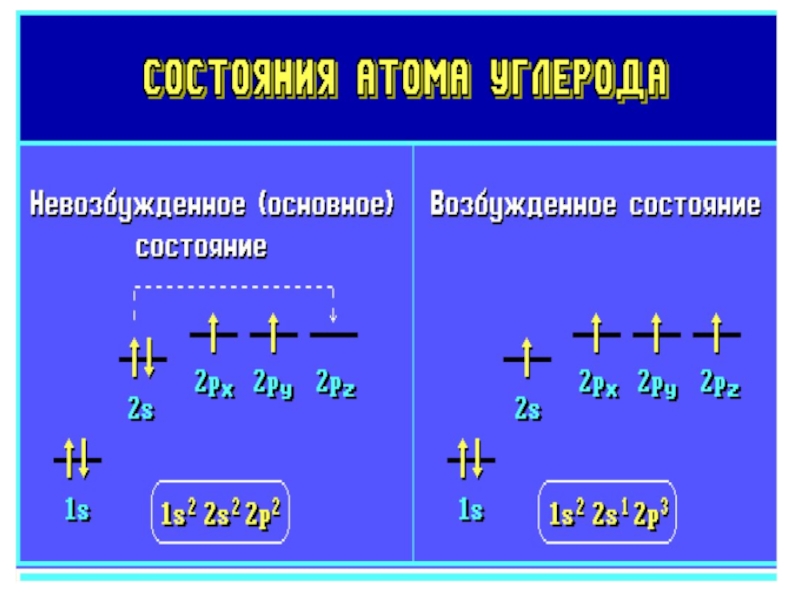
Стоит обратить внимание, что порядок заполнения атомных орбиталей определяется не соотношением их энергий, а требованием минимума полной энергии атома, которая отлична от суммы одноэлектронных энергий. Например, в атомах K и Ca заполняются электронами 4s, а не 3d состояния. Это связано с пространственным строением этих орбиталей. Так, 4s АО имеет три радиальных узла и значительная часть 4s электронов сконцентрирована ближе к ядру, чем максимум 3d радиальной функции распределения. В результате 4s электроны атомов K и Ca сильнее связаны электрон-ядерным взаимодействием, чем были бы связаны 3d электроны, описываемые безузловой радиальной функцией, и испытывающие экранированное воздействие со стороны ядра.Слайд 74Примеры электронных структур
Полная электронная формула
Se - 1s22s22p63s23p64s23d104p4
Краткая формула Se -
4s24p4
Электроно-графическая формула Ti
4
3
2
1
Слайд 92Энергия и потенциал ионизации атомов
Энергия ионизации – это энергия, необходимая
для отрыва электрона от атома и превращение атома в положительно
заряженный ионЕион [кДж/моль]
Ионизационный потенциал – это разность потенциалов, при которой происходит ионизация