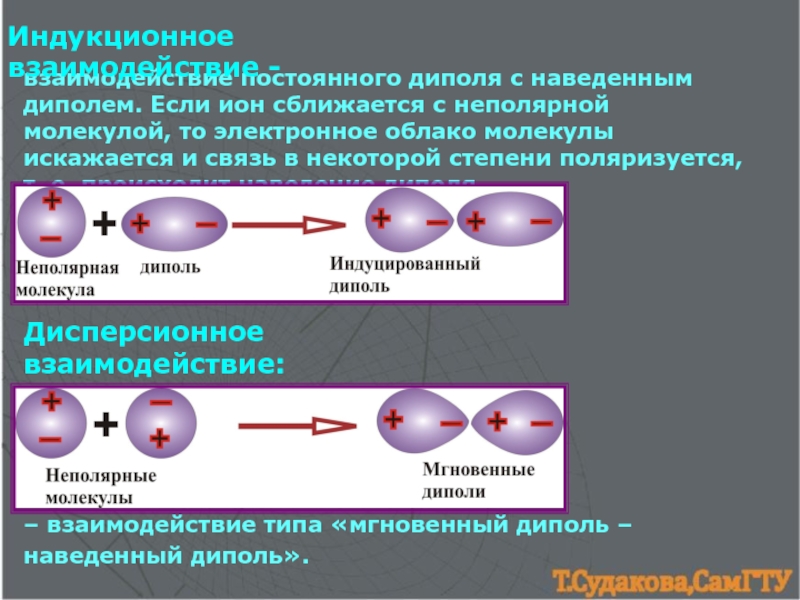
момент.
3. Ионная связь. Оценка степени ионности связи.
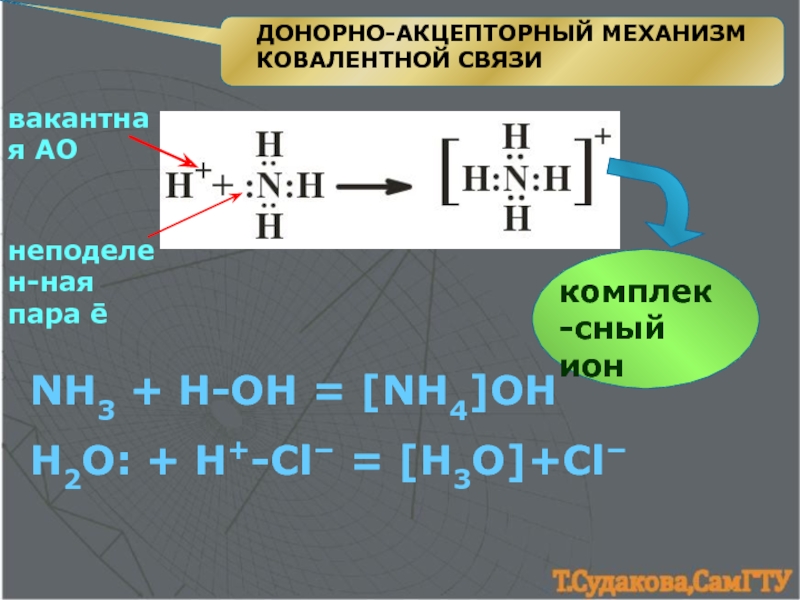
4. Донорно-акцепторный механизм
образования ковалентной связи.5. Водородная связь. 6. Силы межмолекулярного взаимодействия.
По выражению г-на Брайка Кроуфорда мл. « Вопрос о природе химической связи – сердце всей химии (1953)





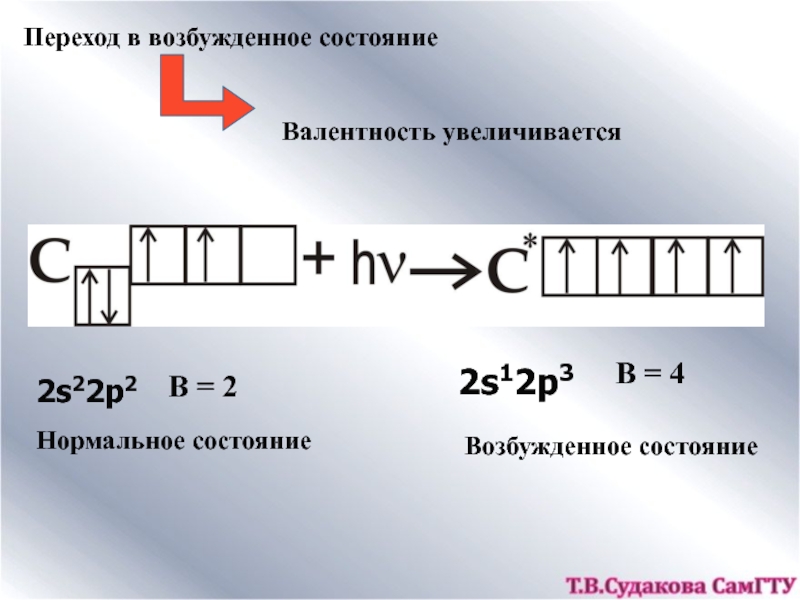
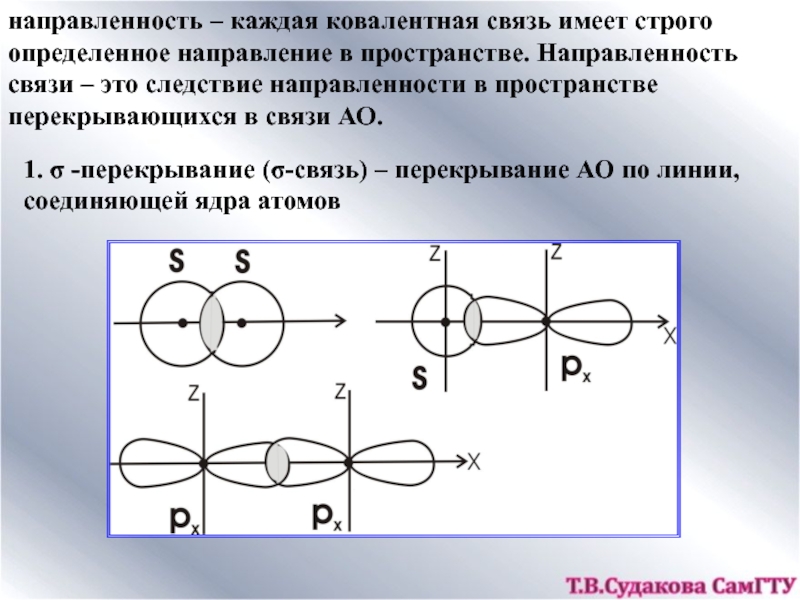
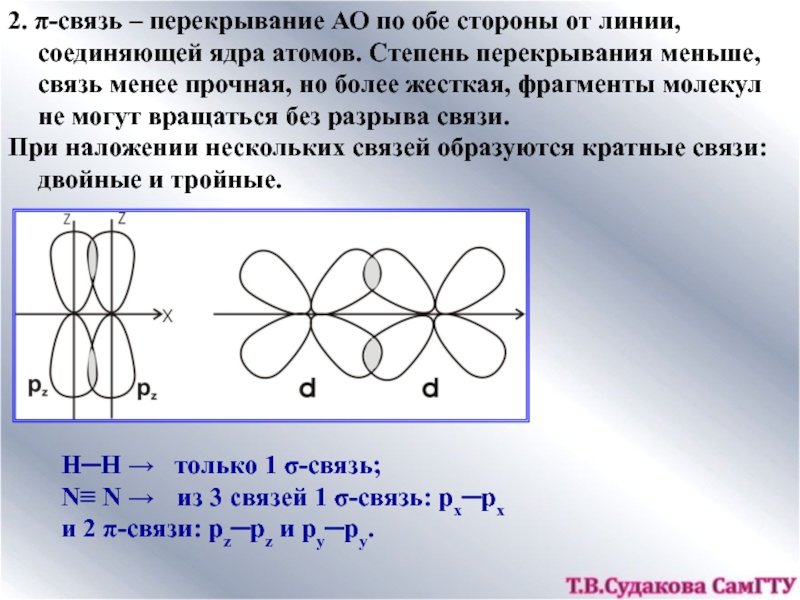



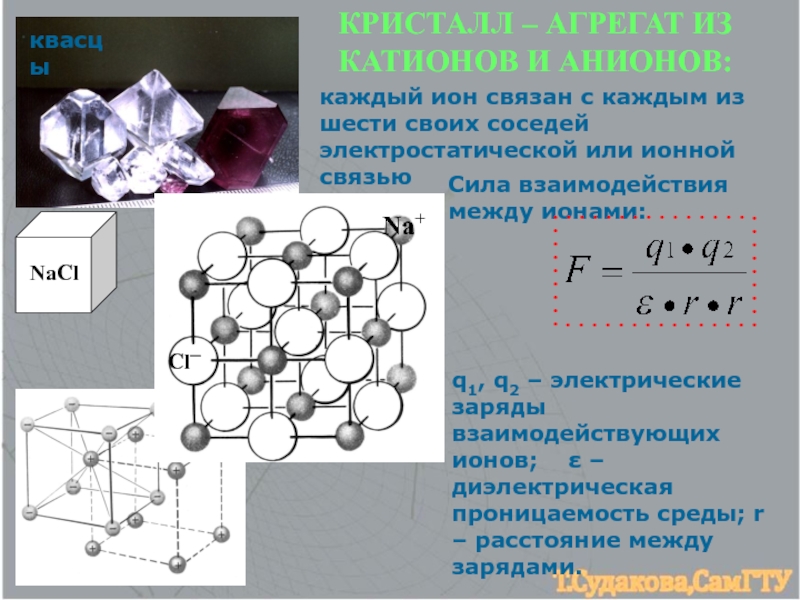
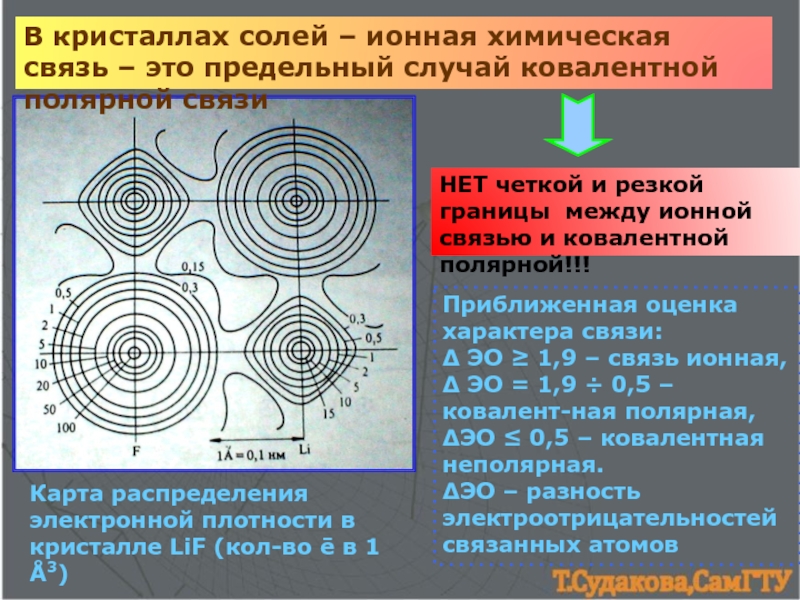
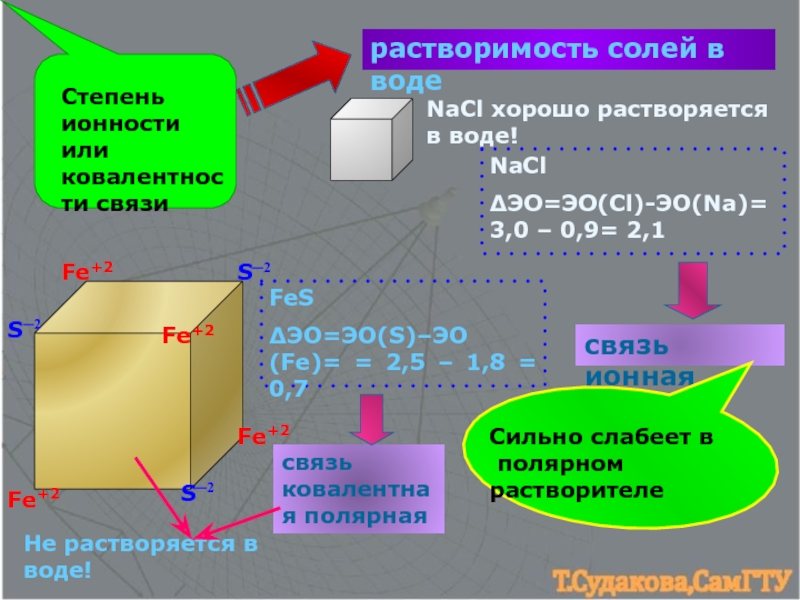
![ХИМИЧЕСКАЯ СВЯЗЬ
План.
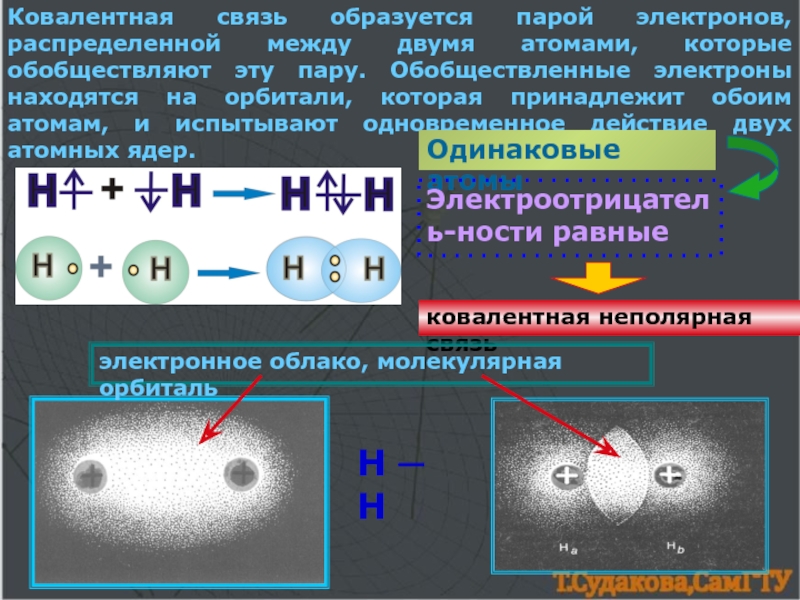
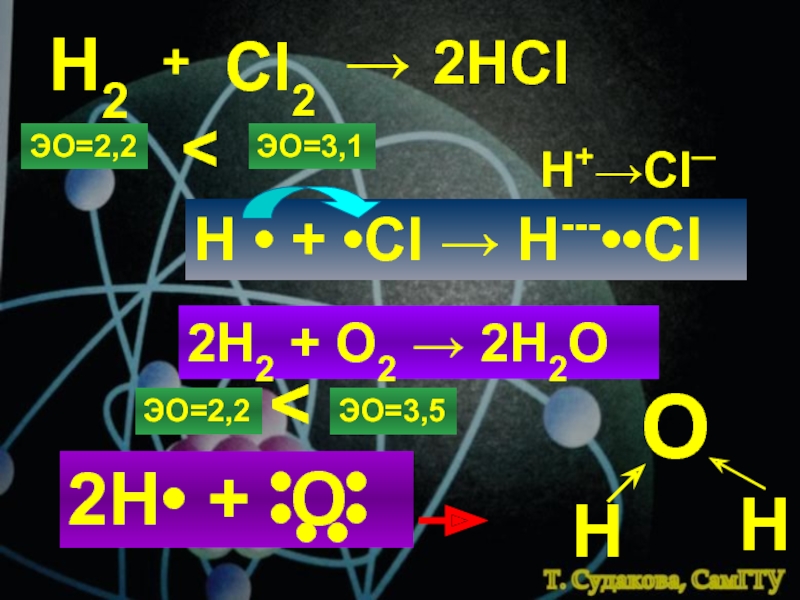
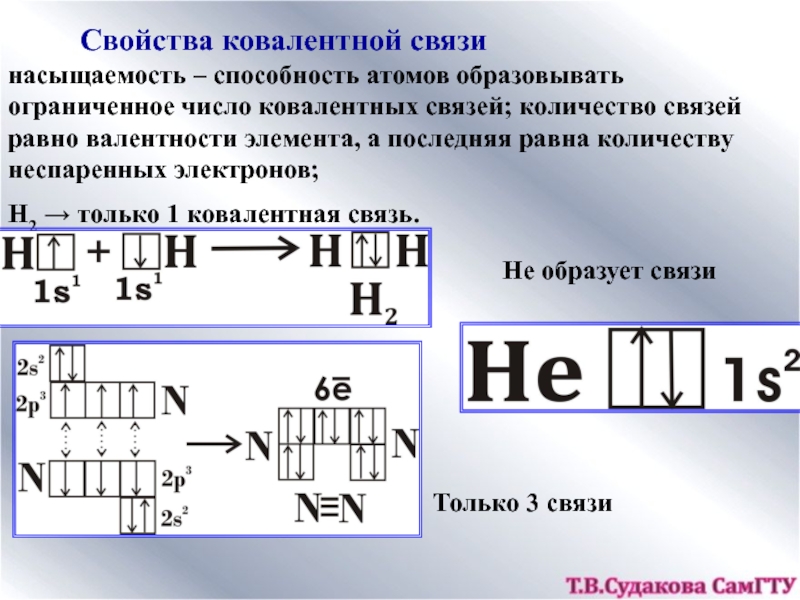
1.Электронная теория химической связи.
2. Ковалентная комплексные ионыКатионы [NH4]+, [Zn(NH3)4]2+Анионы[Al(OH)4]─, [CuCl4]2─структура комплексного иона[Zn+2(NH3)04]2+[Cu+2Cl─4]2─ион-комплексообразовательлигандыкоординаци-онное числоКомплексные соединения:[NH4]OH, [Zn(NH3)4]SO4, Na[Al(OH)4], Na[CuCl4]Сульфат тетраамминцинка, тетрахлорокупрат натрия комплексные ионыКатионы [NH4]+, [Zn(NH3)4]2+Анионы[Al(OH)4]─, [CuCl4]2─структура комплексного иона[Zn+2(NH3)04]2+[Cu+2Cl─4]2─ион-комплексообразовательлигандыкоординаци-онное числоКомплексные соединения:[NH4]OH, [Zn(NH3)4]SO4, Na[Al(OH)4], Na[CuCl4]Сульфат тетраамминцинка, тетрахлорокупрат](/img/thumbs/1d8222757b0555a46742863c302bac78-800x.jpg)
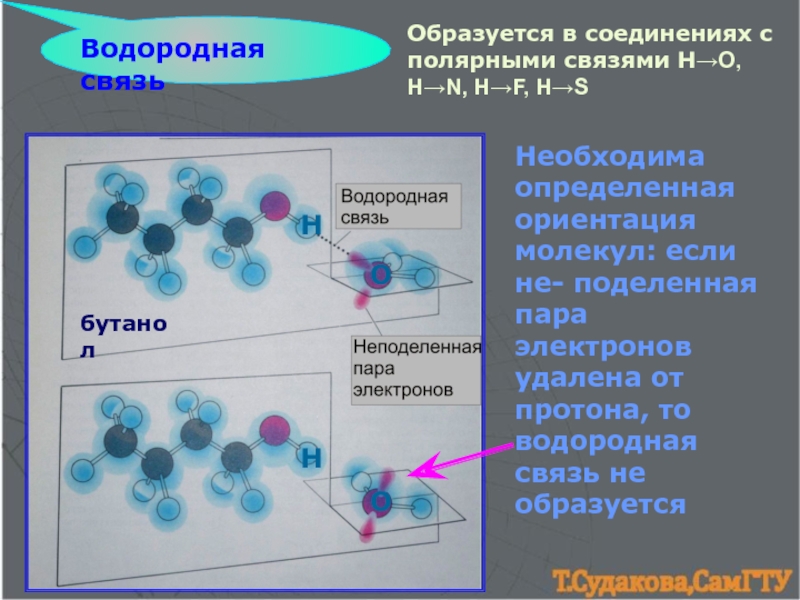


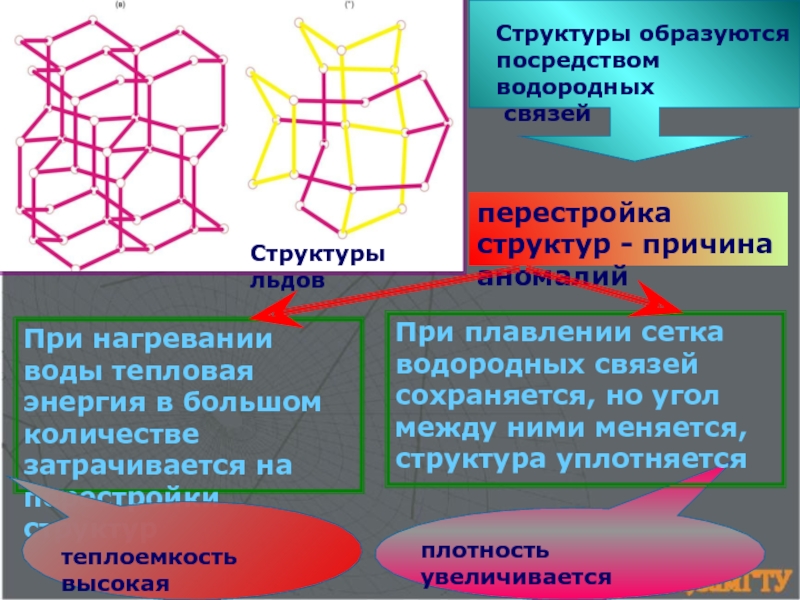
![ХИМИЧЕСКАЯ СВЯЗЬ
План.
1.Электронная теория химической связи.
2. Ковалентная Силы межмолекулярного взаимодействияСилы Ван-дер-Ваальса: электростатическая природа, слабые, Ион-дипольное взаимодействиегидраты ионов в Силы межмолекулярного взаимодействияСилы Ван-дер-Ваальса: электростатическая природа, слабые, Ион-дипольное взаимодействиегидраты ионов в водных растворах, например, [Na(H2O)x]+, [F(H2O)y]− в](/img/thumbs/0cb273e1f03218b7f3a5e832048b846e-800x.jpg)