Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА Лекция Лектор: Кондратьев Денис Андреевич заведующий
Содержание
- 1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА Лекция Лектор: Кондратьев Денис Андреевич заведующий
- 2. Гальванические элементы – это устройства, которые применяют для преобразования энергии окислительно-восстановительной реакции в электрическую энергию.
- 3. Принцип действия ХИТ
- 4. Принцип действия ХИТ
- 5. Принцип действия ХИТ
- 6. Основные терминыРазряд - процесс, во время которого
- 7. КлассификацияПервичные ХИТ - устройства, допускающие лишь однократное
- 8. КлассификацияТопливный элемент (ТЭ) – ХИТ, в котором
- 9. Устройство и принцип действия гальванического элементаЛюбой гальванический
- 10. Устройство и принцип действия гальванического элементаРеагенты, участвующие
- 11. Устройство и принцип действия гальванического элементаАВ отрицательного
- 12. Устройство и принцип действия гальванического элементаГальванический элемент
- 13. ПримерыЭлектролиз раствора CuCl2 с инертным анодом, рН=7.
- 14. Устройство и принцип действия гальванического элемента
- 15. Устройство и принцип действия гальванического элементаРазличают электроды
- 16. Устройство и принцип действия гальванического элементаКомпоненты активных
- 17. Устройство и принцип действия гальванического элементаЭлектролиты:водные растворы
- 18. Устройство и принцип действия гальванического элементаСепараторы и
- 19. Э.Д.С. гальванического элементаЭ.Д.С. гальванического элемента можно представить
- 20. Напряжение разомкнутой цепиВ литературе по ХИТ широко
- 21. Разрядное и зарядное напряженияНапряжение ХИТ при разряде
- 22. Мощность и вольт-амперная характеристика ХИТ Зависимость разрядного напряжения от силы тока представляет вольт-амперную характеристику ХИТ.
- 23. Мощность и вольт-амперная характеристика ХИТМощность ХИТ –
- 24. Мощность и вольт-амперная характеристика ХИТПолезная мощность ХИТ
- 25. Разрядная кривая Разрядная кривая ХИТ позволяет судить о
- 26. Разрядная криваяМожно выделить два участка – постепенного
- 27. Ёмкость ХИТРазрядная емкость ХИТ С – это
- 28. СаморязрядСаморазряд – потеря емкости ХИТ, обусловленная протеканием
- 29. Причины саморазрядаВзаимодействие активных веществ электродов с электролитом,
- 30. Причины саморазрядаВзаимодействие активного вещества отрицательного электрода с
- 31. Причины саморазрядаВзаимодействие активных веществ отрицательного и положительного
- 32. Нормированный токУдобным параметром для сравнения режимов разряда
- 33. Ресурс и циклТехнический ресурс аккумулятора – число
- 34. Марганцево-цинковые элементыс солевым электролитом1865 г. - первый
- 35. Марганцево-цинковые элементыс солевым электролитомВозможные электрохимические системы для
- 36. Марганцево-цинковые элементыс солевым электролитомПервичной анодной реакцией является
- 37. Марганцево-цинковые элементыс солевым электролитомДля солевых МЦ ХИТ
- 38. Марганцево-цинковые элементыс солевым электролитом1 – цинковый стаканчик,2
- 39. Марганцево-цинковые элементыс щелочным электролитомЭлектрохимическая система таких элементов:Zn
- 40. Марганцево-цинковые элементыс щелочным электролитомРеакция на цинковом электроде
- 41. Марганцево-цинковые элементыс щелочным электролитом1 – токоотвод «плюса»,
- 42. Свинцовые (кислотные) аккумуляторыЧетыре основные группы: Стартерные Стационарные ТяговыеПортативные (герметизированные)
- 43. Свинцовые (кислотные) аккумуляторы Стартерные батареи
- 44. Свинцовые (кислотные) аккумуляторыСтационарные аккумуляторы используются в энергетике,
- 45. Свинцовые (кислотные) аккумуляторыТяговые батареи емкостью от 40
- 46. Свинцовые (кислотные) аккумуляторыЭлектрохимическая система : Pb |
- 47. Свинцовые (кислотные) аккумуляторыСтартерные СА состоят из следующих основных частей:полублоков отрицательных и положительных пластин;межэлементных соединений;электролита;сепараторов;сосуда;крышки.
- 48. Свинцовые (кислотные) аккумуляторыОдноименные пластины соединены в полублоки
- 49. Свинцовые (кислотные) аккумуляторыРешётки из свинцовых сплавов для последующей намазки активных массОтливкаиз Pb-Sb сплаваПросечная решёткаиз Pb-Ca сплава
- 50. Свинцовые (кислотные) аккумуляторыПластины соединены пайкой с помощью БАРЕТКИ.полублок (-) пластинполублок (+) пластин
- 51. Свинцовые (кислотные) аккумуляторыОдин из применяемых сепараторов (мипласт). Выступами обращён к плюсу.
- 52. Свинцовые (кислотные) аккумуляторыПричины выхода из строя стартерных
- 53. Свинцовые (кислотные) аккумуляторыПричины выхода из строя стартерных
- 54. Свинцовые (кислотные) аккумуляторыПричины выхода из строя стартерных
- 55. Свинцовые (кислотные) аккумуляторыПричины выхода из строя стартерных
- 56. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА
Лекция
Лектор: Кондратьев Денис Андреевич
заведующий кафедрой
технологии неорганических веществ электрохимических
производств,
Слайд 2Гальванические элементы – это устройства, которые применяют для преобразования энергии
окислительно-восстановительной реакции в электрическую энергию.
Слайд 6Основные термины
Разряд - процесс, во время которого ХИТ отдает энергию
во внешнюю цепь.
В ХИТ можно использовать энергию лишь окислительно-восстановительной реакции,
и нужно разделить окислительную и восстановительную реакции, проводя их раздельно (но одновременно) на разных электродах.Батарея – это два или более элемента, соединенные электрически, имеющие общий корпус, выводы и маркировку.
Слайд 7Классификация
Первичные ХИТ - устройства, допускающие лишь однократное использование заключенных в
них активных материалов. Отдача электрической энергии может быть осуществлена в
один или несколько приемов. Полностью разряженный первичный источник тока к дальнейшей работе непригоден.Вторичные – ХИТ, работоспособность которых после разряда может быть восстановлена путем заряда, т.е. пропусканием постоянного электрического тока в направлении, противоположном току разряда. При заряде продукты разряда превращаются в первоначальные реагенты. Вторичные ХИТ подразделяются на аккумуляторы (вторичные элементы) и аккумуляторные батареи.
Слайд 8Классификация
Топливный элемент (ТЭ) – ХИТ, в котором реагенты непрерывно и
раздельно подводятся к электродам. ТЭ входят в состав электрохимического генератора
(ЭХГ), который включает батарею ТЭ, устройства для переработки и подвода топлива и окислителя, для вывода продуктов реакции, контроля и поддержания температуры и другие устройства.Слайд 9Устройство и принцип действия гальванического элемента
Любой гальванический элемент состоит из
двух электродов, разделенных слоем электролита.
Электродная электрохимическая реакция протекает на границе
раздела фаз между электродом и электролитом. В общем случае эти фазы следующие:фаза с электронной проводимостью (для подвода или отвода электронов);
фаза с ионной проводимостью (электролит);
реагент (окислитель или восстановитель).
Слайд 10Устройство и принцип действия гальванического элемента
Реагенты, участвующие в электродных реакциях,
называются активными веществами (АВ).
АВ в совокупности с электролитом образуют электрохимическую
систему.Слайд 11Устройство и принцип действия гальванического элемента
АВ отрицательного электрода служит восстановитель,
отдающий электроны. При разряде отрицательный электрод является анодом.
АВ положительного электрода
служит окислитель, присоединяющий электроны. При разряде положительный электрод является катодом.При разряде электроны движутся от отрицательного электрода во внешнюю (нагрузочную) цепь; при электролизе электроны движутся от отрицательного вывода выпрямителя к отрицательному электроду.
Слайд 12Устройство и принцип действия гальванического элемента
Гальванический элемент Якоби-Даниэля состоит из
медной пластины, погруженной в раствор сульфата меди (медный электрод), и
цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод).Элемент работает за счет энергии реакции:
Zn + Cu2+ = Cu + Zn2+
Слайд 15Устройство и принцип действия гальванического элемента
Различают электроды с твердыми реагентами
и электроды с жидкими и газообразными реагентами.
В электроде с твердым
реагентом всегда содержатся определенный запас АВ и фаза с электронной проводимостью, служащая для токоотвода. АВ наносится на специальный токоотвод.Для улучшения работоспособности электрода активные вещества часто используют в составе активных масс – смесей с веществами, придающими массе определенные физико-химические свойства.
Слайд 16Устройство и принцип действия гальванического элемента
Компоненты активных масс:
электропроводные добавки (металлические,
угольные, графитовые порошки);
связующие (карбоксиметилцеллюлоза, фторопласт, полиэтилен, полипропилен и т.д.);
расширители –
соединения, препятствующие рекристаллизации частиц активного вещества и способствующие сохранению высокой истинной поверхности электрода;ингибиторы коррозии (в случае порошковых металлических анодов);
активирующие добавки, способствующие повышению коэффициента использования активного вещества, и т.д.
Слайд 17Устройство и принцип действия гальванического элемента
Электролиты:
водные растворы кислот, щелочей или
солей;
электролиты на основе неорганических неводных растворителей;
электролиты на основе органических растворителей;
ионные
расплавы;твердые электролиты.
Слайд 18Устройство и принцип действия гальванического элемента
Сепараторы и их функции:
предотвращение внутренних
коротких замыканий между разноименными электродами;
механическое удержание активной массы на электродах
во избежание ее выкрашивания и осыпания;замедление роста металлических дендритов при заряде некоторых типов аккумуляторов;
удержание электролита вблизи поверхности электродов (функция электролитоносителя);
уменьшение саморазряда ХИТ вследствие замедления массопереноса растворенных активных веществ к противоположным электродам.
Слайд 19Э.Д.С. гальванического элемента
Э.Д.С. гальванического элемента можно представить как разность равновесных
электродных потенциалов, один из которых отвечает реакции протекающей на катоде
и называется потенциалом катода, а другой – анодной реакции и называется потенциалом анода:Е = φр+ – φр-.
Зависимость величины потенциала электродного процесса от различных факторов выражается уравнением:
φ0 – стандартный электродный потенциал данного процесса,
R – универсальная газовая постоянная, Т – абсолютная температура;
z – число электронов, принимающих участие в процессе, F – число фарадея, [Ox] и [Red] – произведения концентраций веществ, участвующих в процессе в окисленной и восстановленной формах.
Слайд 20Напряжение разомкнутой цепи
В литературе по ХИТ широко используется термин напряжение
разомкнутой цепи (НРЦ), представляющее собой разность бестоковых потенциалов положительного и
отрицательного электродов:UРЦ = φ+ - φ-
UРЦ ≤ Е
Слайд 21Разрядное и зарядное напряжения
Напряжение ХИТ при разряде Up меньше напряжения
разомкнутой цепи на абсолютную величину поляризации электродов (|η+| и η-)
и на величину падения напряжения на омическом сопротивлении ROM ХИТ (сопротивление электролита, электродов и других токоведущих деталей ХИТ):Up = UРЦ – (|η+| + η-) – IROM
При заряде аккумулятора зарядное напряжение UЗ > UРЦ:
UЗ = UРЦ + (η+ + |η-|) + IROM
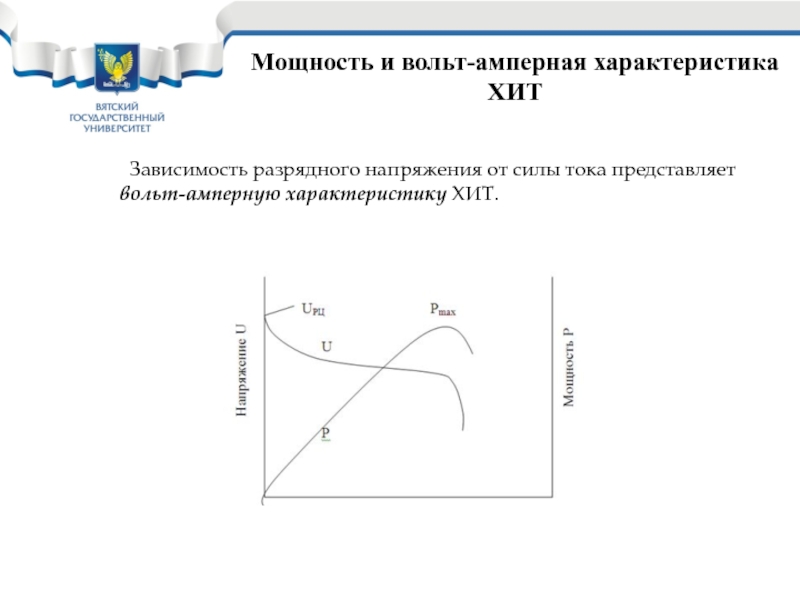
Слайд 22Мощность и вольт-амперная характеристика ХИТ
Зависимость разрядного напряжения от силы тока
представляет вольт-амперную характеристику ХИТ.
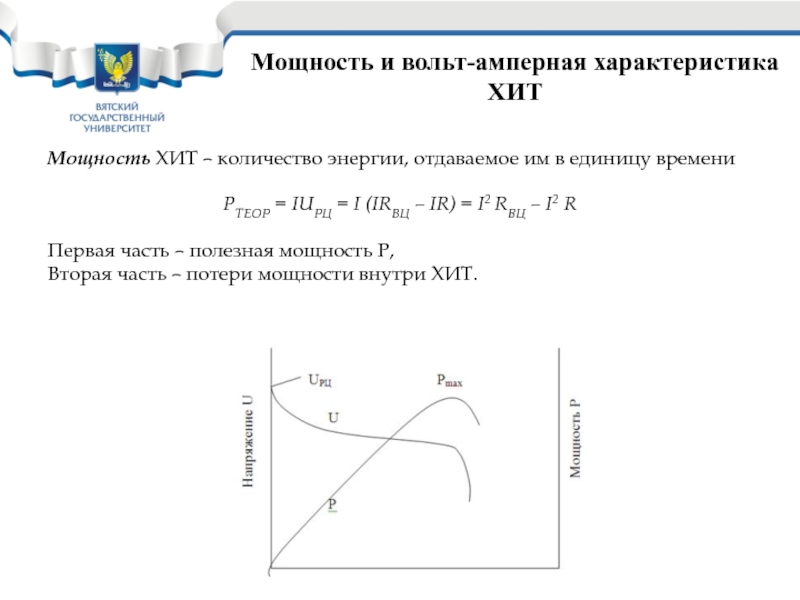
Слайд 23Мощность и вольт-амперная характеристика ХИТ
Мощность ХИТ – количество энергии, отдаваемое
им в единицу времени
РТЕОР = IUРЦ = I (IRВЦ
– IR) = I2 RВЦ – I2 RПервая часть – полезная мощность Р,
Вторая часть – потери мощности внутри ХИТ.
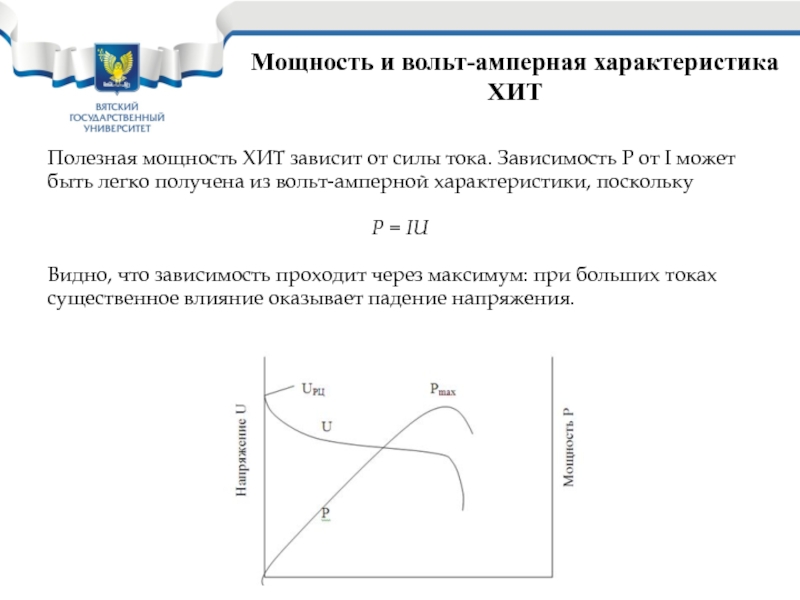
Слайд 24Мощность и вольт-амперная характеристика ХИТ
Полезная мощность ХИТ зависит от силы
тока. Зависимость Р от I может
быть легко получена из вольт-амперной
характеристики, посколькуP = IU
Видно, что зависимость проходит через максимум: при больших токах
существенное влияние оказывает падение напряжения.
Слайд 25Разрядная кривая
Разрядная кривая ХИТ позволяет судить о величине и степени
постоянства напряжения при разряде. По оси абсцисс откладывается либо время
разряда, либо количество электричества Q, отобранное от ХИТ .Слайд 26Разрядная кривая
Можно выделить два участка – постепенного спада напряжения и
резкого спада напряжения в конце разряда.
Резкое снижение напряжения в конце
разряда может быть вызвано:1. израсходованием активного вещества хотя бы одного электрода;
2. пассивацией одного из электродов;
3. короткими замыканиями между электродами.
Постепенное снижение напряжения при разряде может быть обусловлено:
1. уменьшением НРЦ;
2. увеличением поляризации одного или обоих электродов во времени;
3. увеличением значения RОМ.
Слайд 27Ёмкость ХИТ
Разрядная емкость ХИТ С – это количество электричества, отдаваемого
источником тока при его разряде до достижения UКОН при заданном
режиме разряда.
Если разряд ведется при I = const, то
CI = Iτ
Под τ понимается время достижения Uкон
Слайд 28Саморязряд
Саморазряд – потеря емкости ХИТ, обусловленная протеканием в нем самопроизвольных
процессов. Саморазряд имеет место как при хранении, так и при
разряде ХИТ.Слайд 29Причины саморазряда
Взаимодействие активных веществ электродов с электролитом, обусловленное термодинамической неустойчивостью
многих восстановителей и окислителей (потенциалы электродов расположены за пределами области
термодинамической устойчивости электролита), например, в свинцовом аккумуляторе:на отрицательном электроде
Pb + H2SO4 → PbSO4 + H2
на положительном электроде
PbO2 + H2SO4 → PbSO4 + H2O + ½ O2
Слайд 30Причины саморазряда
Взаимодействие активного вещества отрицательного электрода с окислителями, имеющимися в
ХИТ (растворенный кислород, ионы Fe3+, MnO4- и др.), и активного
вещества положительного электрода с материалом токоотвода, например, в свинцовом аккумулятореPb + 2 Fe3+ + H2SO4 → PbSO4 + 2 Fe2+ + 2 H+
PbO2 + Pb (токоотвод) + 2 H2SO4 → 2 PbSO4 + 2 H2O
Слайд 31Причины саморазряда
Взаимодействие активных веществ отрицательного и положительного электродов, обусловленное их
непосредственным контактом внутри ХИТ из-за повышенной растворимости в электролите хотя
бы одного из двух активных веществ.Диффузионный и конвективный вынос активного вещества, растворенного в электролите, за пределы межэлектродного пространства, например, в ХИТ, работающих в морской воде.
Разряд ХИТ без подключенной внешней нагрузки на мостики с электронной проводимостью, имеющиеся внутри ХИТ между электродами; такие мостики, например, образуются в серебряно-цинковом аккумуляторе и приводят в конечном итоге к коротким замыканиям.
Разряд ХИТ без подключенной внешней нагрузки на электролитные мостики; он может иметь место, если на крышке источника тока находится пролитый электролит или сконденсированная влага, а напряжение ХИТ достаточно, чтобы электролиз воды шел с заметной скоростью (U > 1,7 В).
Слайд 32Нормированный ток
Удобным параметром для сравнения режимов разряда или заряда ХИТ
служит нормированный ток j. Это численное значение отношения тока (в
А) к номинальной емкости (в А.ч):j = I / C0
Размерность нормированного тока (ч-1) иногда не указывается.
Например, если говорится, что нормированный ток заряда равен 0,3, это означает, что сила зарядного тока (в А) численно составляет 30 % от емкости аккумулятора (в А.ч), а сам заряд будет длиться 1 : 0,3 = 3,33 ч
Слайд 33Ресурс и цикл
Технический ресурс аккумулятора – число циклов, которое должен
выдержать аккумулятор при эксплуатации или испытаниях, пока его емкость не
снизится до доли от номинальной, установленной в стандарте на аккумулятор (обычно в конце срока службы на 20 – 25 % меньше номинальной).Цикл представляет собой заряд и последующий за ним разряд.
Слайд 34Марганцево-цинковые элементы
с солевым электролитом
1865 г. - первый МЦ элемент (Ж.-Л.
Лекланше).
Преимущества МЦ солевых ХИТ:
-дешевизна (самые дешевые из первичных ХИТ);
-удовлетворительные электрические
показатели;-приемлемая сохраняемость;
-удобства в эксплуатации.
Недостаток – резкое падение напряжения при разряде (конечное напряжение составляет 50 – 70 % начального).
Солевые МЦ ХИТ используют для энергопитания различных бытовых приборов (фонари, игрушки, радиоприемники, часы, и др.).
Слайд 35Марганцево-цинковые элементы
с солевым электролитом
Возможные электрохимические системы для солевых МЦ элементов:
Zn
| NH4Cl | MnO2 и Zn | ZnCl2 | MnO2
Реакция
на положительном электроде:MnO2 + H2O + e- → MnOOH + OH-
Слайд 36Марганцево-цинковые элементы
с солевым электролитом
Первичной анодной реакцией является ионизация цинка:
Zn →
Zn2+
Последующие реакции в электролите:
1. в растворе хлорида
аммония:Zn2+ + 2NH4Cl → Zn(NH3)2Cl2↓ + 2H+
2. в растворе хлорида цинка:
4Zn2+ + ZnCl2 + 9H2O → ZnCl2.4ZnO.5H2O↓ + 8H+
Слайд 37Марганцево-цинковые элементы
с солевым электролитом
Для солевых МЦ ХИТ характерен значительный саморазряд
(до 30 % в год), обусловленный взаимодействием цинкового электрода с
хлоридом аммония, водой и растворенным кислородом с последующим образованием малорастворимых пассивных пленок:Zn + 2 NH4Cl → ↓Zn(NH3)2Cl2 + H2
Zn + 2 H2O → Zn(OH)2 + H2
Для снижения саморазряда в электролит вводят ингибиторы коррозии: сулема (HgCl2), различные органические ингибиторы.
Слайд 38Марганцево-цинковые элементы
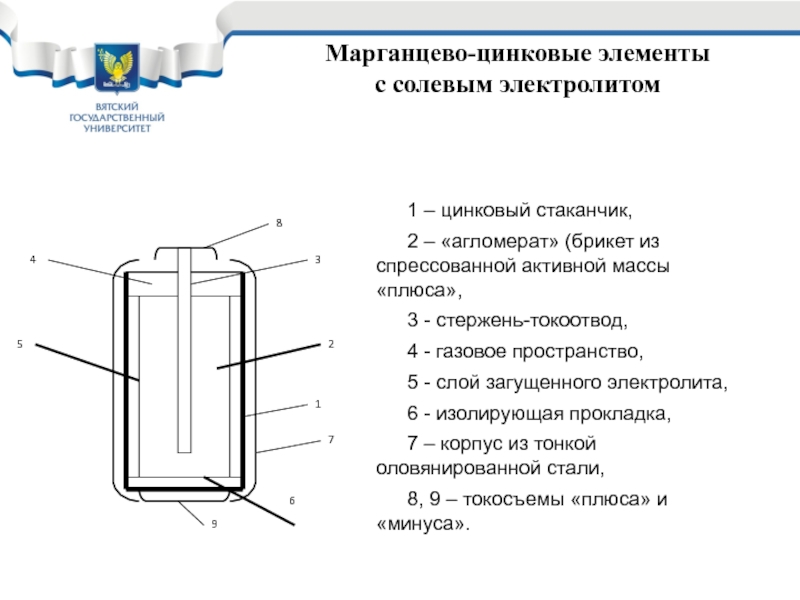
с солевым электролитом
1 – цинковый стаканчик,
2 – «агломерат» (брикет
из спрессованной активной массы «плюса»,
3 - стержень-токоотвод,
4 - газовое пространство,
5
- слой загущенного электролита,6 - изолирующая прокладка,
7 – корпус из тонкой оловянированной стали,
8, 9 – токосъемы «плюса» и «минуса».
Слайд 39Марганцево-цинковые элементы
с щелочным электролитом
Электрохимическая система таких элементов:
Zn | KOH, K2Zn(OH)4
| MnO2
Впервые были предложены в 1912 г. Щелочные МЦ элементы
превосходят солевые по допускаемой интенсивности разряда, работоспособности при низких температурах, удельной энергии и сохраняемости.Сравнительное расположение разрядных кривых щелочного и солевого МЦ ХИТ
Слайд 40Марганцево-цинковые элементы
с щелочным электролитом
Реакция на цинковом электроде («первичный процесс»):
Zn +
4OH- → Zn(OH)42- + 2e
После достижения концентрации насыщенного раствора по
цинкату раствора начинается его распад с выделением в осадок гидроксида и оксида цинка:Zn(OH)42- → Zn(OH)2 + 2OH-
Zn(OH)42- → ZnO + H2O + 2OH-
Реакция на положительном электроде:
MnO2 + H2O + e- → MnOOH + OH-
Слайд 41Марганцево-цинковые элементы
с щелочным электролитом
1 – токоотвод «плюса»,
2 – изоляционная
шайба,
3 – внешний металлический корпус,
4 – пастообразный электролит,
5 –
АМ «минуса»,6 – АМ «плюса»,
7 – стальной внутренний стаканчик,
8 – пластмассовая разделяющая прокладка,
9 – токоотвод «минуса»,
10 – полимерная шайба,
11 – отверстие предохранительного клапана,
12 – изолирующая шайба,
13 – внешний токоотвод «минуса»
Слайд 42Свинцовые (кислотные) аккумуляторы
Четыре основные группы:
Стартерные
Стационарные
Тяговые
Портативные (герметизированные)
Слайд 43Свинцовые (кислотные) аккумуляторы
Стартерные батареи используют для запуска
двигателей и освещения транспортных средств.
Напряжение батарей 6,
12 или 24 В, емкость от 6 до 215 А.ч. Электроды в таких батареях намазного типа; типы батарей: СТ (для автомобилей), ТСТ (для тракторов, мощных автомобилей), СТК (для катеров), МТ (для мотоциклов),А, САМ (для самолетов).
Во время движения транспортного средства производится их подзаряд от мотор-генератора для компенсации потери емкости при запуске двигателя и от саморазряда.
Срок службы тонких (1 – 3 мм) пластин 2 – 3 года (150 – 400 циклов). В авиационных батареях толщина пластин ~ 1 мм, в стартерных автомобильных ~ 2 мм
Слайд 44Свинцовые (кислотные) аккумуляторы
Стационарные аккумуляторы используются в энергетике, на телефонных станциях,
в телекоммуникационных системах в качестве аварийного источника тока.
Они работают в
режиме непрерывного подзаряда.Значительная толщина электродных пластин (10 – 12 мм) обеспечивает их длительный срок службы (10 лет и более; 1000 – 1500 циклов).
Слайд 45Свинцовые (кислотные) аккумуляторы
Тяговые батареи емкостью от 40 до 1200 А.ч
применяют для электроснабжения электрокар, электропогрузчиков, рудничных электровозов.
Значительная
толщина электродных пластин (10 – 12 мм) обеспечивает их длительный срок службы (10 лет и более; 1000 – 1500 циклов).Портативные батареи применяют для питания приборов, инструмента,
аварийного освещения.
Слайд 46Свинцовые (кислотные) аккумуляторы
Электрохимическая система :
Pb | H2SO4 | PbO2
Концентрированные
растворы серной кислоты диссоциированы на ионы
Н+ и HSO4-, правильнее
записывать с участием бисульфат-ионов: (-) Pb + HSO4- ↔ PbSO4 + H+ + 2e
(+) PbO2 + HSO4- + 3 H+ + 2 e ↔ PbSO4 + 2 H2O
Суммарная токообразующая реакция:
Pb + PbO2 + 2 H2SO4 ↔ 2 PbSO4 + 2 H2O
Слайд 47Свинцовые (кислотные) аккумуляторы
Стартерные СА состоят из следующих основных частей:
полублоков отрицательных
и положительных пластин;
межэлементных соединений;
электролита;
сепараторов;
сосуда;
крышки.
Слайд 48Свинцовые (кислотные) аккумуляторы
Одноименные пластины соединены в полублоки с помощью баретки
– перемычки из Pb – Sb сплава.
Межэлементные соединения из того
же сплава служат для соединения аккумуляторов в батареи.Батарея монтируется в моноблоке – общем сосуде из кислотостойкого материала (эбонита, полипропилена, полиамида и др.), разделенном внутри перегородками.
В качестве сепараторов применяют: микропористый эбонит (мипор): микропористый поливинилхлорид (мипласт, поровинил и т.д.), стеклянный войлок и др.
Слайд 49Свинцовые (кислотные) аккумуляторы
Решётки из свинцовых сплавов для последующей намазки активных
масс
Отливка
из Pb-Sb сплава
Просечная решётка
из Pb-Ca сплава
Слайд 50Свинцовые (кислотные) аккумуляторы
Пластины соединены пайкой с помощью БАРЕТКИ.
полублок (-) пластин
полублок
(+) пластин
Слайд 51Свинцовые (кислотные) аккумуляторы
Один из применяемых сепараторов (мипласт). Выступами обращён к
плюсу.
Слайд 52Свинцовые (кислотные) аккумуляторы
Причины выхода из строя стартерных аккумуляторов
коррозия решеток положительного
электрода
Причина коррозии токоотводящих решеток из свинцовых сплавов - термодинамическая неустойчивость
свинца в условиях работы положительного электрода.Нарушается контакт решетки с активной массой; кроме того, образующийся диоксид свинца имеет больший удельный объем, чем свинец, поэтому помимо утоньшения решётки происходит и её деформация.
Слайд 53Свинцовые (кислотные) аккумуляторы
Причины выхода из строя стартерных аккумуляторов
оплывание активной массы
положительного электрода
Это отпадение от пластин кристаллов и зерен PbO2.
Наблюдается в
конце заряда.Способствует отпадению кристаллов выделяющийся кислород.
Оплывание усиливается при пониженных температурах, при увеличенной концентрации кислоты, а также при повышенной рабочей плотности тока. В этом случае при заряде (+) электрода образуются легко осыпающиеся дендриты PbO2.
Слайд 54Свинцовые (кислотные) аккумуляторы
Причины выхода из строя стартерных аккумуляторов
необратимая сульфатация пластин
Это
образование на электродах (прежде всего на отрицательных) плотной белой корки
сульфата.Аккумулятор не принимает заряд.
Причина - рекристаллизация сульфата свинца при хранении СА в разряженном состоянии.
По этой причине СА не рекомендуется хранить в разряженном состоянии: периодически его необходимо подзаряжать.
Слайд 55Свинцовые (кислотные) аккумуляторы
Причины выхода из строя стартерных аккумуляторов
перенос сурьмы из
решеток положительных электродов в активную массу отрицательных электродов и связанный
с этим повышенный саморазряд отрицательных электродовПричина – анодное растворение сурьмяной составляющей решеток при длительном заряде с образованием ионов Sb (III) и Sb (V), их последующая диффузия к (-) электродам и катодное восстановление ионов сурьмы на (-) электроде в виде мелкодисперсного порошка (на предельном токе).
Одна из мер борьбы – замена сурьмы в решётках на кальций.