Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химические свойства НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ (ПОВТОРЕНИЕ)
Содержание
- 1. Химические свойства НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ (ПОВТОРЕНИЕ)
- 2. K2SO4 --K2S– SHClH2SBr2CCuCl2
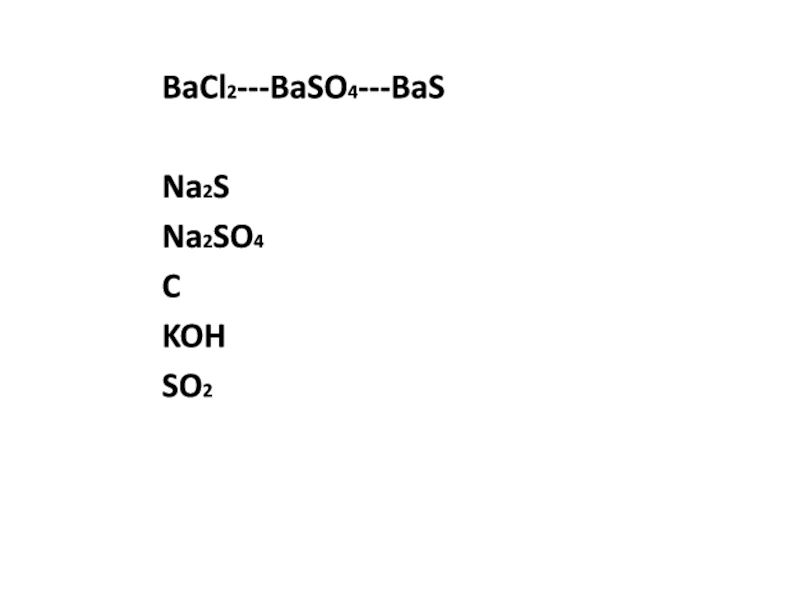
- 3. BaCl2---BaSO4---BaSNa2SNa2SO4CKOHSO2
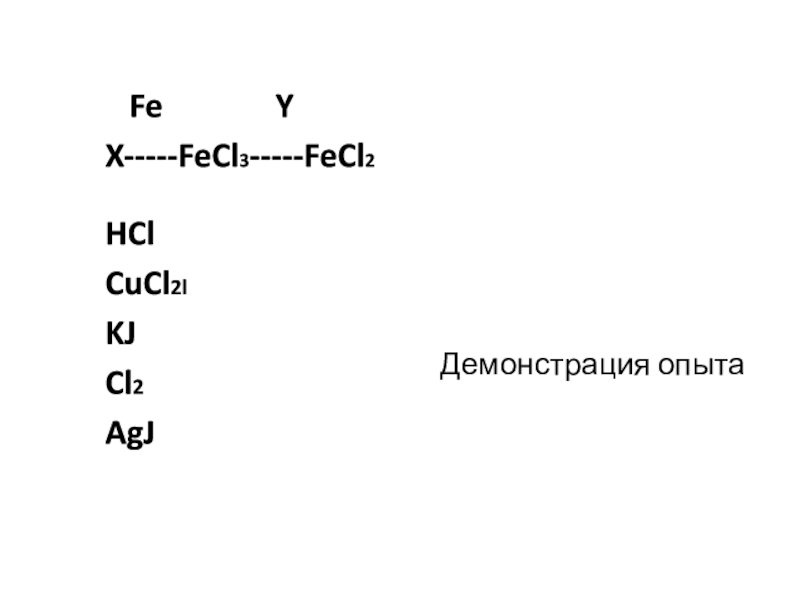
- 4. Демонстрация опыта Fe YX-----FeCl3-----FeCl2HClCuCl2lKJCl2AgJ
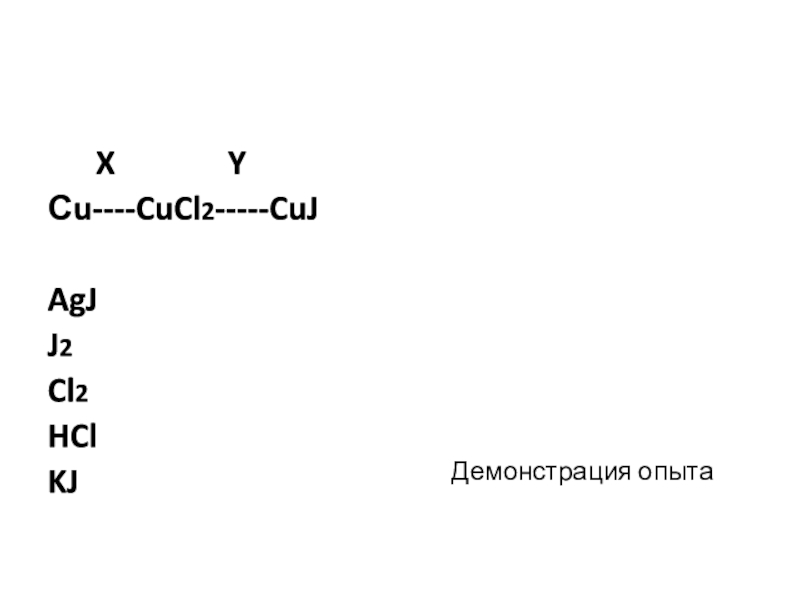
- 5. X YСu----CuCl2-----CuJAgJJ2Cl2HClKJДемонстрация опыта
- 6. Слайд 6
- 7. https://www.youtube.com/watch?v=HwlgknbeHVo жидкий азот и туман с водой
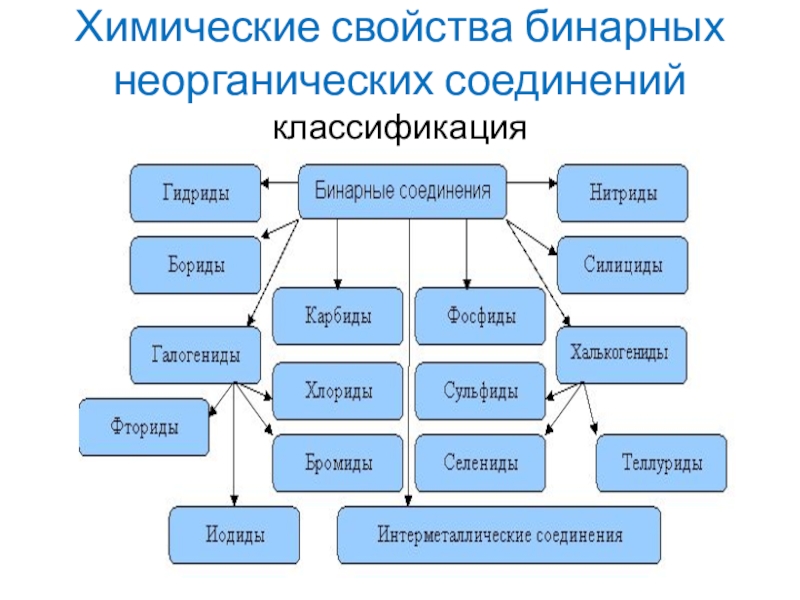
- 8. Химические свойства бинарных неорганических соединенийклассификация
- 9. Названия бинарных соединений
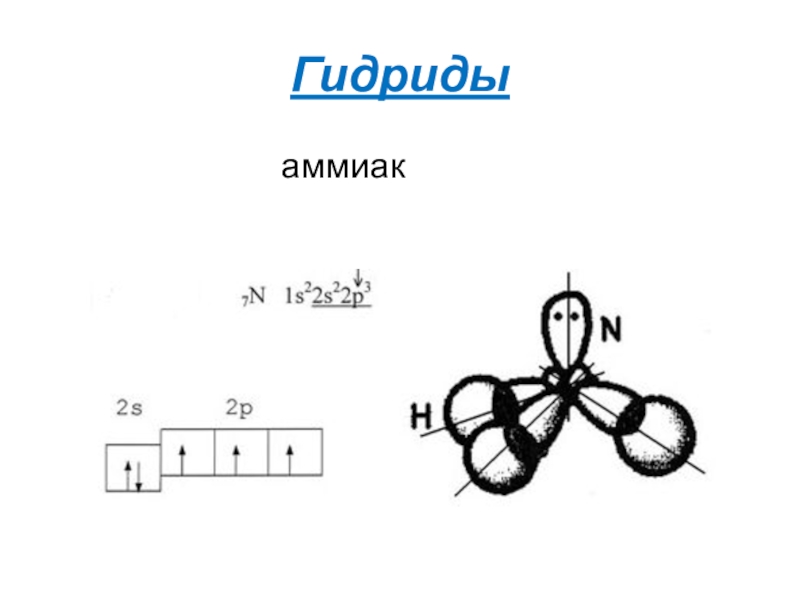
- 10. Гидридыаммиак
- 11. Химические свойства бинарных неорганических соединений
- 12. Слайд 12
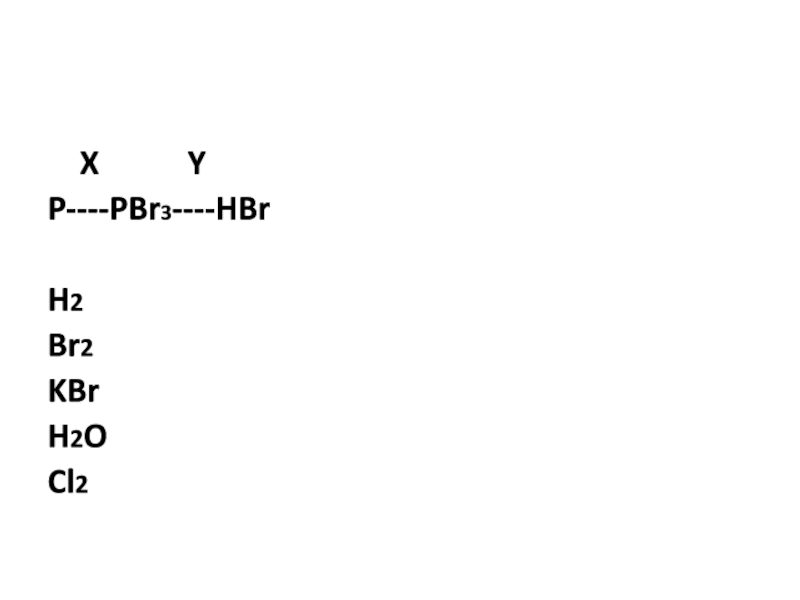
- 13. X YP----PBr3----HBrH2Br2KBrH2OCl2
- 14. Кислоты фосфораОртофосфорная (электролит средней силы) трёхосновнаяМетафосфорная (слабый электролит)Пирофосфорная(слабый электролит) четырёхосновная
- 15. Слайд 15
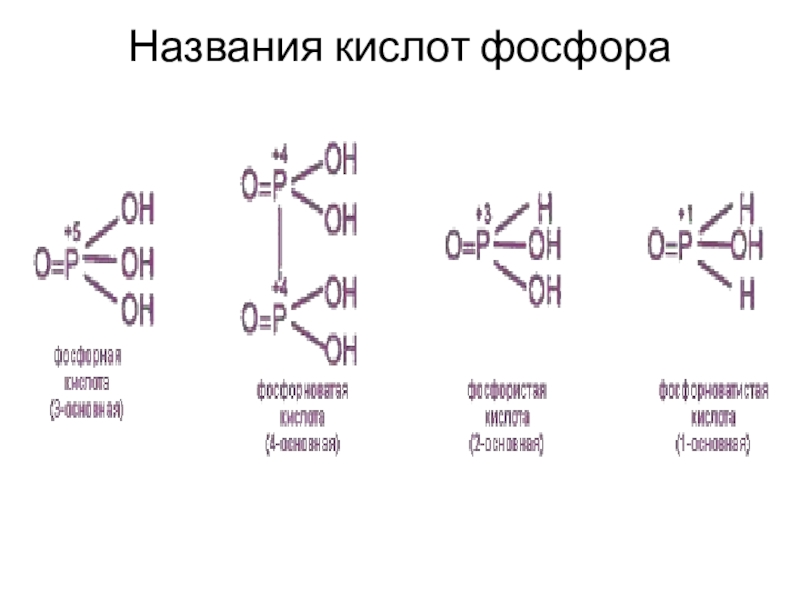
- 16. Кислоты фосфора (С.О.+5)
- 17. Названия кислот фосфора
- 18. фосфорноватая кислотаДиспропорционирует при комнатной температуре
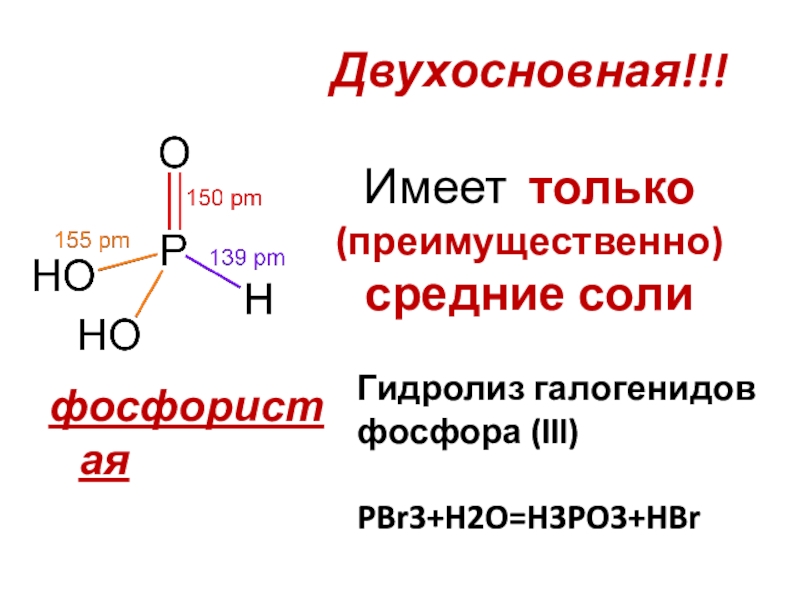
- 19. Двухосновная!!! Имеет только (преимущественно) средние солифосфористаяГидролиз галогенидов фосфора (lll)PBr3+H2O=H3PO3+HBr
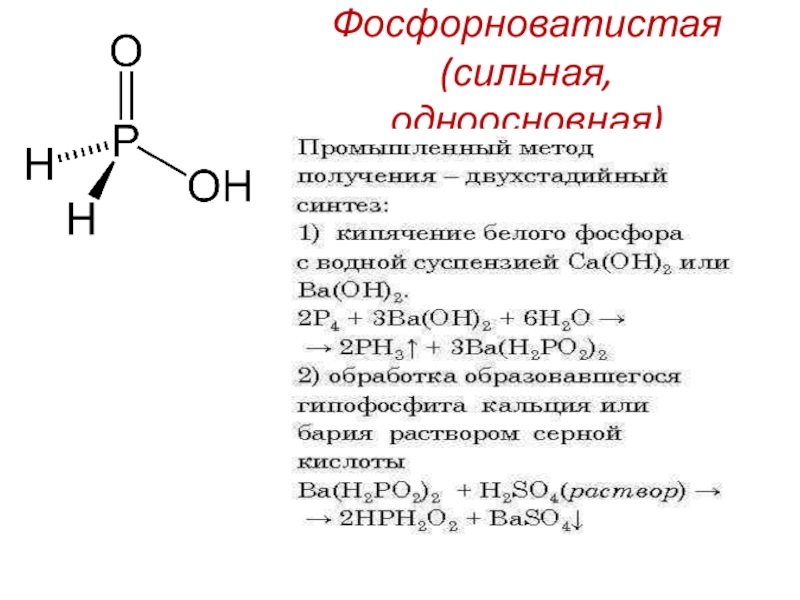
- 20. Фосфорноватистая (сильная, одноосновная)
- 21. Соли фосфорноватистой кислоты (гипофосфиты) образуются при взаимодействии белого фосфора со щелочамиhttps://www.youtube.com/watch?v=g1ujYPHn3Fo
- 22. Слайд 22
- 23. Слайд 23
- 24. Классификация неорганических веществФормула оксидаNOCr2O3CrOMnO2MnOMn2O7SiOSiO2Li2OPbOPbO2MgON2OV2O5VONO2N2O3N2O5Al2O3B2O3BeOSeO2SOCOCO2Тип оксидаНесолеоб-разующийКислотныйОсновныйАмфортер-ный
- 25. ФОРМУЛАKH2PO2Na2H2P2O7KFe(SO4)KHPO4Na[Al(OH)4]Cr(OH)2NO3Na2MnO4Na2Cr2O7Na[Ag(CN)2]CuSO4*5H2ONaCl*KClMg2(OH)2CO2(CuOH)2CO3Na2HPO3KH2PO3HCOOKCa3(PO4)2CaClFAlK(SO4)2**12H2OТИП СОЛИСредняя сольКислая сольОсновная сольСмешанная сольДвойная сольКомплексная сольКристол-логидрат
- 26. ТРИВИАЛЬНЫЕ НАЗВАНИЯКрасная кровяная сольK3[Fe(CN)6]Реактив на определение железа
- 27. https://www.youtube.com/watch?v=- → →OvtjGb15EEK4[Fe(CN)6]Используется для обнаружения Fe3+: образуется
- 28. Zn2+: образуется белый осадок гексацианоферрата(II) цинка-калия:3ZnCl2 +
- 29. Железная окалина (железный сурик) FeO*Fe2O3Свинцовый сурик2PbO*PbO2или Pb2PbO4 (ортоплюмбат свинца)
- 30. Слайд 30
- 31. Свинцовые белилареставрацияPb(ОН)2CO3
- 32. Свинцовые белила на воздухе очень медленно реагирует
- 33. ПоташК2СО3ГипсCaSO4·2H2OKNO3Калийная селитра
- 34. Негашеная известьГашеная известь («пушонка»)СаОCa(OH)2
- 35. КорундAl2O3рубинсапфир
- 36. Кремнезём SiO2SiO2 не реагирует с водой.Химически стоек
- 37. SiO2 с щелочами и основными оксидами, а
- 38. Аналитические реакции на ионыhttps://www.youtube.com/watch?v=ExB1r4m7Bb8
- 39. Скачать презентанцию
K2SO4 --K2S– SHClH2SBr2CCuCl2
Слайды и текст этой презентации
Слайд 7https://www.youtube.com/watch?v=HwlgknbeHVo жидкий азот и туман с водой (мин. 2.39 -3.09)
H2O Y
X- ------NH3------Cu
N2
CuO
CuSO4
MgN2
NH4Cl
Слайд 14Кислоты фосфора
Ортофосфорная (электролит средней силы) трёхосновная
Метафосфорная (слабый электролит)
Пирофосфорная
(слабый электролит) четырёхосновная
Слайд 19Двухосновная!!!
Имеет только (преимущественно) средние соли
фосфористая
Гидролиз галогенидов фосфора (lll)
PBr3+H2O=H3PO3+HBr
Слайд 21Соли фосфорноватистой кислоты (гипофосфиты) образуются при взаимодействии белого фосфора со
щелочами
https://www.youtube.com/watch?v=g1ujYPHn3Fo
Слайд 24Классификация неорганических веществ
Формула оксида
NO
Cr2O3
CrO
MnO2
MnO
Mn2O7
SiO
SiO2
Li2O
PbO
PbO2
MgO
N2O
V2O5
VO
NO2
N2O3
N2O5
Al2O3
B2O3
BeO
SeO2
SO
CO
CO2
Тип оксида
Несолеоб-разующий
Кислотный
Основный
Амфортер-ный
Слайд 25ФОРМУЛА
KH2PO2
Na2H2P2O7
KFe(SO4)
KHPO4
Na[Al(OH)4]
Cr(OH)2NO3
Na2MnO4
Na2Cr2O7
Na[Ag(CN)2]
CuSO4*5H2O
NaCl*KCl
Mg2(OH)2CO2
(CuOH)2CO3
Na2HPO3
KH2PO3
HCOOK
Ca3(PO4)2
CaClF
AlK(SO4)2*
*12H2O
ТИП СОЛИ
Средняя соль
Кислая соль
Основная соль
Смешанная соль
Двойная соль
Комплексная соль
Кристол-логидрат
Слайд 26ТРИВИАЛЬНЫЕ НАЗВАНИЯ
Красная кровяная соль
K3[Fe(CN)6]
Реактив на определение железа (II)
2 К3[Fe(CN)6 ]
+3 Fe SO4 =
= KFe[Fe(CN)6])↓ + 3K2SO4
Турнбуллева синь
ВИДЕО https://www.youtube.com/watch?v=yyhg_2khzbA
Слайд 27https://www.youtube.com/watch?v=- → →OvtjGb15EE
K4[Fe(CN)6]
Используется для обнаружения Fe3+: образуется малорастворимый синий осадок
«берлинской лазури»:
FeIIICl3 + K4[FeII(CN)6] →
→ KFeIII[FeII(CN)6] + 3KCl,
Видео:
https://www.youtube.com/watch?v=-OvtjGb15EE
Слайд 28Zn2+: образуется белый осадок гексацианоферрата(II) цинка-калия:
3ZnCl2 + 2K4[FeII(CN)6] → K2Zn3[Fe(CN)6]2↓
+ 6KCl,
Cu2+: из нейтральных или слабокислых растворов выпадает красно-бурый осадок
гексацианоферрата(II) меди(II):2CuCl2 + K4[FeII(CN)6] → Cu2[Fe(CN)6]↓ + 4KCl,
Слайд 29Железная окалина
(железный сурик)
FeO*Fe2O3
Свинцовый сурик
2PbO*PbO2
или
Pb2PbO4
(ортоплюмбат
свинца)
Слайд 32Свинцовые белила на воздухе очень медленно реагирует с сероводородом, часто
содержащемся в загрязненной атмосфере, при этом образуется сульфид свинца(II) черного
цвета, что обуславливает постепенное темнение и тускнение некоторых произведений художественного искусства:[Pb(OH)]2CO3+2H2S=2PbS+CO2+3H2O
Однако при обработке старой картины, написанной с использованием свинцовых белил, пероксидом водорода происходит окисление сульфида свинца до сульфата свинца(II) белого цвета. На этой реакции основан метод восстановления картин, выполненных масляными красками.
PbS+4H2O2=PbSO4+4H2O
Слайд 36Кремнезём
SiO2
SiO2 не реагирует с водой.
Химически стоек к действию кислот, но
реагирует с газообразным фтороводородом:
SiO2+4HF= SiF4+2H2O
и плавиковой кислотой:
SiO2+6HF=H2[SiF6]+2H2O
Эти две
реакции широко используют для плавления стекла.Слайд 37SiO2 с щелочами и основными оксидами, а также с карбонатами
активных металлов образуются силикаты — соли не имеющих постоянного состава
очень слабых, нерастворимых в воде кремниевых кислот общей формулы xH2O·ySiO2 (довольно часто в литературе упоминаются не кремниевые кислоты, а кремниевая кислота, хотя фактически речь при этом идёт об одном и том же веществе).Например, может быть получен ортосиликат натрия:
SiO2+4NaOH=Na4SiO4+2H2O















![Химические свойства НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ (ПОВТОРЕНИЕ) ФОРМУЛАKH2PO2Na2H2P2O7KFe(SO4)KHPO4Na[Al(OH)4]Cr(OH)2NO3Na2MnO4Na2Cr2O7Na[Ag(CN)2]CuSO4*5H2ONaCl*KClMg2(OH)2CO2(CuOH)2CO3Na2HPO3KH2PO3HCOOKCa3(PO4)2CaClFAlK(SO4)2**12H2OТИП СОЛИСредняя сольКислая сольОсновная сольСмешанная сольДвойная сольКомплексная сольКристол-логидрат ФОРМУЛАKH2PO2Na2H2P2O7KFe(SO4)KHPO4Na[Al(OH)4]Cr(OH)2NO3Na2MnO4Na2Cr2O7Na[Ag(CN)2]CuSO4*5H2ONaCl*KClMg2(OH)2CO2(CuOH)2CO3Na2HPO3KH2PO3HCOOKCa3(PO4)2CaClFAlK(SO4)2**12H2OТИП СОЛИСредняя сольКислая сольОсновная сольСмешанная сольДвойная сольКомплексная сольКристол-логидрат](/img/tmb/7/618137/c437a5616d49d262dd8dcaaffb4ad53e-800x.jpg)
![Химические свойства НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ (ПОВТОРЕНИЕ) ТРИВИАЛЬНЫЕ НАЗВАНИЯКрасная кровяная сольK3[Fe(CN)6]Реактив на определение железа (II)2 К3[Fe(CN)6 ] +3 ТРИВИАЛЬНЫЕ НАЗВАНИЯКрасная кровяная сольK3[Fe(CN)6]Реактив на определение железа (II)2 К3[Fe(CN)6 ] +3 Fe SO4 == KFe[Fe(CN)6])↓ + 3K2SO4Турнбуллева](/img/tmb/7/618137/ed65749e427ed8b53e5a2435c4c76960-800x.jpg)
![Химические свойства НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ (ПОВТОРЕНИЕ) https://www.youtube.com/watch?v=- → →OvtjGb15EEK4[Fe(CN)6]Используется для обнаружения Fe3+: образуется малорастворимый синий осадок «берлинской https://www.youtube.com/watch?v=- → →OvtjGb15EEK4[Fe(CN)6]Используется для обнаружения Fe3+: образуется малорастворимый синий осадок «берлинской лазури»:FeIIICl3 + K4[FeII(CN)6] →→ KFeIII[FeII(CN)6] +](/img/tmb/7/618137/9e6e785a4cb0abf9fb77609e7b7ae282-800x.jpg)
![Химические свойства НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ (ПОВТОРЕНИЕ) Zn2+: образуется белый осадок гексацианоферрата(II) цинка-калия:3ZnCl2 + 2K4[FeII(CN)6] → K2Zn3[Fe(CN)6]2↓ + Zn2+: образуется белый осадок гексацианоферрата(II) цинка-калия:3ZnCl2 + 2K4[FeII(CN)6] → K2Zn3[Fe(CN)6]2↓ + 6KCl,Cu2+: из нейтральных или слабокислых растворов](/img/tmb/7/618137/b5e569e853999b8bf115f4f5503647b5-800x.jpg)





























