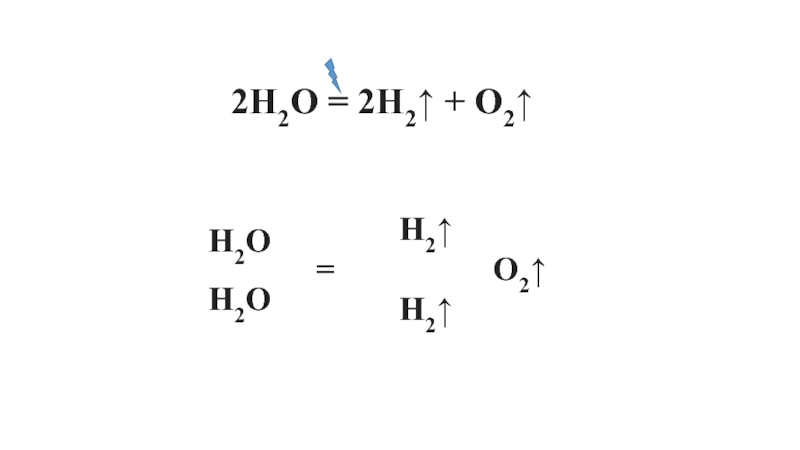Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химические уравнения и материальный баланс Занятие 10 8 класс Кроль Игорь
Содержание
- 1. Химические уравнения и материальный баланс Занятие 10 8 класс Кроль Игорь
- 2. Признаки химической реакции:Выделение газа;Образование или растворение осадка;Изменение цвета;Изменение запаха;Излучение света;Выделение или поглощение тепла.
- 3. Закон сохранения массы:Масса веществ, вступающих в реакцию, равна массе веществ,
- 4. Уравнения химических реакцийCuSO4 + 2NaOH = Cu(OH)2↓
- 5. 2H2О = 2H2↑ + O2↑ H2О H2О
- 6. Zn + HCl = ZnCl2+ H2↑ NaOH
- 7. Количество вещества.Расчёты по уравнениям реакций2H2О = 2H2↑ + O2↑ N2 + 3H2 = 2NH3
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Скачать презентанцию
Признаки химической реакции:Выделение газа;Образование или растворение осадка;Изменение цвета;Изменение запаха;Излучение света;Выделение или поглощение тепла.
Слайды и текст этой презентации
Слайд 1Химические уравнения и материальный баланс
Занятие 10
8 класс
Кроль Игорь Михайлович
https://vk.com/club186206591
Слайд 2Признаки химической реакции:
Выделение газа;
Образование или растворение осадка;
Изменение цвета;
Изменение запаха;
Излучение света;
Выделение
или поглощение тепла.
Слайд 3Закон сохранения массы:
Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате
реакции.
Или
Вещество и энергия не возникают из ничего и не обращаются
в ничто.Слайд 4Уравнения химических реакций
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Cu(OH)2 +
2HCl = CuCl2 + 2H2O
Выпадение осадка Cu(OH)2
Растворение осадка
Cu(OH)2 Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Выделение газа СО2
Слайд 6Zn + HCl = ZnCl2+ H2↑
NaOH + HCl =
NaCl+ H2O
2
Ca(OH)2 + HCl = CaCl2+ H2O
2
H2
+ O2 = H2O 4
2
P2O5 + Н2О = Н3РO4
2
3
Коэффициенты в химических реакций