Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химические вещества и материалы в индустрии красоты
Содержание
- 1. Химические вещества и материалы в индустрии красоты
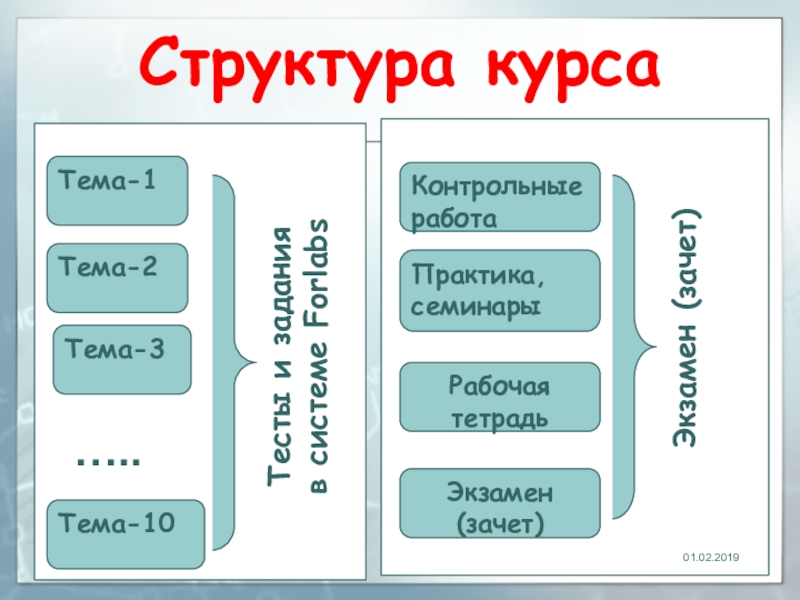
- 2. Структура курсаТема-1Тема-10Тема-2Тема-3Тесты и задания в системе ForlabsПрактика, семинарыРабочая тетрадьЭкзамен (зачет)Экзамен (зачет) Контрольные работа…..
- 3. Темы курсаТема 1 – Общая и неорганическая
- 4. Темы курсаТема 7– Состав средств декоративной косметикиТема
- 5. Оценка по курсуТема-1Тема-5Практика Рабочая тетрадьЭкзамен (зачёт)30%20%20%20%После прохождения
- 6. Фармацевтическая промышленность
- 7. Искусственные волокна
- 8. Пластмассы
- 9. Синтетические каучуки
- 10. Продукты оргсинтезаЭтиловый спиртКрасителиВзрывчатые веществаВ настоящее время известно
- 11. Топливная промышленность
- 12. Косметическая химия (от греч. κοσμητική – искусство украшать)
- 13. Косметическая химияразвивалась вместе с накоплением сведений о
- 14. Слайд 14
- 15. Ряды Рихтера и триады Дёберейнера Немецкий химик
- 16. Группы элементов ГессаВ изданном в 1849 г.
- 17. Спираль Шанкуртуа или «теллурический винт»В 1862 году
- 18. Закон октавВ 1865 г. американский химик Дж.
- 19. Таблица Лотара МейераВ 1864 г. немецкий химик
- 20. Периодический закон и периодическая система химических элементов Д.И. Менделеев, 1869г. Создание учебника «Основы химии»
- 21. Периодический закон«Свойства простых тел, а также формы
- 22. Периодическая система химических элементов Д.И. Менделеева (1873 г.)
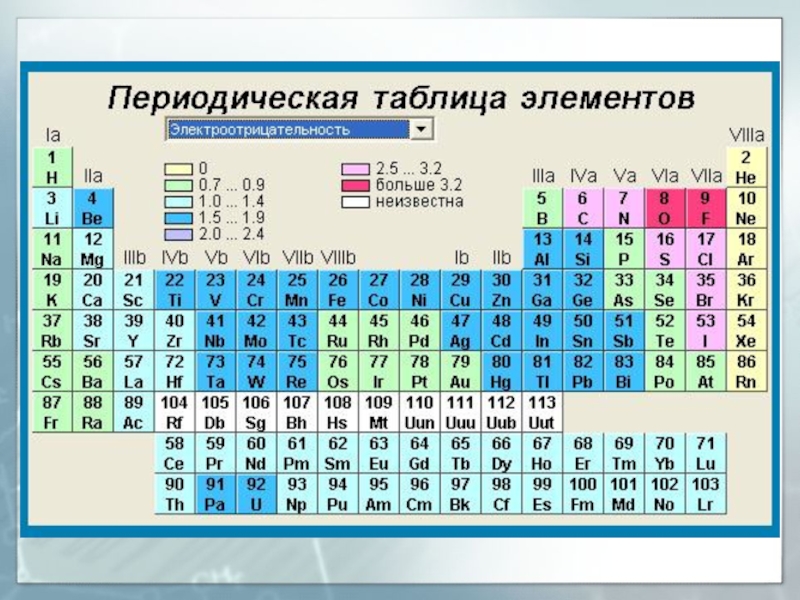
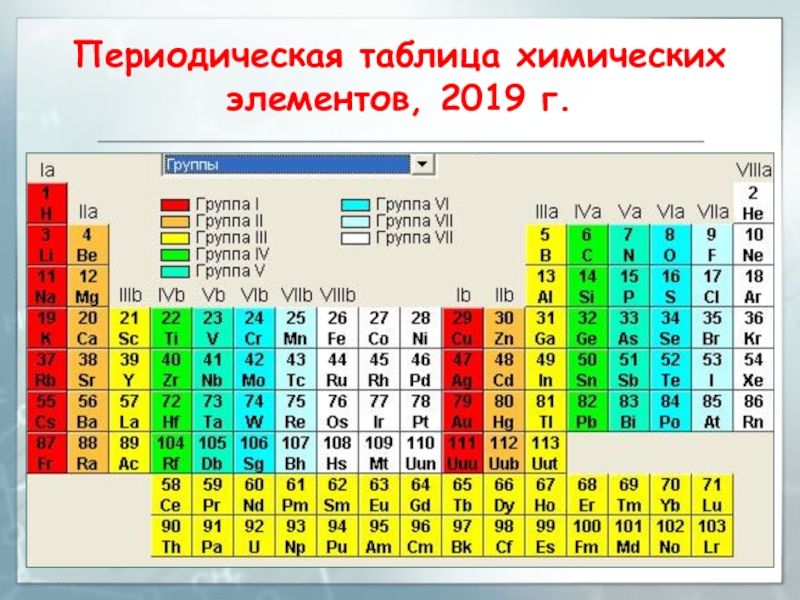
- 23. Периодическая таблица химических элементов, 2019 г.
- 24. Атомные массы и периодическая система химических элементов
- 25. Атомная орбиталь (АО) область наиболее вероятного пребывания электрона (электронное облако) в электрическом поле ядра атома.
- 26. Типы атомных орбиталейПоложение элемента в Периодической системе
- 27. Форма и энергия атомных орбиталейАтомные орбитали s-типа
- 28. Форма и энергия атомных орбиталейр-орбитали имеют форму
- 29. В элементах второго периода электроны занимают пять
- 30. Заполнение атомных орбиталей электронамиПринцип устойчивости АО заполняются
- 31. Принцип устойчивости
- 32. Заполнение атомных орбиталей электронамиПринцип Паули На одной
- 33. Заполнение атомных орбиталей электронамиПравило Хунда (Гунда) На
- 34. Слайд 34
- 35. Квантовые числа энергетические параметры, определяющие состояние электрона
- 36. Квантовые числа Главное квaнтовое число n определяет
- 37. Квантовые числа Орбитальное (побочное или азимутальное) квантовое
- 38. Квантовые числа Магнитное квантовое число m определяет
- 39. Квантовые числа Спиновое квантовое число s может
- 40. Правило Клечковского (правило n + l
- 41. Магнитные свойстваАтомы или ионы, имеющие только спаренные
- 42. Магнитные свойстваАтомы или ионы, имеющие один или
- 43. Энергия ионизации Энергия (потенциал) ионизации атома Ei -
- 44. Сродство к электронуСродство атома к электрону Ee
- 45. Электроотрицательность(абсолютная электроотрицательность)Лайнус-Карл ПОЛИНГ (28.02.1901 – 19.08.1994)
- 46. Предсказание химических элементовМенделеев оставил в таблице пустые
- 47. Физический смысл порядкового номера элементаА.И. Ван ден
- 48. Периодический закон сегодня:"Свойства химических элементов, а также
- 49. Структура периодической системы элементовПериодическая система химических элементов
- 50. Слайд 50
- 51. Слайд 51
- 52. Слайд 52
- 53. Период и группаПериод – горизонтальная последовательность элементов,
- 54. Слайд 54
- 55. Слайд 55
- 56. ПериодичностьПериодичность – это повторяемость свойств химических и
- 57. Вертикальная периодичностьОбусловливает объединение элементов в группы элементы
- 58. Горизонтальная периодичностьГоризонтальная периодичность заключается в появлении максимальных
- 59. Горизонтальная периодичность
- 60. Диагональная периодичностьПовторяемость свойств простых веществ и соединений
- 61. Диагональная периодичностьПримеры: литий похож по свойствам на
- 62. Звездная периодичностьПример: свойства германия напоминают свойства его
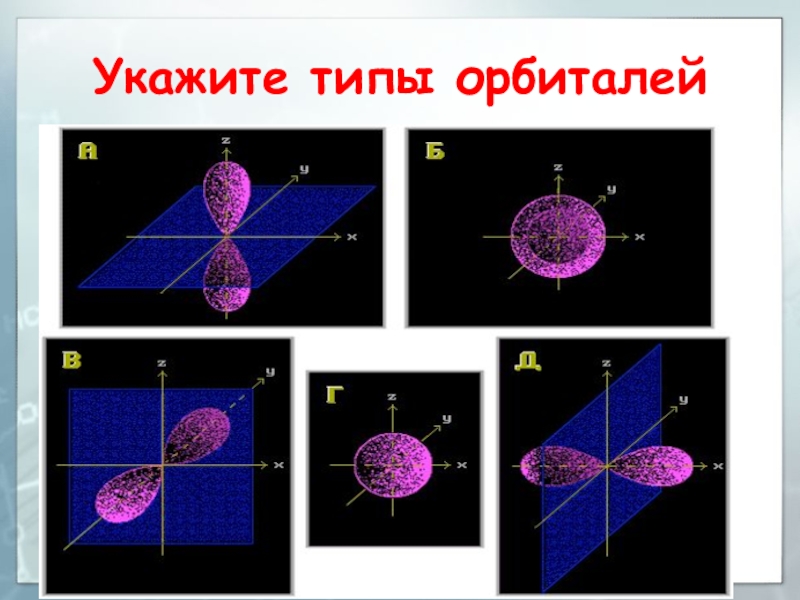
- 63. Укажите типы орбиталей
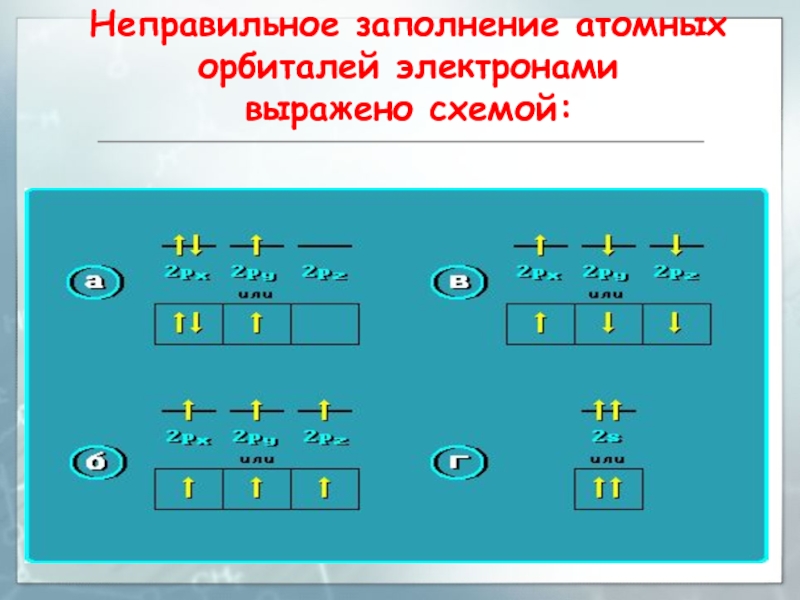
- 64. Неправильное заполнение атомных орбиталей электронами выражено схемой:
- 65. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Химические вещества и материалы в индустрии красоты
Лекция 1. Периодический закон
и периодическая система химических элементов
ВалерьевичСлайд 2Структура курса
Тема-1
Тема-10
Тема-2
Тема-3
Тесты и задания
в системе Forlabs
Практика, семинары
Рабочая тетрадь
Экзамен (зачет)
Экзамен
(зачет)
Контрольные работа
…..
Слайд 3Темы курса
Тема 1 – Общая и неорганическая химия
Тема 2 –
Элементы периодической системы Д.И. Менделеева. Металлы и неметаллы
Тема 3 –
Основы органической химии. Теория строения органических соединенийТема 4 - Биохимия. Биологически активные вещества
Тема 5 - Состав парфюмерных средств
Тема 6 – Химические вещества и средства ухода за кожей
Слайд 4Темы курса
Тема 7– Состав средств декоративной косметики
Тема 8 – Красители,
состав средств ухода за волосами
Тема 9 – Состав средств декоративной
косметикиТема 9 – Химические вещества, состав вспомогательных веществ
Практика, семинары - решение задач, контрольные работы, рабочая тетрадь
Слайд 5Оценка по курсу
Тема-1
Тема-5
Практика
Рабочая тетрадь
Экзамен
(зачёт)
30%
20%
20%
20%
После прохождения всего курса компьютер выведет
среднюю оценку
Т-1 …
Т-5
ПР
ПТ
Э-З
(самостоятельная работа) (во время
семестра) Контрольные
10%
КР
Слайд 10Продукты оргсинтеза
Этиловый спирт
Красители
Взрывчатые вещества
В настоящее время известно более 1 750
000 органических веществ,
неорганических веществ – около 50 000.
Слайд 12Косметическая химия
(от греч. κοσμητική – искусство украшать)
наука о строении
и свойствах веществ, используемых в косметических целях,
наука о способах
получения косметических средств и о их влиянии на кожу, волосы, ногти человека. Слайд 13Косметическая химия
развивалась вместе с накоплением сведений о лекарствах и лекарственных
растениях, вместе с развитием медицины, химии и физики.
Прикладной задачей косметической
химии является создание и производство косметических средствСлайд 15Ряды Рихтера и триады Дёберейнера
Немецкий химик И.В. Рихтер в
1793 г. расположил металлы, обладающие близкими свойствами (натрий и калий;
магний, кальций, стронций и барий) в ряд по возрастанию их атомных масс.В 1817 году немецкий химик И.В. Дёберейнер обнаружил, триады сходных по свойствам элементов: кальций – стронций – барий, литий - натрий - калий; сера - селен - теллур и хлор - бром - иод.
Слайд 16Группы элементов Гесса
В изданном в 1849 г. учебнике "Основания чистой
химии", российский химик Г.И. Гесс рассмотрел группы элементов-неметаллов: углерод −
бор − кремний; азот − фосфор − мышьяк; сера − селен − теллур и хлор − бром − иод.Считается, что именно Гесс впервые ввел в употребление понятие "группа элементов".
Герман Иванович ГЕСС (7.08.1802 - 12.12.1850)
Слайд 17Спираль Шанкуртуа или «теллурический винт»
В 1862 году французский ученый А.
Бегье де Шанкуртуа сгруппировал элементы по спирали вокруг цилиндра в
порядке возрастания атомных масс.В спирали Шанкуртуа сходные по химическим свойствам элементы расположены на образующей цилиндра, на который навертывается «спираль».
БЕГЬЕ ДЕ ШАНКУРТУА Александр-Эмиль (1819-1886)
Слайд 18Закон октав
В 1865 г. американский химик Дж. Ньюлендс предложил "закон
октав".
В таблице Ньюлендса близкие по свойствам элементы повторялись через
семь номеров.Дж. Ньюлендс впервые употребил термин «порядковый номер элемента».
Джон-Александер-Рейна НЬЮЛЕНДС (26.09.1837-29.07.1898)
1.H 8.F 15.Cl 22.Co,Ni
2.Li 9.Na 16.K 23.Rb,Cs
3.Be 10.Mg 17.Ca 24.Zn
4.B 11.Al 18.Cr 25.Y
5.C 12.Si 19.Ti 26.In
6.N 13.P 20.Mn 27.As
7.O 14.S 21.Fe 28.Se
Слайд 19Таблица Лотара Мейера
В 1864 г. немецкий химик Л.Ю. Мейер в
книге "Современные теории химии и их значения для химической статики"
опубликовал таблицу, где химические элементы были расположены в порядке увеличения их атомных масс.В эту таблицу Мейер поместил 27 элементов.
Лотар-Юлиус МЕЙЕР (19.08.1830 - 11.04.1895)
Слайд 20Периодический закон и периодическая система химических элементов
Д.И. Менделеев, 1869г.
Создание учебника «Основы химии»
Слайд 21Периодический закон
«Свойства простых тел, а также формы и свойства соединений
элементов находятся в периодической зависимости (или, выражаясь алгебраически, образуют периодическую
функцию) от величины атомных весов элементов».МЕНДЕЛЕЕВ Дмитрий Иванович (8.02.1834 - 2.02.1907)
Слайд 24Атомные массы и периодическая система химических элементов
Менделеев учитывал, что
для некоторых элементов атомные массы могли быть определены неточно (пример
– бериллий).Исключения в порядке возрастания масс атомов с ростом атомного номера (особенности изотопного состава элементов):
Cl − 35,5 Ar − 39,9 K − 39,1
Fe − 55,8 Co − 58,9 Ni − 58,7
Sb − 121,8 Te − 127,6 I − 126,9
Слайд 25Атомная орбиталь (АО)
область наиболее вероятного пребывания электрона (электронное облако)
в электрическом поле ядра атома.
Слайд 26Типы атомных орбиталей
Положение элемента в Периодической системе определяет тип орбиталей
его атомов (s-, p-, d-, f-), различающихся энергией, формой, размерами
и пространственной направленностьюСлайд 27Форма и энергия атомных орбиталей
Атомные орбитали s-типа имеют форму сферы:
Объем
сферы увеличивается с ростом энергетического уровня: 1s < 2s
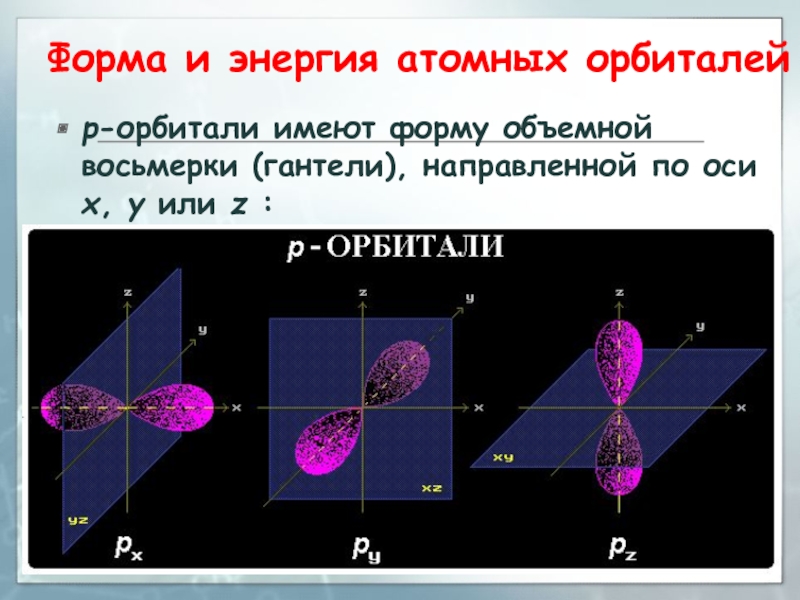
3sСлайд 28Форма и энергия атомных орбиталей
р-орбитали имеют форму объемной восьмерки (гантели),
направленной по оси x, y или z :
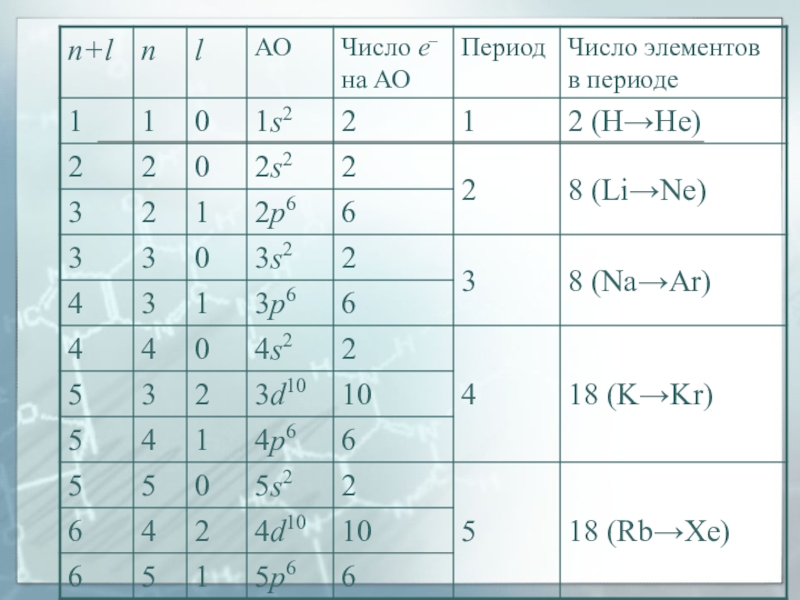
Слайд 29В элементах второго периода электроны занимают пять АО на двух
энергетических уровнях:
первый уровень 1s;
второй уровень - 2s, 2px,
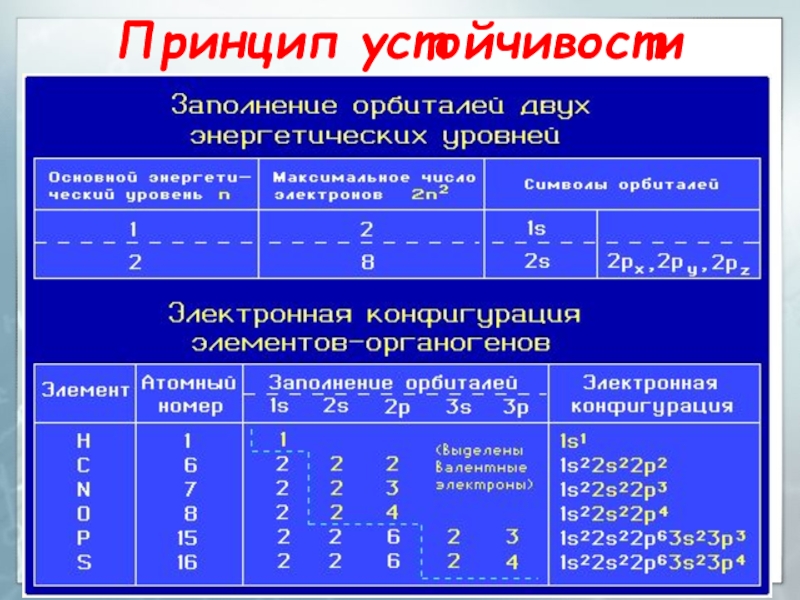
2py, 2pz. (цифры обозначают номер энергетического уровня, буквы - форму орбитали)Слайд 30Заполнение атомных орбиталей электронами
Принцип устойчивости
АО заполняются электронами в порядке
повышения их энергетических уровней:
1s < 2s < 2p
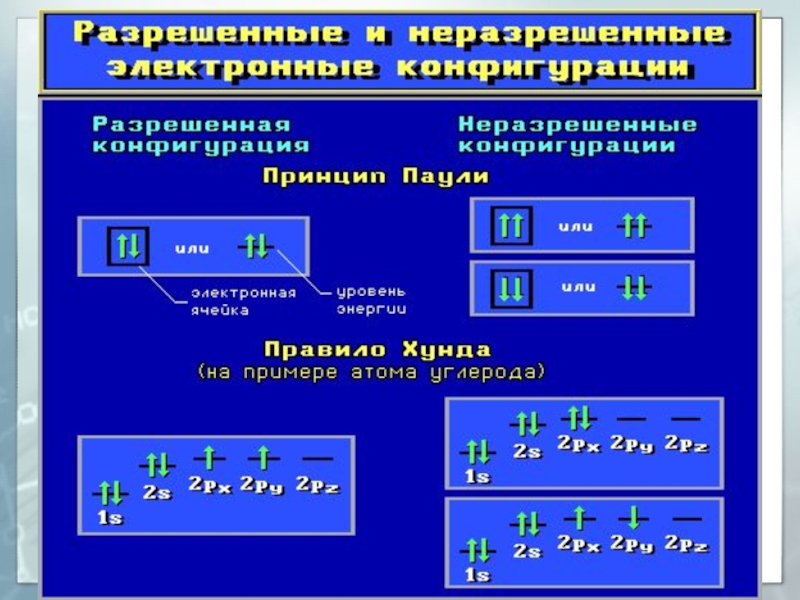
3s < 3p < 4s < 3d …Слайд 32Заполнение атомных орбиталей электронами
Принцип Паули
На одной АО могут находиться
не более двух электронов с противоположными спинами.
Слайд 33Заполнение атомных орбиталей электронами
Правило Хунда (Гунда)
На АО с одинаковой
энергией, так называемых вырожденных орбиталях, электроны стремятся расположиться по одному
с параллельными спинами.Слайд 35Квантовые числа
энергетические параметры, определяющие состояние электрона и тип атомной
орбитали, на которой он находится:
1. n - главное квaнтовое
число2. l – орбитальное квантовое число
3. m - магнитное квантовое число
4. s - спиновое квантовое число
Слайд 36Квантовые числа
Главное квaнтовое число n определяет общую энергию электрона
и степень его удаления от ядра (номер энергетического уровня);
оно
принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .) Слайд 37Квантовые числа
Орбитальное (побочное или азимутальное) квантовое число l определяет
форму атомной орбитали.
Оно может принимать целочисленные значения от 0
до n-1 (l = 0, 1, 2, 3,..., n-1).Каждому значению l соответствует орбиталь особой формы.
l = 0 называются s-орбиталями, l =1 - р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 - d-орбиталями (5 типов), l = 3 - f-орбиталями (7 типов).
Слайд 38Квантовые числа
Магнитное квантовое число m определяет направление орбитали в
пространстве.
Его значения изменяются от +l до - l, включая
0. например, при l = 1 число m принимает 3 значения: +1, 0, -1,
поэтому существуют 3 типа р-АО: px, py, pz.
Слайд 39Квантовые числа
Спиновое квантовое число s может принимать лишь два
возможных значения +1/2 и -1/2.
Они соответствуют двум возможным и
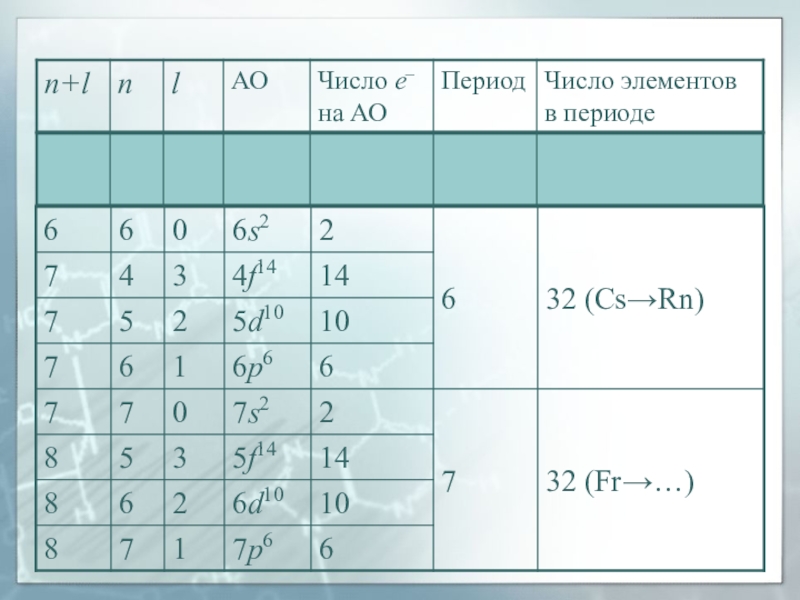
противоположным друг другу направлениям собственного магнитного момента электронаСлайд 40Правило Клечковского
(правило n + l )
Заселение электронами энергетических уровней
и подуровней в нейтральных атомах в основном состоянии происходит с
увеличением порядкового номера элемента в порядке увеличения суммы главного и орбитального квантовых чисел (n + l), а при одинаковом значении (n + l) − в порядке увеличения главного квантового числа n.Слайд 41Магнитные свойства
Атомы или ионы, имеющие только спаренные электроны, выталкиваются из
магнитного поля (они диамагнитны).
Примеры: He – 1s2
Be – 1s22s2
F–
– 1s22s22p6Al3+ – 1s22s22p63s03p0
Слайд 42Магнитные свойства
Атомы или ионы, имеющие один или несколько неспаренных электронов,
втягиваются в магнитное поле (они парамагнитны).
Примеры: 1H – 1s1
3Li
– 1s22s17N – 1s22s22p3
24Cr – [Ar]4s13d 5
Слайд 43Энергия ионизации
Энергия (потенциал) ионизации атома Ei - минимальная энергия, необходимая
для удаления электрона из атома:
Х = Х+ + е−;
Ei Значения Ei (кДж/моль):
H 1312,1
K 418,7 F 1680,8 He 2372
Rb 403,0 Cl 1255,5 Ne 2080
Cs 375,7 Br 1142,6 Ar 1520
Слайд 44Сродство к электрону
Сродство атома к электрону Ee – способность атомов
присоединять добавочный электрон и превращаться в отрицательный ион.
Мерой сродства
к электрону служит энергия, выделяющая или поглощающаяся при этом:
Х + е− = Х− ; Ee Значения Ee (кДж/моль)
F −345,7
Cl −366,7
Br −341,6
Слайд 45Электроотрицательность
(абсолютная электроотрицательность)
Лайнус-Карл ПОЛИНГ
(28.02.1901 – 19.08.1994)
Слайд 46Предсказание химических элементов
Менделеев оставил в таблице пустые места для не
открытых элементов (экабор, экаалюминий, экасилиций, экамарганец и двимарганец),
были заполнены
в последующие десятилетия (элементы скандий, галлий, германий и др.)Слайд 47Физический смысл порядкового номера элемента
А.И. Ван ден Брук (1870-1926) предположил,
что "каждому элементу должен соответствовать внутренний заряд, соответствующий его порядковому
номеру".В 1913 г. это подтвердил Г. Мозли (1887-1915) своими рентгеноспектральными исследованиями.
В 1920 г. Дж. Чедвик (1891-1974) экспериментально определил заряды ядер атомов меди, серебра и платины. Было установлено, что порядковый номер элемента совпадает с зарядом его ядра.
Слайд 48Периодический закон сегодня:
"Свойства химических элементов, а также образуемых ими простых
и сложных веществ находятся в периодической зависимости от заряда ядра".
Заряд ядра атома определяет число электронов.
Электроны заселяют атомные орбитали таким образом, что строение внешней электронной оболочки периодически повторяется.
Это выражается в периодическом изменении химических свойств элементов и их соединений.
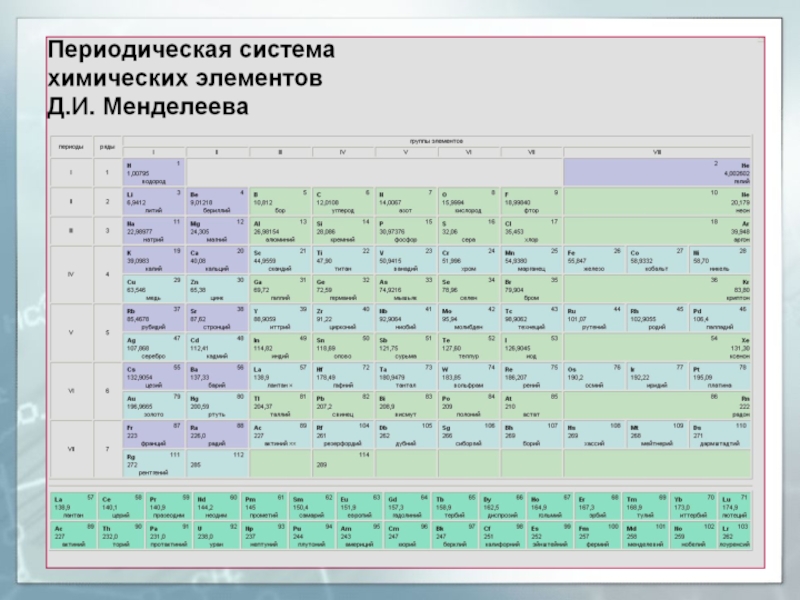
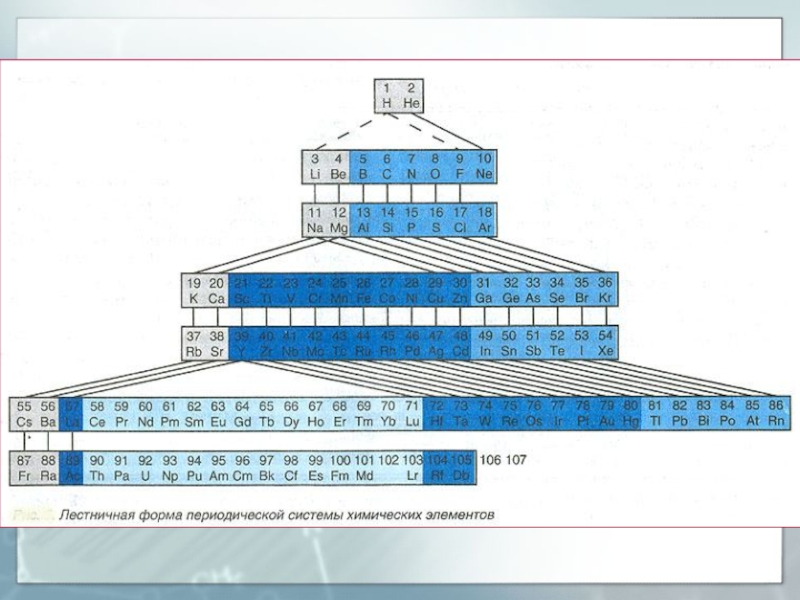
Слайд 49Структура периодической системы элементов
Периодическая система химических элементов - классификация химических
элементов, являющаяся табличным выражением периодического закона
Прообразом Периодической системы химических элементов
послужила таблица, составленная Д.И. Менделеевым 1 марта 1869 г.В 1870 г. Менделеев назвал систему естественной, а в 1871 г. - периодической.
Формы периодической таблицы: короткопериодная, длиннопериодная, лестничная
Слайд 53Период и группа
Период – горизонтальная последовательность элементов, начинающаяся со щелочного
металла и заканчивающаяся благородным газом; главное квантовое число n, равное
номеру периода и характеризующее внешний энергетический уровень, у всех элементов периода одинаково.Группа элементов (в длиннопериодном варианте) – вертикальная совокупность элементов, обладающих однотипной электронной конфигурацией и определенным химическим сходством.
Слайд 56Периодичность
Периодичность – это повторяемость свойств химических и физических свойств элементов
и их соединений по определенному направлению, при скачкообразном изменении порядкового
номера элементов.Виды периодичности: вертикальная, горизонтальная, диагональная, звездная.
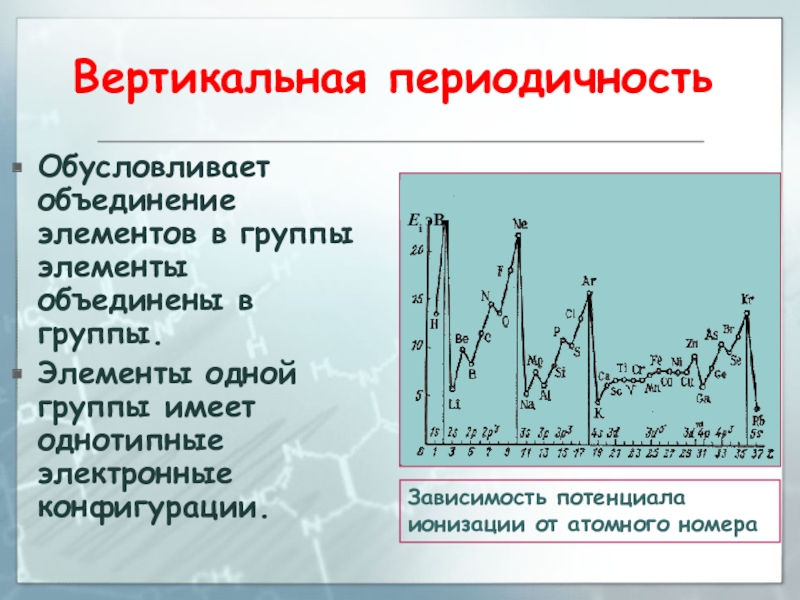
Слайд 57Вертикальная периодичность
Обусловливает объединение элементов в группы элементы объединены в группы.
Элементы
одной группы имеет однотипные электронные конфигурации.
Зависимость потенциала ионизации от
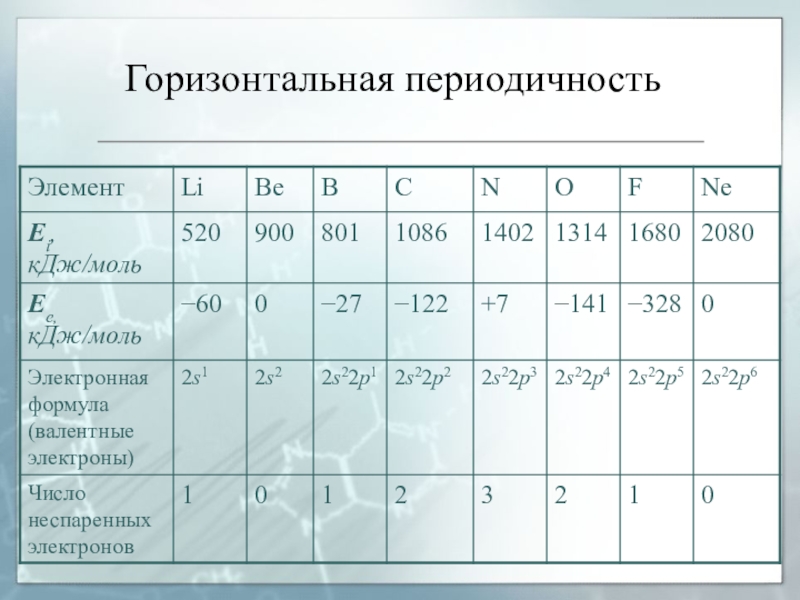
атомного номераСлайд 58Горизонтальная периодичность
Горизонтальная периодичность заключается в появлении максимальных и минимальных значений
свойств простых веществ и соединений в пределах каждого периода.
Слайд 60Диагональная периодичность
Повторяемость свойств простых веществ и соединений по диагоналям Периодической
системы;
связана с возрастанием неметаллических свойств в периодах слева направо
и в группах снизу вверх. Слайд 61Диагональная периодичность
Примеры: литий похож по свойствам на магний, бериллий на
алюминий, бор на кремний, углерод на фосфор.
Бериллий и алюминий
имеют сходные значения окислительно-восстановительных потенциалов. Бор и кремний образуют летучие, реакционноспособные молекулярные гидриды.