Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химия элементов. Лекция 2
Содержание
- 1. Химия элементов. Лекция 2
- 2. Sn, PbАллотропия олова:-Sn (порошок)13,2 °С -Sn (металл)-Sn 173 °С расплав232 °С
- 3. Sn, Pb Cплавыприпой (30-70)% Sn, Pbбронза Cu+Sn,
- 4. Получение металловSnO2(т) + C(т) = Sn(ж) +
- 5. ЭII Оксиды ЭОSnOPbO (устойчив: глёт, массикот)
- 6. Аквакатионы ЭII [Э(H2O)3]2+ + H2O
- 7. [Pb2+]: PbSO4 > PbCrO4 > PbS
- 8. амфотерн. с преобладанием кислотн. св-в полигидраты ЭO2.n H2O (уст. при рН
- 9. Окислительно-восстановительные свойстваSn2+ – мягкий восстановительрН < 7
- 10. Окислительно-восстановительные свойства PbO2 – сильный окислительрН <
- 11. Разделение олова и свинца (сульфидный метод)Осаждение сульфидов
- 12. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Sn, Pb
Cплавы
припой (30-70)% Sn, Pb
бронза Cu+Sn, Al, Be, Pb
баббит Sn+Sb, Cu; Pb+Sb, Cu
гарт
(типограф. сплав) 84% Pb, 11% Sb, 5% SnОлово – лужение железа (белая жесть); станиоль
Свинец – аккумуляторы, защита от радиации, хим. аппаратура
181
232
327
Эвтектика
0,65
Sn(т) – уст. на воздухе; Pb(т) – покр. оксидн. пленкой
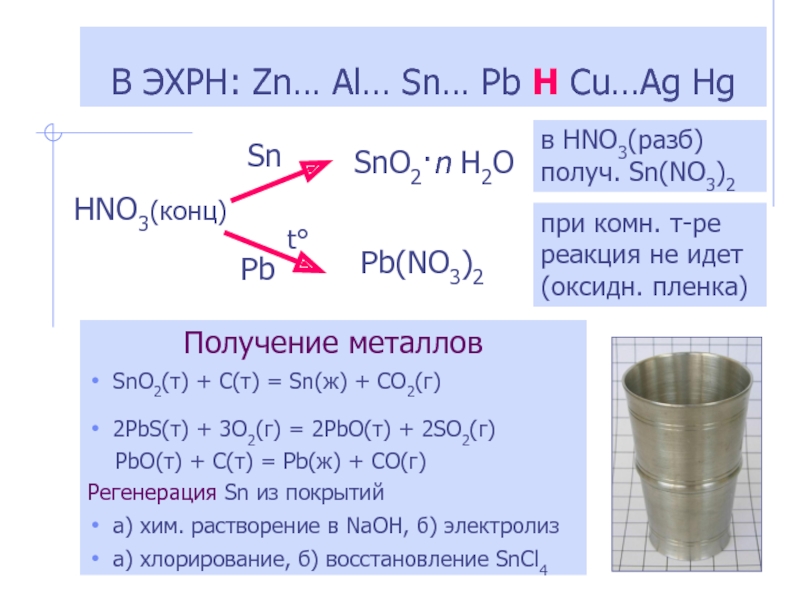
Слайд 4Получение металлов
SnO2(т) + C(т) = Sn(ж) + CO2(г)
2PbS(т) + 3O2(г)
= 2PbO(т) + 2SO2(г)
PbO(т) + C(т) = Pb(ж)
+ CO(г)Регенерация Sn из покрытий
а) хим. растворение в NaOH, б) электролиз
а) хлорирование, б) восстановление SnCl4
В ЭХРН: Zn… Al… Sn… Pb H Cu…Ag Hg
HNO3(конц)
SnO2·n H2O
Pb(NO3)2
при комн. т-ре реакция не идет (оксидн. пленка)
в HNO3(разб) получ. Sn(NO3)2
Слайд 5 ЭII Оксиды ЭО
SnO
PbO (устойчив: глёт, массикот)
Sn(OH)2(т) + 2H3O+
= [Sn(H2O)3]2+ + H2O; Sn(OH)2(т) + OH
= [Sn(OH)3]Pb(OH)2 (т) + 2H3O+ = [Pb(H2O)3]2+ + H2O; Pb(OH)2(т) + OH = [Pb(OH)3]
Гидроксиды Sn(OH)2 и Pb(OH)2 малорастворимы и амфотерны:
Устойчивость ст.ок. +II растет
Слайд 6Аквакатионы ЭII
[Э(H2O)3]2+ + H2O [Э(H2O)2(OH)]+ + H3O+
SnII –
сильный комплексообразователь (координирует ионы Cl– и др. лиганды)
гидролиз SnCl2·H2O:
[Sn(H2O)Cl2] + H2O Sn(OH)Cl(т) + H3O+ + Cl–
в присутствии HCl образуется комплекс: [Sn(H2O)Cl2] + Cl– = [SnCl3]– + H2O
для SnII: нитрат, перхлорат; Kк = 7,9·10–3 (аквакатион [Э(H2O)3]2+ уст. при рН 1)
для PbII: Kк = 7,1·10–7
Слайд 7 [Pb2+]: PbSO4 > PbCrO4 > PbS
PbSO4(т) + CrO42–
= PbCrO4(т) + SO42–
белый
желтыйPbCrO4(т) + S2– = PbS(т) + CrO42–
жёлтый черный
Растворение осадков:
PbSO4(т) + H2SO4 = Pb(HSO4)2
2PbCrO4(т) + 4HNO3 =
= 2Pb(NO3)2 + H2Cr2O7 + H2O
PbCrO4(т) + 3NaOH = Na[Pb(OH)3] + Na2CrO4
Соли SnII
Соли PbII
Слайд 8 амфотерн. с преобладанием кислотн. св-в
полигидраты ЭO2.n H2O (уст.
при рН
–2)H2OПолучение
SnCl4 + 2H2O = SnO2 + 4HCl
PbCl4 = PbCl2 + Cl2
(вода – катализатор ОВР)
ЭIV Оксиды ЭО2
SnO2 устойч.
PbO2 c. окислитель
Слайд 9Окислительно-восстановительные свойства
Sn2+ – мягкий восстановитель
рН < 7 (HCl): [SnCl3]– +
3Cl– –2e – = [SnCl6]2–;
= +0,14 B
рН >
7: [Sn(OH)3] + 3OH 2e – = [Sn(OH)6]2; = –0,96 B
Sn2+ – очень слабый окислитель (восстановители – Ti3+, Cr2+ …)
рН < 7: (HCl) [SnCl3]– + 2e – = Sn(т) + 3Cl–;
= –0,20 B
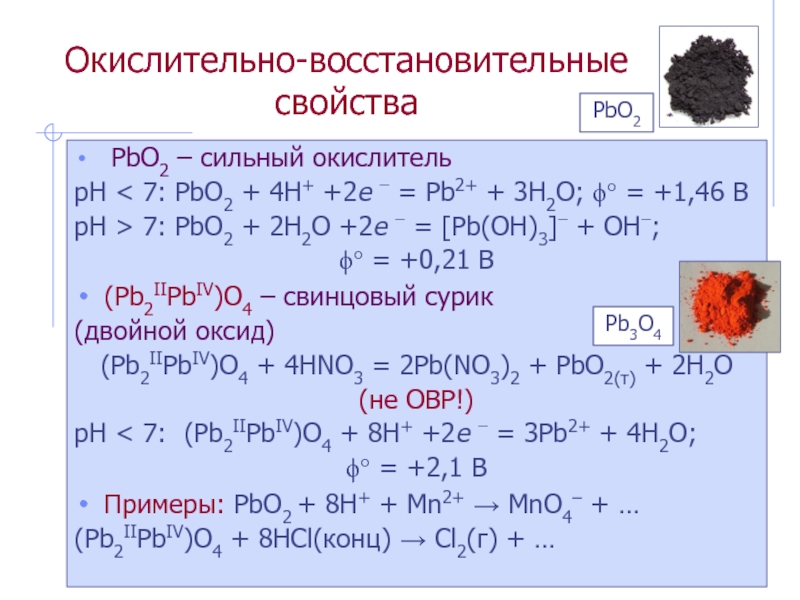
Слайд 10Окислительно-восстановительные свойства
PbO2 – сильный окислитель
рН < 7: PbO2 +
4H+ +2e = Pb2+ + 3H2O; = +1,46
BрН > 7: PbO2 + 2H2O +2e = [Pb(OH)3] + OH;
= +0,21 B
(Pb2IIPbIV)O4 – свинцовый сурик
(двойной оксид)
(Pb2IIPbIV)O4 + 4HNO3 = 2Pb(NO3)2 + PbO2(т) + 2H2O
(не ОВР!)
рН < 7: (Pb2IIPbIV)O4 + 8H+ +2e = 3Pb2+ + 4H2O;
= +2,1 B
Примеры: PbO2 + 8H+ + Mn2+ MnO4– + …
(Pb2IIPbIV)O4 + 8HCl(конц) Cl2(г) + …
Слайд 11Разделение олова и свинца (сульфидный метод)
Осаждение сульфидов (+H2S):
SnS(т)
PbS(т)
2. Растворение сульфида, образование Na2[SnS3] (тиокомплекс)
Na2S2: S–I +1e
– = S–IISnS [SnS3]2– :
Sn+II –2e – = Sn+IV
3. Осаждение [SnS3]2– + 2H+ SnS2(т) + H2S
+Na2S2
+ HCl



![Химия элементов. Лекция 2 ЭII Оксиды ЭОSnOPbO (устойчив: глёт, массикот) Sn(OH)2(т) + 2H3O+ = [Sn(H2O)3]2+ ЭII Оксиды ЭОSnOPbO (устойчив: глёт, массикот) Sn(OH)2(т) + 2H3O+ = [Sn(H2O)3]2+ + H2O;](/img/thumbs/b8d7b9d0220a4f7dedbd321d3f4f1b67-800x.jpg)
![Химия элементов. Лекция 2 Аквакатионы ЭII [Э(H2O)3]2+ + H2O [Э(H2O)2(OH)]+ + H3O+SnII – сильный Аквакатионы ЭII [Э(H2O)3]2+ + H2O [Э(H2O)2(OH)]+ + H3O+SnII – сильный комплексообразователь (координирует ионы Cl– и](/img/thumbs/fd411b6c8e3837aff5e884a88f0d09f3-800x.jpg)
![Химия элементов. Лекция 2 [Pb2+]: PbSO4 > PbCrO4 > PbS PbSO4(т) + CrO42– = [Pb2+]: PbSO4 > PbCrO4 > PbS PbSO4(т) + CrO42– = PbCrO4(т) + SO42– белый](/img/thumbs/0c3d0375a309518933b2a4493e186550-800x.jpg)

![Химия элементов. Лекция 2 Окислительно-восстановительные свойстваSn2+ – мягкий восстановительрН < 7 (HCl): [SnCl3]– + 3Cl– Окислительно-восстановительные свойстваSn2+ – мягкий восстановительрН < 7 (HCl): [SnCl3]– + 3Cl– –2e – = [SnCl6]2–; =](/img/thumbs/af154b988ef6cc923afc373694a70f13-800x.jpg)
![Химия элементов. Лекция 2 Разделение олова и свинца (сульфидный метод)Осаждение сульфидов (+H2S):SnS(т) PbS(т)2. Разделение олова и свинца (сульфидный метод)Осаждение сульфидов (+H2S):SnS(т) PbS(т)2. Растворение сульфида, образование Na2[SnS3]](/img/tmb/3/275333/6c806b3bc6f575fb973cb78ad6113323-800x.jpg)



















