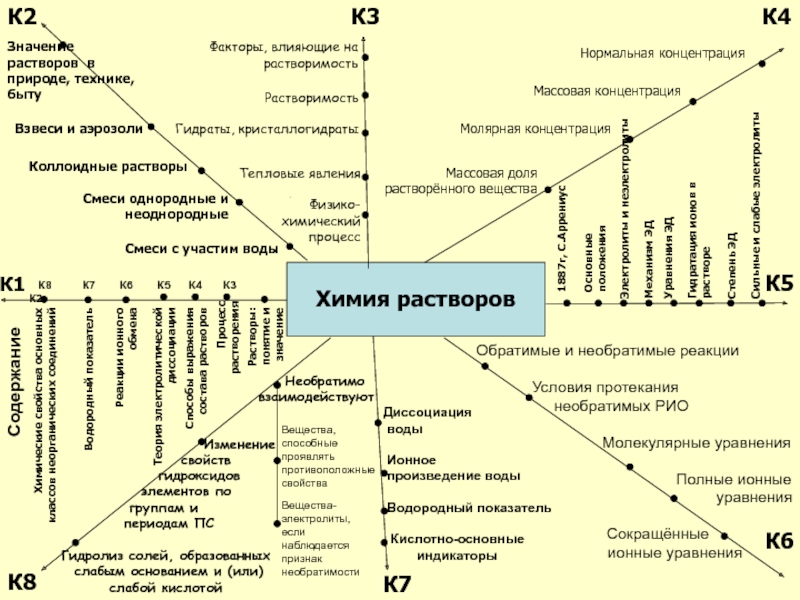
Слайд 1Химия растворов
К2
К3
К4
К1
К5
К6
К8
Содержание
Массовая доля
растворённого вещества
Водородный показатель
Растворы: понятие и значение
Способы выражения
состава растворов
К8 К7
К6 К5 К4 К3 К2
Смеси с участим воды
Взвеси и аэрозоли
Тепловые явления
Физико-химический процесс
Растворимость
Гидраты, кристаллогидраты
Факторы, влияющие на растворимость
Химические свойства основных
классов неорганических соединений
К7
Молярная концентрация
Массовая концентрация
Процесс растворения
Реакции ионного обмена
Теория электролитической диссоциации
Обратимые и необратимые реакции
Условия протекания
необратимых РИО
Молекулярные уравнения
Полные ионные уравнения
Сокращённые
ионные уравнения
Диссоциация
воды
Ионное
произведение воды
Водородный показатель
Кислотно-основные
индикаторы
Необратимо взаимодействуют
Изменение
свойств
гидроксидов
элементов по
группам и
периодам ПС
Смеси однородные и неоднородные
Коллоидные растворы
1887г, С.Аррениус
Основные положения
Уравнения ЭД
Гидратация ионов в растворе
Значение растворов в природе, технике, быту
Нормальная концентрация
Электролиты и неэлектролиты
Механизм ЭД
Степень ЭД
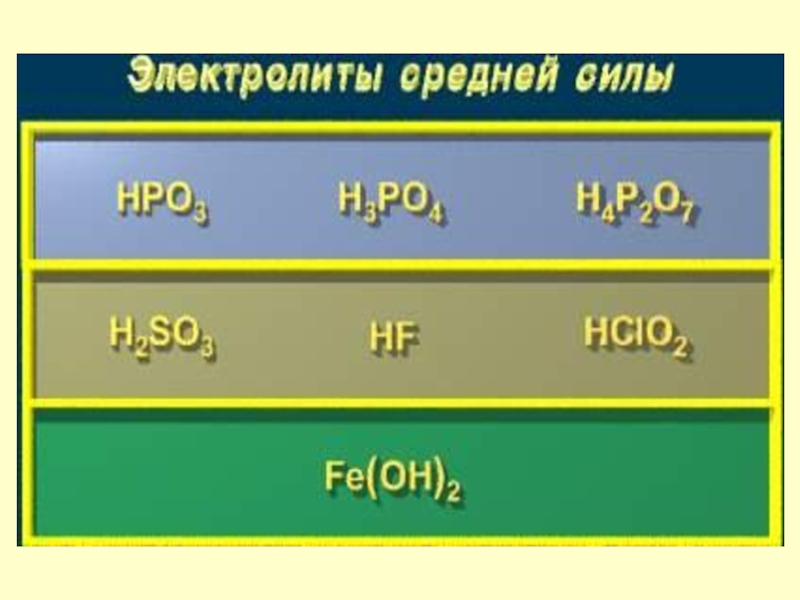
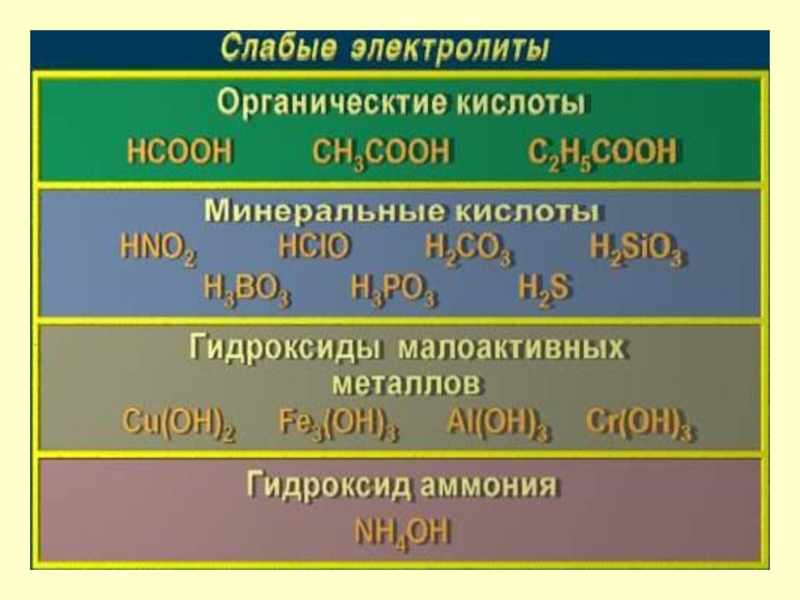
Сильные и слабые электролиты
Вещества, способные проявлять противоположные свойства
Вещества-электролиты, если наблюдается признак необратимости
Гидролиз солей, образованных
слабым основанием и (или)
слабой кислотой
Слайд 2Процесс растворения
Современная теория растворов
Растворение – физико-химический процесс.
Раствор – однородная система
переменного состава, состоящая из частиц растворенного вещества, растворителя и продуктов
их взаимодействия.
Слайд 3Процессы в растворах:
электролитическая диссоциация (ЭД)
Слайд 4Шведский ученый Сванте Аррениус(1859-1927)
В 1887 году создал теорию ЭД.
В
1903 году был удостоен Нобелевской премии
"За чрезвычайные заслуги в
развитии химии".
Слайд 5Каблуков И.А.
Кистяковский В.А.
Слайд 6 Русские химики И.А.Каблуков и В.А.Кистяковский применили к объяснению электролитической диссоциации
химическую теорию растворов Д.И.Менделеева и доказали, что при растворении электролита
происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы.
Слайд 7Вещества
Электролиты
- вещества, растворы и расплавы которых не проводят электрический
ток.
Неэлектролиты
- вещества, растворы и расплавы которых не проводят
электрический ток.
Слайд 8Электролиты
Вещества, которые содержат ионные и ковалентные полярные связи. Эти
связи легко распадаются на ионы.
Неорганические кислоты, основания, соли.
Слайд 9Неэлектролиты
вещества, которые содержат ковалентные неполярные или малополярные связи. Эти
связи не распадаются на ионы.
газы, твердые вещества (неметаллы), органические
соединения (сахароза, бензин, спирт).
Слайд 10Электролитическая диссоциация – процесс распада электролита на ионы при растворении
его в воде или расплавлении
Слайд 11Причины распада вещества на ионы в расплавах
Нагревание усиливает колебания
ионов в узлах кристаллической решётки -кристаллическая решётка разрушается.
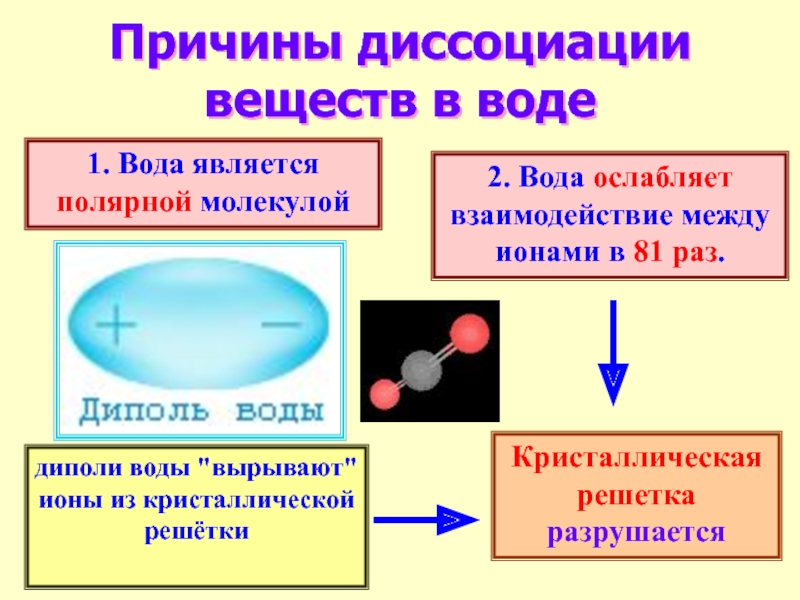
Слайд 12Причины диссоциации веществ в воде
1. Вода является полярной молекулой
2. Вода ослабляет взаимодействие между ионами в 81 раз.
диполи
воды "вырывают" ионы из кристаллической решётки
Кристаллическая решетка разрушается
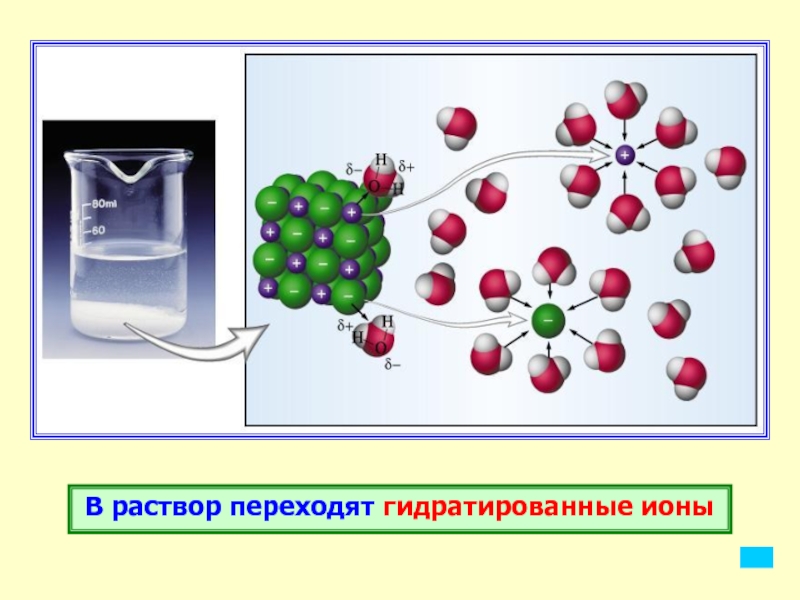
Слайд 13В раствор переходят гидратированные ионы
Слайд 14Образование в результате распада электролитов гидратированных ионов отражается при написании
уравнений диссоциации, однако, чаще эти уравнения записывают в более короткой
форме
Слайд 15Основные положения
теории ЭД
5. Свойства ионов резко отличаются от
свойств
нейтральных атомов
составляющих их элементов. Ионы в
водных растворах гидратированы.
Слайд 16Схема диссоциации полярной молекулы хлороводорода
ориентация диполей воды вокруг полярной
молекулы.
еще большая поляризация полярной молекулы и превращение полярной связи ее
в ионную.
образование свободных гидратированных ионов.
Слайд 17Диссоциация оснований
Основания –
при диссоциации образуют катионы металла и анионы
- гидроксид-ионы.
Ba(OH)2 = Ba2+ + 2OH-
Сa(OH)2 = Сa2+
+ 2OH-
Слайд 18Диссоциация кислот
Кислоты - при диссоциации образуют
катионы водорода и анионы
кислотного
остатка.
осуществляется ступенчато. На каждой ступени отщепляется один ион
водорода.
H Cl = H+ + Cl -
- H2SO4 = H+ + HSO4- (I ступень)
HSO4- = H+ + SO42- (II ступень)
Слайд 19Диссоциация солей
Средние соли – соли, состоящие из атомов металла и
кислотного остатка, диссоциируют в одну ступень:
CaCl2 = Ca2+
+ 2Cl-
KBr = K+ + Br-
NaCl = Na+ + Cl-
Слайд 20Диссоциация солей
Кислые соли – соли, в состав молекул которых кроме
атомов металла входят атомы водорода, распадаются ступенчато. Сначала отрываются все
атомы металла, а затем атомы водорода.
KHCO3 = K+ + HCO3−
HCO3− = H+ + CO32-
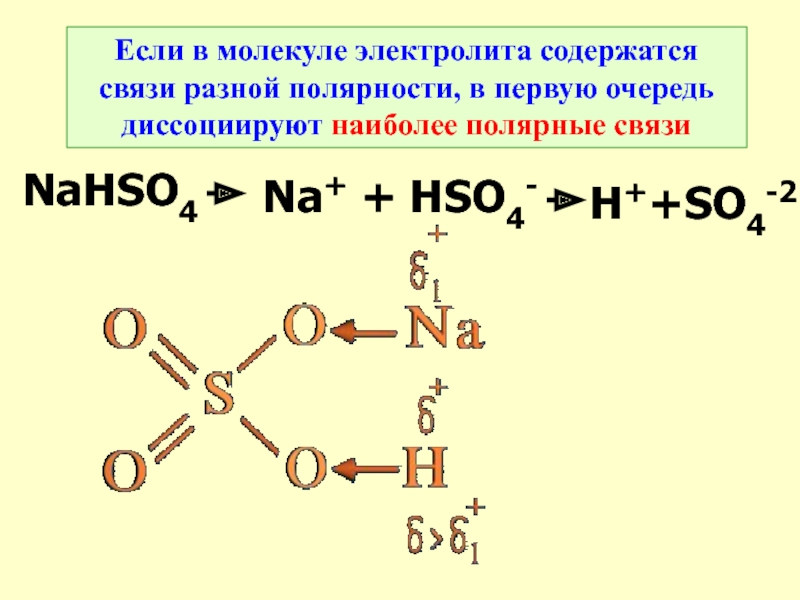
Слайд 21Если в молекуле электролита содержатся связи разной полярности, в первую
очередь диссоциируют наиболее полярные связи
NaHSO4
Na+ + HSO4-
H++SO4-2
Слайд 22Основные положения
теории ЭД
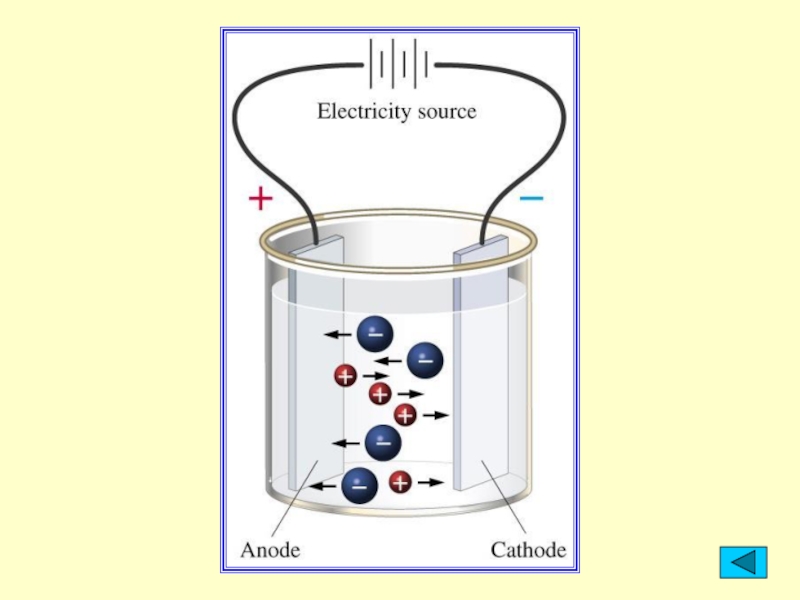
2. Беспорядочное движение ионов в растворе под
действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся
к электроду с отрицательным зарядом (катоду), а анионы – к аноду.
Слайд 24Степень диссоциации
Степень диссоциации (α) - отношение числа распавшихся на ионы
молекул (n) к общему числу растворенных молекул (N):
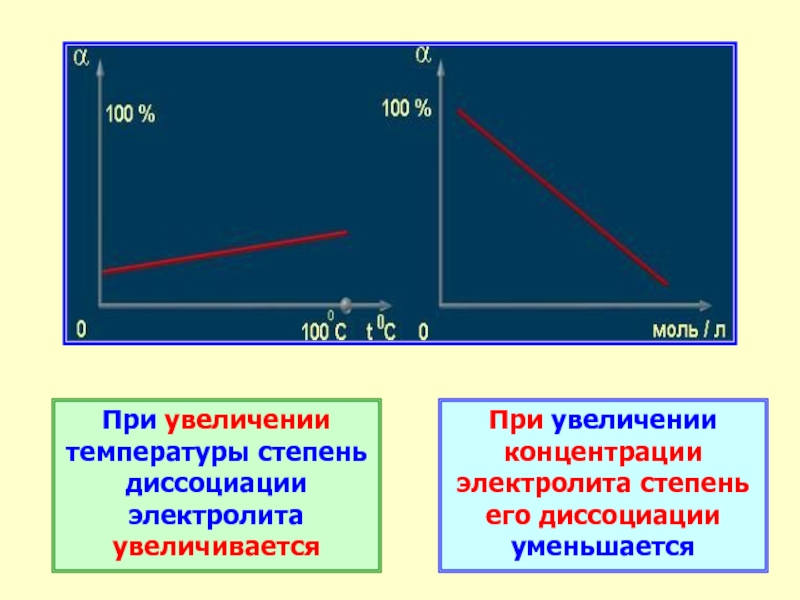
Слайд 25При увеличении температуры степень диссоциации электролита увеличивается
При увеличении концентрации электролита
степень его диссоциации уменьшается
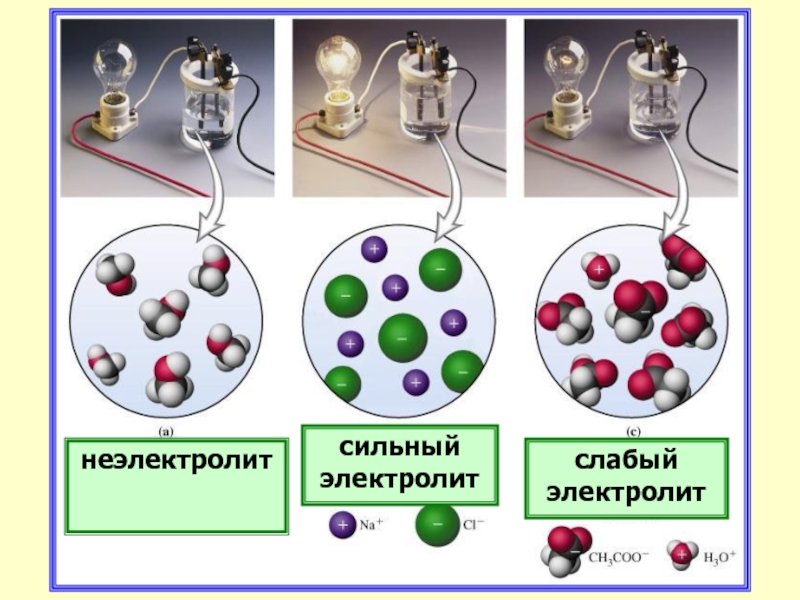
Слайд 26Электролиты
Сильные
- при растворении
в воде практически
полностью
распадаются
на
ионы.
Слабые
частично
распадаются на
ионы. Их растворы
содержат
ионы и
нераспавшиеся
молекулы, поэтому
концентрация ионов
мала.
Слайд 28неэлектролит
сильный электролит
слабый электролит
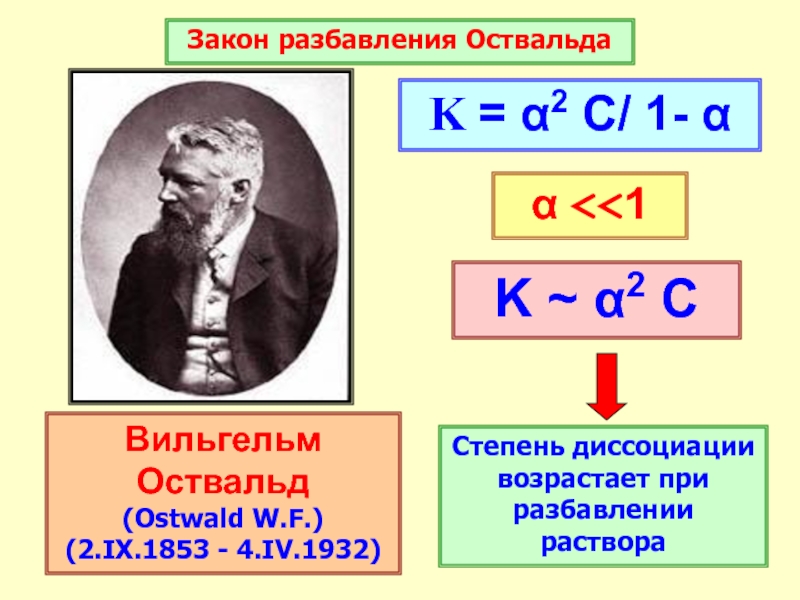
Слайд 32Константа диссоциации
Характеризует способность слабого
электролита распадаться на ионы
Слайд 33Вильгельм Оствальд
(Ostwald W.F.)
(2.IX.1853 - 4.IV.1932)
Закон разбавления Оствальда
K ~ α2 C
Степень
диссоциации возрастает при разбавлении раствора
K = α2 C/ 1- α
α
<<1
Слайд 34Пример 9.1. Степень диссоциации муравьиной кислоты НСООН в 0,2 н. растворе
равна 0,03. Определить константу диссоциации кислоты.
Решение:
Воспользуемся выражением закона разбавления Оствальда:
K = α2 C / (1- α)
В это выражение вместо СМ можно поставить нормальную концентрацию, поскольку муравьиная кислота относится к одноосновным кислотам.
Ответ: К= 1,86*10-4.
Слайд 35Константа диссоциации воды
Поскольку Kд(Н2О) очень мало, то концентрацию недиссоциированной воды
в знаменателе этого выражения можно считать равной ее общей концентрации
и тогда произведение [Н+]*[ОН-] тоже будет постоянной величиной, которая получила название ионного произведения воды.
В чистой воде при комнатной температуре концентрации ионов водорода и гидроксид-ионов одинаковы и равны 10-7 моль/л.
Это значит, что [Н+]*[ОН-] = 10-14.
Слайд 36Вместо концентраций ионов водорода и гидроксид-ионов на практике чаще пользуются
водородным и гидроксильным показателями:
pH = - lg[H+];
pOH = -
lg[OH-].
Прологарифмировав выражение [Н+]*[OH-] = 10-14, получаем, что при 250С рН + рОН= 14.
В нейтральных растворах рН = 7, в кислых - рН < 7, в щелочных - рН > 7.
Слайд 37Пример 9.2. Вычислить значения [Н+], [ОН-] и рОН для раствора муравьиной
кислоты из предыдущего примера.
Решение:
По закону разбавления Оствальда мы нашли величину
К = 1,86*10-4, которая, с другой стороны, равна .
По условию задачи, [НСООН] = 0,2 моль/л. Поэтому можно записать, что [Н+][СООН ] = 0,2*1,86*10-4 = 0,372*10-4.
Так как концентрация ионов водорода [Н+] при диссоциации молекул кислоты равна концентрации кислотного остатка [СООН-], то:
[Н+] = 6.1*10-3.
рН = -lg(6,1*10-3) = 2,21.
Тогда рОН = 14 – 2,21 = 11,79.
Рассчитываем [ОН-] = 10-11,79 = 1.63*10-12 моль/л.
Ответ: [Н+] = 6,1*10-3 моль/л; [ОН-] = 1.63*10-12 моль/л; рОН= 11,79.
Слайд 38Пример 1. Определите pH среды, если концентрация ионов OH– в растворе составляет 1,8·10–9 моль/л.
Решение.
Используя ионное
произведение воды, вычислим концентрацию ионов H+ в растворе:
[H+] = Kw/[OH–] =
10–14/1,8·10–9 = 5,56·10–6 моль/л
Определим pH cреды: pH = –lg[H+] = –lg 5,56·10–6 = 5,25.
Ответ: 5,25.
Слайд 39Пример 2. Определите концентрацию (моль/л) ионов H+ в растворе, если pH среды равен
12,7.
Решение.
По определению pH = –lg[H+]. Поэтому [H+]=10–pH. Следовательно, в данном случае [H+]=10–12,7=2·10–13.
Ответ: 2·10–13 моль/л.
Слайд 40Пример 6. Определить рН 0,1 М раствора ортофосфата калия
.
Решение.
Будем считать, что гидролиз практически протекает только по первой ступени:
K3PO4 + H2O ⇔ K2HPO4 + KOH, PO4 3- + H2O ⇔ HPO4 2- + OH- .
K3,H3PO4 = 1,3×10-12 (приложение, табл. 1). Кг,1 = а,3 w K K = 12 14 1,3 10 10 − − × = 7,7×10-3. h = MeA г1 C K = 0,1 7,7 10−3 × = 2,8×10-2. [OH- ] = hCMeA = 2,8×10-2×0,1 = 2,8×10-3 М, pOH = -lg[OH- ] = -lg(2,8×10-3) = 2,55, pH = 14 – 2,55 = 11,45.
Слайд 41Пример 5. Рассчитать рН 0,04 М раствора гидроксида аммония, если степень
его диссоциации равна 0,06.
Решение.
Записываем уравнение диссоциации NH4ОН: NH4ОН
⇔ NH4+ + ОН-
Концентрация гидроксид-ионов равна доле молекул электролита, распавшихся на ионы
[OH- ] = с α = 0,04×0,06 = 2,4×10-3 моль-ион/л. рОН = -lg [ОН- ] = -lg(2,4×10-3) = 3 – lg2,4 = 2,62.
рН = 14 – рОН = 14 –2,62 = 11,38.
Слайд 42Способы выражения состава растворов
Слайд 43Раствором называется
однородная (гомогенная) система, состоящая из двух или более компонентов,
относительные концентрации которых могут изменяться в широких пределах. Наиболее распространенными
и важными для практического использования являются жидкие растворы. В случае растворов газов или твердых веществ жидкость является растворителем, а газы или твердые вещества -растворенными веществами. Отношение количества или массы растворенного вещества (или растворителя) к объему или массе раствора называется концентрацией растворенного вещества (или растворителя) в растворе. Наиболее употребительными понятиями, которые служат для выражения концентрации раствора, являются:
Слайд 44Молярная концентрация (или молярность)
См - отношение имеющегося в растворе количества растворенного вещества, выраженного
в молях, к объему раствора. Измеряется в моль/л. Раствор, содержащий
в 1 литре n молей растворенного вещества, называется n-молярным и обозначается как nМ раствор (например, 3М раствор KCl).
Слайд 45Эквивалентная (или нормальная) концентрация
Сн - отношение числа эквивалентов растворенного вещества к объему раствора. Раствор,
в 1 литре которого имеется n эквивалентов растворенного вещества, называется
n-нормальным (например, запись 3н. раствор NaCl означает, что CH(NaCl) = 3моль-экв/л).
Слайд 46Моляльная концентрация (или моляльностъ)
Сm — отношение числа молей растворенного вещества к массе
растворителя, измеряется в моль/кг. Запись 2 моль/кг означает, что в 1
кг Н2О растворено 2 моля NaCl.
Слайд 47 ω=
mв-ва
mр-ра
.
100 %
Массовая доля
растворенного вещества в растворе
Задача.
Для консервирования огурцов приготовили рассол: на 2 л воды взяли
100г соли, а для консервирования томатов – рассол из 100г соли и 3 л воды. Какой рассол получится более концентрированным?
Слайд 48Пример 1. Вычислите: а) процентную; б) молярную (СМ); в)
эквивалентную (СН); г) моляльную (Сm) концентрации раствора H3PO4, полученного при
растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031 г/см3 . Чему равен титр Т этого раствора?
Решение. а) Так как массу 282 см3 воды можно принять равной 282 г, то масса полученного раствора 18 +282 = 300 г следовательно,
300 – 18
100 – % С% = = 6%
Слайд 49б) мольно-объемная концентрация или молярность , показывает число молей растворенного
вещества, содержащихся в 1л раствора. Масса 1л раствора 1031г. Массу
кислоты в литре раствора находим из соотношения
300 – 18
1031 – Х
Х == 61,86
Молярность раствора получим делением числа граммов H3PO4 в 1л раствора на мольную массу H3PO4 (97,99 г/моль).
СМ = 61,86 / 97,99 = 0,63 М
в) эквивалентная концентрация или нормальность, показывает число эквивалентов растворенного вещества, содержащихся в 1л раствора. Так как эквивалентная масса
H3PO4 = == 32,66 г/моль, то СН = 61,86 / 32,66 = 1,89н;
Слайд 50г) мольно-массовая концентрация или моляльность, показывает число молей растворенного вещества,
содержащихся в 1000г растворителя. Массу H3PO4 в 1000г растворителя находим из
соотношения
282 – 18
1000 – Х Х = = 68,83
Отсюда Сm = 68,83 / 97,99 = 0,65m
Титром раствора называется число граммов растворенного вещества в 1 см3 (мл) раствора. Так как в 1л раствора содержится 61,86 кислоты, то
Т = 61,86 / 1000 = 0,06186 1г/см3
Зная нормальность раствора и эквивалентную массу (mЭ) растворенного вещества, титр легко найти по формуле
Т = СНmЭ / 1000.
Слайд 51Пример 4. Найти массы воды и медного купороса CuSO4 · 5Н2О, необходимые
для приготовления одного литра раствора, содержащего 8% (масс) безводной соли.
Плотность 8% раствора CuSO4 равна 1,084 г/мл.
Решение. Масса 1 л полученного раствора будет составлять 1,084 * 1000 = 1084г. В этом растворе должно содержаться 8% безводной соли, т.е. 1084 * 0,08 = 86,7г. Массу CuSO4 * 5Н2О (мольная масса 249,7 г/моль), содержащую 86,7г безводной соли (мольная масса 159,6 г/моль), найдем из пропорции 249,7 : 159,6 = Х : 86,7.
Х = = 135,6
Необходимая для приготовления раствора масса воды составит 1084 – 135,6 = 948,4г.
Слайд 52Пример 5. К 1л 10% - ного раствора КОН (пл. 1,092
г/ см3) прибавили 0,5л 5% - ного раствора КОН (пл.
1,045 г/ см3). Объем смеси довели до 2л. Вычислить молярную концентрацию полученного раствора.
Решение. Масса 1л 10% - ного раствора КОН 1092 г. В этом растворе содержится 1092 * 10 / 100 = 109,2 г КОН. Масса 0,5л 5% - ного раствора 1045 * 0,5 = 522,5г. В этом растворе содержится 522,5 * 5 / 100 = 26,125г КОН.
В общем объеме полученного раствора (2л) содержимое КОН составляет 109,2 + 26,125 = 135,325г. Отсюда молярность этого раствора СМ = 135,235 / 256,1 = 1,2М, где 56,1 г/моль – мольная масса КОН.
Слайд 53Пример 6. Какой объем 96% - й кислоты плотностью 1,8 г/см3 потребуется
для приготовления 3л 0,4 н раствора?
Решение. Эквивалентная масса
Н2SO4 = = 49,04 г/моль
Для приготовления
3л 0,4 н раствора требуется 49,04 · 0,4 · 3 = 58,848 г Н2SO4 . Масса 1см3 96% - ной кислоты 1,84 г. В этом растворе содержится 1,84 * 96 / 100 = 1,766 г Н2SO4 . Следовательно, для приготовления 3л 0,4 н раствора надо взять 58,848 : 1,766 = 38,32 см3 этой кислоты.
Слайд 54Пример 8.2. Какой объем воды надо прибавить к 100 мл 20%-ного
(по массе) раствора H2SO4 (ρ = 1,14 г/мл), чтобы получить 5
%-ный раствор?
Решение:
Масса H2SO4 в обоих растворах одна и та же, различается лишь масса воды. Найдем массу кислоты. Она составляет 20 % от массы раствора Мp:
Мк= 0,2Мр = 0,2ρV =0,2*1,14г/мл*100мл=22.8 г.
Масса воды в этом растворе равна:
0,8Мр = 0,2*1,14г/мл*100мл =91,2 г.
Теперь определим массу 5 %-ного раствора. Для этого составим пропорцию:
22,8 г составляют 5 % массы раствора
х г составляют 100% массы раствора
Откуда:
.
Вычтя из этой величины массу кислоты (22,8 г) и массу воды в концентрированном растворе (91,2 г), находим массу воды Δm, которую необходимо прибавить к концентрированному раствору:
Δm = 456 г - 22.8 г - 91. 2 г = 342 г.
Откуда дополнительный объем воды
,
где ρв – плотность воды.
Ответ: Дополнительный объем воды - 342 мл.
Слайд 55Пример 8.3. Какой объем 0,1 М раствора Н3РО4 можно приготовить из 75
мл 0,75 н. раствора?
Решение:
Определим сначала молярную концентрацию 0,75 н. раствора
кислоты. В основе определения нормальной концентрации лежит количество эквивалентов растворенного вещества, которое равно отношению его массы к эквивалентной массе. Поскольку мы имеем дело с трехосновной кислотой, то ее эквивалентная масса в 3 раза меньше молярной массы. Это означает, что нормальная концентрация численно в 3 раза выше молярной.
Cледовательно:
.
Чтобы из 0,25 М раствора получить 0,1 М раствор, надо объем увеличить в .
Таким образом, искомый объем будет равен:
75 мл*2,5 = 187,5 мл.
Ответ: Объем 0,1 М раствора равен 187,5 мл.
Слайд 56Пример 8.4. В какой массе воды нужно растворить 25 г CuSO4*5H2O,
чтобы получить 8 %-ный (по массе) раствор CuSO4?
Решение:
Найдем массу сухого
сульфата и кристаллизационной воды в пятиводном сульфате меди. Мольная масса кристаллогидрата равна 249,7 г/моль, мольная масса безводного сульфата равна 159,6 г/моль. Для нахождения массы безводного сульфата меди в кристаллогидрате составим пропорцию:
25 г CuSO4*5H2O отвечают мольной массе 249,7 г/моль,
х г CuSO4 отвечают мольной массе 159,6 г/моль
Откуда:
Тогда масса воды в кристаллогидрате будет равна:
25 г- 15,98 г = 9,02 г.
Масса воды в 8 %-ном (по массе) растворе CuSO4 может быть найдена из пропорции:
8 % соответствуют 15,98 г
92% соответствуют х г
Откуда:
.
Но в кристаллогидрате уже есть 9,02 г воды, следовательно, нужно взять (183,77 г – 9,02 г) = 174,75 г воды для приготовления нужного раствора.
Ответ: Требуемая масса воды 174,75 г.
Слайд 57Температуры кристаллизации, замерзания и кипения растворов:
Раствор кипит при более высокой
и замерзает при более низкой температуре, чем растворитель. Повышение температуры
кипения и понижение температуры замерзания растворов прямо пропорционально их моляльной концентрации:
∆t0кип = ЕСm; ∆t0зам = КСm,
где
∆t0кип - повышение температуры кипения;
∆t0зам - понижение температуры замерзания;
Е - эбуллиоскопическая константа;
К - криоскопическая константа;
Сm - моляльная концентрация раствора.
Зная t0кип или t0зам можно найти молекулярную массу растворенного вещества (М), эбуллиоскопическую (Е) или криоскопическую (К) константы.
Слайд 58Например. Определить температуру кипения 10% - го растворы глюкозы в воде.
Е = 0,520.
Решение. В 10% - ом растворе глюкозы в 100г
раствора содержится 10г глюкозы и 90 г растворителя. Подставив конкретные значения:
Е = 0,520, m = 10г; m1 = 90г
М= 180 в уравнение (II) , получим
t0кип = 0,52 = 0,3200
Вода кипит при р = 760 мм.рт.ст. при 1000С, поэтому температура кипения раствора равна 100 + 0,32 = 100,320С.



























![Химия растворов
К2
К3
К4
К1
К5
К6
К8
Содержание
Массовая доля
растворённого Пример 9.2. Вычислить значения [Н+], [ОН-] и рОН для раствора муравьиной кислоты Пример 9.2. Вычислить значения [Н+], [ОН-] и рОН для раствора муравьиной кислоты из предыдущего примера. Решение:](/img/tmb/3/283639/43f57a7788d1818474e6f5f9dbf02aed-800x.jpg)

![Химия растворов
К2
К3
К4
К1
К5
К6
К8
Содержание
Массовая доля
растворённого Пример 2. Определите концентрацию (моль/л) ионов H+ в растворе, если pH среды равен 12,7. Пример 2. Определите концентрацию (моль/л) ионов H+ в растворе, если pH среды равен 12,7. Решение.По определению pH = –lg[H+]. Поэтому [H+]=10–pH. Следовательно,](/img/thumbs/d2181746d196dc54ae8d8e9f426e9303-800x.jpg)