Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Иллюстрированные методики анализа лекарственных средств к лабораторным занятиям
Содержание
- 1. Иллюстрированные методики анализа лекарственных средств к лабораторным занятиям
- 2. Доказательство подлинности катиона кальцияРеакция осаждения с раствором
- 3. Реакция осаждения с раствором аммония оксалатабелый осадок кальцияоксалатаРастворкальция хлорида 5%-200 млПодлинность
- 4. осадок не растворим в растворе аммиакаосадок не растворим в уксусной кислоте+NH4OH+CH3COOHОсадок кальция оксалата
- 5. осадок растворим в хлористоводо-роднойкислоте+HClосадок растворим в хлористоводо-роднойкислотеОсадок кальция оксалата
- 6. Доказательство подлинности хлорид-ионаРеакция осаждения с раствором серебра
- 7. Реакция осаждения с раствором серебра нитрата белый творожистый осадок серебрахлоридаРастворкальция хлорида 5%-200 млПодлинность
- 8. осадок серебра хлорида не растворилсяосадок серебра хлорида
- 9. Комплексонометрический метод (прямое титрование)Титрант: 0,05 М раствор
- 10. Комплексонометрический методВ точке эквивалентности:окраска раствора за счет
- 11. Комплексонометрический метод (прямое титрование)К 1 мл препарата
- 12. Отмеривают пипеткой навеску препарата
- 13. Прибавляют воду очищенную
- 14. Прибавляют аммиачный буферный раствор
- 15. Прибавляют индикаторную смесь хромового темно-синего
- 16. Окраска раствора до начала титрования
- 17. Титруют раствором трилона Б до сине-фиолетового окрашивания
- 18. Окраска раствора в конце титрования
- 19. Список литературы Беликов, В.Г. Фармацевтическая химия
- 20. Иллюстрированные методики подготовили: Саттарова Ольга Евгеньевна, доцент
- 21. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1 Иллюстрированные методики анализа лекарственных средств к лабораторным занятиям по
фармацевтической химии для студентов 3 курса
млСлайд 2Доказательство подлинности катиона кальция
Реакция осаждения с раствором аммония оксалата
Методика. К
0,5 мл препарата прибавляют 0,15-0,25 мл 4% раствора аммония оксалата;
образуется белый осадок, нерастворимый в уксусной кислоте разведенной 30% и 10% растворе аммиака, растворимый в разведенныхминеральных кислотах.
Раствор
кальция хлорида 5%-200 мл
Подлинность
Слайд 3Реакция осаждения с раствором аммония оксалата
белый осадок кальция
оксалата
Раствор
кальция хлорида 5%-200
мл
Подлинность
Слайд 4осадок не растворим в растворе аммиака
осадок не растворим в уксусной
кислоте
+NH4OH
+CH3COOH
Осадок кальция оксалата
Слайд 5осадок растворим в хлористоводо-родной
кислоте
+HCl
осадок растворим в хлористоводо-родной
кислоте
Осадок кальция оксалата
Слайд 6Доказательство подлинности хлорид-иона
Реакция осаждения с раствором серебра нитрата
К
0,5 мл препарата прибавляют по 2-3 капли азотной кислоты разведенной
16% и 2% раствора серебра нитрата. Образуется белый творожистый осадок, нерастворимый в азотной кислоты разведенной 16% и растворимый в растворе аммиака.Раствор
кальция хлорида 5%-200 мл
Подлинность
Слайд 7Реакция осаждения с раствором серебра нитрата
белый творожистый
осадок
серебра
хлорида
Раствор
кальция хлорида 5%-200 мл
Подлинность
Слайд 9Комплексонометрический метод (прямое титрование)
Титрант: 0,05 М раствор трилона Б.
Индикатор: хромовый
темно-синий.
Среда: аммиачный буфер с рН 9,5-10,0.
Переход окраски от красной к
сине-фиолетовой.Содержание кальция хлорида в препарате рассчитывают по формуле:
Раствор
кальция хлорида 5%-200 мл
Количественное определение
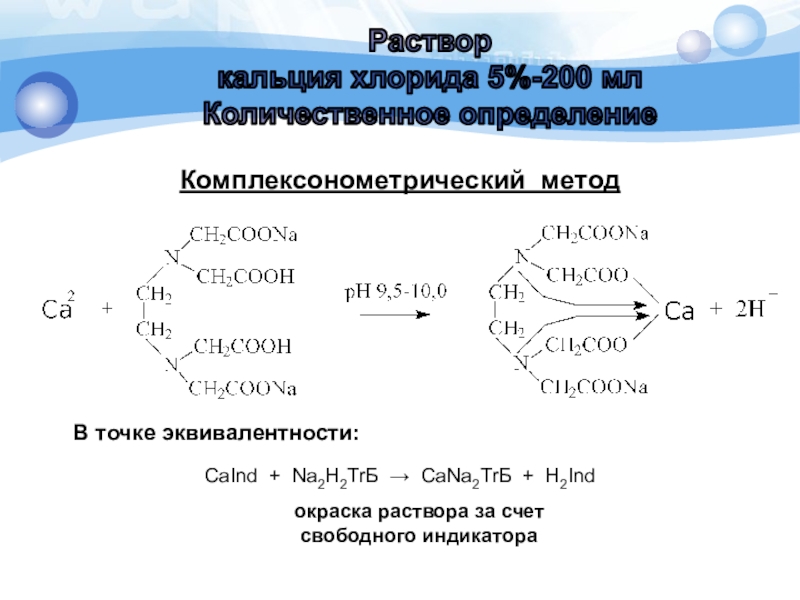
Слайд 10Комплексонометрический метод
В точке эквивалентности:
окраска раствора за счет
свободного индикатора
CaInd +
Na2H2ТrБ CaNa2ТrБ + H2Ind
Раствор
кальция хлорида 5%-200 мл
Количественное определение
Слайд 11Комплексонометрический метод
(прямое титрование)
К 1 мл препарата прибавляют 5 мл
воды, 5 мл аммиачного буферного раствора, 0,05 г индикаторной смеси
хромового темно-синего и титруют 0,05М раствором трилона Б до сине-фиолетовогоокрашивания.
Раствор
кальция хлорида 5%-200 мл
Количественное определение
Слайд 19
Список литературы
Беликов, В.Г. Фармацевтическая химия / 4-е
изд., перераб. и доп. – М., МЕДпрессинформ", 2008. – 613
с.Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос. Федерации. – 10-е изд. – М.: Медицина, 1968. – 1079 с.
Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос. Федерации. – 11-е изд., доп. – М.: Медицина, 1987. Вып. 1. – 336 с.
Государственная фармакопея СССР [Текст] / М-во Здравоохранения Рос. Федерации. – 11-е изд., доп. – М.: Медицина, 1989. Вып. 2. – 400 с.
Государственная фармакопея Российской Федерации [Текст]. – 12-е изд. – М.: Науч. центр экспертизы средств мед. применения, 2007. – Ч. 1. – 696 с.
Практическое руководство к лабораторным занятиям по фармацевтической химии для студентов III курса / Т.И. Ярыгина, О.Л. Визгунова, В.А. Дубовик и др. / под ред. Л.М. Коркодиновой – Пермь, 2011. – 102 с.
Руководство к лабораторным занятиям по фармацевтической химии: учеб. пособие / Э.Н. Аксенова, О.П. Андрианова, А.П. Арзамасцев и др. / под. ред. А.П. Арзамасцева. – 3-е изд., перераб. и доп. – М., Медицина, 2001. – 384 с. : ил.1.