Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Иммунология – изучает реакции системы иммунитета организма в ответ на нарушения
Содержание
- 1. Иммунология – изучает реакции системы иммунитета организма в ответ на нарушения
- 2. Антигены (АГ) – любые вещества, чаще
- 3. Рецепторы – макромолекулы на клетках, специфически
- 4. Иммунитет – эволюционно обусловленная совокупность
- 5. Слайд 5
- 6. Слайд 6
- 7. Виды иммунитета Видовой иммунитет (конституционный,
- 8. «Неиммунитетная» естественная неспецифическая резистентнстьНаружные покровы: кожа, слизистые
- 9. Естественный врожденный иммунитет(неспецифические естественные факторы иммунитета)Гуморальные факторы:система
- 10. Естественный врожденный иммунитетКлеточные факторы: Фагоциты (моноциты, макрофаги,
- 11. Слайд 11
- 12. Приобретенный иммунитет Естественный: активный и пассивный Искусственный: активный и пассивный
- 13. Приобретенный иммунитетЕстественный активный иммунитет появляется в результате
- 14. Приобретенный иммунитет Искусственный активный иммунитет возникает после
- 15. Неинфекционный иммунитет: Трансплантационный - возникает
- 16. Репродуктивный иммунитетИммунитет в системе "мать-плод"
- 17. Выживаемость плода обеспечивают: особая организация тканей между
- 18. Противоопухолевый иммунитетнаправлен против АГ опухолевых клеток:естественный неспецифический:
- 19. Противоопухолевый иммунитет приобретенный специфический: лизис
- 20. Факторы неэффективности
- 21. Опухоль выделяет: цитокины, подавляющие иммунный ответ
- 22. АутоиммунитетЭто реакции СИ на собственные АГ (белки,
- 23. Система иммунитета (СИ)
- 24. Система гранулоцитов (нейтрофилы, базофилы и тучные клетки,
- 25. Центральные органы СИ – красный костный
- 26. Цитокины и интерлейкины Дифференцировка и взаимодействие клеток
- 27. Общие свойства цитокинов Гликопротеины с молекулярной массой
- 28. Классификация цитокинов Интерлейкины (ИЛ) Интерфероны (ИНФ)
- 29. Интерлейкины Это цитокины, которые
- 30. ИЛ-2 выделяется Т-хелперами (Тх1) , стимулирует
- 31. ИЛ-5 стимулирует созревание эозинофилов, базофилов и синтез
- 32. ИЛ-7 – лимфопоэтический фактор, активирует пролиферацию предшественников
- 33. ИЛ-10 – выделяется Т-лимфоцитами (Тх2 и
- 34. ИЛ-17 – выделяется Тх17,- мощный провоспалительный
- 35. Провоспалительные цитокины: ИЛ-1,
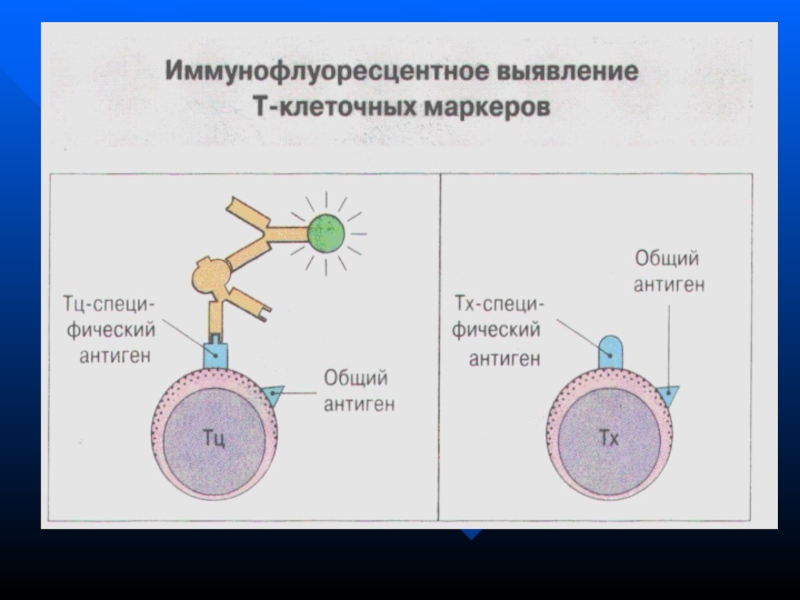
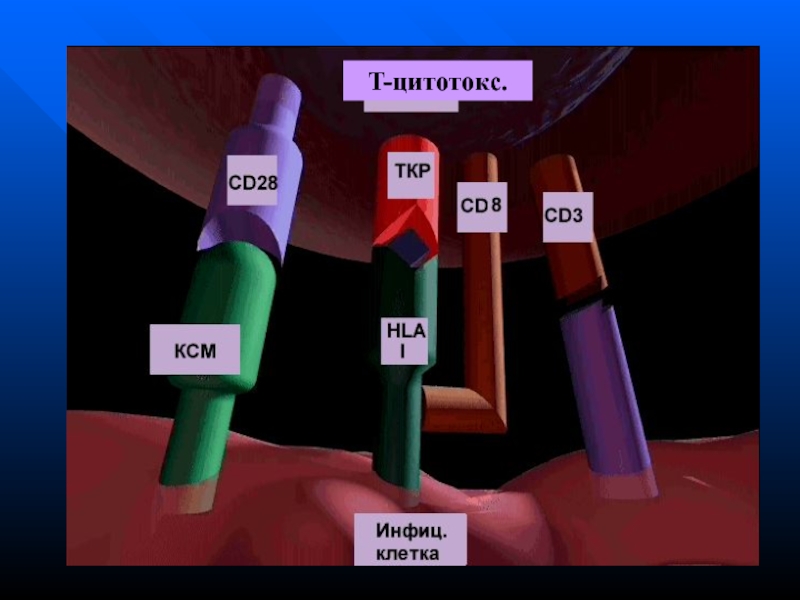
- 36. Молекулы дифференцировки клеток системы иммунитета – CD-антигены
- 37. CD1 –общий АГ тимоцитовCD2 – общий маркер
- 38. CD8 – маркер Т- цитотоксических лимфоцитов (Т-киллеров),
- 39. CD16 – несут нейтрофилы, ЕКК, моноцитыCD19-22 –
- 40. Toll-like рецепторы Распознают типовые структурные компоненты
- 41. TLR-1 связывает липопептиды различных групп бактерий
- 42. Слайд 42
- 43. Функции системы TLR Усиление экспрессии костимуляторных молекул
- 44. Разный цитокиновый профиль стимулирует превращение Тх0
- 45. Функции TLRАктивация АПК через TLR4 ведет к
- 46. Функции TLRАктивация АПК через TLR2 ведет к
- 47. Дифференцировка Т-лимфоцитов ГСК ЛСК про
- 48. Антигензависимая дифференцировка Тх0 Тх1 ( ИЛ2,
- 49. Основные субпопуляции:
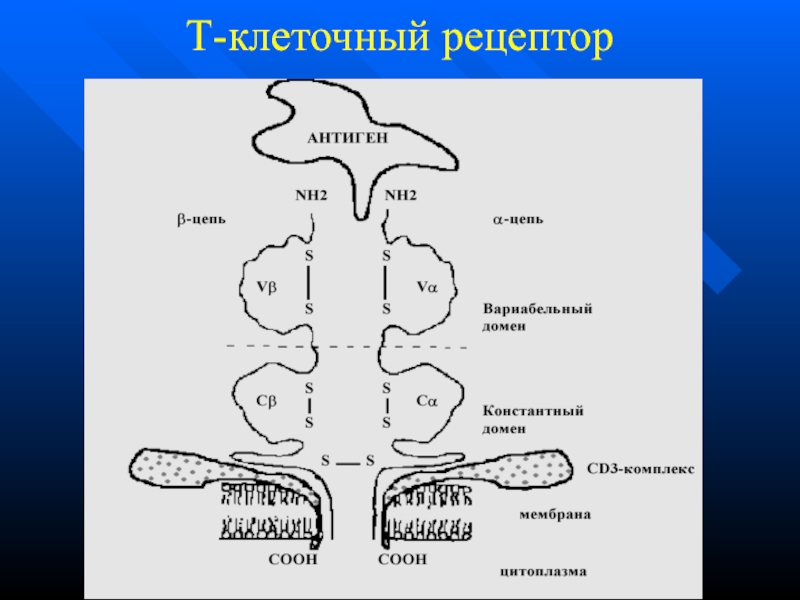
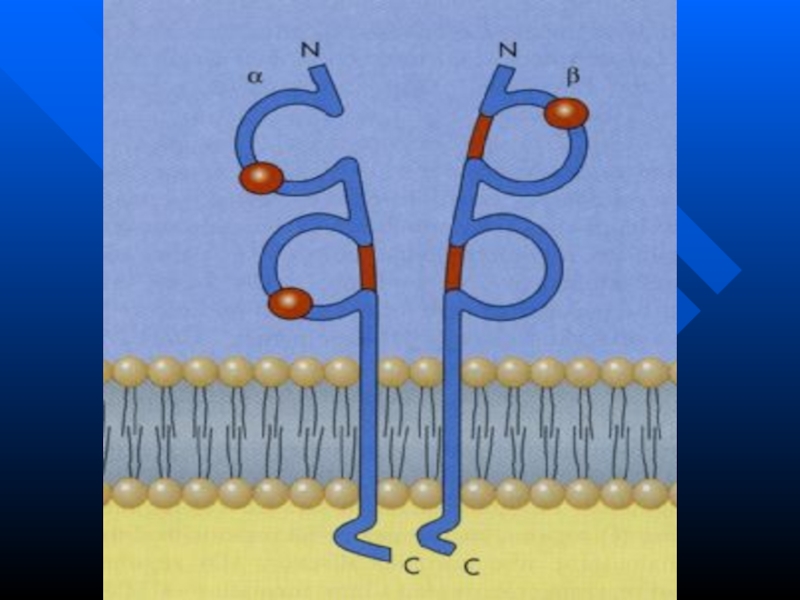
- 50. Т-клеточный рецептор
- 51. ТКР у Т-х и Т-ц
- 52. Слайд 52
- 53. Дифференцировка В-лимфоцитовПроцесс созревания стимулируется цитокинами: ИЛ-3, ИЛ-7,
- 54. пIgM может взаимодействовать с АГ Ig
- 55. Слайд 55
- 56. дифференцировочные АГ В-лимфоцитов: СD19, 20,
- 57. Проточная цитометрияОснована на регистрации флюоресценции и светорассеяния
- 58. Клетки одна за другой проходят через лазерный
- 59. Прямое светорассеяние (малоугловое) Детектор
- 60. Боковое светорассеяниеВнутреннее содержимое клеток оптически неоднородно Луч
- 61. Регистрация флюоресценцииСистема состоит из комплекса светофильтров и
- 62. Полученные данные обрабатываются компьютером и отображаются в
- 63. Сортировка клетокВ проточном цитометре, оборудованном системой для
- 64. Сортировка клетокПроходя сквозь заряжающее кольцо, капля может
- 65. Преимущества сортинга на П Цвысокая чистота получаемой
- 66. Слайд 66
- 67. Слайд 67
- 68. Слайд 68
- 69. Слайд 69
- 70. Слайд 70
- 71. Иммуноглобулины (Ig)
- 72. Структура Ig 2 тяжелые (H – heavy)
- 73. В цепях Ig различают константные (c)
- 74. Между СН1 и СН2 доменами тяжелой
- 75. Функции Fc-фрагмента CН2 домен Fc-фрагмента активирует комплемент
- 76. Слайд 76
- 77. Свойства иммуноглобулинов IgG составляют основную массу иммуноглобулинов
- 78. IgМ – пентамер, в сыворотке крови
- 79. IgА в крови присутствуют в виде мономеров
- 80. Слайд 80
- 81. IgD содержатся в сыворотке крови в
- 82. IgЕ содержится у здоровых людей в
- 83. Антитела Это Ig любого из 5
- 84. Механизмы действия антител нейтрализация активных центров токсиновобразование комплекса АГ-АТ, который активирует комплемент с последующим лизисом клетки
- 85. опсонизация объектов фагоцитоза (усиление фагоцитоза)связывание с Fc-рецепторами
- 86. антирецепторные АТ, связываясь с соответствующим рецептором,
- 87. Бивалентные полные АТ (обычно IgG) имеют
- 88. Сила связывания (сродство) одного активного центра АТ
- 89. Поликлональные АТ сыворотки представляют собой смесь
- 90. Получение моноклональных АТИммунизация мышей антигеном Из селезенки
- 91. Проводят слияние этих антителообразующих В-клеток с
- 92. Их культивируют в специальной среде, в которой
- 93. Применение моноклональных АТВыявление АГ бактерий и вирусовВыявление
- 94. Генетические основы разнообразия АТ и ТКРH и
- 95. Каждый такой сегмент формируется из нескольких участков
- 96. Разнообразие АТ увеличивается и при последовательном
- 97. Антигены (АГ) - любые простые или сложные
- 98. Основные свойства
- 99. Иммуногенность обусловлена сложностью пространственной структуры
- 100. Слайд 100
- 101. Гаптены - низкомолекулярные вещества, в обычных
- 102. Аллергены – АГ или гаптены, которые при
- 103. Т-зависимые АГ- запускают иммунный ответ с участием
- 104. Экзогенные и эндогенные АГ Экзогенные
- 105. Инфекционные АГ- антигены бактерий, вирусов, грибов,
- 106. По локализации: О-АГ Н-АГ К-АГ
- 107. Строение ЛПС
- 108. Липид А - неспецифический иммуностимулятор, токсичен
- 109. Н-АГ входит в состав жгутиков, состоит из
- 110. Протективные антигены Это совокупность антигенных
- 111. Антигенная мимикрия - сходство в строении АГ
- 112. У возбудителя сифилиса есть фосфолипиды, сходные по
- 113. Суперантигены - в небольших дозах вызывают поликлональную
- 114. НЕИНФЕКЦИОННЫЕ АНТИГЕНЫ АГ растений, лекарственные
- 115. АГ животных по отношению к человеку являются
- 116. Антигены эритроцитов
- 117. Антигены лейкоцитов
- 118. Молекулы HLA I класса – гетеродимеры,
- 119. Слайд 119
- 120. Молекулы HLA II класса состоят из двух
- 121. Слайд 121
- 122. Эндогенные АГ - собственные
- 123. По тканевой и клеточной принадлежности
- 124. Система мононуклеарных фагоцитов Моноциты крови Макрофаги
- 125. Молекулярные маркеры моноцитов и макрофагов CD
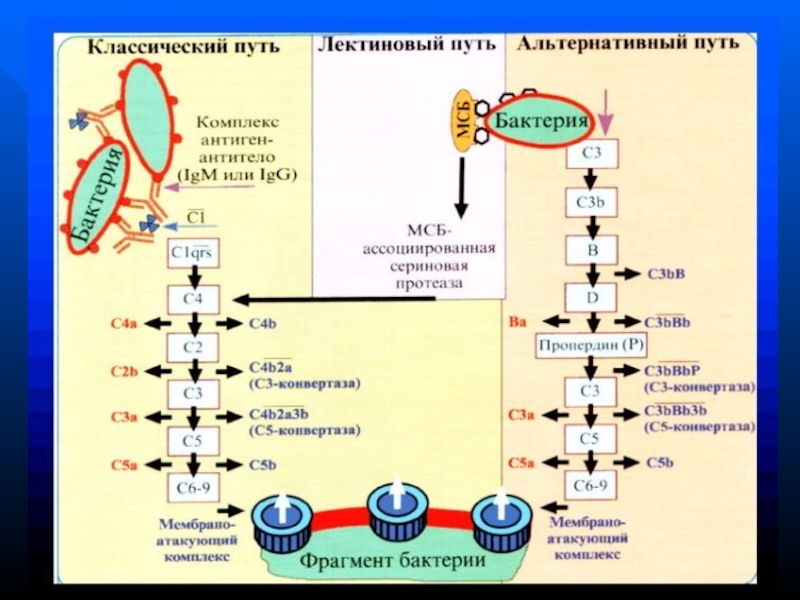
- 126. Функции макрофагов:
- 127. Стадии фагоцитоза - хемотаксис
- 128. Хемотаксис - движение макрофагов к объекту фагоцитоза
- 129. Адгезия реализуется двумя механизмами: иммунным и неиммунным
- 130. В связывании могут участвовать самые разнообразные
- 131. Слайд 131
- 132. - инвагинация мембраны фагоцита
- 133. Кислородзависимые механизмы (образование активных форм кислорода: Н2О2, оксидаза, миелопероксидаза и др.) Кислороднезависимые механизмыПереваривание
- 134. Кислородзависимые бактерицидные механизмы - образование активных форм кислорода (АФК) через гексозомонофосфатный шунт - «дыхательный взрыв»
- 135. Кислороднезависимые механизмы:
- 136. Завершенный фагоцитоз - полное переваривание и гибель
- 137. Судьба нейтрофила после фагоцитоза - гибельАпоптоз –
- 138. Нетоз Происходит распад ядерной оболочки Компоненты ядра
- 139. Нетоз Таким образом, нейтрофилы после активации
- 140. Представление (презентация) АГ В результате
- 141. Экзоантигены - пептиды длиной 12-25 аминокислот связываются
- 142. Секреция медиаторов иммунной системы
- 143. ДРУГИЕ АПК Клетки Лангерганса из кожи мигрируют
- 144. Слайд 144
- 145. СИСТЕМА ГРАНУЛОЦИТОВ
- 146. Слайд 146
- 147. Нейтрофилы составляют 47-72% всех лейкоцитов (2.5
- 148. Азурофильные гранулы содержат
- 149. Слайд 149
- 150. Основные маркеры на нейтрофилах :
- 151. Базофилы участвуют в аллергических реакциях
- 152. Эозинофилы играют большую роль в противопаразитарном иммунитете
- 153. Характеристика системы макрофагов и гранулоцитов 1.
- 154. Определяют фагоцитарный индекс и фагоцитарное число
- 155. Оценка показателей фагоцитоза В норме через 90
- 156. Слайд 156
- 157. С помощью моноклональных АТ определяют АГ
- 158. Система комплемента сложная система ферментативных и рецепторных
- 159. Система комплементаБелки классического пути активации системы комплемента
- 160. При активации компонентов комплемента обычно образуется 2
- 161. Среди регуляторных белков различают естественный С1-ингибитор,
- 162. Пути активации системы комплементаКлассический (запускается комплексом АГ-АТ
- 163. Слайд 163
- 164. Слайд 164
- 165. Слайд 165
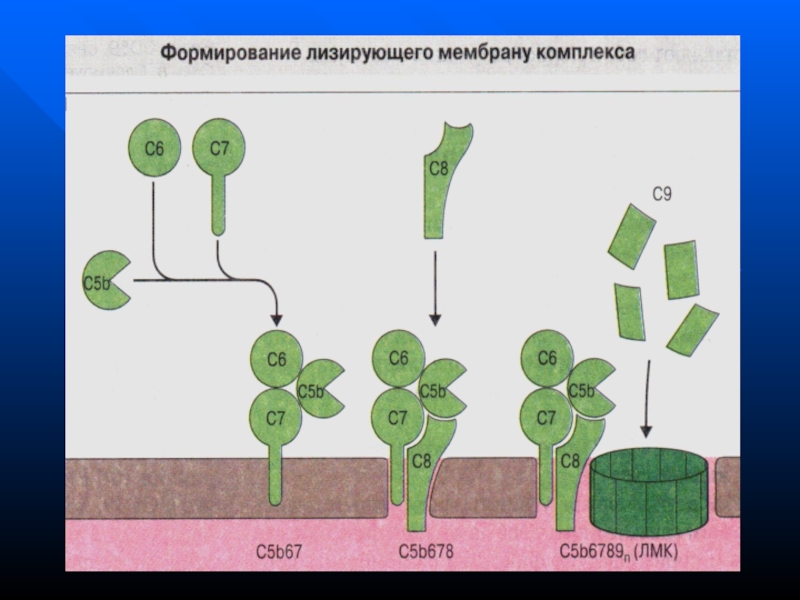
- 166. Функции системы комплементаЛизис клеток-мишеней (бактериальных, зараженных вирусом,
- 167. ДИНАМИКА ИММУННОГО ОТВЕТА
- 168. Неспецифические защитные реакции (гуморальные)Активация комплемента по
- 169. Неспецифические защитные реакции (клеточные)Фагоцитоз микробных клеток нейтрофилами и макрофагамиДействие естественных киллеров -ЕКК (перфорин, АЗКЦ)
- 170. Специфические защитные реакции на Т-независимые АГТакие АГ–
- 171. Специфические защитные реакции на Т-зависимые АГ Процессинг
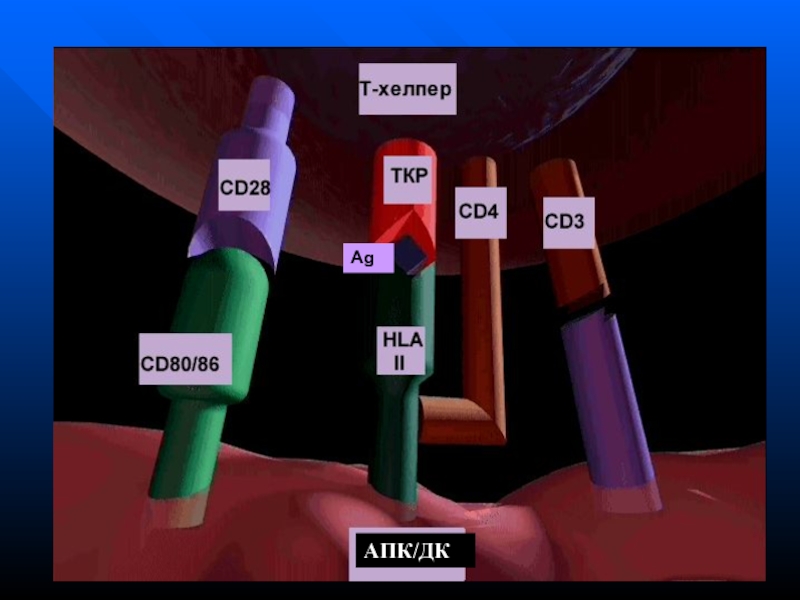
- 172. АПК (дендритные) клетки представляют АГ
- 173. Молекулярный образ патогена
- 174. Функция TLR Активация АПК/ДК через TLR4
- 175. Функция TLR Активация АПК/ДК
- 176. Для активации Т-х необходимы 3 сигнала:Презентация АГ в комплексе с HLA-IIЭкспрессия костимулирующих молекулОпределенный набор цитокинов
- 177. AПК/ДКAg
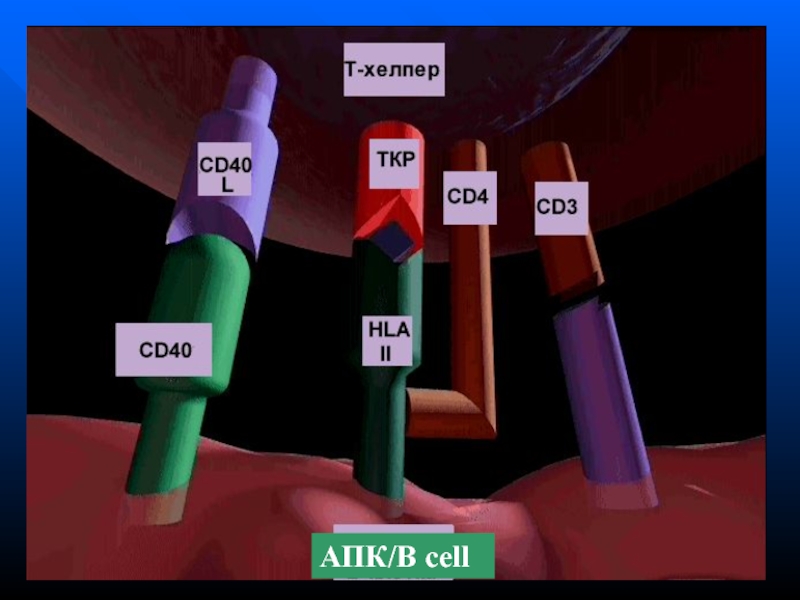
- 178. АПК/B cell
- 179. T-цитотокс.
- 180. Т-х 1 синтезируют
- 181. Т-х 2 синтезируют IL4, IL10
- 182. Эффекторная фазаАктивация фагоцитов и фагоцитозЦитотоксическое действие Т-киллеров и NK-клетокБласттрансформация В-лимфоцитов, образование плазмоцитов, синтез АТ
- 183. Основные стадии и механизмы иммунного цитолизаРаспознавание мишени
- 184. Слайд 184
- 185. Естественное угнетение ИОЦитокины действуют только аутокринно и
- 186. Естественное угнетение ИОСмена костимулирующмх молекул приводит к торможению клеточного деленияНачинается апоптоз актвированных клетокИдиотип – антиидиотипическая регуляция
- 187. Слайд 187
- 188. Первичный иммунный ответ:Развивается после латентного периода (3-5
- 189. Вторичный иммунный ответ:Быстро развивается после повторного контакта
- 190. Спасибо за внимание
- 191. Скачать презентанцию
Антигены (АГ) – любые вещества, чаще белки или гликопротеиды, которые, попадая в организм, вызывают образование специфических АТ и/или ТКР Антитела (АТ) – белковые молекулы, иммуноглобулины (Ig), которые
Слайды и текст этой презентации
Слайд 1Иммунология – изучает реакции системы иммунитета организма в ответ на
нарушения его гомеостаза
цитокиныСлайд 2 Антигены (АГ) – любые вещества, чаще белки или гликопротеиды,
которые, попадая в организм, вызывают образование специфических АТ
и/или ТКРАнтитела (АТ) – белковые молекулы, иммуноглобулины (Ig), которые образуются В-лимфоцитами и плазмоцитами и специфично взаимодействуют с АГ
Слайд 3 Рецепторы – макромолекулы на клетках, специфически связывают различные биологически
активные вещества (лиганды)
Цитокины – медиаторы межклеточных взаимодействий, обеспечивают взаимосвязь
клеток внутри системы иммунитета и с другими системами макроорганизмаСлайд 4
Иммунитет – эволюционно обусловленная совокупность реакций взаимодействия между
системой иммунитета и биологически активными агентами (АГ), направленные на сохранение
гомеостазаРезультатом этих реакций могут быть различные феномены иммунитета
Слайд 5
Полезные феномены:
Противоинфекционный иммунитет
–невосприимчивость организма к конкретным инфекционным агентам - возбудителям заболеваний (микробам, вирусам)Толерантность – терпимость, неотвечаемость системы иммунитета на эндогенные или экзогенные антигены
Слайд 6 Патологические феномены:
Гиперчувствительность
– повышенная реакция СИ на антигены-аллергены – приводит к развитию
двух видов патологии: аллергии и аутоиммунных процессовАнергия- отсутствие реакции на антигены (вариант толерантности), обусловлена недостаточностью различных видов иммунитета
Основой всех реакций иммунитета является иммунологическая память
Слайд 7Виды иммунитета
Видовой иммунитет (конституционный, наследственный)
генетически обусловлен особенностями обмена веществ данного вида, не является истинным
иммунитетом, так как не осуществляется системой иммунитетаСлайд 8«Неиммунитетная» естественная неспецифическая резистентнсть
Наружные покровы: кожа, слизистые оболочки
Механические факторы: слущивание
эпителия, движение ресничек, чихание, кашель, выделение секретов
Химические вещества: соляная, молочная,
жирные кислоты, ферментыФизические барьеры
Слайд 9Естественный врожденный иммунитет
(неспецифические естественные факторы иммунитета)
Гуморальные факторы:
система комплемента, СРП, лизоцим,
интерфероны, цитокины и др.
Естественные АТ- исходно существуют в организме
в небольшом количестве против многих бактерий и вирусовСлайд 10Естественный врожденный иммунитет
Клеточные факторы:
Фагоциты (моноциты, макрофаги, полиморфноядерные лейкоциты), которые
проявляют свою активность во всех тканях, полостях, могут выходить на
поверхность слизистых оболочек и там выполнять защитную функциюСлайд 11 Приобретенный иммунитет
возникает в течение жизни каждого индивида:
Противоинфекционный: антимикробный (стерильный, нестерильный), антивирусный,
антитоксический, антипротозойныйНеинфекционный: трансплантационный, репродуктивный, противоопухолевый, аутоиммунитет
Слайд 12Приобретенный иммунитет
Естественный:
активный и пассивный
Искусственный:
активный и пассивный
Слайд 13Приобретенный иммунитет
Естественный активный иммунитет появляется в результате контакта с возбудителем
(после перенесенного заболевания или после скрытого контакта без проявления симптомов
болезни)Естественный пассивный иммунитет возникает в результате передачи от матери к плоду через плаценту (трансплацентарный) или с молоком готовых защитных факторов – лимфоцитов, антител, цитокинов и т.п.
Слайд 14Приобретенный иммунитет
Искусственный активный иммунитет возникает после введения в организм
вакцин, которые содержат микроорганизмы или их субстанции – антигены
Искусственный
пассивный иммунитет создается после введения в организм готовых антител или иммунных клетокСлайд 15Неинфекционный иммунитет:
Трансплантационный - возникает при пересадке органов
и тканей от донора к реципиенту, при переливании крови и
иммунизации лейкоцитамиОбусловлен наличием на поверхности лейкоцитов индивидуального набора молекул системы HLA
Набор этих молекул идентичен только у однояйцовых близнецов
Слайд 16Репродуктивный иммунитет
Иммунитет в системе "мать-плод"
Это совокупность
реакций матери на АГ плода, так как он отличается по
ним из-за генов, полученных от отцаТолерантность матери поддерживается за счет местной системы иммунитета плаценты, которая формирует иммуносупрессивные факторы
Слайд 17Выживаемость плода обеспечивают:
особая организация тканей между матерью и
плодом (трофобласт и др.)
защитное влияние АТ против АГ плода
блокирующее действие комплексов АГ-АТсупрессивное влияние на клетки СИ матери белков и гормонов плаценты, возникших при беременности
супрессивное действие лимфоцитов плода
блокирующие АТ у беременных против HLA-DR
Слайд 18Противоопухолевый иммунитет
направлен против АГ опухолевых клеток:
естественный неспецифический:
естественные киллеры
активированные
макрофаги и гранулоциты
ФНОα, -интерферон
тромбоциты (медиаторы,цитотоксины)
Слайд 19Противоопухолевый иммунитет
приобретенный специфический:
лизис комплементом опухолевых клеток,
покрытых АТ (в основном в крови)
лизис лейкоцитами опухолевых клеток,
покрытых АТ, а также их фагоцитозлизис специфическими Т-киллерами
антипролиферативное действие специфическими В-лимфоцитов
Слайд 20 Факторы неэффективности
противоопухолевого иммунитета
скорость размножения опухолевых клеток выше,
чем скорость формирования эффекторов иммунитеталейкоциты, связавшие противоопухолевые АТ, взаимодействуют не с мембранами опухолевых клеток, а с растворимыми опухолевыми АГ
Слайд 21 Опухоль выделяет:
цитокины, подавляющие иммунный ответ и экспрессию HLA
молекул, блокирующие активность цитотоксических лимфоцитов
толерогенные дозы АГ
молекулы,
индуцирующие апоптоз лимфоцитов связывает АТ через Fc-рецепторы
Слайд 22Аутоиммунитет
Это реакции СИ на собственные АГ (белки, липопротеиды, гликопротеиды)
Обусловлены нарушением распознавания «своих» молекул, которые воспринимаются системой иммунитета как
«чужие» и разрушаютсяСлайд 23 Система иммунитета (СИ) – совокупность молекул,
клеток, тканей и органов, осуществляющих иммунные реакции
Лимфоидная система :
Т- и В-лимфоциты, которые образуют специфические факторы иммунитета (АТ и ТКР к АГ) Система естественных киллерных клеток (ЕКК)
Система АПК: дендритные клетки, клетки Лангерганса, интердигитирующие клетки и др.
Слайд 24Система гранулоцитов (нейтрофилы, базофилы и тучные клетки, эозинофилы)
Система мононуклеарных фагоцитов
(моноциты, макрофаги тканей и органов)
Гуморальные факторы неспецифического естественного иммунитета: лизоцим,
СРБ, интерфероны, фибронектин, β-лизины, лектины и др.Система комплемента
Система тромбоцитов
Слайд 25
Центральные органы СИ – красный костный мозг и тимус
Периферические – лимфоциты крови, лимфатические узлы, селезенка, миндалины, лимфоидная ткань
кишечника (пейеровы бляшки, солитарные фолликулы, лимфоидные образования аппендикса и др.), бронхоассоциированная лимфоидная ткань, лимфоидные образования кожи, печениСлайд 26Цитокины и интерлейкины
Дифференцировка и взаимодействие клеток СИ между собой,
а также с клетками других систем организма, осуществляется с помощью
регуляторных молекул – цитокиновЦитокины – медиаторы межклеточного взаимодействия, активируют все звенья самой СИ и влияют на различные органы и ткани
Слайд 27Общие свойства цитокинов
Гликопротеины с молекулярной массой 15-25 кД
Действуют
ауто- и паракринно, это короткодистантные молекулы
Действуют в минимальных
концентрацияхИмеют соответствующие специфические рецепторы на мембране клеток
Передают сигнал после взаимодействия с рецептором клетки на ее генетический аппарат
При этом изменяется экспрессия клеточных белков с изменением функции клетки (напр., выделяются другие цитокины)
Слайд 28Классификация цитокинов
Интерлейкины (ИЛ)
Интерфероны (ИНФ)
Факторы некроза опухоли
(ФНО)
Колониестимулирующие факторы
Факторы роста
Хемокины
Слайд 29Интерлейкины
Это цитокины, которые выделяются преимущественно клетками
СИ – факторы межлейкоцитарного взаимодействия
ИЛ-1 выделяется макрофагами, пироген (вызывает повышение
температуры), стимулирует и активирует стволовые клетки, Т-лимфоциты, нейтрофилы, участвует в развитии воспаленияСлайд 30
ИЛ-2 выделяется Т-хелперами (Тх1) , стимулирует пролиферацию и дифференцировку
Т- и В-лимфоцитов, ЕКК, моноцитов
ИЛ-3 - основной гемопоэтический фактор, стимулирует
пролиферацию и дифференцировку ранних предшественников гемопоэзаИЛ-4 – первый фактор роста В-лимфоцитов, стимулирует их пролиферацию на раннем этапе дифференцировки, выделяется Тх2
Слайд 31
ИЛ-5 стимулирует созревание эозинофилов, базофилов и синтез иммуноглобулинов В-лимфоцитами, вырабатывается
Тл под влиянием АГ
ИЛ-6 – выделяется Тл, макрофагами и многими
клетками вне системы иммунитета, стимулирует созревание B-лимфоцитов в плазматические клетки (второй фактор роста В-лимфоцитов), активирует воспалениеСлайд 32
ИЛ-7 – лимфопоэтический фактор, активирует пролиферацию предшественников лимфоцитов
ИЛ-8 – регулятор
хемотаксиса нейтрофилов и Т-клеток (хемокин); секретируется Т-клетками, моноцитами, эндотелием
Слайд 33 ИЛ-10 – выделяется Т-лимфоцитами (Тх2 и регуляторными Тх3 –
Tr), подавляет выделение провоспалительных цитокинов (ИЛ-1, ФНО и др.)
ИЛ-12,
ИЛ-18 – продуцируются моноцитами и макрофагами, стимулируют Тх1 и продукцию ими -интерферона Слайд 34 ИЛ-17 – выделяется Тх17,
- мощный провоспалительный цитокин,
- по
действию напоминает -интерферон,
- стимулирует выработку ИЛ-1, ФНО, хемокинов,
-
является медиатором ПЧЗТ и деструкции клетокСлайд 35
Провоспалительные цитокины: ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12,
ИЛ-17, ИЛ-18, ИНФ-, ФНО и др.
Противоспалительные цитокины: ИЛ4, ИЛ-10, ИЛ-13,
ИЛ-25 и др.)Регуляторы гемопоэза:
ИЛ-3, ИЛ-7, колониестимулирующие факторы, факторы роста
Слайд 36Молекулы дифференцировки клеток системы иммунитета – CD-антигены
В
процессе дифференцировки на мембранах клеток СИ появляются макромолекулы, соответствующие определенной
стадии развития клеток – CD-антигены (clusters of differentiation – кластеры дифференцировки)Слайд 37
CD1 –общий АГ тимоцитов
CD2 – общий маркер всех Т-клеток, обладает
способностью связывать эритроциты барана ( РОК )
СD3 – есть на
мембранах всех зрелых Т-лимфоцитов, обеспечивает передачу сигнала от ТКР в цитоплазмуCD4 – маркер Т-хелперов, рецептор для ВИЧ, участвует в распознавании АГ, ассоциированных с молекулами HLA II
Слайд 38
CD8 – маркер Т- цитотоксических лимфоцитов (Т-киллеров), участвует в распознавании
АГ, ассоциированных с молекулами HLA I
CD14 – есть на
моноцитах-макрофагах, гранулоцитах, это рецептор для комплексов ЛПС с ЛПС-связывающим белком Активация фагоцитов через CD14 приводит к интенсивному выделению провоспалительных цитокинов
Слайд 39
CD16 – несут нейтрофилы, ЕКК, моноциты
CD19-22 – маркеры В-лимфоцитов
CD34 –
имеют все предшественники гемопоэза
CD95 – есть на тимоцитах, активированных Тл
и Вл, рецептор апоптоза клетокСлайд 40Toll-like рецепторы
Распознают типовые структурные компоненты или «Молекулярные образы
патогенов», которые
сходны у разных групп патогенных и
непатогенных микроорганизмовСлайд 41
TLR-1 связывает липопептиды различных групп бактерий
TLR-2 взаимодействует с
липотейхоевыми кислотами большинства грам(+)бактерий, липопротеинами боррелий, трепонем, микобактерий туберкулеза, компонентами
клеточных стенок нейссерий, листерий, грибовСлайд 42
TLR-3 связывается с двухцепочечной РНК, что является важным для эффективного противовирусного иммунитета
TLR-4 реагирует с ЛПС грам(-) бактерий, а также с белками теплового шока
TLR-5 взаимодействует с бактериальным флагеллином (Н-АГ бактерий)
TLR-9 связывается с бактериальными ДНК
Слайд 43Функции системы TLR
Усиление экспрессии костимуляторных молекул (КСМ) на АПК
Без костимуляции Т-лимфоциты переходят в состояние неотвечаемости (анергии)
к данному АГПеренаправление ИО либо по клеточному, либо по гуморальному пути, т.к. активация АПК через разные TLR ведет к продукции разных цитокинов
Слайд 44
Разный цитокиновый профиль стимулирует превращение Тх0 либо в Тх1,
либо в Тх2
Активация Тх1 приводит к развитию клеточного
воспаленииАктивация Тх2 направляет иммунный ответ по гуморальному пути, обеспечивая синтез АТ
Слайд 45Функции TLR
Активация АПК через TLR4 ведет к продукции провоспалительных цитокинов
( ИЛ1, ИЛ12, ИЛ18), стимулируя переход Тх0 в
Тх1 с развитием клеточных иммунных реакций и воспаленияСлайд 46Функции TLR
Активация АПК через TLR2 ведет к синтезу регуляторных цитокинов
( ИЛ4, ИЛ10, ИЛ13,) стимулируя переход Тх0 в Тх2
с активацией гуморального иммунитета и продукцией АТСлайд 47Дифференцировка Т-лимфоцитов
ГСК ЛСК про Тл (CD34, CD7)
Антигеннезависимая дифференцировка
тимус пре Тл (CD2,) пре
Тл ( ТКР, в цитоплазме – CD3) Незрелые двойные позитивные Тл (на мембране ТКР+ CD3, CD4 и CD8)
апоптоз аутореактивных Тл, потеря или CD4, или CD8
Тх CD4, Тц CD8 – миграция в периферические лимфоидные органы
Слайд 48Антигензависимая дифференцировка
Тх0 Тх1 ( ИЛ2, -интерферон) - клеточный иммунитет
Тх0
Тх2 ( ИЛ4, ИЛ5, ИЛ10, ИЛ13) - гуморальный иммунитет
Тх0
Тх3 ( CD25, ИЛ10, белок скурфин) – супрессия иммунного ответаТх0 Тх17 ( ИЛ17 ) – антимикробный, антигрибковый иммунитет на слизистых
Тц Т-киллеры (перфорин)
Т- памяти (CD45, CD45 RO)
Слайд 49 Основные субпопуляции:
Т0 (нулевые,
тимические, «наивные», незрелые)
Т-цитотоксические
Т-хелперы (Тх1, Тх2, Тх3,Тх17)
Т-памяти
В норме у человека Т-лимфоциты составляют 60% (50-75%) всех лимфоцитов крови
Слайд 51 ТКР у Т-х и Т-ц одинаковы по строению
Тх распознают комплексы АГ+HLA II, причем АГ в виде
пептида 12-25 аминокислотных остатковТц распознают комплексы АГ+HLA I, АГ в виде пептида 8-11 аминокислотных остатков
Различие обусловлено участием CD4 у Тх и CD8 у Тц
Слайд 53Дифференцировка В-лимфоцитов
Процесс созревания стимулируется цитокинами: ИЛ-3, ИЛ-7, ИЛ-4
Антигеннезависимая дифференцировка
ГСК (CD34)
ЛСК про Вл ( CD19, пептиды Ig, Ig)
Большой пре В-л (содержит внутриклеточно цепь µ, CD20-21, 72)
Малый пре В-л (поверхностный IgM)
Незрелый В-л (ВКР = пIgM+Ig, Ig)
Слайд 54
пIgM может взаимодействовать с АГ
Ig и Ig
- передают сигнал в клетку
Зрелый В-л (ВКР, IgD
– маркер зрелых В- лимфоцитов)Субпопуляции Вл несут также IgG, IgA, IgE на мембране
Антигензависимая дифференцировка Вл
РБТЛ плазмоциты синтез Ig=АТ
Слайд 56
дифференцировочные АГ В-лимфоцитов:
СD19, 20, 22, 40, 72,
рецепторы к эритроцитам мыши, к Fс-фрагменту IgG, к С3
компоненту комплемента и др.Субпопуляции: В1 (СД5) и В2
В норме в крови у человека содержится 18-30% В-л от общего числа лимфоцитов
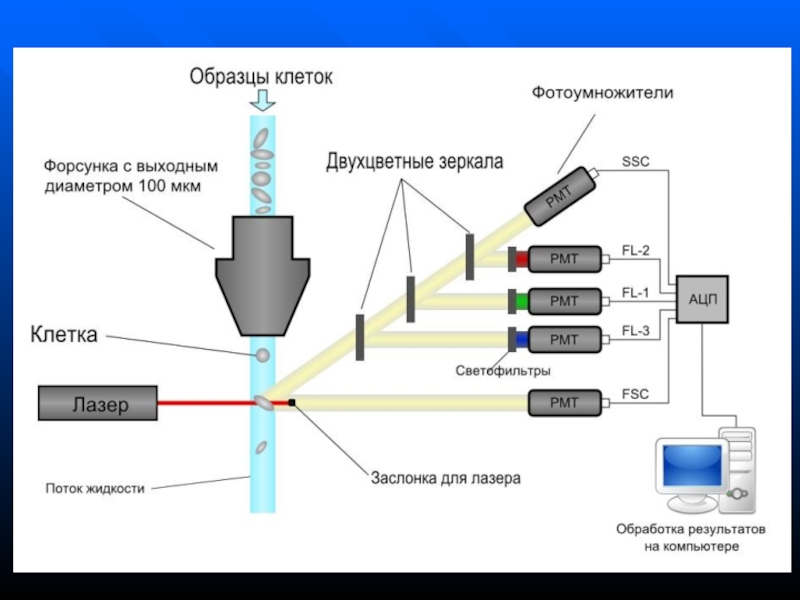
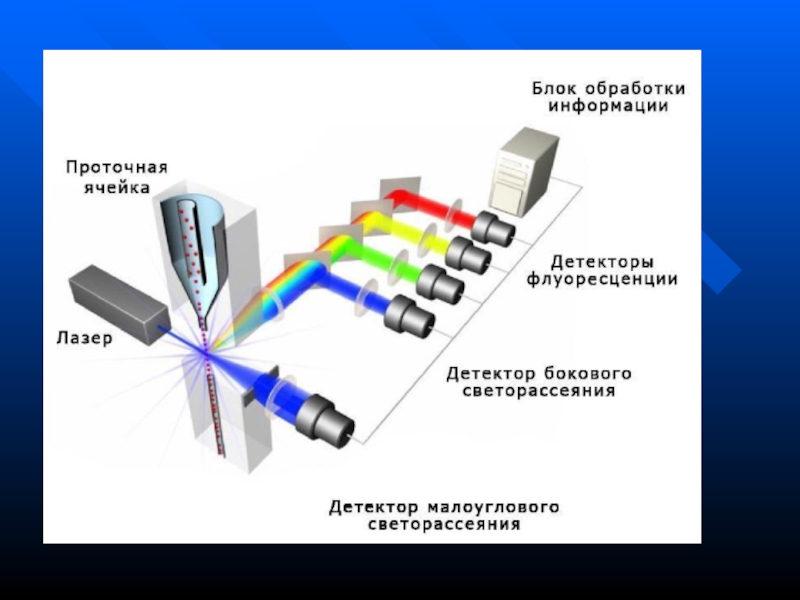
Слайд 57Проточная цитометрия
Основана на регистрации флюоресценции и светорассеяния от каждой отдельной
клетки в клеточной суспензии
Суспензия клеток под давлением подается в
проточную ячейку, где за счет разности давлений между образцом и обтекающей жидкостью находясь в ламинарном потоке жидкости, клетки выстраиваются в цепочку друг за другом (гидродинамическое фокусирование)Слайд 58
Клетки одна за другой проходят через лазерный луч, а высокочувствительные
детекторы, расположенные вокруг проточной ячейки, регистрируют флюоресценцию и рассеянное лазерное
излучение каждой клеткиПолученный сигнал передается в компьютер, обрабатывается, и данные отображаются в виде различных графиков и гистограмм
Слайд 59Прямое светорассеяние (малоугловое)
Детектор регистрирует излучение лазера,
которое рассеивается под углами 2-19 градусов
Интенсивность рассеянного под малым
углом света пропорциональна размеру клетки Более крупные клетки рассеивают свет сильнее мелких
Слайд 60Боковое светорассеяние
Внутреннее содержимое клеток оптически неоднородно
Луч лазера, проходя сквозь
клетку, многократно преломляется и рассеивается во все стороны
Регистрация этого
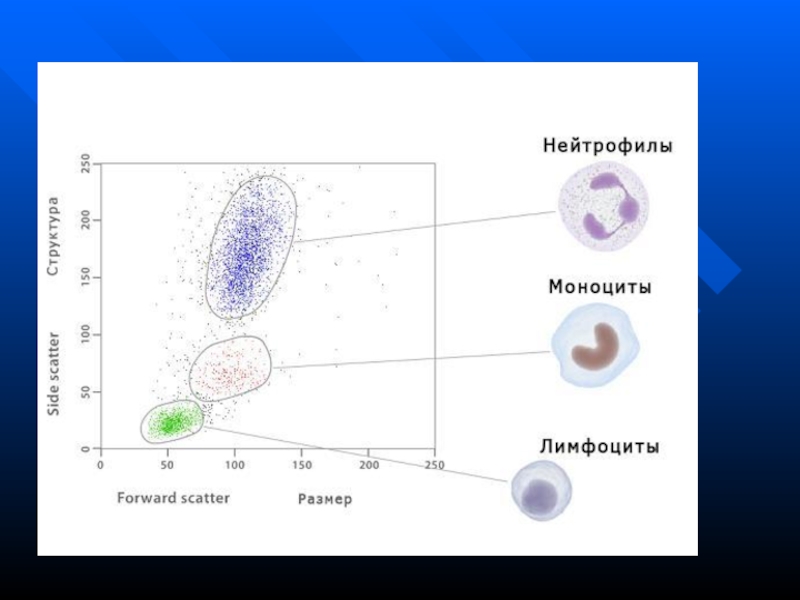
излучения позволяет судить о соотношение ядро-цитоплазма, наличие гранул, других внутриклеточных включенийКомбинация бокового и прямого светорассеяния позволяет судить о морфологии клетки в целом, выделять различные популяции клеток (лимфоциты, моноциты, гранулоциты) для дальнейшего анализа
Слайд 61Регистрация флюоресценции
Система состоит из комплекса светофильтров и фотоумножителей, которые регистрирует
излучение в диапазоне длины волны соответствующего флюорохрома
Основными типами таких красителей
являются флюоресцентные метки моноклональных АТ ( FITC и др.) для определения мембранных АГ клетки (напр., СД-АГ)Есть красители для оценки жизнеспособности клеток , для нуклеиновых кислот и т.д.
Слайд 62
Полученные данные обрабатываются компьютером и отображаются в виде одномерных гистограмм
или двух- и трехмерных точечных графиков
Анализ данных позволяет определить
количество клеток, оценить интенсивность флюоресценции (т.е. плотность того или иного маркера на поверхности клетки)В некоторых случаях при помощи проточного цитометра можно определить абсолютное число клеток в исследуемом образце
Слайд 63Сортировка клеток
В проточном цитометре, оборудованном системой для сортировке клеток, проточная
ячейка закреплена на пьезокристалле
При подаче на него напряжения кристалл
вместе с ячейкой совершает колебания с заданной частотой, в результате чего струя жидкости с клетками разбивается на отдельные каплиСлайд 64Сортировка клеток
Проходя сквозь заряжающее кольцо, капля может приобретать положительный или
отрицательный заряд в зависимости от того, какая клетка содержится внутри
каплиПролетая мимо отклоняющих пластин капля с клеткой притягивается к ним, выходит из основного потока и попадает в пробирку
Слайд 65Преимущества сортинга на П Ц
высокая чистота получаемой популяции клеток (до
99.9% позитивных клеток в отсортированной фракции)
возможность сортировать клетки по
любым параметрам позволяет отсортировать любое количество клеток, вплоть до единичных, что незаменимо в технологиях клонирования
Слайд 71Иммуноглобулины (Ig)
большое семейство
белков, которые синтезируются В-л и плазмоцитами
при электрофорезе образуют
фракцию γ-глобулиновнаходятся в сыворотке крови
часть Ig связана с клетками
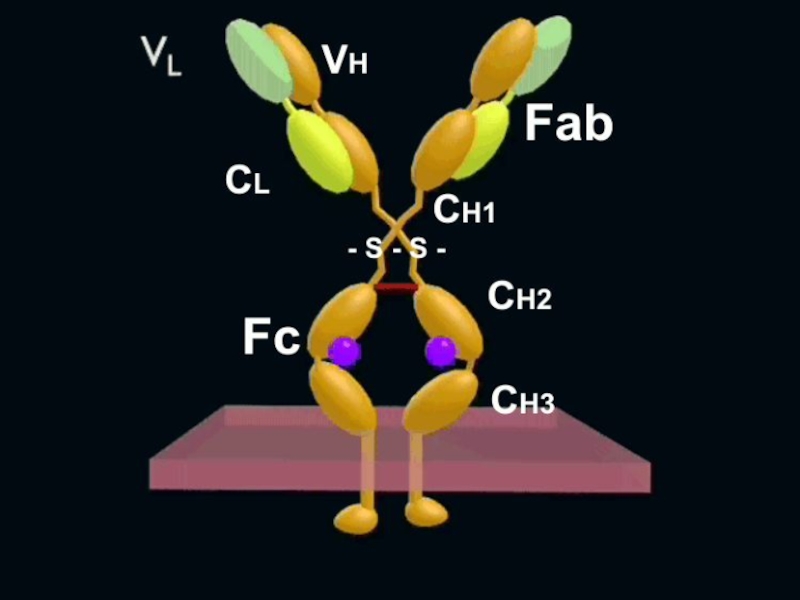
Слайд 72Структура Ig
2 тяжелые (H – heavy) полипептидные цепи
2 легкие
(L – light) полипептидные цепи
между собою
L и H цепи соединены дисульфидными связями Тяжелые цепи определяют класс Ig:
γ - IgG, - IgA, - IgM, - IgD, - IgE
Слайд 73
В цепях Ig различают константные (c) и вариабельные (v)
участки
Участки цепей, замкнутые в виде глобул - домены
Гипервариабельные домены L и H цепей формируют активный центр АТ для взаимодействия с АГ – паратоп Слайд 74
Между СН1 и СН2 доменами тяжелой цепи локализуется подвижный
участок Ig - «шарнир», чувствительный к протеолитическим ферментам
Под действием
папаина молекула иммуноглобулина расщепляется надва Fab-фрагмента и Fc-фрагмент
Слайд 75Функции Fc-фрагмента
CН2 домен Fc-фрагмента активирует комплемент по классическому пути
(после образования комплекса АГ+АТ)
СH3 домен может связываться с
Fc-рецепторами на лейкоцитах и других клеткахСлайд 77Свойства иммуноглобулинов
IgG составляют основную массу иммуноглобулинов сыворотки крови (75-85%)
– 10 г/л (8-12 г/л)
Передаются от матери к плоду
через плацентуАТ IgG появляются в большом количестве при вторичном иммунном ответе
Слайд 78
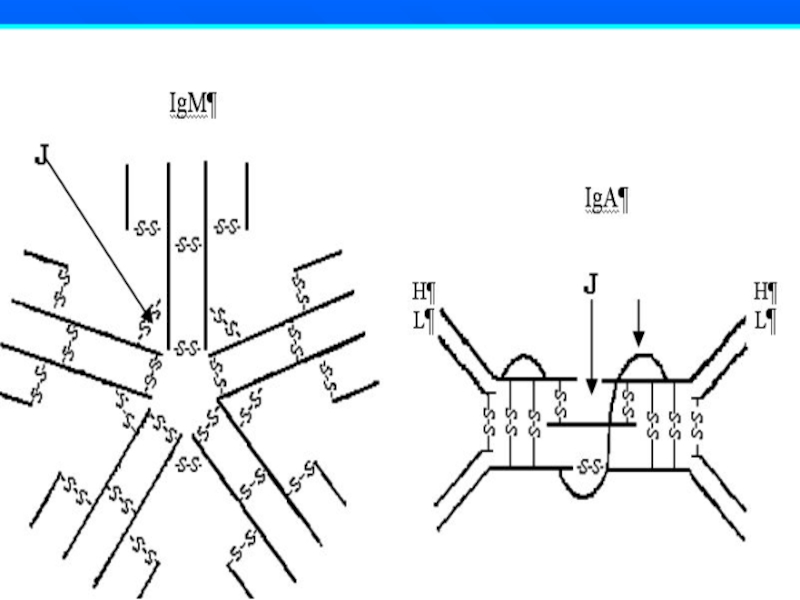
IgМ – пентамер, в сыворотке крови в среднем –
1 г/л (0.8-1.5 г/л)
АТ IgM синтезируются в организме
при первичном иммунном ответеСлайд 79IgА в крови присутствуют в виде мономеров (от 1,5 до
3 г/л), а в секретах в форме димеров и тримеров
Секреторные АТ IgA (sIgA) формируют местный иммунитет:
- препятствуют адгезии м/о к эпителию
слизистых оболочек,
- опсонируют микробные клетки,
- усиливают фагоцитоз
Слайд 81
IgD содержатся в сыворотке крови в концентрации 0,03-0,04
г/л
Служат рецепторами зрелых В- лимфоцитов
Количество
IgD увеличивается при некоторых вирусных инфекцияхСлайд 82
IgЕ содержится у здоровых людей в сыворотке крови в
концентрации около 0,00005 г/л или от 0 до 100 МЕ/мл
(1 МЕ ~ 2,4 нг)Количество АТ IgЕ увеличивается при аллергии
Слайд 83Антитела
Это Ig любого из 5 классов, специфично взаимодействующие
с АГ
Естественные АТ находятся в организме без предварительного введения АГ
(иммунизации) Иммунные АТ накапливаются и выявляются в сыворотке крови после предварительной иммунизации АГ
Слайд 84Механизмы действия антител
нейтрализация активных центров токсинов
образование комплекса АГ-АТ, который
активирует комплемент с последующим лизисом клетки
Слайд 85
опсонизация объектов фагоцитоза (усиление фагоцитоза)
связывание с Fc-рецепторами лейкоцитов, которые приобретают
способность специфично взаимодействовать с АГ ("вооружающий" эффект АТ)
Слайд 86
антирецепторные АТ, связываясь с соответствующим рецептором, блокируют или стимулируют
функцию клетки
АТ обладают собственной медленной ферментативной активностью и могут
расщеплять некоторые субстраты (абзимная активность)Слайд 87
Бивалентные полные АТ (обычно IgG) имеют 2 активных центра
Моновалентные неполные АТ, у которых только
один активный центр из-за пространственной блокировки второго центраСлайд 88
Сила связывания (сродство) одного активного центра АТ с эпитопом АГ-
аффинность
Прочность связывания всей молекулы АТ с АГ- авидность
Наибольшей
авидностью обладают IgM (пентамеры)Слайд 89
Поликлональные АТ сыворотки представляют собой смесь Ig различных классов
Моноклональные АТ
- разработаны на основе гибридомной технологии
- моноспецифичны
- направлены
к одному эпитопу АГ Слайд 90Получение моноклональных АТ
Иммунизация мышей антигеном
Из селезенки иммунизированных мышей получают
суспензию клеток, среди которых есть антителообразующие В-лимфоциты
Слайд 91
Проводят слияние этих антителообразующих В-клеток с В-клетками мышиной опухоли
– плазмоцитомы («бессмертные» клетки)
Образуются гибридные клетки, которые:
- способны синтезировать специфические АТ (как иммунные В-лимфоциты)- становятся долгоживущими ( как клетки плазмоцитомы)
Слайд 92
Их культивируют в специальной среде, в которой не растут обычные
негибридные клетки
Из смеси гибридных клеток выделяют по 1 клетке,
помещают в лунки с жидкой питательной средой и размножают (клонируют)Выявляют клон, синтезирующий АТ, специфичные к единственному эпитопу изучаемого АГ и размножают его
Слайд 93Применение моноклональных АТ
Выявление АГ бактерий и вирусов
Выявление клеточных маркеров (CD)
Выявление
гормонов, медиаторов и др.
Лечение ( инфликсимаб – моноклональные АТ, блокирующие
действие ФНО и тем самым подавляющие местное и системное воспаление) Слайд 94Генетические основы разнообразия АТ и ТКР
H и L цепи Ig
кодируются несколькими генными сегментами, расположенными в разных хромосомах. В ДНК
половых клеток они разобщены и объединяются непосредственно в Вл и плазмоцитахВариабельные участки L цепей кодируются V-сегментами (несколько сотен вариантов) и J-сегментами
Вариабельные участки Н цепей кодируются V, D, J-генными сегментами
Слайд 95
Каждый такой сегмент формируется из нескольких участков ДНК
При объединении фрагментов
генома в единую последовательность ДНК происходят множественные рекомбинации и мутации,
т.е. количество вариантов нарастаетСлайд 96 Разнообразие АТ увеличивается и при последовательном переключении классов Ig
(IgM и IgD на IgG, A и т.д.), продуцируемых одной
клеткойРазнообразие АТ продолжает увеличиваться и после контакта СИ с АГ, что связано с постоянными мутациями ДНК, таким образом в организме предсуществуют миллиарды вариантов Ig (также происходит и с ТКР)
Слайд 97Антигены (АГ) - любые простые или сложные вещества, которые при
попадании в организм вызывают иммунную реакцию и способны специфично взаимодействовать
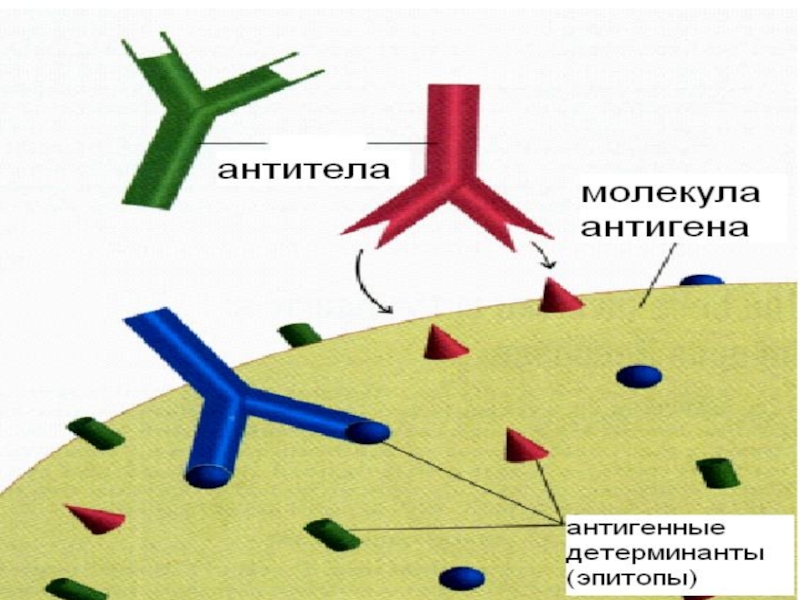
с продуктами этой реакции: АТ и ТКРСлайд 98 Основные свойства АГ: Иммуногенность
– способность АГ индуцировать в организме иммунную реакцию Специфичность
– способность взаимодействовать только с комплементарными ему АТ и/или ТКР Высокая молекулярная масса (более 10000 дальтон) – полноценные АГ (белки и их комплексные соединения) Поливалентность - на 1 молекуле полноценного АГ может быть 10-20 и более эпитоповСлайд 99 Иммуногенность обусловлена сложностью пространственной структуры молекулы (боковые радикалы, разветвленные
цепи и т.п.) Эпитоп (антигенная детерминанта ) - участок молекулы
АГ, взаимодействующий с одним активным центром АТ (паратопом) или ТКРСлайд 101 Гаптены - низкомолекулярные вещества, в обычных условиях не вызывают
иммунную реакцию Способны запускать иммунный ответ после связывания с
белками организма В результате образуются АТ, способные взаимодействовать с гаптеномСлайд 102Аллергены – АГ или гаптены, которые при повторном попадании в
организм вызывают аллергическую реакцию Все АГ и гаптены могут быть
аллергенамиСлайд 103Т-зависимые АГ- запускают иммунный ответ с участием Т-лимфоцитов (белки) Т-независимые
АГ- запускают иммунный ответ и синтез АТ
В-клетками без Т-лимфоцитов (высокополимерные полисахариды, ЛПС и др.)Слайд 104Экзогенные и эндогенные АГ Экзогенные АГ попадают в организм из
внешней среды Среди них различают
- инфекционные - неинфекционныеСлайд 105 Инфекционные АГ- антигены бактерий, вирусов, грибов, простейших, токсины, ферменты
- группоспецифические (у разных видов одного рода или семейства) - видоспецифические
(у различных представителей одного вида) - типоспецифические (определяют серологические варианты - серовары, антигеновары внутри одного вида)Слайд 106По локализации: О-АГ Н-АГ К-АГ О-АГ - полисахарид, входит в
состав к л е т
о ч ной стенки бактерий, является частью ЛПС у грам(-) бактерий, термостабилен По О-АГ различают много сероваров у бактерий одного видаСлайд 107 Строение ЛПС Центральная часть ЛПС –
полисахарид, состоит из остатков 2-кето-3-дезоксиоктоната, галактозы, глюкозы, гептозы и N-ацетилглюкозамина
С одной стороны к этому ядру присоединен липид А, а с другой – О-специфические олигосахаридные цепочки из 3-4 сахаровСлайд 108Липид А - неспецифический иммуностимулятор, токсичен ЛПС - эндотоксин и
пироген В небольших дозах активирует макрофаги с выделением ИЛ1, ФНО и
др. цитокинов В больших дозах угнетает фагоцитоз, вызывает нарушение функции сердечно-сосудистой системы, тромбозы, эндотоксический шокСлайд 109Н-АГ входит в состав жгутиков, состоит из белка флагеллина, термолабилен
К-АГ - гетерогенная группа поверхностных капсульных АГ бактерий, содержат обычно
кислые полисахариды Варианты К-антигена: A, B, L у кишечной палочки, Vi – у сальмонеллСлайд 110Протективные антигены Это совокупность антигенных детерминант (эпитопов), которые вызывают наиболее
сильный иммунный ответ, что предохраняет организм от повторной инфекции данным
возбудителемСлайд 111Антигенная мимикрия - сходство в строении АГ бактерий, человека, животных
Гемолитические стрептококки группы А содержат АГ, общие с АГ эндокарда
и клубочков почек человека Вызывают образование АТ, перекрестно реагирующих с клетками человека, что приводит к развитию ревматизма и постстрептококкового гломерулонефритаСлайд 112У возбудителя сифилиса есть фосфолипиды, сходные по строению с кардиолипидным
АГ сердца животных и человека Поэтому кардиолипиновый АГ из сердца
животных используют для выявления АТ к возбудителю сифилиса (реакция Вассермана)Слайд 113Суперантигены - в небольших дозах вызывают поликлональную активацию и пролиферацию
большого числа Т-лимфоцитов ( более 20%, обычные АГ- 0,01%) При
этом вырабатывается много цитокинов, вызывающих воспаление и повреждение тканей Суперантигены: энтеротоксины, эксфолиатины, холероген и др.Слайд 114НЕИНФЕКЦИОННЫЕ АНТИГЕНЫ АГ растений, лекарственные препараты, химические, природные и синтетические
вещества, антигены животных и человека
Слайд 115АГ животных по отношению к человеку являются ксеногенными АГ, отличающие
одного индивидуума от другого, называют аллогенными или изоантигенами К аллогенным АГ
относятся АГ эритроцитов и лейкоцитов (HLA-система) и др.Слайд 116 Антигены эритроцитов На поверхности эритроцитов
имеется более 100 антигенов, относящихся к 14 системам Наиболее важными
являются изогемагглютиногены системы А В 0 групп крови и резус-АГ (Rh+)Слайд 117 Антигены лейкоцитов HLA
(Human Leucocyte Antigens) контролируются генами 6 хромосомы
(главным комплексом гистосовместимости) - обусловливают несовместимость тканей при трансплантации - участвуют в распознавании АГ - участвуют в межклеточных взаимодействиях - являются маркерами «своего» - определяют предрасположенность к заболеваниямСлайд 118 Молекулы HLA I класса – гетеродимеры, состоят из
двух цепей Легкая цепь – b 2-микроглобулин
Тяжелая цепь имеет три домена (a1, a2, a3), гидрофобный участок, фиксирующий цепь в мембране, и концевой участок в цитоплазме HLA I класса есть на всех ядросодержащих клетках маркеры «своего» Гены HLA I класса представлены тремя локусами: HLA-A, HLA-B, HLA-CСлайд 120Молекулы HLA II класса состоят из двух полипептидных цепей: a
и b. Обе цепи имеют по два домена (a1, a2
и b1, b2), закрепленные в клеточной мембране дополнительным участком HLA II класса экспрессированы на В-л, макрофагах, активированных Т-л Гены, контролирующие HLA II класса, имеют три локуса : HLA-DR, HLA-DQ, HLA-DP HLA II класса участвуют в распознавании чужеродных АГСлайд 122 Эндогенные АГ - собственные аутологичные молекулы (аутоАГ), вызывающие
активацию системы иммунитета - естественные первичные (нормальная ткань хрусталика
глаза, нервная ткань и др.) - приобретенные вторичные (продукты повреждения тканей микробами, вирусами, ожоговые, лучевые, холодовые АГ)Слайд 123 По тканевой и клеточной принадлежности -
Стромальные (АГ эластических, коллагеновых и других волокон) - Клеточные
(мембранные, цитоплазматические, ядерные и т.д.) - Внеклеточные аутоантигены (антигены межтканевой жидкости и др.)Слайд 124Система мононуклеарных фагоцитов
Моноциты крови
Макрофаги печени
(клетки Купфера)
Мезангиальные клетки
Альвеолярные макрофаги
Глиальные
макрофагиОстеокласты
Макрофаги соединительной ткани и др.
Слайд 125Молекулярные маркеры моноцитов и макрофагов
CD 14 – рецептор
для ЛПС связывающего белка
рецепторы для Fc-фрагмента IgG
рецепторы
к цитокинам интегрины (CD11a/CD18)
Toll-like рецепторы
Слайд 126 Функции макрофагов: 1. фагоцитоз
2. распознавание и представление (презентация) антигенов 3.
секреция медиаторов системы иммунитета (монокинов)Слайд 127 Стадии фагоцитоза - хемотаксис - адгезия - эндоцитоз (поглощение) -
переваривание
- удаление продуктов фагоцитоза
Слайд 128Хемотаксис - движение макрофагов к объекту фагоцитоза по градиенту концентрации
хемотаксических факторов (бактериальных компонентов, интерлейкинов (IL-8) и т.д.)
Слайд 129Адгезия реализуется двумя механизмами: иммунным и неиммунным Неиммунный фагоцитоз осуществляется
за счет связывания АГ на поверхности макрофага В иммунном фагоцитозе
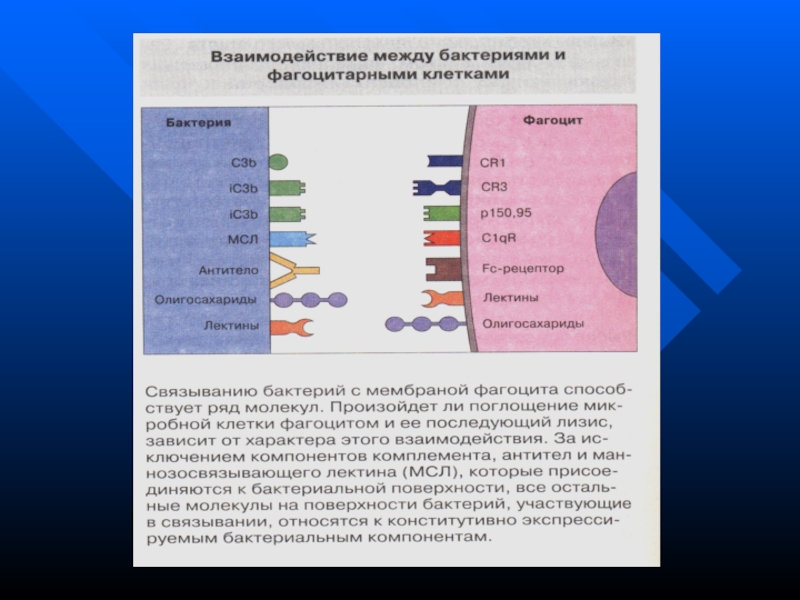
участвуют рецепторы макрофагов к иммуноглобулинам (опсонинам)Слайд 130 В связывании могут участвовать самые разнообразные молекулы и рецепторы: -
Лектины микробных клеток - Лектины фагоцитарных клеток (рецепторы комплемента CR3
и CR4, маннансвязывающий белок, интегрины и др.) - Компоненты комплемента - Fc-рецепторы - Toll-like рецепторы и др.Слайд 132 - инвагинация мембраны фагоцита - обволакивание объекта фагоцитоза
- образование фагосомы - слияние фагосомы с лизосомами и
образование фаголизосомыЭндоцитоз (поглощение)
Слайд 133Кислородзависимые механизмы (образование активных форм кислорода: Н2О2, оксидаза, миелопероксидаза и
др.)
Кислороднезависимые механизмы
Переваривание
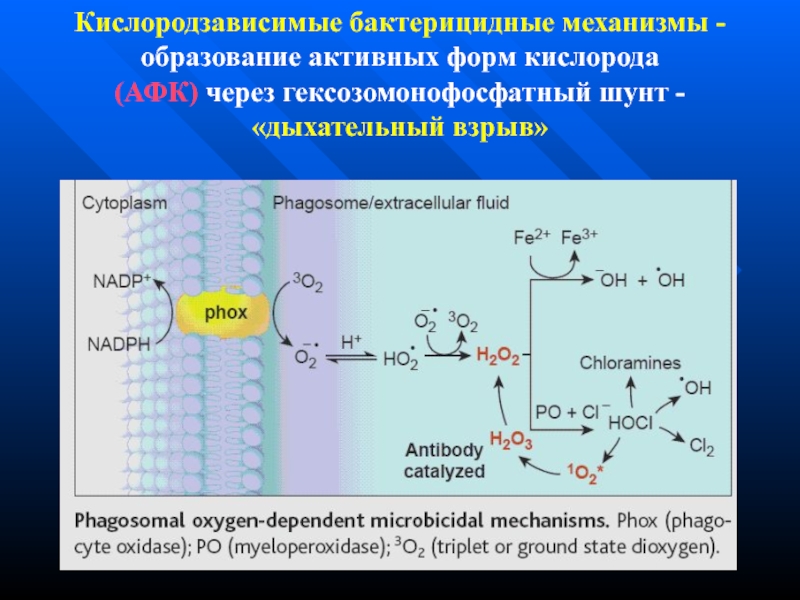
Слайд 134Кислородзависимые бактерицидные механизмы - образование активных форм кислорода (АФК) через гексозомонофосфатный
шунт - «дыхательный взрыв»
Слайд 135 Кислороднезависимые механизмы: Ферменты-гидролазы - катепсины, лизоцим,
глюкуронидаза и т.д. Катионные антибиотикоподобные белки - дефензимы вызывают образование
ионных каналов в мембране микробной клетки Метаболиты азота - образование токсичного для бактерий и опухолевых клеток оксида азота NO(II) Дополнительные антимикробные механизмы - после слияния лизосом содержимое фаголизосомы временно подщелачивается, после чего рН падает (подкисление)Слайд 136Завершенный фагоцитоз - полное переваривание и гибель бактериальной клетки Незавершенный фагоцитоз
– бактерии остаются жизнеспособными Механизмы: - микобактерии туберкулеза и токсоплазмы
препятствуют слиянию фагосом с лизосомами - гонококки, стафилококки и стрептококки устойчивы к действию лизосомальных ферментов - риккетсии и хламидии могут долго персистировать в цитоплазме вне фаголизосомыСлайд 137Судьба нейтрофила после фагоцитоза - гибель
Апоптоз – строго регулируемый ответ
для предотвращения попадания содержимого клетки в межклеточное пространство
Некроз –
разрушение внешней мембраны лейкоцита, но оболочка ядра сохраняетсяНетоз – образование внеклеточных сетевых ловушек
Слайд 138Нетоз
Происходит распад ядерной оболочки
Компоненты ядра и гранул смешиваются
Образуются
поры в ЦПМ, через которые наружу выходят ДНК и антимикробные
ферменты нейтрофилаСлайд 139Нетоз
Таким образом, нейтрофилы после активации выбрасывают во
внеклеточное пространство сетеподобные структуры, в состав которых входят:
ДНК, гистоны
Продукты респираторного
взрываФерменты гранул
Результат: изоляция, ограничение и уничтожение бактерий и грибковых патогенов
Слайд 140Представление (презентация) АГ В результате фагоцитоза и переваривания АГ образуется
большое количество низкомолекулярных антигенных фрагментов (процессинг) Часть из них в
виде пептидов перемещается на поверхность макрофагаСлайд 141Экзоантигены - пептиды длиной 12-25 аминокислот связываются с HLA 2
класса (HLA-DR, HLA-DP, HLA-DQ). Только после этого они взаимодействуют с
Тх Таким образом, макрофаги представляют переработанный антиген Т-хелперам в комплексе со своими HLA (1-й сигнал)Слайд 142 Секреция медиаторов иммунной системы 2-ой сигнал для активации
Тх - выделение макрофагами ИЛ1 - монокина с многообразным биологическим
и пирогенным действием Кроме этого, макрофаги выделяют и другие медиаторы: ИЛ-6, 8, 12, 18, ФНОa , простагландины, лейкотриены, a и b интерфероны, факторы комплемента, ферменты и др.Слайд 143ДРУГИЕ АПК
Клетки Лангерганса из кожи мигрируют в паракортикальные области
регионарных лимфоузлов. Там они взаимодействуют с Т-клетками и представляют собой
уже интердигитирующие (переплетенные) клетки. Такая миграция обеспечивает доставку АГ из кожи и слизистых оболочек к Т-хелперам в лимфоузлахФолликулярные дендритные (разветвленные) клетки, презентируют антигены В-лимфоцитам
Слайд 145 СИСТЕМА ГРАНУЛОЦИТОВ В нее входят нейтрофилы, базофилы
и эозинофилы (микрофаги) Все они происходят из ГСК через ряд
предшественников под влиянием гранулоцитарно-макрофагальных колониестимулирующих факторовСлайд 147 Нейтрофилы составляют 47-72% всех лейкоцитов (2.5 - 4.5х109/л) Средний
срок жизни нейтрофилов 7-9 часов В цитоплазме есть 2
основных типа гранул – азурофильные первичные и специфические вторичныеСлайд 148 Азурофильные гранулы содержат b-глюкуронидазу, катепсины, кислые и
нейтральные протеиназы, миелопероксидазу В специфических гранулах находятся коллагеназа, лизоцим, лактоферрин
и др.Слайд 150Основные маркеры на нейтрофилах : СД 14, CD16, CD32
,СD64 рецепторы к С1q, С3b, С5а компонентам комплемента
много адгезинов, интегрины, хемокиновые рецепторы и др.Слайд 151 Базофилы участвуют в аллергических реакциях На
поверхности базофилов есть Fce-рецепторы, связывающие IgE В гранулах содержится
большое количество медиаторов аллергии (гистамин, серотонин, фактор активации тромбоцитов, простагландины, лейкотриены, факторы хемотаксиса, гепарин и др.) В крови в норме присутствует 0-1% клетокСлайд 152Эозинофилы играют большую роль в противопаразитарном иммунитете и аллергии
В крови 1-6%, созревают под действием ИЛ-5 В гранулах
содержится основной белок - цитотоксин, повреждающий паразитов и собственные клетки организма При активации эозинофилов из гранул высвобождается большое количество медиаторов аллергических реакций Есть рецепторы для С4, С3, С3b компонентов комплемента, для Fс-фрагментов IgG, IgEСлайд 153Характеристика системы макрофагов и гранулоцитов 1. Определяют количество лейкоцитов в крови 2.
Оценивают поглотительную и переваривающую активность фагоцитов: К взвеси
лейкоцитов добавляют взвесь микроорганизмов. Готовят 3 пробы, инкубируют при 370С 1-ю пробу 30 мин, 2-ю - 60 мин, 3-ю - 90 мин. Делают мазки, высушивают их, фиксируют и окрашивают по Романовскому-ГимзеСлайд 154Определяют фагоцитарный индекс и фагоцитарное число Фагоцитарный индекс - это
среднее количество частиц или микроорганизмов в одном фагоците (норма 3-12)
Фагоцитарное число - это количество фагоцитов, участвующих в фагоцитозе (норма - 60-80%)Слайд 155Оценка показателей фагоцитоза В норме через 90 мин фагоцитарный индекс должен
быть ниже, чем через 30 мин и 60 мин.в связи
с перевариванием микробов. При нарушении переваривания он не меняется Переваривание микробов оценивают - посев лизатов лейкоцитов на питательные среды - подсчет выросших колонийСлайд 156
НСТ-тест Метаболическую активность - «дыхательный взрыв» определяют после окраски
лейкоцитов раствором нитросинего тетразолия Под влиянием активных форм кислорода НСТ превращается в нерастворимый формазан, который выпадает в цитоплазме в виде глыбок голубого цвета В норме таких лейкоцитов 15-18%, при инфекциях их число увеличивается до 40% и болееСлайд 157 С помощью моноклональных АТ определяют АГ фагоцитов (СD14, СD11, СD18,
HLA-DR и др.) Выявляют рецепторы к С3 компоненту комплемента, к иммуноглобулинам
и др. Оценивают спонтанную и направленную миграцию (хемотаксис) Определяют способность секретировать цитокины (ИЛ-1, -ФНО и др.) и их уровень в кровиСлайд 158Система комплемента
сложная система ферментативных и рецепторных белков сыворотки крови
(более 20)
активация системы комплемента - цепная ферментативная реакция, при
которой каждый предыдущий компонент активирует последующие за счет их ферментативного расщепления Слайд 159Система комплемента
Белки классического пути активации системы комплемента называются компонентами и
обозначаются буквой C (C1, С2, С3 и т.д.)
Белки альтернативного пути
активации называются факторами и обозначаются большими латинскими буквами (B, H и т.д.)Все они образуются в печени и секретируются макрофагами
Слайд 160
При активации компонентов комплемента обычно образуется 2 фрагмента
Больший фрагмент
обозначается малой латинской буквой «b» (напр., С3b), является активным, продолжает
каскад расщепленияМеньшие фрагменты в дальнейшей активации комплемента обычно не участвуют (кроме С2а), обладают многообразными биологическими функциями
Они обозначаются малой латинской буквой «а» (например, С3а)
Комплексы активированных компонентов обозначаются сверху чертой
Слайд 161
Среди регуляторных белков различают естественный С1-ингибитор, который тормозит спонтанную
активацию C1q компонента
При дефиците С1 ингибитора возникает наследственный ангионевротический
отек (отек Квинке)Фактор DAF или ускоряет деградацию С3b компонента на мембранах собственных клеток организма, предотвращая их лизис
Альтернативный путь активации блокируется факторами Н, I и т.д.
Слайд 162Пути активации системы комплемента
Классический (запускается комплексом АГ-АТ в присутствии катионов
Ca и Mg обычно на поверхности клетки-мишени )
Лектиновый (похож на
классический, но активируется лектинами бактерий, например МСБ, С-реактивным белком, фибронектином и т.д.)Альтернативный (запускается ЛПС клеточной стенки бактерий (эндотоксинами), агрегированными Ig, лекарственными препаратами и т.д.)
Слайд 166Функции системы комплемента
Лизис клеток-мишеней (бактериальных, зараженных вирусом, опухолевых)
Опсонизация, т.е. усиление
фагоцитоза через рецепторы к комплементу (например, CD35)
Участие в воспалении, хемотаксисе
и аллергических реакцияхРастворение иммунных комплексов, что препятствует их отложению в тканях
Слайд 168Неспецифические защитные реакции (гуморальные)
Активация комплемента по альтернативному пути через
С3-компонент
Белки острой фазы воспаления (СРП, фибронектин и др) препятствуют адгезии
, микробной инвазии и стимулируют лектиновый путь активации комплементаЕстественные АТ
Слайд 169Неспецифические защитные реакции (клеточные)
Фагоцитоз микробных клеток нейтрофилами и макрофагами
Действие естественных
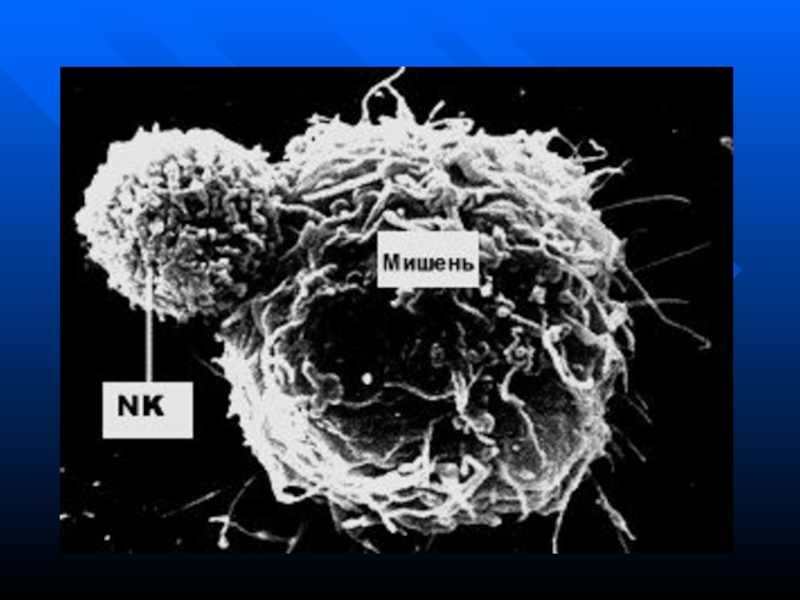
киллеров -ЕКК (перфорин, АЗКЦ)
Слайд 170Специфические защитные реакции на Т-независимые АГ
Такие АГ– высокомолекулярные чужеродные структуры,
имеют выраженный заряд ((полисахариды бактерий)
Способны связать не менее 2-х молекул
IgМ или IgD на поверхности В-лимфоцита
Это - условие для дифференцировки и превращения В-л в плазмоциты
Синтезируются АТ класса IgМ
Слайд 171Специфические защитные реакции на Т-зависимые АГ
Процессинг и презентация АГ
Индуктивная фаза с активацией
Т-хелперов 1 и 2 типов
Эффекторная
фазаСлайд 172 АПК (дендритные) клетки представляют АГ для Т-х
АПК играют центральную роль в перенаправлении ИО по клеточному
или гуморальному путиЭто связано со взаимодействием АГ
с Toll-like рецепторами на АПК
Слайд 174Функция TLR
Активация АПК/ДК через TLR4 ведет к продукции
провоспалительных цитокинов ( IL1, IL12, IL18, ФНО-α)
Стимулирует
переход Tх 0 в Tх 1 с активацией клеточных иммунных реакций и воспаленияСлайд 175 Функция TLR
Активация АПК/ДК через TLR2 ведет
к синтезу регуляторных цитокинов (IL 4, IL10, IL 13), стимулируя
переход Tх0 в Tх2 с активацией гуморального иммунитета и продукцией АТЭтот путь стимулируется также антигенпредставляющими В-л
Кроме того, активация через TLR усиливает экспрессию костимуляторных молекул
Слайд 176Для активации Т-х необходимы
3 сигнала:
Презентация АГ в комплексе с
HLA-II
Экспрессия костимулирующих молекул
Определенный набор цитокинов
Слайд 180 Т-х 1 синтезируют -интерферон, IL 2 и -ФНО
-INF стимулирует макрофаги, которые усиливают продукцию IL1, IL12 и
IL18 Это ведет к дальнейшей стимуляции Tх1 с синтезом -INF (положительная обратная связь)Слайд 181 Т-х 2 синтезируют IL4, IL10 и др. IL4 активирует
В-лимфоциты, стимулирует их бласттрансформацию в плазмоциты. Они начинают секретировать АТ
всех классов – гуморальный иммунный ответ IL10 угнетает клеточные воспалительные реакцииСлайд 182Эффекторная фаза
Активация фагоцитов и фагоцитоз
Цитотоксическое действие Т-киллеров и NK-клеток
Бласттрансформация В-лимфоцитов,
образование плазмоцитов, синтез АТ
Слайд 183Основные стадии и механизмы иммунного цитолиза
Распознавание мишени и активация CD8+
цитотоксического лимфоцита
Летальный удар с выделением перфорина, гранзимов, активацией апоптоза через
CD95Лизис клетки-мишени
Слайд 185Естественное угнетение ИО
Цитокины действуют только аутокринно и паракринно
Синтезируются в пикомолярных
концентрациях
Цитокины взаимно угнетают друг друга: ИЛ-10 подавляет все цитокины, ИЛ-12
блокирует цитокины Тх2 (гуморальный ИО), ИЛ4 блокирует Тх1 (клеточный ИО)Слайд 186Естественное угнетение ИО
Смена костимулирующмх молекул приводит к торможению клеточного деления
Начинается
апоптоз актвированных клеток
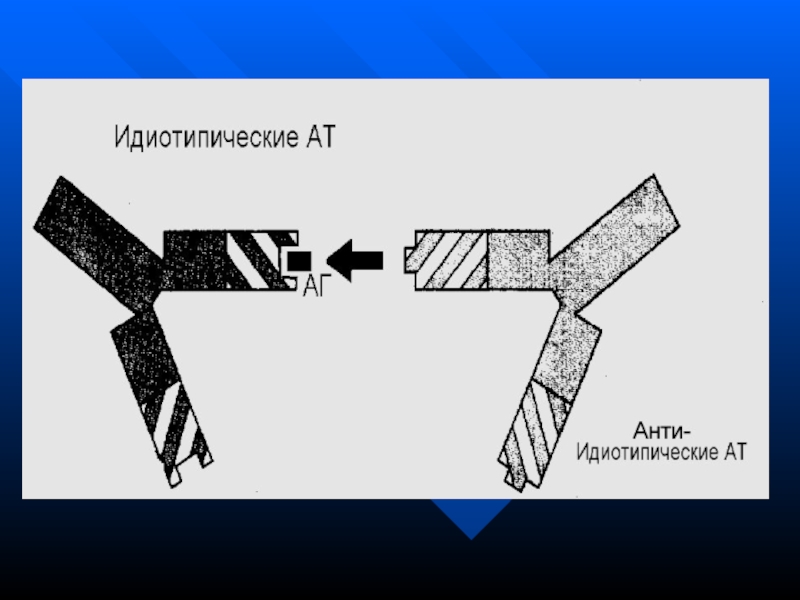
Идиотип – антиидиотипическая регуляция
Слайд 188Первичный иммунный ответ:
Развивается после латентного периода (3-5 дней)
Образуются АТ класса
IgM (на 2-3 день)
К концу 2-й недели образуются АТ IgG
Одновременно
в пролиферацию вступают специфические Т-лЗатихает через 2-3 недели с образованием клеток памяти
Слайд 189Вторичный иммунный ответ:
Быстро развивается после повторного контакта с АГ (на
1-3 день)
Резко увеличивается количество АТ класса IgG. Аффинность и авидность
АТ высокаяМаксимальная быстрая активация всех Т-клеточных субпопуляций